A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יישום של עכבר Ligated מעיים תיקון של Peyer Assay Loop להערכת ספיגת חיידקים על ידי תאים M
In This Article
Summary
בתאי האפיתל M זקיק הקשורים התמחה כיסוי טלאים של Peyer לשחק תפקיד חשוב עבור immunosurveillance הרירית ברקמת המעי הקשורים הלימפה. כאן אנו תיאר את שיטת הערכה transcytosis חיידקי ידי תאים M In vivo. שיטה זו מספקת שיטה להבין M-תא לתפקד במערכת החיסונית.
Abstract
החלק הפנימי של המעי שלנו מאוכלס עם מספר עצום של חיידקים commensal. פני הרירית של מערכת העיכול חשופה ברציפות אליהם מדי פעם כדי פתוגנים. רקמת מעי הקשורים הלימפה (Galt) לשחק תפקיד מפתח לזירוז של התגובה החיסונית ברירית אלה החיידקים 1, 2. כדי ליזום את התגובה החיסונית ברירית, אנטיגנים הרירית חייב להיות מועבר מן לומן המעיים על פני המכשול אפיתל לתוך זקיקי הלימפה מאורגן כמו טלאים של Peyer. Transcytosis אנטיגן זה מתווך על ידי תאים מיוחדים M אפיתל 3, 4. תאים M הם תאים אפיתל טיפוסיות כי פעיל phagocytose מקרומולקולות חיידקים. שלא כמו תאים דנדריטים (DCS) וכן מקרופאגים, אנטיגנים אשר היעד lysosomes של השפלה, תאים M בעיקר transcytose אנטיגנים הפנימו. זה transcytosis macromolecular נמרץ באמצעות תאים M מספק אנטיגן אל זקיקי הלימפה הבסיסית מאורגןד הוא האמין להיות חיוני ליזום אנטיגן ספציפי התגובה החיסונית ברירית. עם זאת, המנגנונים המולקולריים בקידום זה ספיגת אנטיגן על ידי תאים M אינם ידועים ברובם. יש לנו דיווח בעבר כי גליקופרוטאין 2 (Gp2), הביע במפורש על הממברנה פלזמה apical של תאים M בין enterocytes, משמש לרצפטור transcytotic עבור משנה של commensal ו פתוגניים enterobacteria, כולל coli Escherichia ו סלמונלה enterica serovar Typhimurium (ס Typhimurium ), על ידי הכרה FimH, רכיב של סוג אני פילי על הממברנה החיצונית חיידקי 5. כאן, אנו מציגים שיטה ליישום התיקון assay Peyer של העכבר לולאת המעי להעריך את ספיגת חיידקים על ידי תאים ז. שיטה זו היא גרסה משופרת של assay עכבר לולאת המעי שתואר לעיל 6, 7. נקודות לשיפור הן כדלקמן: 1. Isoflurane שימש כסוכן הרדמה. 2. כ 1 ס"מ ligated includ לולאת המעיתיקון ing של Peyer הוקם. 3. חיידקים נלקח על ידי תאים M היו שכותרתו fluorescently ידי מגיב תיוג או על ידי חלבון פלואורסצנטי overexpressing ניאון כגון חלבון פלואורסצנטי ירוק (GFP). 4. בתאי האפיתל M זקיק הקשורים מכסה תיקון של Peyer התגלו על ידי כל הר immunostainig עם נוגדן אנטי Gp2. 5. Transcytosis פלורסנט חיידקי ידי תאים M נצפו על ידי ניתוח מיקרוסקופי confocal. מעיים המדבקה Peyer של העכבר assay לולאה יכול לספק את התשובה איזה סוג של commensal או חיידקים פתוגניים transcytosed ידי תאים M, ועלולה לגרום לנו להבין את המנגנון המולקולרי של איך לגרות את המערכת החיסונית ברירית באמצעות תאים ז.
Protocol
1. הכנת תאים חיידקיים
- גליצרול Streak מצויד חיידקים ניאון (כמו ה-GFP לבטא ס Typhimurium) LB על צלחת אגר המכילה 100 מיקרוגרם / מ"ל של אמפיצילין.
- תרבות מושבה אחת מן אגר LB לילה 2 מ"ל של מדיום LB חדש.
- הוסף 0.5 מ"ל של תרבית החיידקים עד 4.5 מ"ל של מדיום LB דגירה חדשים עד צפיפות אופטית של 1.0 ב 600 ננומטר הוא הגיע.
- קציר תאים חיידקיים ידי צנטריפוגה (3000 XG, 5 דק ', 4 ° C).
- בטל supernatant ולשטוף פעמיים עם 5.0 מ"ל של תמיסת מלח סטרילית חיץ פוספט (PBS).
- Resuspend גלולה חיידקי עם 5 מ"ל של PBS, ולהשתמש 50 μl של השעיה המכיל כ -10 יחידה 7 המושבה להרכיב (CFU) כמו inoculum.
- במקרה של שימוש בחיידקים שכותרתו fluorescently, התאים חיידקי תויגו על ידי מגיב תיוג הקרינה על פי הפרוטוקול הסטנדרטי.
2.nesthesia
- ממלאים קופסת פלסטיק קטנה (10 x 10 x 5 ס"מ) עם 5% (v / v) מתאדה isoflurane מעורבב עם אוויר (קצב זרימה: 200 mL / min).
- הרדימי שמונה עד שש עשרה חלש בן עכברים זכר או נקבה בתיבה.
- העבר את העכברים לשולחן נתיחה לאחר הרדמה.
- ברציפות להרדים את העכברים ב -2% (v / v) מתאדה isoflurane מעורבב עם אוויר (קצב זרימה: 200 mL / min) (איור 1). זהו הליך סופני.
3. לולאה תיקון Peyer Ligated של assay
- 1cm לחרות של עור הבטן ולאחר מכן לחתוך את הבטן הצפק של עכבר הרדים לקחת את המעי הדק המכיל תיקון של Peyer.
- ולקשור את המעי עם חוט תפירה, מקפיד להימנע כלי הדם. הערה: רק אחד לאגד צד של המעי, ולהשאיר את הצד השני משוחרר.
- הזרק 50 μl של השעיה או חיידקי PBS (שליטה) בעזרת מזרק לתוך הלולאה תיקון Peyer של ligated על ים הרופףIDE של המעי (איור 2).
- Bind צד רופף, קרוב לבטן של עכבר עם קליפ.
- לאחר h 1, להסיר את ligated של Peyer לולאה תיקון ו להרדים את העכבר על ידי נקע בצוואר הרחם.
- Peyer והבלו של תיקון מן הלולאה תיקון Peyer של ligated.
- מהבהב הצד apical של תיקון של Peyer ידי 1ml של PBS עם שימוש במזרק המצורף מחט להסיר עודפי נוזלים ברירית וחיידקים. הברקה תיקון של Peyer נוסף פעמיים.
4. הר מכתים שלמות ניתוח מיקרוסקופי confocal של תיקון של Peyer
- תיקון של תיקון Peyer בפתרון Cytofix / Cytoperm BD על הקרח עבור שעה 1.
- לשטוף תיקון של Peyer שלוש פעמים עם 1ml של BD פרם / לשטוף חיץ עבור 5 דקות, ולאחר מכן לחסום עם 1 מ"ל של חיץ חסימת המכיל 0.1% (w / v) saponin, 0.2% (w / v) BSA ב PBS למשך 30 דקות על קרח.
- הוספת 200 פי בדילול אנטי עכבר GP2 נוגדנים חד שבטיים (5 מיקרוגרם / מ"ל) ל הדגימה כדי לזהותM תאים.
- דגירה של 2 שעות בטמפרטורת החדר או לילה ב 4 ° C.
- לשטוף שלוש פעמים עם 1 מ"ל של קר PBS, ולאחר מכן להוסיף 200 פי נוגדן אנטי דילול עכברוש IgG מצומדות עם DyLight549 (20 מיקרוגרם / מ"ל) כדי הדגימה.
- לדגור על מדגם קרח במשך 2 שעות.
- לשטוף שלוש פעמים עם 1 מ"ל של קר PBS, ולאחר מכן להוסיף 50 פי אלקסה בדילול 633 Phalloidin מצומדות כדי הדגימה כדי לזהות F-אקטין.
- לדגור על קרח במשך 2 שעות.
- לשטוף קלות עם 1 מ"ל של קר PBS. אז במקום 3-4 חתיכות זכוכית לכסות מעגלי בשקופית, ולהטביע את הדגימות בתמיסה 30% גליצרול ב PBS בשקופית (איור 3).
- שימו לב דגימות עם מיקרוסקופ DM-IRE2 confocal סריקת לייזר או שחזור DeltaVision מיקרוסקופ deconvolution.
5. נציג תוצאות:
הדוגמה הדגימה של עכבר ligated לולאה תיקון של Peyer assay עם GFP-S. typhimurium נצפתה עם מיקרוסקופ deconvolution שיקום DeltaVision (איור 4). GFP-S. Typhimurium הוא transcytosed ידי GP2 תאים + M. מעיים תיקון Peyer של העכבר assay לולאה יכול לזהות סוג של חיידקים פתוגניים commensal או שניתן transcytosed ידי תאים ז.

באיור 1. הרדמה של עכברים בתנאי isoflurane מתאדה. לאייר isoflurane סופקו על ידי מנגנון הרדמה ייעודי (צד שמאל).
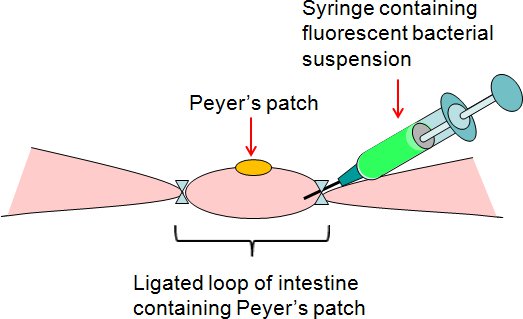
באיור 2. סיכום תיקון assay Peyer של ligated לולאה מעיים. המתלים חיידקי פלורסנט היה מוזרק על ידי מזרק לתוך הלולאה תיקון Peyer של ligated בצד רופף של המעי.
באיור 3. הר של דגימות. דגימות היו מוטבעים בתמיסה 30% גליצרול ב PBS בשקופית מיוחד בו צלחת פלסטיק מחורר (1 מ"מ עובי) היה כבול על ידי סוכן דבק בשקופית זכוכית.
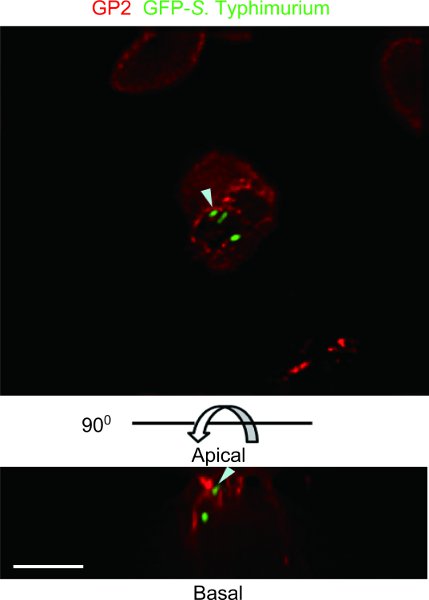
איור 4. דוגמה של עכבר ligated לולאה תיקון של Peyer assay עם GFP-Typhimurium ס. GP2, אשר דיווחו כסמן תא ספציפי M 5, היה מוכתם GP2 נוגדן אנטי עכבר (אדום). הדגימה נצפתה באמצעות מיקרוסקופ deconvolution DeltaVision שיקום. GFP-לבטא ס Typhimurium היה שותף מקומי עם GP2 על הממברנה של התא פלזמה apical M ו שלפוחית cytoplasmic subapical (ראשי חץ). למעלה, apical להציג. התחתונה בצד, נופים לרוחב. סרגל קנה מידה: 10 מיקרומטר.
Discussion
זמן הדגירה של תיקון Peyer של ligated עם השעיה חיידקית היא בדרך כלל עבור שעות 1 כדי לבחון את שילוב חיידקים לתאי M. במקרה של דגירה 4 שעות, חיידקים מזוהים לעתים קרובות באזור תא T של טלאים של Peyer. כמו הרדמה מתאדה נשימתית isoflurane יכול לשמור על עכברים יציב, זמן הדגירה של תיקון Peyer של li...
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
המחברים מבקשים להודות לכל חברי EIB לפיתוח טכניקה זו. מחקר זה מומן בחלקו על ידי מענק סיוע-in-למחקר מדעי על אזורי עדיפות "התנועה ממברנה" (HO), ו "המטריקס של תופעות זיהומיות" (קרן היסוד), מדענים צעירים (SF ו KH), ואת המחקר המדעי (HO ), וכן על תחומי מחקר מדעי חדשני "לוגיסטיקה תאיים" (HO), ממשרד החינוך, התרבות, הספורט, המדע והטכנולוגיה של יפן.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | הערות (אופציונלי) |
|---|---|---|---|
| LB-אגר אמפיצילין 100 | SIGMA | L5667 | |
| Cy3 מונו-reactive דיי חבילת | GE Healthcare | PA23001 | |
| אלקסה פלואוריד 350 carboxylic חומצה, succinimidyl אסתר | Invitrogen | A10168 | |
| שאיפת הרדמה מנגנון | שיננו Seisakusho | SN-487 | |
| קיבוע ו Permeabilization פתרון | BD | 554722 | |
| נגד עכבר גליקופרוטאין 2 נוגדן | MBL | D278-3 | 200 פי דילול (5μg/ml) |
| Anti-Rat עיזים IgG, F (ab ') 2 שבר ספציפי | ג'קסון ImmunoResearch | 112-505-006 | 200 פי דילול (20μg/ml) |
| אלקסה פלואוריד 633 Phalloidin | מולקולרית בדיקות | A22284 | דילול של פי 50 |
| Confocal לייזר סריקת מיקרוסקופ | Leica Microsystems | DMIRE2 | |
| DeltaVision שחזור deconvolution מיקרוסקופ | אפלייד Precision | DeltaVision Core |
References
- Fagarasan, S., Honjo, T. Intestinal IgA synthesis: regulation of front-line body defences. Nat. Rev. Immunol. 3, 63-72 (2003).
- Hapfelmeier, S. Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses. Science. 328, 1705-1709 (2010).
- Owen, R. L., Jones, A. L. Epithelial cell specialization within human Peyer's patches: an ultrastructural study of intestinal lymphoid follicles. Gastroenterology. 66, 189-203 (1974).
- Neutra, M. R., Mantis, N. J., Kraehenbuhl, J. P. Collaboration of epithelial cells with organized mucosal lymphoid tissues. Nat. Immunol. 2, 1004-1009 (2001).
- Hase, K. Uptake through glycoprotein 2 of FimH(+) bacteria by M cells initiates mucosal immune response. Nature. 462, 226-230 (2009).
- Punyashthiti, K., Finkelstein, R. A. Enteropathogenicity of Escherichia coli. I. Evaluation of mouse intestinal loops. Infect. Immun. 4, 473-478 (1971).
- Owen, R. L., Pierce, N. F., Apple, R. T., Cray, W. C. M cell transport of Vibrio cholerae from the intestinal lumen into Peyer's patches: a mechanism for antigen sampling and for microbial transepithelial migration. J. Infect. Dis. 153, 1108-1118 (1986).
- Owen, R. L. M cells--entryways of opportunity for enteropathogens. J. Exp. Med. 180, 7-9 (1994).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infect. Immun. 66, 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infect. Immun. 66, 3758-3766 (1998).
- Nagai, S. Role of Peyer's patches in the induction of Helicobacter pylori-induced gastritis. Proc. Natl. Acad. Sci. U. S. A. 104, 8971-8976 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved