Method Article
تحديد الشركاء البروتين عن طريق التفاعل جنبا الى جنب الانجذاب تنقية
* These authors contributed equally
In This Article
Summary
جنبا إلى جنب تقارب تنقية هو نهج قوي للتعرف على شركاء بروتين ملزمة. كدليل على المفهوم، تم تطبيق هذه المنهجية على eIF4E ترجمة جيدة تتميز عامل البدء إلى راسب المشترك العوامل الخلية المضيفة المشاركة في بدء الترجمة. ويتم تكييف هذه الطريقة بسهولة إلى أي بروتين خلوي أو فيروسي.
Abstract
والخطوة الحاسمة، والحد من كثير من الأحيان في فهم وظيفة المضيفة والبروتينات الفيروسية هو تحديد التفاعل شركاء بروتين خلوي أو فيروسي. هناك الكثير من النهج التي تتيح التعرف على شركاء التفاعل، بما في ذلك نظام هجين 2 الخميرة، وكذلك سحب المقايسات كما انخفض استخدام البروتينات المؤتلف ومناعي للبروتينات الذاتية تليها تحديد قياس الطيف الكتلي 1. وقد أبرزت الدراسات الحديثة فائدة مزدوجة تقارب العلامة تنقية بوساطة، إلى جانب اثنين من الخطوات شطف محددة في تحديد البروتينات المتفاعلة. واستخدمت في البداية لهذا النهج، ووصف تنقية الانجذاب جنبا الى جنب (وات)، في خميرة 2،3 لكن في الآونة الأخيرة قد تم تكييفه لاستخدامه في خلايا الثدييات 4-8.
كما إثبات المفهوم، من وضعنا تنقية تقارب جنبا إلى جنب (وات) طريقة استخدام جيدا تتميز ترجمة حقيقية النواة بدء القوات المسلحة الكونغوليةتور eIF4E 9،10. عامل ترجمة الخلوية eIF4E هو عنصر حاسم من مجمع eIF4F الخلوية العاملة في كاب يعتمد على بدء ترجمة 10. وتتكون العلامة وات المستخدمة في الدراسة الحالية من وحدتين G البروتين والببتيد streptavidin ملزم مفصولة فيروس إحفر التبغ (TEV) البروتيني تسلسل الانقسام. وتتكون العلامة وات المستخدمة في الدراسة الحالية من وحدتين G البروتين والببتيد streptavidin ملزم مفصولة فيروس التبغ إحفر (TEV) البروتيني تسلسل انشقاق 8. للتخلي عن الحاجة إلى جيل من خطوط الخلايا نسيلي، قمنا بتطوير نظام سريع يعتمد على التعبير عن برنامج المشورة التقنية الموسومة بروتين الطعم من البلازميد episomally حافظت على أساس pMEP4 (إينفيتروجن). وتمت السيطرة التعبير عن eIF4E الفئران الموسومة من هذا البلازميد باستخدام محرض كلوريد الكادميوم المروج metallothionein.
تحلل الخلايا التعبير عن واللاحقة تنقية تقارب عبر الربط إلى Rabbit مفتش الاغاروز، TEV انشقاق الأنزيم البروتيني، الربط إلى الاغاروز streptavidin مرتبط واللاحقة شطف البيوتين تحديد البروتينات المحددة العديدة على ما يبدو إلى eIF4E المنسدلة (بالمقارنة مع السيطرة على خطوط الخلايا معربا عن علامة TAP وحدها). وقد تم الحصول على هويات من البروتينات عن طريق الاستئصال من العصابات من 1D SDS-PAGE واللاحقة جنبا إلى جنب مطياف الكتلة. وشملت العناصر التي تم تحديدها من البروتينات المعروفة eIF4E ملزم eIF4G و4EBP-1. وبالإضافة إلى ذلك، المكونات الأخرى للمجمع eIF4F، من هو الذي eIF4E تم تحديد عنصر، وهي eIF4A وبولي بروتين ملزمة. القدرة على تحديد ليس فقط يعرف شركاء الربط المباشر، فضلا عن الثانوية البروتينات المتفاعلة، يسلط الضوء على مزيد من جدوى هذا النهج في توصيف البروتينات من وظيفة غير معروفة.
Protocol
1. جيل من خطوط الخلايا: pMEP4 ترنسفكأيشن / التعبير
- Transfect الخلايا التي تحتوي على ناقلات التعبير pMEP4 وحدد مع 100 ميكروغرام من B هيغروميسين / مل (روش) حتى قتل جميع الخلايا وهمية transfected قبالة. يتم الحفاظ على البلازميد pMEP4 episomally ذلك ليست هناك حاجة لعزل الحيوانات المستنسخة محددة.
- يمكن تحريض الخلايا التي تحتوي على ناقلات pMEP4 بواسطة العلاج مع 10 ميكرومتر CdCl 2 لمدة 16 ساعة. وينبغي تأكيد التعبير وinducibility على نطاق ضيق قبل التضخيم من خطوط الخلايا. ويمكن للبروتين وات الموسومة الكشف بسهولة كما بروتين المجالات G ربط الأجسام المضادة من جميع الأنواع تقريبا. على نطاق واسع التنقيات مطلوبة عادة 10 متكدسة 175 سم 2 قوارير من الخلايا. وهذا يعادل ما يقرب من 2 8 خلايا X10 تعبير.
2. خلية المحللة إعداد
- تتخلص من الخلايا في برنامج تلفزيوني والجمع في أنبوب واحد 50 مل. تدور 1200X GFأو 5 دقائق (وهذا ينبغي أن يؤدي إلى 2-3 مل من الخلايا معبأة في البداية، الأمر الذي يقلل إلى حوالي 1.5 مل بعد غسل).
- غسل الخلايا ثلاث مرات في الجليد الباردة في برنامج تلفزيوني (50 ملل في كل مرة).
- ليز الخلايا في 5 مل العازلة تحلل (50 ملم تريس، حمض الهيدروكلوريك (7.5 درجة الحموضة)، 125 مم كلوريد الصوديوم، الجلسرين بنسبة 5٪، 0.2٪ NP-40، 1.5 ملم MgCl 2، 25 ملم ناف، 1 ملم نا 3 VO (4) ومثبطات الأنزيم البروتيني ). ينبغي أن يضاف ناف، نا 3 VO (4) ومثبطات الأنزيم البروتيني جديدة: مذكرة. ماصة صعودا ونزولا 10 مرات قبل ان يغادر لمدة 5 دقائق على الجليد. حقنة صعودا وهبوطا 5-10 مرات باستخدام إبرة حادة قبل ان يغادر مجددا على الجليد لمدة 5 دقائق على الجليد. كرر غسول ويترك لمدة 5 دقائق أخرى على الجليد.
- تجميد ذوبان الجليد في المحللة مرتين (جليد السائل غ / م 2 أو الجافة والايثانول). لا تسمح عينة للوصول إلى أكبر من 4 درجات مئوية. ملاحظة: يمكنك تخزين هذه العينة على -80 درجة مئوية حتى يكون لديك الوقت لمعالجة.
- قسامة العينة في أنابيب 1.5 مل وإزالة الخلايا unlysed ودebris بواسطة الطرد المركزي (10 دقائق في 4 درجات مئوية، 16000 X ز).
- استرداد طاف، والجمع في أنبوب 15 مل صقر و (اختياريا) يمر عبر فلتر 0.45 ميكرون قبل أخذ عينة 20 ميكرولتر لتقدير العائد من البروتين. إزالة مزيد من قسامة 50 ميكرولتر لتحليلها لاحقا (نموذج 1).
3. الربط إلى أرنب مفتش-الاغاروز
(ملاحظة: يجب أن يتولى جميع يدور بها في ز 1200X في جهاز للطرد المركزي المبردة في 4 درجة مئوية لمدة 1 دقيقة، ما لم يذكر خلاف ذلك)
- resuspend بلطف مفتش-الاغاروز أرنب حل (سيغما الدريخ) بواسطة يحوم زجاجة. أخذ 380 ميكرولتر من الاغاروز مفتش (باستخدام قطع رأس ماصة 1ml) وإزالة الشحن / محاليل حافظة بواسطة الطرد المركزي لمدة 1 دقيقة. يغسل ثلاث مرات في الاغاروز العازلة تحلل مبرد (4 درجة مئوية) باستخدام الطرد المركزي لتوضيح. وينبغي أن العائد النهائي من الاغاروز يكون حوالي 250 ميكروليتر من الخرز معبأة.
- إضافة المحللة خلية تطهيرها من 2.6 (في حوض 15 مل صقره) إلى الاغاروز أرنب، مفتش غسلها والحضانة لمدة 3 ساعات (أو بين عشية وضحاها) في 4 درجات مئوية باستخدام خلاط الدورية.
- تدور أسفل حبات الاغاروز لمدة 5 دقائق في درجة مئوية (4) وإزالة طاف للتحليل لاحقة (نموذج 2). ملاحظة: الآن يجب أن برنامج المساعدة التقنية المفتاحية بروتين تترافق مع الخرز.
4. TEV البروتيني الانقسام
(ملاحظة: يجب أن يتولى جميع يدور بها في ز 1200X في جهاز للطرد المركزي المبردة في 4oC لمدة 1 دقيقة، ما لم يذكر خلاف ذلك)
- يغسل أرنب مفتش الخرز الاغاروز ثلاث مرات في المخزن المبرد تحلل (4 درجة مئوية) باستخدام الطرد المركزي لتوضيح (ملاحظة: المخزن المؤقت لا ينبغي أن تحلل تحتوي على مثبطات الأنزيم البروتيني). وينبغي الحرص على عدم إزالة أو تفقد أي الخرز خلال خطوات الغسيل.
- تغسل حبات أخرى مرتين مع عازلة انشقاق TEV-البروتيني (10 ملم تريس، حمض الهيدروكلوريك (7.5 درجة الحموضة)، و 100 كلوريد الصوديوم مم، و 0.2٪ NP-40) باستخدام الطرد المركزي لتوضيح. بعد غسل مشاركة إزالة بعناية كل لىمضغة من الخرز.
- يعد الانقسام البروتيني TEV مزيج؛ لكل عينة تشمل 467،5 ميكرولتر H 2 O، 25 ميكرولتر 20X TEV العازلة (إينفيتروجن)، و 5 ميكرولتر DTT 0.1M و 2.5 ميكروليتر (25 U) TEV البروتياز (إينفيتروجن). إضافة 500 ميكروليتر من هذا المزيج انشقاق TEV على كل عينة من الخرز معبأة ونقل هذا المزيج كله إلى أنبوب 1.7 قبل مشحم مل (Costar). قبل حضانة إزالة قسامة 30 ميكرولتر لتحليلها لاحقا (نموذج 3).
- احتضان التفاعل البروتيني TEV بين عشية وضحاها في 4 درجة مئوية باستخدام خلاط الدورية. لاحظ التي يمكن أن تستخدم أقصر حضانات مرات تبعا لطبيعة البروتين الطعم وسهولة الوصول إلى موقع البروتيني انشقاق TEV لكن فترة حضانة الحد الأدنى ينبغي أن تحدد تجريبيا.
5. الربط إلى Ultralink Streptavidin مشلول زائد الخرز
(ملاحظة: يجب أن يتولى جميع يدور بها في ز 1200X في جهاز للطرد المركزي المبردة في 4 درجة مئوية لمدة 1 دقيقة، ما لم يذكر خلاف ذلك)
- منبذة رد فعل الانقسام TEV التي تحتوي على مفتش أرنب الخرز الاغاروز لمدة 5 دقائق في ز 1200X (4 درجة مئوية). إزالة قسامة 20 ميكرولتر من طاف أوضح للتحليل (نموذج 4)
- نقل طاف المتبقية (حوالي 480 ميكرو لتر) إلى 1.5 مل الطازج قبل مشحم أنبوب (Costar) وترك هذا على الجليد. لا تتخلص من هذا طاف - وهذا يحتوي على بروتين TEV الطعم المشقوق وأي البروتينات المرتبطة بها ملزم.
- إضافة 500 ميكرولتر من العازلة تحلل مبرد (القسم 2.3) إلى حبات أرنب المتبقية الاغاروز مفتش الحكومة وresuspend. منبذة هذا الخليط لتوضيح الخرز قبل إزالة طاف والجمع بينها وبين أن من الخطوة 5.2. ترك هذا الأنبوب على الجليد (يجب أن تحتوي الآن ~ 980 ميكروليتر من العينة).
- الإبقاء على مفتش أرنب الخرز الاغاروز للتحليل لاحقة (نموذج 5). ملاحظة: إذا قمت بتشغيل هذه العينة على هلام SDS-PAGE (أو لطخة غربية) وسوف تعطي الكثير من المعلومات الأساسية بسبب وجود كثيف للمفتش والضوءالسلاسل.
- في هذه الأثناء resuspend بلطف Ultralink مشلول Streptavidin زائد الخرز الاغاروز (بيرس) عن طريق تحريكها زجاجة. باستخدام 200 رأس ماصة ميكرولتر مع خفض نهاية، قسامة 70 ميكرولتر من الخرز streptavidin في العينة إلى ما قبل مشحم أنابيب 1.5 مل وإزالة الشحن / محاليل حافظة بواسطة الطرد المركزي. ملاحظة: هذه حبات صغيرة جدا وغير ذلك "منقار البطة" أو شقة / يمكن استخدامها ضيق العضوية نصائح لتقليل الخسائر حبة أثناء الغسل.
- تغسل حبات streptavidin ثلاث مرات في المخزن المبرد تحلل (4 درجة مئوية) باستخدام الطرد المركزي لتوضيح. وهذا ينبغي أن يترك ما يقرب من 45-50 ميكروليتر من الخرز معبأة في أنبوب.
- نقل طاف انشقاق TEV-البروتيني (أي ميكرولتر 980 من عينة من الخطوة 5.3) لأنبوب يحتوي على حبات streptavidin غسلها والحضانة لمدة 3 ساعات (أو بين عشية وضحاها) في 4 درجات مئوية باستخدام خلاط الدورية.
- تدور أسفل حبات streptavidin لمدة 5 دقائق في درجة مئوية (4) وإزالة طاف للتحليل لاحقة (سامالتنوير القائل 6). تغسل حبات streptavidin ثلاث مرات في المخزن المبرد تحلل (4 درجة مئوية) باستخدام الطرد المركزي لتوضيح. بعد غسل النهائي، وإزالة بعناية كل العازلة غسيل المتبقية.
6. البيوتين شطف من الببتيد الربط streptavidin والبروتين الطعم
(ملاحظة: يجب أن يتولى جميع يدور بها في ز 1200X في جهاز للطرد المركزي المبردة في 4 درجة مئوية لمدة 1 دقيقة، ما لم يذكر خلاف ذلك)
- أزل البروتينات الموسومة من الخرز streptavidin وذلك بإضافة 500 ميكروليتر من PBS: البيوتين (1 ملم مد البيوتين) وتفرخ في 4 درجة مئوية لمدة 3 ساعات (أو بين عشية وضحاها) باستخدام خلاط الدورية.
- تدور أسفل حبات streptavidin لمدة 5 دقائق في درجة مئوية (4) وإزالة طاف على أنبوب 1.5 مل قبل مشحم (ملاحظة: هذا هو النموذج النهائي الخاص بك / شطف (نموذج 7).
- إضافة آخر البيوتين 500 ميكروليتر: برنامج تلفزيوني لحبات streptavidin المتبقية واحتضان في 4 درجة مئوية لمدة 2-3 ساعات (أو بين عشية وضحاها) باستخدام خلاط الدورية.
- إعادةجفت الخطوة 6.2 و الجمع بين elutions اثنين (عينة 7). ويمكن تخزين هذه شطف النهائي في -80 درجة مئوية.
- لتقييم كفاءة شطف البيوتين، وتجميد حبات streptavidin المتبقية والغليان في وقت لاحق العازلة عينة SDS (نموذج 8) (التوصيات: LaneMarker 5X العازلة عينة الحد من فيشر).
7. بروتين تركيز
- وشطافة النهائي (نموذج 7) يجب أن تتركز قبل تحليل نظرا لتركيز منخفض البروتين والحجم الكبير نسبيا. ويمكن تحقيق ذلك باستخدام الوزن الجزيئي المنخفض (<5 قده) أعمدة تدور Vivaspin (Vivascience). تهدف إلى التركيز على خفض مستوى الصوت إلى أقل من 100 ميكروليتر. ويمكن غليه هذه العينة النهائية وتخزينها في المخزن عينة بروتين (التوصيات: LaneMarker 5X العازلة عينة الحد من فيشر).
8. تحليل
- ويمكن تحليل عينات 1-8 بواسطة طخة غربية لتحديد كفاءة هدم. ملاحظة: معظم الأجسام المضادة الثانوية سوفمع المجالات G البروتين من البروتين الانصهار عبر رد فعل، ولكن تتم إزالة هذا بعد انشقاق TEV البروتيني.
- ويمكن تحليل عينة 7 من 1D أو 2D SDS PAGE. لا يمكن أن يؤديها تلطيخ استخدام الفضة أو Coomassie (التوصيات: SilverQuest تلطيخ الفضية وصمغي تلطيخ Coomassie الأزرق مجموعات من إينفيتروجن). لا يمكن أن يؤديها تحديد بروتين باستخدام الطيف الكتلي.
9. ممثل النتائج
وتقدم مثالا للتحليل SDS-PAGE 1D للشطف النهائي (نموذج 7) من هذا البروتوكول إلى تحديد الشركاء ملزم من eIF4E وات المفتاحية في الشكل 2. هذا جل ممثل يعكس الطبيعة المعقدة وفيرة من التفاعلات eIF4E مع غيرها من البروتينات في الخلية. بالمقارنة مع الشاهد السلبي هو مبين أيضا في الشكل 2، ولدت من خط خلية يعبر فقط عن العلامة وات، ويوضح خصوصية هذا eIF4E اصطاد المنسدلة. في هذا المثال 15٪ من شطف النهائي المركزة (عينةوقد تم تحليل 7) بواسطة SDS-1D الصفحة باستخدام المواد الهلامية المتاحة تجاريا التدرج مسبقة الصنع قبل ان تلطخ باستخدام تلطيخ الفضة Silverquest عدة من إينفيتروجن.
وعادة ما يتم تحليل 50-85٪ من شطف المتبقية نهائي المركزة (نموذج 7) مع Coomassie صمغي وصمة عار (إينفيتروجن). تم استخراج عينات من ثم (شرائح هلام / عصابات) من حارة كامل وتحليلها بواسطة مطياف الكتلة.
تم ترشيح البروتينات التي تم تحديدها في eIF4E المنسدلة ضد شركاء ملزم من سيطرة سلبية لتحديد غير محددة شركاء ملزم. ويمكن رؤية البروتينات النهائية التي تم تحديدها باستخدام هذه العملية من eIF4E علامات وات في الشكل 2، والذي هو ممثل من البروتينات الطبيعية التي تم تحديدها باستخدام هذه التقنية. وبالإضافة إلى ذلك، تم تنظيم عدد من الوحدات الفرعية eIF3 كما حددت (لا تظهر البيانات).
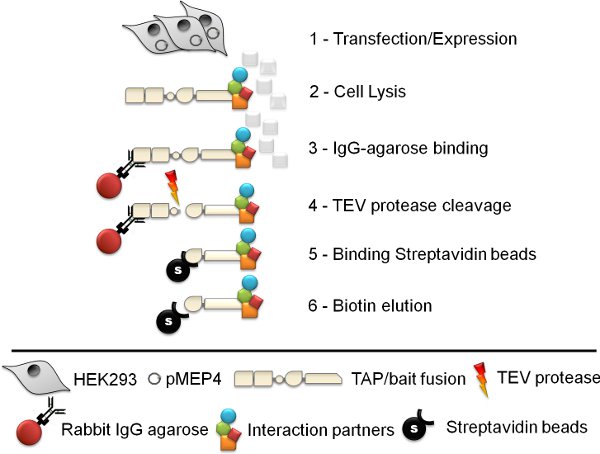
الشكل 1. التخطيطي للجنبا إلى جنب إجراء تنقية تقارب. وجنبا إلى جنب خطوة تقارب 6 تنقية (وات) بروتوكول ينطوي على خلية توليد خط، تحلل الخلية، أرنب مفتش الاغاروز المناعية هطول الأمطار، وTEV انشقاق الأنزيم البروتيني، streptavidin تنقية تقارب حبة وشطف البيوتين أخيرا.
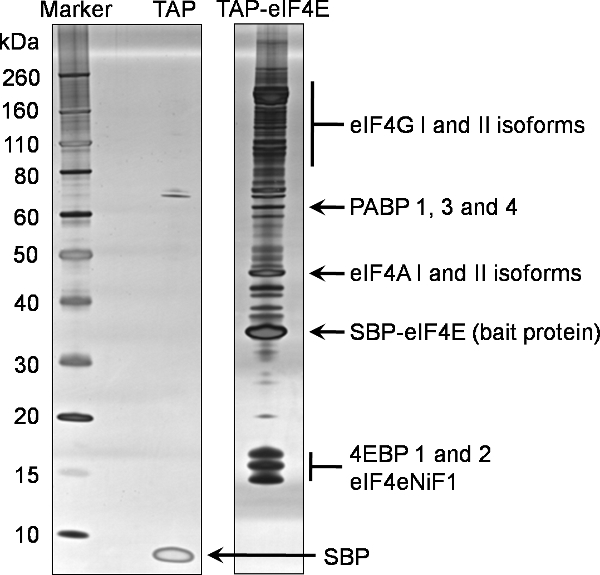
الشكل 2. جنبا إلى جنب تقارب تنقية البروتين eIF4E الفئران. التفاعل شركاء N عضال تنصت المفتاحية وتنقيته eIF4E من خلايا حقيقية النواة HEK293 باستخدام بروتوكول المرفق. وكان من تحليل قدر ضئيل من 20٪ من شطف النهائي (نموذج 7) بواسطة SDS-PAGE على هلام مسبقة الصنع الانحدار 4-12٪ (وات، eIF4E حارة). تم إجراء تحليل ما يعادلها للعلامة وحده (حارة وات). وقد تم تحديد البروتينات باستخدام تلطيخ الفضة. ويسلط الضوء البروتينات التي تم تحديدها في وقت لاحق من قبل قياس الطيف الكتلي لنفس العينة على هذا الجل.
الاختصارات: eIF4G؛ بدء ترجمة حقيقية النواة و4 الفاعل غاما، PABP؛ polyA بروتين ملزمة، eIF4A: حقيقية النواة عامل بدء ترجمة 4 ألفا، SBP-eIF4e؛ الطعم وات المتبقية البروتين الذي يحتوي على الببتيد streptavidin ملزم تنصهر ل4E ترجمة حقيقية النواة عامل بدء، 4EBPs؛ حقيقية النواة عامل بدء 4E ترجمة ملزم البروتينات، eIF4eNiF1l بدء ترجمة حقيقية النواة عامل 4E النووية عامل الاستيراد 1، SBP، والببتيد streptavidin المتبقية ملزم من الببتيد TAP غير مدمجة TEV.
Discussion
تقنية العنونة وات يتضح هنا يدل على طريقة محددة للغاية وصرامة لعزل شركاء ملزم للبروتينات الطعم في الخلايا حقيقية النواة. ويمكن تطبيق هذا النهج على البروتينات الخلوية والفيروسية. على حد علمنا، هذه هي المرة الأولى التي يتم فيها تطبيق هذه التقنية لعامل eIF4E ترجمة بدء. تحديد eIF4G eIF4E البروتينات ملزم المعروفة و4EBPs وباستخدام هذه التقنية ويؤكد على صحة هذا النهج. وبالإضافة إلى ذلك، وتحديد العنصر المتبقي من مجمع eIF4F، وهي eIF4A، وPABP يؤكد ان التفاعل غير المباشر ومجمعات التعليم العالي، لا تزال سليمة خلال عملية تنقية. وكان التعرف على الأشكال الإسوية متعددة من البروتينات الكنسي ملزم eIF4e واضحة أيضا. يتم وصف هذه في مزيد من التفاصيل في الشكل 2.
فيما يتعلق بالقيود على النهج، ينبغي توخي الحذر معينة فيما يتعلق باختيارمن البروتين و الطعم. أو عدم وضع علامة TAG في N-أو محطة-C قد يكون من المستحسن لإجراء فحص وظيفي أو دراسة توطين انصهار بروتين بواسطة المجهر قبل تنقية النطاق الكامل لضمان مشتق الموسومة هو وظيفي. قد لا يتجزأ أو بروتينات غشاء نووي بالضرورة أن صدر عن ظروف منظف معتدل نسبيا وصفها في خطوة تحلل. كما هو الحال مع جميع immunoprecipitations وفحوصات مماثلة المنسدلة، يمكن إجراء تعديلات على طبيعة وتركيز المنظفات في المخزن المؤقت تحلل إلى زيادة كفاءة تحلل. ويمكن أيضا تركيز أيوني للمخازن وتحلل الغسيل يمكن تعديلها لزيادة أو نقصان صرامة للتنقية. ومن الممكن أيضا لأداء تنقية أولية تحت ظروف معتدلة معيار (المذكورة أعلاه) ولكن بعد ذلك تفرق الخرز streptavidin (القسم 5.8) في aliquots 4-5، والتي يمكن بعد ذلك يتم غسلها تحت يخدع الأيونية زيادةditions. هذا قد تمكن المستخدم من تحديد الظروف المثلى التي تعمل على إزالة غير محددة البروتينات المتفاعلة. ويمكن أيضا أن العملية برمتها يمكن تنفيذها باستخدام ترنسفكأيشن عابر حيث من المعروف أن الشركاء التفاعل وجودها أو عدم وجود يحددها طخة غربية لاحقة فقط. في هذه الحالة نقترح 2 100cm 2 أطباق من الخلايا كل transfected مع 8 ميكروغرام التعبير البلازميد. هذا الإجراء هو تعديل للاستخدام خاص عند النظر في قدرة المشتقات متحولة من البروتين TAP-انصهار للتفاعل مع شركاء ملزم معروف.
تحليل عينات من 1 إلى 8 في المواد الهلامية الفضة SDS-PAGE الملون (أو لطخة غربية ما إذا كان الجسم المضاد هو متاح) هو وسيلة ممتازة لاستكشاف الأخطاء وإصلاحها، يجب أن تفشل هذه التقنية لتوليد نتائج مقبولة. ويمكن تحليل كفاءة كل هطول الأمطار تقارب القائم وشطف محددة باستخدام هذا النهج أخذ العينات بطريقة منهجية. وينبغي أخذ عينات 1-8 خلال OPTIMسعودة للبروتوكول لكل بيت جديد.
تقنية العنونة البرنامج يوفر بديلا قويا وقوية لمناهج أخرى مثل ضريبة السلع والخدمات سحب هبوطا، خميرة 2 المقايسات هجين وما إلى ذلك. تنقية تقارب مزدوجة وخطوات محددة شطف (انشقاق TEV وشطف البيوتين) توفير خصوصية وصرامة على الإبقاء على ارتفاع مستوى طوال الإجراء تنقية. ويمكن للغاية أن تطبق هذه التقنية إلى أي بروتين، ويمثل ذلك وسيلة ممتازة للتعرف على شركاء ملزم لهدف بروتين من الفائدة.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وقد تم تمويل هذا البحث من قبل الزمالة ويلكوم ترست كبار منحت للدكتور إيان Goodfellow.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
| هيغروميسين B | روش | 10843555001 | |
| أرنب مفتش الاغاروز | سيغما | A2909 | |
| AC-TEV البروتياز | إينفيتروجن | 12575-015 | |
| البروتيني المانع كوكتيل | Calbiochem | 539134 | |
| مشلول Ultralink Streptavidin الخرز زائد | ثقب | 53116 | |
| Vivaspin 500 المكثف الطرد المركزي (5KDa) | Vivaspin | V50112 | |
| SilverQuest عدة الفضة تلطيخ | إينفيتروجن | LC6070 | |
| Novex صمغي تلطيخ Coomassie الأزرق عدة | إينفيتروجن | LC6025 | |
| 1.7ml أنابيب prelubricated | Costar | 3207 | |
| Microcapillary نصائح ماصة | VWR | 37001-150 | |
| NuPage 4-12٪ مكرر تريس التدرج المواد الهلامية | إينفيتروجن | NP0322BOX | |
| CdCl 2 | سيغما | 202908 | |
| 5X الواق SDS عينة | الصياد | PN39000 |
References
- Williamson, M. P., Sutcliffe, M. J. Protein-protein interactions. Biochem. Soc. Trans. 38 (4), 875-878 (2010).
- Rigaut, G. A generic protein purification method for protein complex characterization and proteome exploration. Nat. Biotechnol. 17 (10), 1030-1032 (1999).
- Blackwell, C., Brown, J. D. The application of tandem-affinity purification to Candida albicans. Methods Mol. Biol. 499, 133-148 (2009).
- Cochrane, A. Stable complex formation between HIV Rev and the nucleosome assembly protein, NAP1, affects Rev function. Virology. 388 (1), 103-111 (2009).
- Fernandez, E. Targeted tandem affinity purification of PSD-95 recovers core postsynaptic complexes and schizophrenia susceptibility proteins. Mol. Syst. Biol. 5, 269-269 (2009).
- Gloeckner, C. J. Tandem affinity purification of protein complexes from mammalian cells by the Strep/FLAG (SF)-TAP tag. Methods Mol. Biol. 564, 359-372 (2009).
- Holowaty, M. N. Protein profiling with Epstein-Barr nuclear antigen-1 reveals an interaction with the herpesvirus-associated ubiquitin-specific protease HAUSP/USP7. J. Biol. Chem. 278 (32), 29987-29994 (2003).
- Burckstummer, T. An efficient tandem affinity purification procedure for interaction proteomics in mammalian cells. Nat. Methods. 3 (12), 1013-1019 (2006).
- Goodfellow, I. Calicivirus translation initiation requires an interaction between VPg and eIF 4 E. EMBO Rep. 6 (10), 968-972 (2005).
- Goodfellow, I. G., Roberts, L. O. Eukaryotic initiation factor 4E. Int. J. Biochem. Cell Biol. 40 (12), 2675-2680 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved