Method Article
鉴定蛋白质相互作用的合作伙伴使用串联亲和纯化
摘要
串联亲和纯化的蛋白结合合作伙伴的标识是稳健的做法。由于概念证明,这种方法的应用以及特色的翻译起始因子eIF4E共沉淀的宿主细胞因子参与翻译起始。这种方法是很容易适应任何细胞或病毒蛋白。
摘要
一个经常限制的关键一步,在了解主机和病毒蛋白的功能是相互作用的细胞或病毒蛋白伙伴的标识。有许多方法,使识别的互动合作伙伴,包括酵母双杂交系统,以及下拉检测用重组蛋白免疫沉淀和内源性蛋白质质谱鉴定1。最近的研究都强调实用的双亲和力标签介导的净化,再加上两个相互作用的蛋白质鉴定的具体洗脱步骤。这种方法称为串联亲和纯化(TAP)的,最初用于酵母2,3,但最近已经适应在哺乳动物细胞中的使用4-8。
作为证据的概念,我们已经建立了串联亲和纯化(TAP)的方法,利用良好的特点真核翻译起始因子TOR eIF4E的9,10。细胞翻译因子eIF4E是一个蜂窝eIF4F复杂的重要组成部分,涉及帽依赖的翻译起始10。在目前的研究中使用的TAP标签是两个G蛋白单位组成,由烟草蚀纹病毒(TEV)蛋白酶切割序列1链亲和素结合肽的分离。在目前的研究中使用的TAP标签组成的两个G蛋白单位和1链亲和素结合肽的分离,由烟草蚀纹病毒(TEV)蛋白酶切割序列8。放弃代克隆细胞系的需要,我们开发了一种快速的系统依赖于从episomally保持质粒的TAP标签的诱饵在pMEP4(Invitrogen公司)为基础蛋白表达。使用氯化镉诱导金属硫蛋白启动子控制的标签从这个质粒的小鼠eIF4E的表达。
通过结合到R的表达和随后的亲和纯化的裂解abbit抗体琼脂糖,TEV蛋白酶裂解,结合链霉联系琼脂糖和生物素洗脱随后确定了许多蛋白质显然是具体的eIF4E的下拉(时相比,控制细胞株单独表达TAP标签)。蛋白质的身份获得了从一维的SDS-PAGE和随后的串联质谱带切除。确定的组件包括知名eIF4E的结合蛋白eIF4G和4EBP-1。此外,eIF4F复杂的其他组成部分,其中eIF4E的是一个组件被确定,即eIF4A和聚A结合蛋白。识别能力,不仅直接约束力的合作伙伴以及二级相互作用的蛋白质,进一步突出了在未知功能的蛋白质的特性,这种方法的效用。
研究方案
1。代细胞系:pMEP4转/表达
- 与pMEP4表达载体转染细胞和潮霉素B /毫升(罗氏)与100微克的选择,直到所有的模拟转染细胞被杀害。在pMEP4质粒保持episomally所以没有必要隔离特定的克隆。
- 10μM2 CDCL 16小时治疗,可诱发细胞包含pMEP4向量。应证实前小规模扩增的细胞株的表达和诱发。作为G蛋白域几乎所有种类的抗体结合,可以很容易地检测到的TAP标签蛋白。对于大规模纯化通常为10合流175厘米2的细胞瓶是必需的。这相当于约2 X10的8表 达细胞。
2。细胞裂解液的准备
- 刮至PBS的细胞,并结合成一个单一的50毫升管。旋转1200X GF或5分钟(这应该导致在2-3毫升包装细胞开始,清洗后减少到约150毫升)。
- 在冰冷的PBS(每次50毫升)洗细胞三次。
- 在5毫升裂解液(裂解细胞50毫米的Tris-HCl(pH值7.5),125 mM氯化钠,5%甘油,0.2%的NP-40,MgCl 2的 1.5毫米,25毫米,1毫米氟化钠钠4 3旁白和蛋白酶抑制剂)。注:氟化钠,钠3 VO 4和蛋白酶抑制剂应补充新鲜。吸取了前5分钟在冰上留下的10倍。离开冰再次在冰上5分钟前使用钝针注射器上升和下降的5-10倍。重复syringing和离开进一步冰上5分钟。
- 冻融裂解两次(液体N 2 /或干冰块和乙醇)。不要让样品达到大于4°C。注意:您可以储存在-80°C,直到你有时间来处理这个范例。
- 分装到1.5毫升管样本和删除unlysed细胞和Debris通过离心(在4°C,16,000 XĞ10分钟)。
- 恢复上清液,在15毫升猎鹰管相结合,并通过0.45微米的过滤(可选)前通过采取定量蛋白质产量的20μL样品。卸下进一步的后续分析(样品1)50μL等份。
3。结合兔IgG-琼脂糖
(注:应进行所有的自旋1200XĞ在冷冻离心机1分钟,在4°C,除非另有说明)
- 纷飞瓶轻轻悬浮兔IgG-琼脂糖溶液(Sigma-Aldrich公司)。取380μL的IgG琼脂糖(截止1毫升枪头)和离心1分钟,除去航运/防腐剂的解决方案。琼脂糖三次洗冷冻裂解液(4℃)使用离心澄清。琼脂糖的最终产量应该装珠约250μL。
- 从2.6(15毫升猎鹰浴缸中加入清除的细胞裂解液E)水洗兔IgG琼脂糖孵育3小时(或隔夜)在4°C使用一个旋转的搅拌机。
- 降速琼脂糖珠在4°C 5分钟,取出供后续分析(样品2)上清。注:标签蛋白的TAP现在应与珠。
4。 TEV蛋白酶切割
(注:应进行所有的自旋1200XĞ在冷冻离心机在4℃1分钟,除非另有说明)
- 冷冻裂解液洗兔IgG琼脂糖珠三次(4°C)使用离心澄清(注:裂解液中不应该包含蛋白酶抑制剂)。应小心,不要删除或失去任何珠在洗涤步骤。
- 洗珠TEV蛋白酶裂解缓冲使用离心澄清(10毫米的Tris-HCl(pH值7.5),100 mM氯化钠,0.2%NP-40)进一步两次。最后一次洗涤后小心取出所有李从珠嚼食。
- 准备一个TEV蛋白酶切割组合;每个样品包括467.5μL 氢澳,25μL20X,TEV缓冲(Invitrogen公司),5微升0.1M数码地面电视和2.5μL(25美)TEV蛋白酶(Invitrogen公司)。加入500μl这个TEV酶切组合的每个样品包装珠和整个组合转移到1.7毫升预润滑管(COSTAR)。之前,以孵化为后续分析(样品3)删除30μL等份。
- TEV蛋白酶反应过夜孵育4℃用一个旋转的搅拌机。请注意,可用于较短的孵化时间取决于诱饵蛋白和无障碍TEV蛋白酶裂解位点,但最小的孵化时间的性质,应凭经验确定。
5。结合ULTRALINK固定的链霉加珠
(注:应进行所有的自旋1200XĞ在冷冻离心机1分钟,在4°C,除非另有说明)
- 离心TEV酶切反应,其中包含为1200X克(4℃)5分钟的兔IgG琼脂糖珠。删除的分析澄清上清20μL等份(样品4)
- 其余上清液(约480μL)转移到一个新的1.5毫升预润滑管(COSTAR)离开冰。不要扔掉此上清 - 这包含TEV切割诱饵蛋白和任何关联的结合蛋白。
- 新增500个冷藏裂解缓冲液(2.3节),其余兔IgG琼脂糖珠和重悬。这种混合物离心澄清之前,去除上清相结合,从步骤5.2珠。离开冰管(它现在应该包含〜980μL的样品)。
- 保留供后续分析兔IgG琼脂糖珠(样品5)。注:如果你运行这个样本上的SDS-PAGE胶(或印迹),它会给很多背景,由于存在的IgG重型和轻型链。
- 同时轻轻悬浮ULTRALINK固定纷飞的瓶子,加链霉亲和素琼脂糖珠(皮尔斯)。使用切成末,预润滑1.5毫升管分装成70μL链亲和素珠每样本200μL枪头和离心除去运输/防腐剂的解决方案。注意:这些珠子都非常小,所以“鸭子嘴”或平/窄端的技巧可以使用,以尽量减少损失洗涤过程中的珠。
- 洗链亲和素珠冰鲜裂解液3次(4°C)使用离心澄清。这应该留下约45-50微升,每管装珠。
- 转让TEV蛋白酶裂解上清(即从步骤5.3样品980μL)管含3小时(或隔夜)洗链亲和素磁珠孵育4℃用一个旋转的搅拌机。
- 降速在4°C 5分钟的链亲和素珠,去除上清,为后续的分析(山姆PLE 6)。洗链亲和素珠冰鲜裂解液3次(4°C)使用离心澄清。最后一次洗涤后,小心地取出所有剩余的洗涤缓冲液。
6。素的链亲和素的结合肽和诱饵蛋白的洗脱
(注:应进行所有的自旋1200XĞ在冷冻离心机1分钟,在4°C,除非另有说明)
- 加入500μL的PBS洗脱标记的链亲和素珠蛋白生物素(1毫米D-生物素),并在4°C孵育3小时,用一个旋转的搅拌机(或过夜)。
- 降速5分钟,在4°C的链亲和素珠,并取出上清液1.5毫升预润滑管(注:这是你最后的样品/洗脱(7)样品。
- 另外500μL生物素:PBS加入剩余的链亲和素珠,并在4°C孵育2-3小时,用一个旋转的搅拌机(或过夜)。
- 重新泥炭加强6.2,并结合两个洗脱(样本7)。这是最后的洗脱可以储存在-80°C
- 为了评估生物素洗脱效率,冻结余下的链亲和素珠,煮沸后在SDS样品缓冲液(样品8)(建议:减少从费舍尔LaneMarker 5倍样品缓冲液)。
7。蛋白质浓度
- 最后洗脱液(样品)需要分析前要集中,因为低蛋白浓度相对高容量。这可以使用低分子量(<5 KDA)Vivaspin自旋列(Vivascience)。旨在集中量小于100μL。这最后的样本,可煮,蛋白上样缓冲液中(建议:LaneMarker 5倍减少从费舍尔的样品缓冲液)。
8。分析
- 样品1-8可以通过免疫印迹分析,以确定下拉效率。注意:大多数中学抗体与G蛋白域的融合蛋白发生交叉反应,但这是TEV蛋白酶裂解后删除。
- 可以1D或2D SDS-PAGE电泳分析样品7。可以使用银或考马斯(建议:SilverQuest银染色和蓝色胶体考马斯染色试剂盒自Invitrogen)进行染色。可以用质谱进行蛋白质鉴定。
9。代表结果
1D的SDS-PAGE分析,从该协议的最终洗脱(样本7)确定的TAP标签eIF4E的结合伙伴的一个例子是在图2。这代表凝胶反映的复杂和丰富的自然与其他蛋白质在细胞中eIF4E的相互作用。在图2所示的阴性对照,从一个细胞只表达TAP标签生成的比较,说明这eIF4E的诱饵下拉的特殊性。在这种情况下集中的最终洗脱15%(样本7)使用Invitrogen公司从Silverquest银染色试剂盒染色前1D使用市售的预制梯度凝胶的SDS-PAGE分析。
通常50-85%,其余集中的最终洗脱(样本7)进行了分析与胶体考马斯染色(Invitrogen公司)。从整个车道的样品(凝胶片/条),然后提取和分析,质谱分析。
eIF4E的下拉鉴定的蛋白质进行过滤对从阴性对照,以确定非特异性结合合作伙伴的具有约束力的合作伙伴。确定最终的蛋白质使用这个TAP标签eIF4E的过程可以看出,在图2中,这是正常的蛋白质确定使用这种技术的代表。此外,还确定了一些eIF3亚基(数据未显示)。
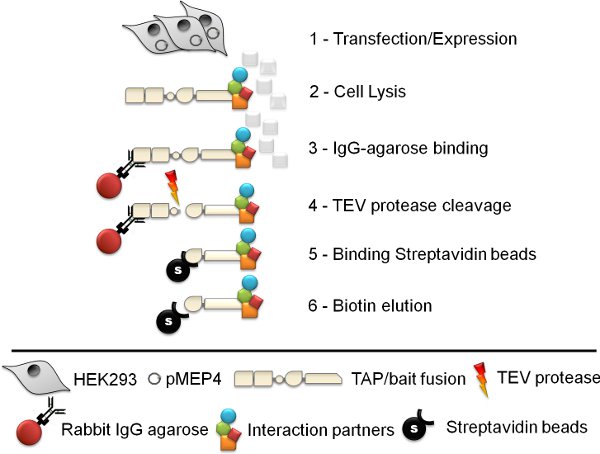
图1。示意图串联亲和纯化过程。六步串联亲和纯化(TAP),协议涉及细胞的生成,细胞裂解,兔IgG琼脂糖凝胶免疫沉淀,TEV蛋白酶裂解,链霉亲和素磁珠亲和纯化,并终于素洗脱。
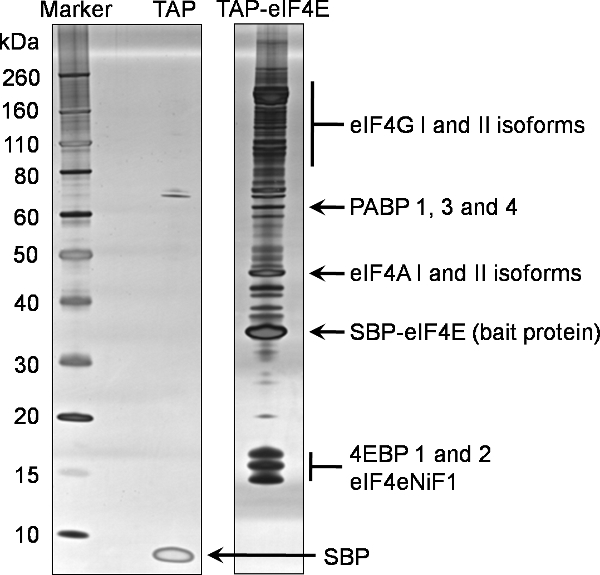
图2。串联亲和纯化的小鼠eIF4E的蛋白质。互动合作伙伴的N末端 抽头标签eIF4E的使用所附的协议,从真核细胞转染HEK293细胞进行纯化。一个20%的分数,最后洗脱(样本7),通过SDS-PAGE分析,预铸的4-12%梯度凝胶电泳的TAP-eIF4E的车道上。一个单独的标签(TAP车道)进行等效分析。用银染蛋白。随后通过对同一样品质量法确定的蛋白质强调这种凝胶。
缩写:eIF4G;真核翻译起始f演员4伽马,PABP认证;多聚腺苷酸结合蛋白,eIF4A:真核翻译起始因子4α,收缩压,eIF4E的;其余的TAP诱饵蛋白,含有融合的真核翻译起始因子4E,4EBPs;真核生物翻译起始因子4E结合的链亲和素的结合肽蛋白质,eIF4eNiF1l真核翻译起始因子4E核进口因子1,收缩压(SBP),其余的从TEV非稠合的TAP肽链霉结合肽。
讨论
说明这里的TAP标签技术演示为诱饵蛋白在真核细胞中分离的具有约束力的合作伙伴的高度特异性和严格的方法。这种方法可应用于细胞和病毒蛋白。据我们所知,这是第一次,这种技术已被应用到翻译起始因子eIF4E。知名eIF4E的结合蛋白eIF4G和使用这种技术的4EBPs鉴定,证实了这种方法的有效性。此外,鉴定eIF4F复杂的剩余部分,即eIF4A和PABP至证实,间接的互动关系和大专院校的复合物留在净化过程中的完整。 eIF4E的结合蛋白的典型多个亚型的识别也很明显。图2中更详细地描述了这些。
至于该方法的局限性,某些保健应采取的选择与问候诱饵蛋白和是否放置在N-或C-末端的TAG标签。这可能是最好进行功能检测,或本地化融合蛋白通过显微镜检查,以确保标签的衍生工具是功能完整的大规模纯化。积分膜或核蛋白质不一定被释放裂解步骤中所述的条件相对温和的洗涤剂。与所有免疫沉淀和类似拉下来分析,修改,可以在提高效率的裂解裂解液的性质和浓度的洗涤剂。离子浓度的溶解和洗涤缓冲也可以修改,增加或减少净化的严格。它也可以执行初步净化温和条件下标准(如上所述),但随后分裂的链亲和素珠(5.8节)为4-5等份,随后被冲下离子浓度增加ditions。这可能使用户能够确定的最佳条件,消除非特异性相互作用的蛋白质。整个过程中也可以使用互动的合作伙伴被称为瞬时转染和随后印迹确定其存在或不存在。在这种情况下,我们建议各8微克的表达质粒转染细胞100厘米2菜。这个修改过程是研究突变衍生物的TAP融合蛋白与已知的具有约束力的合作伙伴互动的能力时,特定用途。
分析样品1,通过银染SDS-PAGE凝胶(或印迹,如果抗体是可用的)8,是一个很好的方法排除故障,技术故障产生可接受的结果。使用此系统抽样的方法,可以分析的基于每个亲和力的降水和具体洗脱效率。样品应采取一至八个期间OPTIM化的协议,为每个新的诱饵。
TAP标签技术提供了一个强大和稳健的替代其他方法,如GST拉,酵母双杂交实验等双亲和纯化和具体洗脱步骤(TEV酶切和生物素洗脱)提供特异性和严格保持在整个净化过程中的较高水平。批判这种技术可以应用到任何蛋白质,因此确定为目标蛋白结合合作伙伴的一个极好的方法。
披露声明
没有利益冲突的声明。
致谢
这项研究是由威康信托高级奖学金颁发给伊恩·古德费洛博士。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| 潮霉素B | 罗氏公司 | 10843555001 | |
| 兔IgG的琼脂糖 | 西格玛 | A2909 | |
| AC-TEV蛋白酶 | Invitrogen公司 | 12575-015 | |
| 蛋白酶抑制剂 | Calbiochem公司 | 539134 | |
| ULTRALINK链霉亲和素固定加珠 | 刺穿 | 53116 | |
| vivaspin 500离心选矿(5KDa) | vivaspin | V50112 | |
| SilverQuest银染试剂盒 | Invitrogen公司 | LC6070 | |
| NOVEX蓝色胶体考马斯染色试剂盒 | Invitrogen公司 | LC6025 | |
| 1.7毫升预润滑管 | COSTAR | 3207 | |
| 微毛细管移液器提示 | 厂商VWR | 37001-150 | |
| NuPage 4-12%二,三梯度凝胶 | Invitrogen公司 | NP0322BOX | |
| CDCL 2 | 西格玛 | 202908 | |
| 5X SDS样品缓冲 | 费舍尔 | PN39000 |
参考文献
- Williamson, M. P., Sutcliffe, M. J. Protein-protein interactions. Biochem. Soc. Trans. 38 (4), 875-878 (2010).
- Rigaut, G. A generic protein purification method for protein complex characterization and proteome exploration. Nat. Biotechnol. 17 (10), 1030-1032 (1999).
- Blackwell, C., Brown, J. D. The application of tandem-affinity purification to Candida albicans. Methods Mol. Biol. 499, 133-148 (2009).
- Cochrane, A. Stable complex formation between HIV Rev and the nucleosome assembly protein, NAP1, affects Rev function. Virology. 388 (1), 103-111 (2009).
- Fernandez, E. Targeted tandem affinity purification of PSD-95 recovers core postsynaptic complexes and schizophrenia susceptibility proteins. Mol. Syst. Biol. 5, 269-269 (2009).
- Gloeckner, C. J. Tandem affinity purification of protein complexes from mammalian cells by the Strep/FLAG (SF)-TAP tag. Methods Mol. Biol. 564, 359-372 (2009).
- Holowaty, M. N. Protein profiling with Epstein-Barr nuclear antigen-1 reveals an interaction with the herpesvirus-associated ubiquitin-specific protease HAUSP/USP7. J. Biol. Chem. 278 (32), 29987-29994 (2003).
- Burckstummer, T. An efficient tandem affinity purification procedure for interaction proteomics in mammalian cells. Nat. Methods. 3 (12), 1013-1019 (2006).
- Goodfellow, I. Calicivirus translation initiation requires an interaction between VPg and eIF 4 E. EMBO Rep. 6 (10), 968-972 (2005).
- Goodfellow, I. G., Roberts, L. O. Eukaryotic initiation factor 4E. Int. J. Biochem. Cell Biol. 40 (12), 2675-2680 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。