Method Article
Идентификация белка взаимодействие партнеров, используя тандем аффинной очистки
* Эти авторы внесли равный вклад
В этой статье
Резюме
Тандем аффинной очистки является надежным подходом для идентификации связывания с белками партнеров. В качестве доказательства концепции, эта методика была применена к хорошо характеризуется фактор инициации трансляции eIF4E к сотрудничеству осадок факторов клетки-хозяина, участвующих в инициации трансляции. Этот метод легко адаптирована к любой сотовой или вирусных белков.
Аннотация
A critical and often limiting step in understanding the function of host and viral proteins is the identification of interacting cellular or viral protein partners. There are many approaches that allow the identification of interacting partners, including the yeast two hybrid system, as well as pull down assays using recombinant proteins and immunoprecipitation of endogenous proteins followed by mass spectrometry identification1. Recent studies have highlighted the utility of double-affinity tag mediated purification, coupled with two specific elution steps in the identification of interacting proteins. This approach, termed Tandem Affinity Purification (TAP), was initially used in yeast2,3 but more recently has been adapted to use in mammalian cells4-8.
As proof-of-concept we have established a tandem affinity purification (TAP) method using the well-characterized eukaryotic translation initiation factor eIF4E9,10.The cellular translation factor eIF4E is a critical component of the cellular eIF4F complex involved in cap-dependent translation initiation10. The TAP tag used in the current study is composed of two Protein G units and a streptavidin binding peptide separated by a Tobacco Etch Virus (TEV) protease cleavage sequence. The TAP tag used in the current study is composed of two Protein G units and a streptavidin binding peptide separated by a Tobacco Etch Virus (TEV) protease cleavage sequence8. To forgo the need for the generation of clonal cell lines, we developed a rapid system that relies on the expression of the TAP-tagged bait protein from an episomally maintained plasmid based on pMEP4 (Invitrogen). Expression of tagged murine eIF4E from this plasmid was controlled using the cadmium chloride inducible metallothionein promoter.
Lysis of the expressing cells and subsequent affinity purification via binding to rabbit IgG agarose, TEV protease cleavage, binding to streptavidin linked agarose and subsequent biotin elution identified numerous proteins apparently specific to the eIF4E pull-down (when compared to control cell lines expressing the TAP tag alone). The identities of the proteins were obtained by excision of the bands from 1D SDS-PAGE and subsequent tandem mass spectrometry. The identified components included the known eIF4E binding proteins eIF4G and 4EBP-1. In addition, other components of the eIF4F complex, of which eIF4E is a component were identified, namely eIF4A and Poly-A binding protein. The ability to identify not only known direct binding partners as well as secondary interacting proteins, further highlights the utility of this approach in the characterization of proteins of unknown function.
протокол
1. Поколение клеточных линий: pMEP4 трансфекции / выражение
- Трансфекции клеток с pMEP4 вектор экспрессии и выберите 100 мкг гигромицину B / мл (Roche), пока все макеты трансфицированных клеток были истреблены. PMEP4 плазмида поддерживается episomally, поэтому нет необходимости изолировать отдельные клоны.
- Клетки, содержащие pMEP4 вектор может быть вызвано обращение с 10 мкМ CdCl 2 в течение 16 часов. Выражение и Индуцируемость должны быть подтверждены в небольших масштабах до усиление клеточных линиях. TAP-меченый белок можно легко обнаружить, как белка G области связываются с антителами почти из всех видов. Для крупных очищение обычно 10 сливной 175 см 2 колбах клеток не требуется. Это соответствует примерно 2 X10 8 экспрессирующие клетки.
2. Подготовка сотового лизат
- Очистите клеток в PBS и объединить в единый 50 мл трубку. Спиновая 1200X GFили 5 минут (это должно привести к 2-3 мл упакованных клеток, чтобы начать с того, что снижает до 1,5 мл после мытья).
- Промойте клетки три раза в ледяной PBS (50 мл каждый раз).
- Лизировать клетки в 5 мл лизис буфера (50 мМ Трис-HCl (рН 7,5), 125 мМ NaCl, 5% глицерина, 0,2% NP-40, 1,5 мМ MgCl 2, 25 мМ NaF, 1 мМ Na 3 VO 4 и ингибиторов протеазы ). Примечание: NaF, Na 3 VO 4 и ингибиторов протеаз следует добавить свежей. Пипетировать вверх и вниз 10 раз, прежде чем покинуть в течение 5 минут на льду. Шприц вверх и вниз 5-10 раз, используя тупой иглой перед отъездом снова на льду в течение 5 минут на льду. Повторите спринцевания и оставить еще на 5 минут на льду.
- Морозостойкость лизат в два раза (жидкость № 2 / или сухого льда и этанола). Не позволяйте образец достичь более 4 ° C. Примечание: вы можете сохранить этот образец при температуре -80 ° C до вас есть время, чтобы обработать.
- Алиготе образца в пробирки на 1,5 мл и удалить unlysed клеток и гebris центрифугированием (10 минут при 4 ° С, 16 000 X г).
- Восстановление супернатант, сочетают в 15 мл трубку сокол и (опционально) через 0,45 мкм фильтр, прежде чем принимать 20 мкл образца для белок количественный выход. Удаление еще 50 мкл для последующего анализа (Пример 1).
3. Привязка к кролика IgG-агарозы
(Примечание: Все спины должна осуществляться на 1200X г в охлажденном центрифуге при температуре 4 ° С в течение 1 минуты, если не указано иное)
- Осторожно ресуспендирования кролика IgG-агарозы решение (Sigma-Aldrich), вращая бутылку. Возьмите 380 мкл IgG агарозы (с использованием разреза 1 мл пипетки) и снимите доставки / консервант решение путем центрифугирования в течение 1 минуты. Вымойте агарозном три раза в охлажденной буфера для лизиса (4 ° C) с помощью центрифугирования уточнить. Окончательный выход из агарозы должна быть около 250 мкл упакованы бисера.
- Добавить очищенные клетки лизат от 2,6 (в 15 мл ванны соколе) промытый кролика IgG агарозы и инкубировать в течение 3 часов (или ночь) при 4 ° С с помощью вращающегося смесителя.
- Спином вниз агарозном бисер в течение 5 минут при температуре 4 ° C и удалить супернатант для последующего анализа (пример 2). Примечание: TAP меченый белок должен быть связан с бисером.
4. TEV протеазы расщепление
(Примечание: Все спины должна осуществляться на 1200X г в охлажденном центрифуге при 4 ° С в течение 1 минуты, если не указано иное)
- Вымойте кролика IgG агарозном бисером три раза в охлажденной буфера для лизиса (4 ° C) с помощью центрифугирования уточнить (примечание: лизис буфера, не должны содержать ингибиторы протеазы). Следует проявлять осторожность, чтобы не удалить или потерять бисер во время промывки.
- Вымойте бисер еще два раза с TEV-протеаза расщепления буфера (10 мМ Трис-HCl (рН 7,5), 100 мМ NaCl и 0,2% NP-40) с помощью центрифугирования уточнить. После последнего мытья тщательно удалить все лифунтов из бисера.
- Подготовить ТРВ смесь расщепления протеазы для каждого образца включает 467,5 мкл H 2 O, 25 мкл 20x TEV буфера (Invitrogen), 5 мкл 0,1 М ДТТ и 2.5 мкл (25 U) TEV протеазы (Invitrogen). Добавить 500 мкл этого ТРВ смесь расщепления для каждого образца упакованных шариков и передать всю смесь в 1,7 мл предварительно смазав трубу (Costar). До инкубации удалить 30 мкл для последующего анализа (пример 3).
- Инкубируйте TEV реакции протеазы в течение ночи при 4 ° С с помощью вращающегося смесителя. Обратите внимание, что короче инкубации раз могут быть использованы в зависимости от природы белка приманки и доступность TEV сайт расщепления протеазы, но минимальное время инкубации определяется эмпирически.
5. Привязка к приборы Ultralink Иммобилизованные стрептавидином Plus бисера
(Примечание: Все спины должна осуществляться на 1200X г в охлажденном центрифуге при температуре 4 ° С в течение 1 минуты, если не указано иное)
- Центрифуга TEV реакции расщепления содержащих IgG кролика агарозном бисером течение 5 минут при 1200X г (4 ° С). Удаление на 20 мкл надосадочной уточнил для анализа (Пример 4)
- Передача оставшейся надосадочной (примерно 480 мкл) в 1,5 мл свежей предварительно смазав трубу (Costar) и оставить на льду. Не выбрасывайте этот супернатант - это содержащий TEV дрова белка приманки и любых связанных с белками.
- Добавить 500 мкл охлажденного буфера для лизиса (раздел 2.3) к остальным кролика IgG агарозном бисером и ресуспендирования. Центрифуга эту смесь уточнить бисер перед удалением надосадочной и комбинируя его с с шагом 5.2. Оставьте пробирку на льду (он теперь должен содержать ~ 980 мкл образца).
- Сохраните кролика IgG агарозном шарики для последующего анализа (Пример 5). Примечание: если вы запустите этот пример на SDS-PAGE гель (или западный пятно) это даст много фона, обусловленного наличием IgG тяжелых и легкихцепей.
- В то же время осторожно ресуспендируют Ultralink Иммобилизованные стрептавидином Plus агарозном бисером (Pierce), вращая бутылку. С помощью 200 мкл кончике пипетки с конца разреза, аликвоту 70 мкл стрептавидина бисером на образец в предварительно смазав пробирки на 1,5 мл и удалить доставки / консервант решение с помощью центрифугирования. Примечание: эти бусы очень малы, и поэтому "утка-счета» или квартира / узкого состава советов может быть использована, чтобы минимизировать потери бусинки во время стирки.
- Вымойте стрептавидин бисером три раза в охлажденной буфера для лизиса (4 ° C) с помощью центрифугирования уточнить. Это должно оставить примерно 45-50 мкл упакованы в бисер трубки.
- Передача TEV-протеаза расщепления супернатант (т.е. 980 мкл образца, начиная с шага 5.3) в пробирку с промытой бисером стрептавидином и инкубировать в течение 3 часов (или ночь) при 4 ° С с помощью вращающегося смесителя.
- Спином вниз стрептавидин бисер в течение 5 минут при температуре 4 ° C и удалить супернатант для последующего анализа (SamНапример 6). Вымойте стрептавидин бисером три раза в охлажденной буфера для лизиса (4 ° C) с помощью центрифугирования уточнить. После последней промывки, тщательно удалить все оставшиеся промывочным буфером.
6. Биотин элюирования стрептавидин обязательных пептидов и белков приманки
(Примечание: Все спины должна осуществляться на 1200X г в охлажденном центрифуге при температуре 4 ° С в течение 1 минуты, если не указано иное)
- Элюции меченных белков из бисера стрептавидин добавлением 500 мкл PBS: Биотин (1 мМ D-биотин) и инкубации при температуре 4 ° С в течение 3 часов (или ночь) с помощью вращающегося смесителя.
- Спином вниз стрептавидин бисер в течение 5 минут при температуре 4 ° C и удалить супернатант в 1,5 мл предварительно смазав трубу (Примечание: это ваш последний пример / элюирования (Пример 7).
- Добавьте еще 500 мкл биотин: PBS в остальных бусин стрептавидином и инкубировать при температуре 4 ° С в течение 2-3 часов (или ночь) с помощью вращающегося смесителя.
- Повторноторф шаг 6.2 и объединить два elutions (Пример 7). Этот последний элюирования может храниться при температуре -80 ° C.
- Для оценки эффективности элюции биотин, заморозить оставшиеся бисером стрептавидином и кипятить в конце SDS буфера образца (образец 8) (рекомендации: LaneMarker 5x снижения образец буфер из Фишер).
7. Концентрация белка
- Окончательный элюата (Пример 7) должно быть сосредоточено до анализа в связи с низким содержанием белка и относительно высоком уровне громкости. Это достигается с помощью низкой молекулярной массой (<5 кДа) Vivaspin спина столбцов (Vivascience). Старайтесь сосредоточиться объем до менее чем 100 мкл. Этот последний пример можно варить и хранить в буфере белка образца (рекомендации: LaneMarker 5x снижения образец буфер из Фишер).
8. Анализ
- Примеры 1-8 могут быть проанализированы западной пятном, чтобы определить эффективность снести. Примечание: Большинство вторичных антител будетперекрестно реагируют с белком G области гибридного белка, но снимается после ТРВ расщепления протеазы.
- Пример 7 могут быть проанализированы 1D или 2D SDS-PAGE. Окрашивание может быть выполнено с использованием серебра или Кумасси (рекомендации: SilverQuest окрашивание серебряных и коллоидной Синяя окраска Кумасси комплектов Invitrogen). Белки идентификация может осуществляться с помощью масс-спектрометрии.
9. Представитель Результаты
Пример 1D SDS-PAGE анализа окончательного вымывания (Пример 7) из этого протокола для определения обязательных партнеров TAP помеченный eIF4E предоставляется на рисунке 2. Этот представитель гель отражает сложный и богатый характер eIF4E взаимодействие с другими белками в клетке. Сравнение с отрицательным контролем также показано на рисунке 2, созданного на основе клеточной линии выразить только TAP тег, свидетельствует о специфике этого eIF4E наживкой выпадающего. В этом случае 15% от централизованных выпускных элюирования (образец7) была проанализирована 1D SDS-PAGE с использованием коммерчески доступных сборных гель градиента перед окрашивали окрашивания Silverquest серебряный комплект из Invitrogen.
Обычно 50-85% оставшихся централизованных выпускных элюирования (Пример 7) анализируется с коллоидной Кумасси пятно (Invitrogen). Образцы (гель слоями / полосами) со всей полосе затем извлекается и анализируется масс-спектрометрии.
Белки, определенных в eIF4E выпадающие были отфильтрованы с обязательным партнерами из отрицательного контроля для определения неспецифического связывания партнеров. Окончательный белков определяется с помощью этого процесса TAP eIF4E пометки можно увидеть на рисунке 2, который является представителем нормальной белков определяется с помощью этой техники. Кроме того, ряд eIF3 подразделения были также названы (данные не представлены).
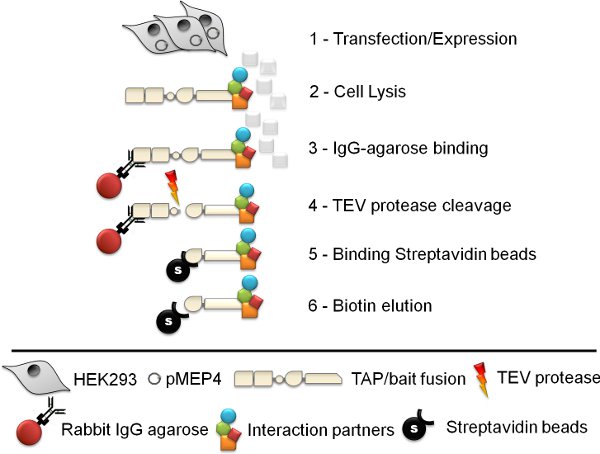
Рисунок 1. СхемаТандем близость процедуры очистки. Шесть шаг тандема аффинной очистки (TAP) протокол включает в себя линии клеток поколения, лизиса клеток, Кролик IgG агарозном иммуно-осадки, ТРВ протеазы декольте, стрептавидин шарик аффинной очистки и, наконец, биотин элюирования.
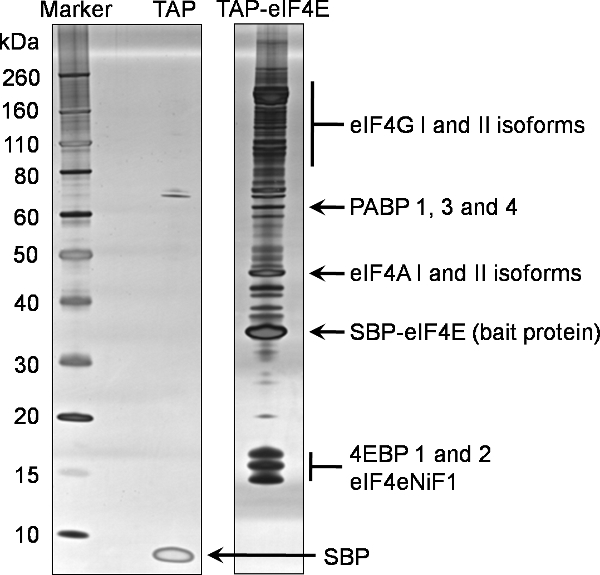
Рисунок 2. Тандем близость очистки мышиных белков eIF4E. Взаимодействие партнеров N неизлечимо Тэп помеченный eIF4E очищали от эукариот НЕК293 использованием прилагаемого протокола. 20% долей окончательного вымывания (Пример 7) были проанализированы SDS-PAGE на сборных 4-12% градиентного гель (TAP-eIF4E переулок). Эквивалентную анализ был проведен для тега один (TAP переулок). Белки были определены с использованием серебрения. Белки впоследствии определены методом масс-спектрометрии и того же образца будут выделены на этот гель.
Сокращения: eIF4G; эукариотической инициации трансляции еАктер 4 гамма, PABP; полиА связывающий белок, eIF4A: эукариотических факторов инициации трансляции 4 альфа, SBP-eIF4E, остальные белки приманки TAP содержащего стрептавидин обязательным пептид, слитый с эукариот 4E фактор инициации перевода, 4EBPs; эукариотических фактор инициации трансляции 4Е обязательным белки, eIF4eNiF1l эукариотических фактор инициации трансляции 4Е ядерного импорта фактор 1, САД, остальные стрептавидин обязательным пептид из ТРВ неконденсированное пептид TAP.
Обсуждение
Техника TAP пометки показано здесь демонстрирует очень конкретный и строгий метод выделения обязательными партнерами приманки белков в эукариотических клетках. Этот подход может быть применен как для клеточных и вирусных белков. Насколько нам известно, это первый раз, когда такая методика была применена к фактору eIF4E инициации трансляции. Идентификация известных eIF4E обязательным eIF4G белков и 4EBPs использовании этого метода подтверждает правильность такого подхода. Кроме того, идентификация оставшихся компонентов комплекса eIF4F, а именно eIF4A и PABP подтверждает, что косвенное взаимодействие и высшего комплексы остаются неизменными в процессе очистки. Определение нескольких изоформ канонического eIF4E белков была также очевидна. Они подробно описаны на рисунке 2.
Что касается ограничения подхода, определенного следует проявлять осторожность в отношении выбораприманки белка и нужно ли поместить TAG тег в N-или С-конца. Было бы целесообразно провести функциональный анализ и изучение локализации гибридного белка с помощью микроскопа до полной очистки масштабе для обеспечения отмеченных производная функционала. Интегральные мембранные или ядерные белки, не обязательно быть освобожден относительно мягким моющим средством условиях, описанных в лизис шаг. Как и все immunoprecipitations и подобные выпадающие анализы, изменения могут быть внесены в характере и концентрации моющих средств в лизис буфера для повышения эффективности лизиса. Ионной концентрации лизис и мыть буфера также может быть изменена для увеличения или уменьшения жесткости очистки. Кроме того, можно выполнить начальную очистку при стандартных мягких условиях (описано выше), но впоследствии разделить стрептавидином шарики (раздел 5.8) на 4-5 порции, которые могут впоследствии быть вымыты при увеличении ионной конусловиях. Это может позволить пользователю определить оптимальные условия, которые удаляют неспецифические взаимодействия белков. Весь процесс также может быть выполнено с использованием временной трансфекции, где взаимодействующие партнеры известны, и их наличие или отсутствие определяется последующей западной пятном только. В этом случае мы предлагаем два 100см 2 блюда из каждой клетки трансфицированных с 8 мкг плазмиды экспрессии. Это изменение процедуры особенно полезны при изучении способности мутантных производных TAP-гибридного белка взаимодействовать с известными обязательными партнерами.
Анализ образцов с 1 по 8 на серебро окрашенных SDS-PAGE гелей (или западный пятно, если антитела есть) является отличным способом для устранения неполадок, если техника не в состоянии генерировать приемлемые результаты. Эффективность каждого близость на основе осадков и конкретные элюирования могут быть проанализированы с помощью этого системного подхода выборки. Образцы 7:59 должно быть принято в течение Optimции протокола для каждой новой приманки.
Техника TAP пометки обеспечивает мощную и надежную альтернативу другие подходы, такие как стоимость выпадающие меню, дрожжи двух гибридных анализы и т.д. двойной очистки близости и конкретные шаги элюирования (ТРВ декольте и биотин элюирования) обеспечивают специфику и жесткость будет поддерживаться на Высокий уровень всей процедуры очистки. Критически этот метод может быть применен к любой белка и, следовательно, представляет собой отличный способ для определения обязательных партнеров для белка-мишени интерес.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Это исследование финансировалось Wellcome Trust старший стипендия присуждена д-р Ян Гудфеллоу.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | |
| Гигромицину B | Roche | 10843555001 | |
| Кролик IgG агарозном | Сигма | A2909 | |
| AC-ТРВ протеазы | Invitrogen | 12575-015 | |
| Коктейль Ингибитор протеазы | Calbiochem | 539134 | |
| Ultralink Иммобилизованные стрептавидином Plus бисера | Прокалывать | 53116 | |
| Vivaspin 500 центробежный концентратор (5KDa) | Vivaspin | V50112 | |
| SilverQuest серебрения комплект | Invitrogen | LC6070 | |
| Novex коллоидной Синяя окраска Кумасси комплект | Invitrogen | LC6025 | |
| 1.7ml prelubricated труб | Costar | 3207 | |
| Микрокапиллярных наконечники | VWR | 37001-150 | |
| NuPage 4-12% Bis-Tris градиент гели | Invitrogen | NP0322BOX | |
| CdCl 2 | Сигма | 202908 | |
| 5x Пример SDS буфера | Рыбак | PN39000 |
Ссылки
- Williamson, M. P., Sutcliffe, M. J. Protein-protein interactions. Biochem. Soc. Trans. 38 (4), 875-878 (2010).
- Rigaut, G. A generic protein purification method for protein complex characterization and proteome exploration. Nat. Biotechnol. 17 (10), 1030-1032 (1999).
- Blackwell, C., Brown, J. D. The application of tandem-affinity purification to Candida albicans. Methods Mol. Biol. 499, 133-148 (2009).
- Cochrane, A. Stable complex formation between HIV Rev and the nucleosome assembly protein, NAP1, affects Rev function. Virology. 388 (1), 103-111 (2009).
- Fernandez, E. Targeted tandem affinity purification of PSD-95 recovers core postsynaptic complexes and schizophrenia susceptibility proteins. Mol. Syst. Biol. 5, 269-269 (2009).
- Gloeckner, C. J. Tandem affinity purification of protein complexes from mammalian cells by the Strep/FLAG (SF)-TAP tag. Methods Mol. Biol. 564, 359-372 (2009).
- Holowaty, M. N. Protein profiling with Epstein-Barr nuclear antigen-1 reveals an interaction with the herpesvirus-associated ubiquitin-specific protease HAUSP/USP7. J. Biol. Chem. 278 (32), 29987-29994 (2003).
- Burckstummer, T. An efficient tandem affinity purification procedure for interaction proteomics in mammalian cells. Nat. Methods. 3 (12), 1013-1019 (2006).
- Goodfellow, I. Calicivirus translation initiation requires an interaction between VPg and eIF 4 E. EMBO Rep. 6 (10), 968-972 (2005).
- Goodfellow, I. G., Roberts, L. O. Eukaryotic initiation factor 4E. Int. J. Biochem. Cell Biol. 40 (12), 2675-2680 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены