A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الداخلية الثديية البشرية الشريان (IMA) وزرع الدعامات: نموذج الإنسان لدراسة تطوير داخل الدعامة عودة التضيق
In This Article
Summary
هذا الفيديو يبين لنا نموذجا لدراسة تطوير تضخم البطانية بعد نشر الدعامات باستخدام سفينة الإنسان (IMA) في نموذج الفئران العوز المناعي.
Abstract
قبل السريرية المجراة في نماذج البحوث للتحقيق في عمليات pathobiological والمرضية في جسم المريض في وضع تضخم البطانية بعد الدعامات سفينة حاسمة ل1،2 النهج متعدية.
ويشيع استخدام نماذج حيوانية تشمل الفئران والجرذان والأرانب والخنازير و3-5. ومع ذلك، فإن ترجمة هذه النماذج إلى المرافق الصحية لا يزال صعبا، حيث يتم دراستها بالفعل تلك العمليات البيولوجية في الحيوانات ولكن لم سفن تنفيذها قبل في النماذج البحثية الإنسان 6،7. في هذا الفيديو نظهر نموذج جديد أنسنة للتغلب على هذه الفجوة متعدية. الإجراء المعروض هو استنساخه، وسهلة، وسريعة لأداء ومناسبة لدراسة تطوير تضخم باطنة وتطبيق الدعامات المختلفة.
هذا الفيديو يبين لنا كيفية تنفيذ هذه التقنية في الدعامات الأوعية الإنسان تليها زرع في الفئران العوز المناعي، ويحدد منشأ الخلايا المتكاثرة والإنسان.
Protocol
1. الداخلية الشريان الثديي (IMA) إعداد
- والمعري والبطانة الشريانية عن طريق مرور قسطرة فوغارتي 2-استئصال الصمة الشريانية الفرنسية (باكستر للرعاية الصحية، ديرفيلد، IL، الولايات المتحدة الأمريكية). يتم سحبها من خلال القسطرة طول السفينة كله مرتين لضمان الضرر البطانية.
- استخدام أي دعامة الإنسان للطول و 2.5 ملم 8MM-3 مم في القطر (مثل Translumina، يوكون الدعامة). تنبيه: ويبلغ قطر الدعامات لا ينبغي أن يتجاوز قطرها السفينة بأكثر من 10٪ لتجنب تضيق قبل وبعد الدعامات. تنبيه: لا تستخدم طول الدعامات داخل نفس الدراسة.
- نشر الدعامات باستخدام بالون الضغط المناسب (ويلاحظ على الحزمة التي الدعامات) لتحقيق القطر المطلوب.
- stented متجر IMA في 4 ° C + RPMI الهيبارين (500 مل IE/10) على الجليد حتى الزرع.
2. إعداد الحيوان
RNU عاري (CRL: NIH-Foxn1rnu) الفئران (300-350 ز) هي هوىالتهوية الحوار الاقتصادي الاستراتيجي في ظل ظروف التقليدية في خزائن scantainer، بنك الاحتياطي الفيدرالي القياسية تشاو الفئران وتعقيمها libidum الإعلان المياه.
- تخدير الفئران مع isoflurane (2.5-3٪) باستخدام دائرة تحريض.
- حلق شعر البطن ووضع الفئران على ظهرها ووضع قناع على الأنف والفم في المحافظة على التخدير.
- تطهير منطقة البطن باستخدام اليود على نطاق واسع، بروفو، واستخدام الايثانول 80٪ المقبل - كرر هذه الخطوة مرتين. تحقق ردود الفعل على معسر قدميه الخلفيتين للتأكد من أن الفئران يكفي تخدير.
- ضمن عرض المجهرية، إجراء فتح البطن العلوية وسيطة لفضح الشريان الأورطي البطني infrarenal.
- وضع قفاز على الأمعاء في رطب المالحة. طي القفازات في جميع أنحاء الأمعاء لمنع فقدان الرطوبة.
- تشريح الشريان الأورطي من المنطقة infrarenal إلى التشعب، بعناية بعدم التسبب في ضرر على فروع السفن.
- استخدام المشابك الصغيرة لوقف تدفق الدم الأبهري. ضعالمشبك القريبة الأولى، تليها المشبك البعيدة.
- إزالة أحد التطبيقات. 0،5-0،7 مم الجزء الأبهر الأورطي وتدفق المتبقية مع الهيبارين (200 وحدة).
- اتخاذ IMA stented واختصارها لمدة كافية وضعه في الفراغ.
- ربط الشريان الأورطي إلى IMA المتلقي، عن طريق تشغيل الغرز باستخدام 8-0 البرولين خياطة (Ethicon، مدينة Norderstedt، ألمانيا).
- فتح بعناية المشبك 1 الجمجمة ثم المشبك الذيلية.
- يجب أن يكون هناك نبض مرئية في IMA المزروعة وعند الطرف البعيد من الشريان الأورطي.
- وضع الأمعاء مرة أخرى في البطن.
- مسح البطن قبل تحسنت مع ملحي معقم.
- إغلاق طبقة العضلات من جدار البطن باستخدام الخيوط الجراحية 6-0 البرولين تشغيل (Ethicon، مدينة Norderstedt، ألمانيا).
- في حين أن الفئران لا يزال في التخدير، وضخ 4-5 ملغ / كغ كاربروفين تحت الجلد.
- إدارة تسكين بعد الجراحة حسب الاقتضاء (على سبيل المثال كاربروفين أو Meloxicam) لمدة 3 أيام آخر سورغريها.
3. ممثل النتائج
لعلم الأنسجة، وثبتت العينات في الفورمالين 4٪، المجففة في سلسلة متدرجة من الكحول، وتسلل في خليط (MMA I) من methylmethacrylate 80٪ و 20٪ لdibutylphthalate 1 يوم، I MMA مع بيروكسيد البنزويل الجافة 1٪ ل 1 يوم، وأنا مع MMA 3٪ بيروكسيد البنزويل الجافة (MMA III) لمدة 1-2 أيام عند 4 ° C. بعد ذلك، تم بلمرة العينات في الثالث MMA جديدة في قوارير الزجاج في حمام مائي على قاعدة ما قبل بلمرة. وقد تحقق البلمرة بطيئة عن طريق الحفاظ على قنينة في 26 ° C بين عشية وضحاها، وزيادة درجة الحرارة إلى 28 ° C صباح اليوم التالي، وزيادة درجة الحرارة تدريجيا ثم بنسبة 0.5 ° C أكثر من 12 ساعة حتى وقعت البلمرة. وكانت الكتل بلمرة مقطوع في سمك 5 ميكرومترات باستخدام HM ميكرومولار 360 مشراح مجهزة كربيد التنغستن سكين.
لتحديد منشأ الخلايا المتكاثرة (الشكل 1)، قكانت ملطخة lides مع الأجسام المضادة تحديد إما أخضر الفئران البروتين (GFP) أو الفلورسنت MHC-I وخلايا العضلات الملساء. لهذه الدراسات، وحضنت الإنسان IMA مع GFP الجينات مراسل باستخدام جزيئات lentiviral بين عشية وضحاها لتنبيغ مستقرة من الخلايا IMA. ويمكن تحديد الخلايا الوليدة من أصل تقسيم الإنسان بالإعراب عن GFP. بعد deparaffinization، يتم تنفيذ الحرارة التي يسببها حاتمة استرجاع عن طريق تسخين الشرائح في حل استرجاع مستضد باستخدام باخرة. يمكن استخدام صورة FX-IT إشارة محسن للخطوة حظر. يتم تحديد الخلايا البشرية المنشأ باستخدام الأجسام المضادة وحيدة النسيلة الماوس ضد GFP (1:100 المخفف في مادة تخفيف الأجسام المضادة الأولية (داكو))، والمسمى كذلك مع مفتش الماعز المضادة للماوس، اليكسا فلور 488 (1:1000 مخففة في مادة تخفيف الأجسام المضادة الثانوية ). تميزت خلايا العضلات الملساء العضلات مع أرنب المضادة للسلس polycolonal α-الأكتين (1:100 المخفف في مادة تخفيف الأجسام المضادة الأولية)، تليها مفتش الماعز المضادة للأرنب، اليكسا فلووص 555 (1:1000 مخففة في منظفة الأجسام المضادة الثانوية). يتم تنفيذ كل خطوة حضانة الأجسام المضادة في C ° 37 لمدة 1 ساعة ثلاث مرات مع برنامج تلفزيوني في غسل بين. هي ملطخة النوى مع دابي لمدة 10 دقيقة. بعد المتصاعدة من الشرائح باستخدام كاشف الذهب إطالة antifade، وقد تم تحليل العينات باستخدام المجهر متحد البؤر.
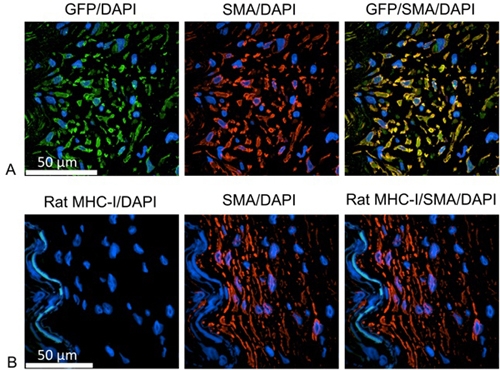
الشكل 1. الخلايا البشرية كما neointimal خلايا العضلات الملساء A:. أخضر = مكافحة GFP، ووضع العلامات خلايا المنشأ البشرية؛ الأحمر = خلية مكافحة العضلات الملساء الإنسان الأكتين؛ الأزرق = دابي، وتحديد نوى الخلايا B: أخضر = الفئران مكافحة MHC-I، ووضع العلامات خلايا المنشأ الفئران؛ الأحمر = خلية مكافحة العضلات الملساء الإنسان الأكتين؛ الأزرق = دابي، وتحديد نواة الخلية. يتم تحديد الخلايا المتكاثرة وخلايا العضلات الملساء وإيجابية لGFP، ولكن سلبية على جزيء MHC-I الفئران. لذلك، هي أصل الخلايا المتكاثرة الإنسان.
Discussion
على الرغم من أن مختلف النماذج البحثية في الجسم الحي والقائمة للتحقيق في تضخم تطوير البطانية بعد وضع الدعامة، وهذه النماذج لا تزال تواجه عقبات متعدية إلى التغلب عليها. وعلاوة على ذلك، النماذج الحيوانية الكبيرة وظروف السكن مكلفة خاصة وكذلك المعدات الجراحية ليست ...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
الكتاب أشكر كريستيان Pahrmann لمساهمتها. شكر خاص لEthicon، مدينة Norderstedt، هامبورغ (ألمانيا) لتوفير مواد خياطة الجروح.
التمويل
سونيا Schrepfer وقد حصل على منحة بحثية من جمعية الألمانية للبحوث (DFG) (SCHR992 / 3 1 وSCHR992/4-1).] وأيد هذا العمل من قبل Shumway ISHLT التطوير الوظيفي غرانت عام 2010 وتمويل البحوث فولك (جامعة ستانفورد).
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | كتالوج رقم | تعليقات |
| 2 القسطرة فوغارتي الفرنسية | باكستر للرعاية الصحية، ديرفيلد، IL، USA | 120602F | |
| يوكون الدعامة | Translumina محدودة، Hechingen، ألمانيا | استخدام الدعامات التي تختارها وفقا لبروتوكول الدراسة الخاصة بك | |
| RPMI وسائل الإعلام | Biochrom | Nr.F1275 | |
| الهيبارين | باكستر | 2B0953 | |
| isoflurane | رئيس الدير | B506 | |
| بروفو على اليود | Betadine Puredue فارما | EAN: 5995327165830 | |
| 80٪ ethanoL | غيير | ETV 80/0500 | |
| الدقيقة المشبك | هارفارد جهاز | PY2-61-0186 | |
| الغرز 8-0 | جونسون آند جونسون، | 2808G | |
| الغرز 6-0 | جونسون آند جونسون، | H 1698 | |
| كاربروفين | Feizer البيطرية | PZN: 0110208 | |
| Metamizol | راتيوفارم | ||
| هدف حل لاسترجاع المعلومات، pH9 | داكو | S2368 | |
| الصورة FX-IT إشارة محسن | إينفيتروجن | I36933 | |
| الماوس وحيدة النسيلة المضادة للأجسام المضادة GFP | الألوان الحية BD | 632381 | |
| الأجسام المضادة الأولية مخفف | داكو | S3022 | |
| الماعز المضادة للمفتش الماوس، اليكسا فلور 488 | إينفيتروجن | A11017 | |
| الأجسام المضادة الثانوية مخفف | داكو | S0809 | |
| أرنب polycolonal مكافحة سلس العضلات α-أكتين | Abcam، | ab5694 | |
| الماعز المضادة للأرنب مفتش، اليكسا فلور 555 | إينفيتروجن | A21430 | |
| إطالة الذهب كاشف antifade | إينفيتروجن | P36930 |
References
- Deuse, T., Ikeno, F., Robbins, R. C., Schrepfer, S. Imaging In-Stent Restenosis: An Inexpensive, Reliable, and Rapid Preclinical Model. J. Vis. Exp. (31), e1346 (2009).
- Oyamada, S. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. J. Surg. Res. 166, e91-e95 (2011).
- Chamberlain, J. A novel mouse model of in situ stenting. Cardiovascular research. 85, 38-44 (2010).
- Deuse, T. Introducing the first polymer-free leflunomide eluting stent. Atherosclerosis. 200, 126-134 (2008).
- Finn, A. V. Differential healing after sirolimus, paclitaxel, and bare metal stent placement in combination with peroxisome proliferator-activator receptor gamma agonists: requirement for mTOR/Akt2 in PPARgamma activation. Circulation research. 105, 1003-1012 (2009).
- Tellez, A. Coronary bare metal stent implantation in homozygous LDL receptor deficient swine induces a neointimal formation pattern similar to humans. Atherosclerosis. 213, 518-524 (2010).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The pre-clinical animal model in the translational research of interventional cardiology. JACC Cardiovasc. Interv. 2, 373-383 (2009).
- Holt, C. M. Intimal proliferation in an organ culture of human internal mammary artery. Cardiovascular research. 26, 1189-1194 (1992).
- Swanson, N., Javed, Q., Hogrefe, K., Gershlick, A. Human internal mammary artery organ culture model of coronary stenting: a novel investigation of smooth muscle cell response to drug-eluting stents. Clin. Sci. (Lond). 103, 347-353 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved