Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Human artère mammaire interne (IMA) à la transplantation et stenting: un modèle humain pour étudier le développement de la resténose intra-stent
Dans cet article
Résumé
Cette vidéo montre un modèle pour étudier le développement de l'hyperplasie intimale après le déploiement du stent aide d'un vaisseau humain (IMA) dans un modèle de rat immunodéprimé.
Résumé
Préclinique in vivo dans des modèles de recherche pour étudier les processus pathobiologiques et physiopathologiques dans le développement de l'hyperplasie intimale après stenting navire sont cruciales pour 1,2 approches de translation.
Les modèles animaux utilisés couramment comprennent les souris, les rats, les lapins et les cochons 3-5. Cependant, la traduction de ces modèles dans des milieux cliniques reste difficile, étant donné que ces processus biologiques sont déjà étudié dans les vaisseaux des animaux, mais jamais réalisée auparavant dans des modèles de recherche de l'homme 6,7. Dans cette vidéo, nous démontrons un nouveau modèle humanisé de combler cette lacune en translation. La procédure indiquée est reproductible, facile et rapide à réaliser et est adapté pour étudier le développement de l'hyperplasie intimale et l'applicabilité des stents diverses.
Cette vidéo montre comment effectuer la technique stent dans les vaisseaux de l'homme suivie d'une greffe chez des rats immunodéprimés, etidentifie l'origine des cellules proliférantes comme des humains.
Protocole
1. L'artère mammaire interne (IMA) Préparation
- L'endothélium artériel est dénudée par le passage d'un cathéter 2-françaises Fogarty embolectomie artérielle (Baxter Healthcare, Deerfield, IL, USA). Le cathéter est tiré à travers toute la longueur du navire à deux reprises pour assurer la lésion de l'endothélium.
- Utilisez n'importe quel stent humaine de la longueur de 8mm et 2,5 mm à 3 mm de diamètre (par exemple Translumina, Yukon stent). ATTENTION: Le diamètre du stent ne doit pas dépasser le diamètre du vaisseau de plus de 10% pour éviter une sténose pré-et post-stent. ATTENTION: Ne mettez pas la longueur du stent dans la même étude.
- Déployer le stent en utilisant la pression appropriée ballonnet (qui est indiquée sur le paquet de stent) pour atteindre le diamètre désiré.
- Magasin stentées IMA dans le 4 ° C RPMI + héparine (500 IE/10 ml) sur la glace jusqu'à la transplantation.
2. Préparation des animaux
RNU Nu (Crl: NIH-Foxn1rnu) chez les rats (300-350 g) sont housed dans des conditions classiques dans scantainer ventilé armoires, une nourriture standard chez le rat et chow autoclavé libitum ad 'eau.
- Anesthésier rat avec de l'isoflurane (2,5-3%) en utilisant une chambre d'induction.
- Raser les poils abdominaux et placez le rat sur son dos et placer un masque sur son nez et la bouche pour maintenir l'anesthésie.
- Désinfecter la région abdominale en utilisant largement Provo-iode, la prochaine utilisation d'éthanol à 80% - répétez cette étape deux fois. Vérifiez réflexes pinçant les pattes de derrière pour être sûr que le rat anesthésié est suffisante.
- En vertu de vue microscopique, effectuer une laparotomie médiane supérieure pour exposer l'aorte abdominale.
- Placez les intestins dans un gant de solution saline hydratée. Pliez le gant autour des intestins pour prévenir la perte d'humidité.
- Disséquer l'aorte de la région de infrarénale à la bifurcation, attention à ne pas causer des dommages sur les branches des vaisseaux.
- Utilisez des pinces micro pour arrêter le flux sanguin aortique. Placez lePince proximale en premier, suivi par la pince distale.
- Supprimer une application. 0,5 au 0,7 mm segment aortique et rincer l'aorte restante avec de l'héparine (200 unités).
- Prenez l'IMA stent et le raccourcir à la longueur adéquate et le positionner dans l'espace.
- Connectez l'IMA à l'aorte destinataire, en exécutant des sutures en utilisant 8-0 prolène suture (Ethicon, Norderstedt, Allemagne).
- Ouvrez avec précaution la première pince crânienne puis la pince caudale.
- Il doit être une impulsion visible dans la transplanté IMA et à l'extrémité distale de l'aorte.
- Placez les intestins dans l'abdomen.
- Rincer l'abdomen avec préchauffé une solution saline stérile.
- Fermez la couche musculaire de la paroi abdominale à l'aide 6-0 prolène sutures en cours d'exécution (Ethicon, Norderstedt, Allemagne).
- Alors que le rat est encore en anesthésie, injecter 4-5 mg / kg carprofène sous-cutanée.
- Administrer une analgésie post-opératoire, le cas échéant (par exemple carprofène ou méloxicam) pendant 3 jours après SurgERY.
3. Les résultats représentatifs
Pour l'histologie, les échantillons ont été fixés dans du formol à 4%, déshydraté dans une série graduée de l'alcool, et se sont infiltrés dans un mélange (MMA I) de méthacrylate de méthyle de 80% et 20% de dibutylphtalate pour un jour, je MMA avec 1% de peroxyde de benzoyle sec pour un jour, et de MMA I avec du peroxyde de benzoyle 3% de matière sèche (MMA III) pendant 1-2 jours à 4 ° C. Par la suite, les échantillons ont été polymérisés à l'état frais MMA III en flacons de verre dans un bain d'eau sur une base pré-polymérisé. Polymérisation lente a été réalisée en conservant les flacons à 26 ° C pendant la nuit, ce qui augmente la température à 28 ° C le lendemain matin, puis en augmentant graduellement la température de 0,5 ° C de plus de 12 h jusqu'à ce que la polymérisation s'est produite. Les blocs polymérisés ont été sectionnés à 5 micron d'épaisseur en utilisant un MICROM HM 360 microtome équipé d'un couteau en métal dur.
Pour identifier l'origine des cellules proliférantes (figure 1), diapositives étaient Stained avec des anticorps identifiant soit le vert rat protéine fluorescente (GFP) ou MHC-I et cellules musculaires lisses humaines. Pour ces études, l'homme IMA a été incubée avec le gène rapporteur GFP nuit en utilisant des particules lentiviraux pour la transduction stable de cellules IMA. Cellules filles de séparation d'origine humaine ont pu être identifiés en exprimant la GFP. Après déparaffinage, la chaleur épitope est effectuée par chauffage des diapositives dans une solution de récupération d'antigène en utilisant un bateau à vapeur. L'image-Ti FX signal de activateur peut être utilisé pour l'étape de blocage. Les cellules d'origine humaine sont identifiés en utilisant des anticorps monoclonaux de souris contre la GFP (1:100 dilué dans du diluant l'anticorps primaire (Dako)), et encore marqué par de chèvre anti-IgG de souris, Alexa Fluor 488 (1:1000 dilué dans du diluant anticorps secondaire ). Les cellules musculaires lisses ont été marqués avec le lapin polycolonal anti-muscle lisse α-actine (1:100 dilué dans du diluant anticorps primaire), suivie par de chèvre anti-IgG de lapin, Alexa Fluor 555 (1:1000 dilbués sur place en diluants anticorps secondaires). Chaque étape d'incubation anticorps est effectuée à 37 ° C pendant 1 heure avec trois fois PBS lavage entre les deux. Les noyaux sont colorés au DAPI pendant 10 minutes. Après le montage des diapositives à l'aide Prolongez réactif antifading Or, les échantillons ont été analysés en utilisant la microscopie confocale.
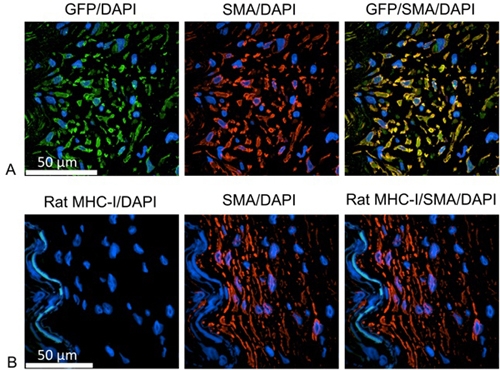
Figure 1. les cellules néo-intimale comme cellules musculaires lisses humaines A:. vert = anti GFP, le marquage de cellules d'origine humaine; rouge = anti-humain de l'actine des cellules musculaires lisses; bleu = DAPI, l'identification des noyaux de cellules B: Vert = rat anti CMH-I, l'étiquetage des cellules d'origine chez le rat; rouge = anti-humain de l'actine des cellules musculaires lisses; bleu = DAPI, l'identification des noyaux de cellules. Les cellules en prolifération sont identifiés comme les cellules musculaires lisses et positives pour la GFP, mais négatif pour le rat molécule MHC-I. Par conséquent, les cellules proliférantes sont d'origine humaine.
Discussion
Bien que différents dans des modèles in vivo de recherche sont en vigueur pour enquêter sur le développement de l'hyperplasie intimale après pose de stent, ces modèles sont encore face à des obstacles à surmonter traductionnelles. En outre, les modèles animaux de grande taille sont les conditions de logement coûteux et spéciaux ainsi que du matériel chirurgical n'est pas disponible pour tous les laboratoires.
L'utilisation d'un IMA humain pour é...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier Christiane Pahrmann pour sa contribution. Un merci spécial à Ethicon, Norderstedt, Hambourg (Allemagne) pour fournir du matériel de suture.
Financement
Sonja Schrepfer a reçu une subvention de recherche de la Deutsche Forschungsgemeinschaft (DFG) (SCHR992 / 3 1 et SCHR992/4-1).] Le travail a été soutenu par le développement de carrière ISHLT Shumway Grant 2010 et la recherche de financement Falk (Université de Stanford).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Le numéro de catalogue | Commentaires |
| 2 sonde de Fogarty française | Baxter Healthcare, Deerfield, IL, Etats-Unis | 120602F | |
| Yukon stent | Translumina GmbH, Hechingen, Allemagne | Utilisez le stent de votre choix en fonction de votre protocole de l'étude | |
| Milieu RPMI | Biochrom | Nr.F1275 | |
| héparine | Baxter | 2B0953 | |
| isoflurane | Abbé | B506 | |
| Provo-iode | Betadine Puredue Pharma | EAN: 5995327165830 | |
| 80% éthanol | Geyer | ETV 80/0500 | |
| Micro pince | Harvard Apparatus | PY2-61-0186 | |
| Les sutures 8-0 | Johnson & Johnson, | 2808G | |
| Les sutures 6-0 | Johnson & Johnson, | 1698 H | |
| Carprofène | Vet Feizer | PZN: 0110208 | |
| Metamizol | Ratiopharm | ||
| Target Retrieval Solution, pH 9 | Dako | S2368 | |
| Image-iT FX signal de enhancer | Invitrogen | I36933 | |
| monoclonal de souris anti-GFP anticorps | Couleurs de la vie BD | 632381 | |
| diluant l'anticorps primaire | Dako | S3022 | |
| de chèvre anti-IgG de souris, Alexa Fluor 488 | Invitrogen | A11017 | |
| diluant l'anticorps secondaire | Dako | S0809 | |
| lapin polycolonal anti-muscle lisse α-actine | Abcam, | ab5694 | |
| de chèvre anti-IgG de lapin, Alexa Fluor 555 | Invitrogen | A21430 | |
| Prolongez réactif antifading Or | Invitrogen | P36930 |
Références
- Deuse, T., Ikeno, F., Robbins, R. C., Schrepfer, S. Imaging In-Stent Restenosis: An Inexpensive, Reliable, and Rapid Preclinical Model. J. Vis. Exp. (31), e1346 (2009).
- Oyamada, S. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. J. Surg. Res. 166, e91-e95 (2011).
- Chamberlain, J. A novel mouse model of in situ stenting. Cardiovascular research. 85, 38-44 (2010).
- Deuse, T. Introducing the first polymer-free leflunomide eluting stent. Atherosclerosis. 200, 126-134 (2008).
- Finn, A. V. Differential healing after sirolimus, paclitaxel, and bare metal stent placement in combination with peroxisome proliferator-activator receptor gamma agonists: requirement for mTOR/Akt2 in PPARgamma activation. Circulation research. 105, 1003-1012 (2009).
- Tellez, A. Coronary bare metal stent implantation in homozygous LDL receptor deficient swine induces a neointimal formation pattern similar to humans. Atherosclerosis. 213, 518-524 (2010).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The pre-clinical animal model in the translational research of interventional cardiology. JACC Cardiovasc. Interv. 2, 373-383 (2009).
- Holt, C. M. Intimal proliferation in an organ culture of human internal mammary artery. Cardiovascular research. 26, 1189-1194 (1992).
- Swanson, N., Javed, Q., Hogrefe, K., Gershlick, A. Human internal mammary artery organ culture model of coronary stenting: a novel investigation of smooth muscle cell response to drug-eluting stents. Clin. Sci. (Lond). 103, 347-353 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon