É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Humanos da artéria mamária interna (IMA) Transplante e implante de stent: um modelo humano para estudar o desenvolvimento de reestenose intra-stent
Neste Artigo
Resumo
Este vídeo mostra um modelo para estudar o desenvolvimento da hiperplasia intimal após a implantação stent utilizando um recipiente humano (IMA) em um modelo murino imunodeficientes.
Resumo
Estudos pré-clínicos em modelos de pesquisa in vivo para investigar os processos Pathobiological e fisiopatológico no desenvolvimento de hiperplasia da íntima após stent navio são cruciais para 1,2 abordagens translacional.
Os modelos animais usados incluem ratinhos, ratos, coelhos, e porcos 3-5. No entanto, a tradução desses modelos em ambientes clínicos continua a ser difícil, uma vez que esses processos biológicos já estudados em vasos de animais, mas nunca realizada antes em modelos de pesquisa humanos 6,7. Neste vídeo mostramos um novo modelo humanizado de colmatar esta lacuna de translação. O procedimento apresentado é reprodutível, fácil e rápido para executar e é adequado para estudar o desenvolvimento da hiperplasia intimal ea aplicabilidade dos stents diversas.
Este vídeo mostra como executar a técnica de stent em vasos humanos seguidos por transplantes em ratos imunodeficientes, eidentifica a origem das células em proliferação como humana.
Protocolo
1. Artéria mamária interna Preparação (IMA)
- O endotélio arterial é desnudada pela passagem de uma 2-francês cateter de embolectomia Fogarty arterial (Baxter Healthcare, Deerfield, IL, EUA). O cateter é puxado através de todo o comprimento do vaso duas vezes para garantir o dano endotelial.
- Use qualquer stent humana de comprimento de 8 mm e 2,5 milímetros-3 milímetros de diâmetro (por exemplo, Translumina, Yukon stent). CUIDADO: O diâmetro do stent não deve exceder o diâmetro do vaso por mais de 10% para evitar a estenose pré e pós-stent. CUIDADO: Não ligue o comprimento do stent dentro do mesmo estudo.
- Implantar o stent usando a pressão do balão adequado (o que é observado na embalagem stent) para atingir o diâmetro desejado.
- Loja stent IMA em 4 ° C RPMI + heparina (500 IE/10 ml) em gelo até ao transplante.
2. Preparação dos animais
RNU Nude (Crl: NIH-Foxn1rnu) ratos (300-350 g) são housed em condições convencionais em scantainer ventilados armários, alimentado com ração e água libidum anúncio autoclavado.
- Anestesiar ratos com isoflurano (2,5-3%), utilizando uma câmara de indução.
- Raspar o cabelo abdominal e coloque o rato sobre as suas costas e colocar uma máscara sobre o nariz ea boca para manter a anestesia.
- Desinfetar a área abdominal amplamente usando Provo iodo, o uso de etanol próxima a 80% - repetir esta etapa duas vezes. Verifique reflexos beliscar as patas traseiras para ter a certeza que o rato é suficiente anestesiados.
- Sob visão microscópica, realizar uma laparotomia mediana superior para expor a aorta abdominal infra-renal.
- Coloque os intestinos em uma luva de solução salina hidratada. Dobrar a luva em torno dos intestinos para evitar a perda de humidade.
- Dissecar a aorta na região infra-à bifurcação, não cuidadosamente para causar danos nos ramos dos vasos.
- Use grampos micro para parar o fluxo sanguíneo na aorta. Colocar obraçadeira proximal primeiro, seguido pelo grampo distai.
- Remover um aplicativo. 0,5-0,7 segmento da aorta mm e lavar restante da aorta com heparina (200 unidades).
- Leve o IMA stent e encurtar a duração adequada e posicioná-lo na abertura.
- Ligue o IMA para a aorta destinatário, executando suturas usando 8-0 Prolene sutura (Ethicon, Norderstedt, Alemanha).
- Com cuidado, abra o grampo primeiro craniano e, em seguida, o grampo caudal.
- Deve haver um pulso visível na IMA transplantado e na extremidade distai da aorta.
- Coloque os intestinos de volta para o abdômen.
- Lave o abdômen com pré-aquecido salina estéril.
- Feche a camada muscular da parede abdominal com prolene 6-0 sutura (Ethicon, Norderstedt, Alemanha).
- Enquanto o rato é ainda em anestesia, injectar Carprofeno mg / kg por via subcutânea 4-5.
- Administrar analgesia pós-operatória como adequado (por exemplo, carprofeno ou Meloxicam) durante 3 dias pós Surgery.
3. Os resultados representativos
Para exame histológico, os espécimes foram fixados em formalina a 4%, desidratado em uma série graduada de álcool, e se infiltrou em uma mistura (MMA I) de metacrilato de metilo 80% e 20% de ftalato de dibutilo durante 1 dia, MMA I com 1% de peróxido de benzoílo seco para 1 dia, e MMA I com peróxido de benzoílo 3% seco (MMA III) durante 1-2 dias a 4 ° C. Em seguida, os espécimes foram polimerizados em fresco MMA III em frascos de vidro em um banho de água sobre uma base de pré-polimerizado. Polimerização lento foi conseguido mantendo os frascos a 26 ° C durante a noite, aumentando a temperatura para 28 ° C, na manhã seguinte, e em seguida aumentando a temperatura gradualmente por 0,5 ° C ao longo de 12 h até a polimerização ocorreu. Os blocos foram seccionados polimerizados em 5 uM espessura utilizando um micrótomo microM HM 360 equipado com uma faca de metal duro.
Para identificar a origem das células em proliferação (Figura 1), slides foram coradas com anticorpos para identificar tanto o verde de rato de proteína (GFP) ou fluorescente MHC-I e células musculares lisas. Para estes estudos, humano IMA foi incubada com o gene repórter da GFP durante a noite usando partículas lentivirais para a transdução estável de células IMA. Células-filhas que dividem de origem humana pode ser identificado por expressando GFP. Após a desparafinização, induzida pelo calor epítopo de recuperação é realizada por aquecimento das lâminas em solução de antigénio de recuperação usando um vaporizador. A Imagem-iT FX sinal potenciador pode ser usado para o passo de bloqueio. Células de origem humana são identificados usando os anticorpos monoclonais de ratinho contra a GFP (1:100 diluído em diluente de anticorpo primário (Dako)), e ainda mais marcada com cabra-anti-IgG de ratinho, Alexa Fluor 488 (1:1000 diluído em diluente de anticorpo secundário ). As células do músculo liso foram marcados com o coelho músculo liso anti-polycolonal α-actina (1:100 diluído em diluente de anticorpo primário), seguido por cabra-anti-IgG de coelho, Alexa Fluor 555 (1:1000 diluído em diluentes anticorpo secundário). Cada passo de incubação do anticorpo é realizado a 37 ° C durante 1 hora com PBS três vezes lavagem entre os dois. Os núcleos são coradas com DAPI durante 10 minutos. Após a montagem dos slides usando Prolongar reagente Antifade ouro, as amostras foram analisadas em microscopia confocal.
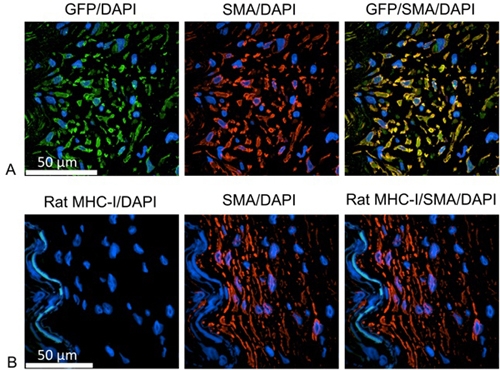
Figura 1. As células neointimal como células musculares lisas A:. Verde = anti GFP, marcação das células de origem humana; vermelho = anti actina de células humanas da musculatura lisa; azul = DAPI, identificando os núcleos das células B: Verde = rato anti MHC-I, rotulagem células de origem rato; vermelho = anti actina de células humanas da musculatura lisa; azul = DAPI, identificando os núcleos das células. As células em proliferação são identificados como células musculares lisas e positivas para GFP, mas negativa para o rato molécula de MHC-I. Portanto, as células em proliferação são de origem humana.
Discussão
Embora diferentes em modelos de pesquisa in vivo são existentes para investigar o desenvolvimento da hiperplasia intimal após a colocação do stent, estes modelos ainda enfrentam obstáculos de translação de superar. Além disso, os modelos animais de grande porte são as condições de habitação caros e especiais, bem como equipamento cirúrgico não está disponível para todos os laboratórios.
Usando um IMA humano para estudar o desenvolvimento da prolif...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores agradecem Christiane Pahrmann por sua contribuição. Agradecimentos especiais a Ethicon, Norderstedt, Hamburgo (Alemanha) para fornecer o material de sutura.
Financiamento
Sonja Schrepfer recebeu uma bolsa de pesquisa do Deutsche Forschungsgemeinschaft (DFG) (SCHR992 / 3 1 e SCHR992/4-1).] O trabalho foi suportado pelo Shumway Carreira ISHLT Desenvolvimento Grant 2010 e da Pesquisa Falk Financiamento (Stanford University).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de Catálogo | Comentários |
| 2 cateter de Fogarty francês | Baxter Healthcare, Deerfield, IL, EUA | 120602F | |
| Yukon Stent | Translumina GmbH, Hechingen, Alemanha | Use o stent de sua escolha de acordo com o protocolo do estudo | |
| Meio RPMI | Biochrom | Nr.F1275 | |
| heparina | Baxter | 2B0953 | |
| isoflurano | Abade | B506 | |
| Provo Iodo- | Betadine Puredue Pharma | EAN: 5995327165830 | |
| 80% etanol | Geyer | ETV 80/0500 | |
| Micro pinça | Harvard Apparatus | PY2-61-0186 | |
| Suturas 8-0 | Johnson & Johnson, | 2808G | |
| Suturas 6-0 | Johnson & Johnson, | 1698 H | |
| Carprofeno | Vet Feizer | PZN: 0110208 | |
| Metamizol | Ratiopharm | ||
| Solução alvo de recuperação, pH9 | Dako | S2368 | |
| Imagem-iT FX sinal potenciador | Invitrogen | I36933 | |
| rato anticorpo anti-GFP monoclonal | Cores vivas BD | 632381 | |
| diluente anticorpo primário | Dako | S3022 | |
| cabra-anti-IgG de ratinho, Alexa Fluor 488 | Invitrogen | A11017 | |
| diluente anticorpo secundário | Dako | S0809 | |
| coelho anti-músculo liso polycolonal α-actina | Abcam, | ab5694 | |
| cabra anti-IgG de coelho, Alexa Fluor 555 | Invitrogen | A21430 | |
| Prolongar reagente Antifade Ouro | Invitrogen | P36930 |
Referências
- Deuse, T., Ikeno, F., Robbins, R. C., Schrepfer, S. Imaging In-Stent Restenosis: An Inexpensive, Reliable, and Rapid Preclinical Model. J. Vis. Exp. (31), e1346 (2009).
- Oyamada, S. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. J. Surg. Res. 166, e91-e95 (2011).
- Chamberlain, J. A novel mouse model of in situ stenting. Cardiovascular research. 85, 38-44 (2010).
- Deuse, T. Introducing the first polymer-free leflunomide eluting stent. Atherosclerosis. 200, 126-134 (2008).
- Finn, A. V. Differential healing after sirolimus, paclitaxel, and bare metal stent placement in combination with peroxisome proliferator-activator receptor gamma agonists: requirement for mTOR/Akt2 in PPARgamma activation. Circulation research. 105, 1003-1012 (2009).
- Tellez, A. Coronary bare metal stent implantation in homozygous LDL receptor deficient swine induces a neointimal formation pattern similar to humans. Atherosclerosis. 213, 518-524 (2010).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The pre-clinical animal model in the translational research of interventional cardiology. JACC Cardiovasc. Interv. 2, 373-383 (2009).
- Holt, C. M. Intimal proliferation in an organ culture of human internal mammary artery. Cardiovascular research. 26, 1189-1194 (1992).
- Swanson, N., Javed, Q., Hogrefe, K., Gershlick, A. Human internal mammary artery organ culture model of coronary stenting: a novel investigation of smooth muscle cell response to drug-eluting stents. Clin. Sci. (Lond). 103, 347-353 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados