このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
人間の内胸動脈(IMA)移植およびステント留置術:ステント内再狭窄の開発を研究するための人体モデル
要約
このビデオでは、免疫不全ラットモデルにおいてヒト血管(IMA)を使用して、ステント展開後に内膜肥厚の開発を研究するためのモデルを示しています。
要約
血管ステント留置後の内膜肥厚の開発にpathobiologicalと病態生理学的プロセスを調べることがin vivoでの研究モデルの前臨床試験では、トランスレーショナルアプローチ1,2のために重要である。
一般的に使用される動物モデルはマウス、ラット、ウサギ、ブタ3-5含まれています。それらの生物学的プロセスが既に動物の血管で研究が、ヒトの研究モデル6,7の前に実行されることはありませんしかし、臨床現場へのこれらのモデルの変換は、困難である。このビデオでは、この翻訳のギャップを克服するための新たなヒト化モデルを示しています。に示す手順は、実行するために、再現性が容易で、高速であり、内膜肥厚と多様なステントの適用の開発を勉強するのに適しています。
このビデオでは、免疫不全ラットへの移植に続いて、人間の血管内ステント技術を実行する方法を示し、人間として増殖する細胞の起源を識別します。
プロトコル
1。内胸動脈(IMA)の準備
- 動脈内皮は2フランスのフォガティ動脈塞栓除去カテーテル(バクスターヘルスケア、ディアフィールド、イリノイ州、米国)の通過によって荒廃しています。カテーテルが血管内皮の損傷を確実にするために二回全体の血管の長さを介してプルアップされています。
- 8mmの長さと直径が2.5ミリメートル、3ミリメートル(例えばTranslumina、ユーコンステント)のいずれかの人間のステントを使用しています。注意:ステントの直径は、事前と事後ステント狭窄を回避するために、10%以上の血管径を超えないようにしてください。注意:同一の研究内ステントの長さを切り替えないでください。
- 所望の直径を達成するために適切なバルーン圧(ステントパッケージに記載されている)を使用してステントを展開します。
- ストアでは、移植まで氷上°C RPMI +ヘパリン(500 IE/10 ml)を4でIMAをステント。
2。動物の準備
RNUヌード(CRL:NIH-Foxn1rnu)ラット(300〜350 g)はHOUです。scantainer、従来の条件の下でsedはキャビネット、飼料標準ラット固形飼料およびオートクレーブ処理水の広告libidumを換気。
- 誘導チャンバーを用いて(2.5から3パーセント)イソフルランでラットを麻酔。
- 腹部の毛を剃ると、その後ろにラットを置いて、その鼻と麻酔を維持するために口にフェイスマスクを配置します。
- 広くプロボ、ヨウ素、次回の使用の80%エタノールを用いて腹部を消毒する - が二回、この手順を繰り返します。ラットが麻酔で十分であることを確認するために、後肢の足をつまんで反射を確認してください。
- 微視的なビューでは、大動脈腹部大動脈を露出させる上部の中央値は開腹術を実行します。
- 生理食塩水保湿手袋で腸を配置します。水分の損失を防ぐために、腸の周りにグローブを折る。
- 大動脈領域から分岐する大動脈を解剖、慎重に血管の枝に損傷を引き起こすことがありません。
- 大動脈の血流を停止するには、マイクロクランプを使用しています。配置近位クランプは、まず遠位クランプ続く。
- アプリを削除します。 0.5〜0.7ミリメートルの大動脈セグメントとヘパリン(200単位)で、残りの大動脈をフラッシュします。
- ステントIMAを取り、十分な長さに短縮し、ギャップに配置します。
- 8から0プロレン縫合糸(エチコン、ノルダーシュテット、ドイツ)を用いて縫合を実行することによって、受信者の大動脈へのIMA接続します。
- 慎重に第一脳神経クランプして、尾クランプを開きます。
- 移植されたIMAおよび大動脈の遠位端で目に見えるパルスがあるはずです。
- 腹部に戻し腸を配置します。
- 予め温めておいた滅菌生理食塩水で腹部をフラッシュします。
- 6から0プロレン実行している縫合糸(エチコン、ノルダーシュテット、ドイツ)を使用して、腹壁の筋層を閉じます。
- ラットが麻酔に入れたまま、皮下に4から5 mg / kgのカルプロフェンを注入します。
- ポストsurg 3日間必要に応じて、外科手術後の鎮痛(例えば、カルプロフェンまたはメロキシカム)の管理ery。
3。代表的な結果
1%乾燥した過酸化ベンゾイルとMMA I、1日のフタル酸ジブチル組織のために、検体はアルコールの段階的なシリーズで脱水し、4%ホルマリンで固定した、と80%のメチルメタクリレートの混合物(MMA I)に浸潤し、20% 4で1〜2日で3%乾燥過酸化ベンゾイル(MMA III)で1日、MMA I℃のその後、標本は、プレ重合ベースで水浴中でガラスバイアルに新鮮なMMA IIIで重合された。ゆっくりと重合が26でバイアルを維持することによって達成された℃で一晩、重合が発生するまで°C翌朝、その後徐々に0.5°C 12時間かけて温度を増加させる28の温度を上昇させる。重合ブロックは、炭化タングステンのナイフを装備マイクロモルHM 360ミクロトームを使用して、5μmの厚さで切片。
増殖細胞の起源( 図1)、sを識別するlidesのいずれか緑色蛍光タンパク質(GFP)またはラットMHC-Iとヒト平滑筋細胞を識別する抗体で染色した。これらの研究では、人間のIMAは、一晩IMAの細胞の安定な形質導入のためにレンチウイルス粒子を用いたレポーター遺伝子GFPとインキュベートした。人間の原点から分割する娘細胞は、GFPを発現することによって同定することができた。脱パラフィンした後、熱誘導エピトープ検索は蒸し器を使って抗原賦活液中でスライドを加熱することによって実行されます。画像-IT FXシグナルエンハンサーブロッキングステップに使用することができます。ヒト由来の細胞は、GFP(一次抗体希釈液(Dako社製)で希釈した1:100)に対するマウスモノクローナル抗体を用いて同定し、さらにヤギ抗マウスIgG、のAlexa Fluor®488(1:1000二次抗体希釈液で希釈しが付いています。)平滑筋細胞は、ヤギ抗ウサギIgG、Alexaのフルオ続いて、ウサギpolycolonal抗平滑筋α-アクチン(一次抗体希釈液で希釈した1:100)でマークされていたR 555(二次抗体希釈液で希釈した1:1000)。各抗体のインキュベーションステップは三回PBSの間での洗浄で1時間37℃で行われます。核は10分間DAPIで染色されています。 Gold褪色防止試薬を延長使用してスライドをマウントした後、試料を共焦点顕微鏡を用いて分析した。
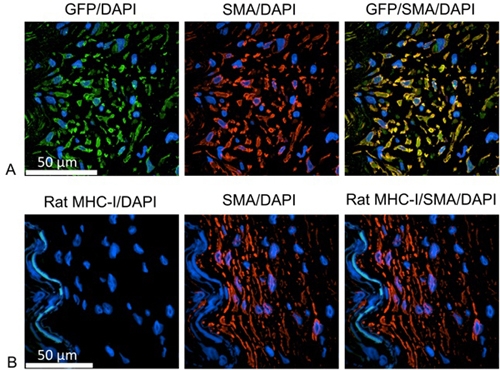
図1。ヒト平滑筋細胞のような新生内膜細胞:緑=抗GFP、ヒト由来の細胞を標識、赤=抗ヒト平滑筋細胞のアクチン、青= DAPI、細胞核を識別B:グリーン=抗ラットMHC-I、ラベリングラット由来の細胞、赤=抗ヒト平滑筋細胞のアクチン、青= DAPI、細胞核を識別します。増殖細胞は平滑筋細胞として同定され、GFP陽性であるが、ラットのMHC-I分子の負されています。したがって、増殖細胞はヒト由来である。
ディスカッション
in vivoでの研究のモデルで異なるが、ステント留置後の内膜肥厚の開発を調査するために既存していますが、これらのモデルは、まだ克服するために、トランスレーショナルハードルに直面している。さらに、大型の動物モデルは、高価で特殊な住宅事情であるだけでなく、手術の機器はすべての研究所では使用できません。
人間の内膜増殖およびステント...
開示事項
利害の衝突が宣言されません。
謝辞
著者は、彼女の貢献のためにクリスティPahrmannに感謝します。縫合材料を提供するためのエチコン、ノルダーシュテット、ハンブルク(ドイツ)に感謝します。
資金調達
ソーニャSchrepferは、ドイツ学術振興(DFG)(SCHR992 / 3 1とSCHR992/4-1)から研究助成を受けています。]仕事がISHLTシャムウェイキャリア開発グラント2010ファルク研究資金(スタンフォード大学)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| 2フランスのフォガティ·カテーテル | バクスターヘルスケア、ディアフィールド、イリノイ州、アメリカ合衆国 | 120602F | |
| ユーコンステント | Translumina GmbHは、ヘッヒンゲン、ドイツ | あなたの研究プロトコルに従って、お好みのステントを使用します。 | |
| RPMI培地 | Biochrom | Nr.F1275 | |
| ヘパリン | バクスター | 2B0953 | |
| イソフルレン | アボット | B506 | |
| プロボ - ヨウ素 | Betadine Puredueファーマ | EAN:5995327165830 | |
| 80パーセントエタノリットル | ガイヤー | ETV 80/0500 | |
| マイクロクランプ | ハーバード装置 | PY2-61から0186 | |
| 縫合8から0 | ジョンソン·エンド·ジョンソン、 | 2808G | |
| 縫合6から0 | ジョンソン·エンド·ジョンソン、 | 1698年H | |
| カルプロフェン | Feizerの獣医 | PZN:0110208 | |
| Metamizol | Ratiopharm | ||
| ターゲット検索ソリューションは、pH9の | Dako社 | S2368 | |
| 画像-IT FXシグナルエンハンサー | インビトロジェン | I36933 | |
| マウスモノクローナル抗GFP抗体 | BDの生活の色 | 632381 | |
| 一次抗体希釈液 | Dako社 | S3022 | |
| ヤギ抗マウスIgG、のAlexa Fluor®488 | インビトロジェン | A11017 | |
| 二次抗体希釈液 | Dako社 | S0809 | |
| ウサギpolycolonal抗平滑筋α-アクチン | アブカム、 | ab5694 | |
| ヤギ抗ウサギIgG、のAlexa Fluor®555 | インビトロジェン | A21430 | |
| Gold褪色防止試薬を延長 | インビトロジェン | P36930 |
参考文献
- Deuse, T., Ikeno, F., Robbins, R. C., Schrepfer, S. Imaging In-Stent Restenosis: An Inexpensive, Reliable, and Rapid Preclinical Model. J. Vis. Exp. (31), e1346 (2009).
- Oyamada, S. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. J. Surg. Res. 166, e91-e95 (2011).
- Chamberlain, J. A novel mouse model of in situ stenting. Cardiovascular research. 85, 38-44 (2010).
- Deuse, T. Introducing the first polymer-free leflunomide eluting stent. Atherosclerosis. 200, 126-134 (2008).
- Finn, A. V. Differential healing after sirolimus, paclitaxel, and bare metal stent placement in combination with peroxisome proliferator-activator receptor gamma agonists: requirement for mTOR/Akt2 in PPARgamma activation. Circulation research. 105, 1003-1012 (2009).
- Tellez, A. Coronary bare metal stent implantation in homozygous LDL receptor deficient swine induces a neointimal formation pattern similar to humans. Atherosclerosis. 213, 518-524 (2010).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The pre-clinical animal model in the translational research of interventional cardiology. JACC Cardiovasc. Interv. 2, 373-383 (2009).
- Holt, C. M. Intimal proliferation in an organ culture of human internal mammary artery. Cardiovascular research. 26, 1189-1194 (1992).
- Swanson, N., Javed, Q., Hogrefe, K., Gershlick, A. Human internal mammary artery organ culture model of coronary stenting: a novel investigation of smooth muscle cell response to drug-eluting stents. Clin. Sci. (Lond). 103, 347-353 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved