Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Humanos mamaria interna arteria (IMA) de Trasplantes y colocación de un stent: un modelo humano para estudiar el desarrollo de la reestenosis intra-stent
En este artículo
Resumen
Este video muestra un modelo para estudiar el desarrollo de hiperplasia de la íntima después de la implantación del stent utilizando un recipiente humano (IMA) en un modelo de rata inmunodeficiente.
Resumen
Preclínica en modelos in vivo de investigación para investigar los procesos patobiológicas y fisiopatológicos en el desarrollo de hiperplasia de la íntima después de la colocación de stents buques son cruciales para el 1,2 enfoques de la traducción.
Los modelos animales comúnmente utilizados son ratones, ratas, conejos, cerdos y 3-5. Sin embargo, la traducción de estos modelos en entornos clínicos sigue siendo difícil, ya que los procesos biológicos ya se estudió en los vasos de los animales, pero nunca realizado antes en modelos de investigación humanos 6,7. En este video se demuestra un nuevo modelo humanizado de superar esta brecha de la traducción. El procedimiento que se muestra es reproducible, fácil y rápido de realizar y es adecuado para estudiar el desarrollo de hiperplasia de la íntima y la aplicación de stents diversas.
Este vídeo muestra cómo realizar la técnica de stent en los vasos humanos seguida por el trasplante en ratas inmunodeficientes, yidentifica el origen de las células proliferantes como humano.
Protocolo
1. La arteria mamaria interna (AMI) Preparación
- El endotelio arterial se desnuda por el paso de un catéter de 2-francés Fogarty embolectomía arterial (Baxter Healthcare, Deerfield, IL, EE.UU.). El catéter se saca a través de la longitud del recipiente entero dos veces para asegurar el daño endotelial.
- Utilice cualquier stent humana de duración de 8 mm y 2,5 mm-3 mm de diámetro (por ejemplo, Translumina, Yukon stent). PRECAUCION: El diámetro del stent no debe exceder el diámetro del vaso en más del 10% para evitar la estenosis pre y post-stent. PRECAUCIÓN: No cambie la longitud del stent dentro del mismo estudio.
- Despliegue el stent utilizando la presión de globo adecuado (que se observa en el paquete del stent) para conseguir el diámetro deseado.
- Tienda IMA stent en 4 ° C RPMI + heparina (500 ml IE/10) sobre el hielo hasta el trasplante.
2. Preparación de Animales
RNU Nude (Crl: NIH Foxn1rnu) ratas (300-350 g) se housed bajo condiciones convencionales en scantainer ventilados, alimentados con pienso estándar para ratas y agua ad libidum autoclave.
- Se anestesia la rata con isoflurano (2,5-3%), utilizando una cámara de inducción.
- Afeitar el vello abdominal y colocar la rata en su espalda y coloque una mascarilla sobre la nariz y la boca para mantener la anestesia.
- Desinfecte la zona abdominal ampliamente mediante Provo-yodo, el próximo uso etanol al 80% - repita este paso dos veces. Compruebe reflejos pellizcando las patas traseras para asegurarse de que la rata es suficiente anestesia.
- Bajo visión microscópica, realizar una laparotomía media superior para exponer la aorta abdominal infrarrenal.
- Coloque los intestinos en un guante hidratada solución salina. Doble el guante alrededor de los intestinos para evitar la pérdida de humedad.
- Disección de la aorta infrarrenal de la región a la bifurcación, con cuidado para no causar daños en las ramas de los vasos.
- Utilice abrazaderas micro para detener el flujo sanguíneo aórtico. Coloque elabrazadera proximal primero, seguido por la pinza distal.
- Eliminar una aplicación. 0.5-0.7 segmento aórtico mm y vaciar la aorta restante con heparina (200 unidades).
- Tome el IMA con stent y acortar a la longitud adecuada y colocarlo en el hueco.
- Conecte el IMA a la aorta receptor, mediante la ejecución de las suturas de prolene 8-0 con puntos de sutura (Ethicon, Norderstedt, Alemania).
- Abra cuidadosamente la primera abrazadera craneal y luego la pinza caudal.
- No debe haber un pulso visible en el trasplantado IMA y en el extremo distal de la aorta.
- Coloque los intestinos en el abdomen.
- Lave el abdomen con pre-calentado solución salina estéril.
- Cerca de la capa muscular de la pared abdominal usando suturas de prolene 6-0 funcionamiento (Ethicon, Norderstedt, Alemania).
- Mientras que la rata se encuentra todavía en la anestesia, inyectar 4-5 mg / kg de carprofeno por vía subcutánea.
- Administrar la analgesia post-quirúrgica, según proceda (por ejemplo, carprofeno o meloxicam) durante 3 días después de la SurgEry.
3. Los resultados representativos
Para histología, las muestras fueron fijadas en formol al 4%, se deshidrataron en una serie gradual de alcohol, y se infiltró en una mezcla (MMA I) de 80% de metacrilato de metilo y el 20% de ftalato de dibutilo por 1 día, yo con MMA seca de peróxido de benzoilo para el 1% Hace 1 semana, y yo MMA con peróxido de benzoilo seca 3% (MMA III) durante 1-2 días a 4 ° C. Posteriormente, las muestras se polimeriza en fresco III MMA en viales de vidrio en un baño de agua sobre una base de pre-polimerizado. Polimerización lenta se logra manteniendo los viales a 26 ° C durante la noche, aumentando la temperatura a 28 ° C a la mañana siguiente, y luego aumentar gradualmente la temperatura de 0,5 ° C durante 12 h hasta que la polimerización se produjo. Los bloques polimerizados se seccionaron en espesor micras 5 utilizando un microtomo MICROM HM 360 equipado con una cuchilla de carburo de tungsteno.
Para identificar el origen de la proliferación de las células (figura 1), las diapositivas se Stained con la identificación de anticuerpos o bien la rata proteína verde fluorescente (GFP) o MHC-I y las células musculares lisas. Para estos estudios, humano IMA se incubó con el gen reportero GFP durante la noche utilizando partículas lentiviral para la transducción estable de células IMA. La división de las células hijas de origen humano podrían ser identificados mediante la expresión de GFP. Después de deparaffinization, inducida por el calor de recuperación del epítopo se realiza mediante el calentamiento de las diapositivas en la solución de antígeno de recuperación con un barco de vapor. La imagen-iT FX señal potenciador se puede utilizar para la etapa de bloqueo. Las células de origen humano se identifican usando los anticuerpos monoclonales de ratón contra GFP (1:100 diluida en diluyente anticuerpo primario (Dako)), y aún más marcado con cabra anti-IgG de ratón, Alexa Fluor 488 (1:1000 diluido en diluyente anticuerpo secundario ). Las células del músculo liso se marcaron con el conejo polycolonal anti-músculo liso α-actina (1:100 diluida en diluyente anticuerpo primario), seguido de cabra anti-IgG de conejo, Alexa Fluor 555 (1:1000 dilbuidas en diluyentes anticuerpo secundario). Cada etapa de incubación del anticuerpo se realizó a 37 ° C durante 1 hora con PBS tres veces el lavado en el medio. Los núcleos se tiñeron con DAPI durante 10 minutos. Después del montaje de las diapositivas utilizando Prolongue reactivo Antifade Oro, las muestras se analizaron mediante microscopía confocal.
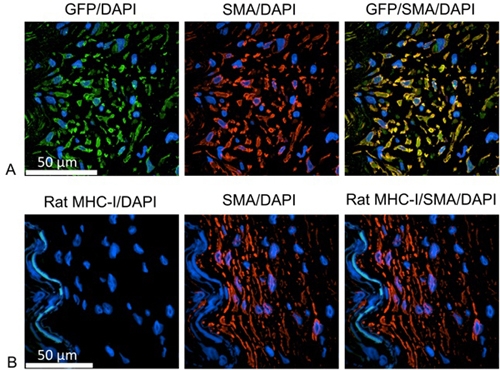
Figura 1. las células neointimal como las células del músculo liso R:. Verde = contra las buenas prácticas agrarias, el etiquetado de las células de origen humano, rojo = humanos anti actina de células musculares lisas, de color azul = DAPI, la identificación de núcleos de células B: Verde = rata anti MHC-I, el etiquetado las células de origen rata; rojo = humanos anti actina de células musculares lisas, de color azul = DAPI, la identificación de los núcleos celulares. Las células en crecimiento se identifican como células musculares lisas y positivos para las buenas prácticas agrarias, pero negativo para la rata MHC-I molécula. Por lo tanto, las células proliferantes son origen humano.
Discusión
Aunque diferentes en los modelos de investigación in vivo son existentes para investigar el desarrollo de hiperplasia de la íntima después de la colocación de un stent, estos modelos siguen enfrentando obstáculos para superar translacional. Además, los modelos animales grandes son las condiciones de vivienda caros y especiales, así como equipo quirúrgico no está disponible para todos los laboratorios.
El uso de un IMA humanos para estudiar el desarrollo humano de l...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores agradecen a Christiane Pahrmann por su contribución. Un agradecimiento especial a Ethicon, Norderstedt, Hamburgo (Alemania) para proporcionar el material de sutura.
Financiamiento
Sonja Schrepfer ha recibido una beca de investigación de la Deutsche Forschungsgemeinschaft (DFG) (SCHR992 / 3 1 y SCHR992/4-1).] El trabajo fue apoyado por la ISHLT Shumway Carrera Donaciones para el Desarrollo de 2010 y la financiación de investigación Falk (Universidad de Stanford).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| 2 catéter de Fogarty francesa | Baxter Healthcare, Deerfield, IL, EE.UU. | 120602F | |
| Yukon stent | Translumina GmbH, Hechingen, Alemania | El uso del stent de su elección de acuerdo a su protocolo de estudio | |
| Medio RPMI | Biochrom | Nr.F1275 | |
| heparina | Baxter | 2B0953 | |
| isoflurano | Abad | B506 | |
| Provo-yodo | Betadine Puredue Pharma | EAN: 5995327165830 | |
| 80% etanol | Geyer | ETV 80/0500 | |
| Micro pinza | Aparato de Harvard | PY2-61 hasta 0186 | |
| Las suturas 8-0 | Johnson & Johnson, | 2808G | |
| Las suturas 6-0 | Johnson & Johnson, | 1698 H | |
| Carprofeno | Feizer Vet | PZN: 0110208 | |
| Metamizol | Ratiopharm | ||
| Target Retrieval Solution, pH 9 | Dako | S2368 | |
| Imagen de la señal FX-iT potenciador | Invitrogen | I36933 | |
| monoclonal de ratón anticuerpos anti-GFP | BD colores vivos | 632381 | |
| diluyente anticuerpo primario | Dako | S3022 | |
| de cabra anti-IgG de ratón, Alexa Fluor 488 | Invitrogen | A11017 | |
| diluyente anticuerpo secundario | Dako | S0809 | |
| conejo polycolonal anti-músculo liso α-actina | Abcam, | ab5694 | |
| cabra anti-IgG de conejo, Alexa Fluor 555 | Invitrogen | A21430 | |
| Prolongar el reactivo Antifade Oro | Invitrogen | P36930 |
Referencias
- Deuse, T., Ikeno, F., Robbins, R. C., Schrepfer, S. Imaging In-Stent Restenosis: An Inexpensive, Reliable, and Rapid Preclinical Model. J. Vis. Exp. (31), e1346 (2009).
- Oyamada, S. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. J. Surg. Res. 166, e91-e95 (2011).
- Chamberlain, J. A novel mouse model of in situ stenting. Cardiovascular research. 85, 38-44 (2010).
- Deuse, T. Introducing the first polymer-free leflunomide eluting stent. Atherosclerosis. 200, 126-134 (2008).
- Finn, A. V. Differential healing after sirolimus, paclitaxel, and bare metal stent placement in combination with peroxisome proliferator-activator receptor gamma agonists: requirement for mTOR/Akt2 in PPARgamma activation. Circulation research. 105, 1003-1012 (2009).
- Tellez, A. Coronary bare metal stent implantation in homozygous LDL receptor deficient swine induces a neointimal formation pattern similar to humans. Atherosclerosis. 213, 518-524 (2010).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The pre-clinical animal model in the translational research of interventional cardiology. JACC Cardiovasc. Interv. 2, 373-383 (2009).
- Holt, C. M. Intimal proliferation in an organ culture of human internal mammary artery. Cardiovascular research. 26, 1189-1194 (1992).
- Swanson, N., Javed, Q., Hogrefe, K., Gershlick, A. Human internal mammary artery organ culture model of coronary stenting: a novel investigation of smooth muscle cell response to drug-eluting stents. Clin. Sci. (Lond). 103, 347-353 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados