Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Menschliche Arteria mammaria interna (IMA) Transplantation und Stenting: A Human Model um die Entwicklung von In-Stent Restenose Studie
In diesem Artikel
Zusammenfassung
Dieses Video zeigt ein Modell zur Entwicklung von Intimahyperplasie nach der Entfaltung des Stents unter Verwendung einer menschlichen Gefäß (IMA) in einem immundefizienten Rattenmodell zu untersuchen.
Zusammenfassung
Präklinische Forschung in vivo Modelle zu pathobiologischen und pathophysiologischen Prozessen in der Entwicklung der Intimahyperplasie nach Gefäß-Stents zu untersuchen sind entscheidend für translationale Ansätze 1,2.
Die am häufigsten verwendeten Tiermodelle gehören Mäuse, Ratten, Kaninchen, Schweine und 3-5. Allerdings bleibt die Übersetzung dieser Modelle in den klinischen Alltag schwierig, da diese biologischen Prozesse bereits in der Tier-Gefäße untersucht werden, aber nie in der menschlichen Forschung Modelle 6,7 durchgeführt. In diesem Video zeigen wir einen neuen humanisierten Modell, um diese Lücke zu überwinden translationale. Das gezeigte Verfahren ist reproduzierbar, einfach und schnell durchzuführen und geeignet ist, die Entwicklung von Intimahyperplasie und die Anwendbarkeit von verschiedenen Stents zu studieren.
Dieses Video zeigt, wie die Stent-Technik in der menschlichen Gefäße durch Transplantation in immundefizienten Ratten folgten durchzuführen, undbezeichnet die Herkunft von proliferierenden Zellen als Menschen.
Protokoll
1. Arteria mammaria interna (IMA) Vorbereitung
- Die arterielle Endothel wird durch die Passage eines 2-Französisch Fogarty arteriellen Embolektomie Katheter (Baxter Healthcare, Deerfield, IL, USA) entblößt. Der Katheter wird durch das ganze Schiff Länge gezogen zweimal zu Endothelschädigung zu gewährleisten.
- Verwenden Sie eine beliebige menschliche Stent 8mm Länge und 2,5 mm-3 mm Durchmesser (zB Translumina, Yukon Stent). ACHTUNG: Der Durchmesser des Stents sollte nicht mehr als die Gefäßdurchmesser um mehr als 10% auf Pre-und Post-Stent-Stenose zu vermeiden. ACHTUNG: Schalten Sie nicht die Länge des Stents innerhalb der gleichen Studie.
- Den Stent unter Verwendung der entsprechenden Ballondruck (die auf dem Stent-Paket angegeben), um den gewünschten Durchmesser zu erreichen.
- Shop gestentet IMA in 4 ° C RPMI + Heparin (500 IE/10 ml) auf Eis bis zur Transplantation.
2. Tierische Vorbereitung
RNU Nude (CRL: NIH-Foxn1rnu) Ratten (300-350 g) sind HouSED unter üblichen Bedingungen in scantainer belüfteten Schränken, Fed Standard Rattenfutter und autoklaviertem Wasser ad libidum.
- Anesthetize Ratte mit Isofluran (2,5-3%) mit einem Induktions-Kammer.
- Rasieren Sie die Bauch-Haar und legen Sie die Ratte auf den Rücken und legen Sie eine Gesichtsmaske über die Nase und den Mund zu halten die Anästhesie.
- Desinfizieren Sie die Bauch-Bereich weit über Provo-Jod nächsten Einsatz 80% Ethanol - wiederholen Sie diesen Schritt zweimal. Überprüfen Reflexe Einklemmen der Hinterpfoten, um sicherzustellen, dass die Ratte ausreichend betäubt ist.
- Unter mikroskopischer Sicht, führen Sie eine obere mediane Laparotomie, um die infrarenalen Bauchaorta aussetzen.
- Platzieren Sie den Darm in einer Kochsalzlösung befeuchtet Handschuh. Falten Sie den Handschuh um den Darm, um den Verlust von Feuchtigkeit zu verhindern.
- Präparieren Sie die Aorta aus der infrarenalen Region zur Bifurkation, vorsichtig, um Schäden nicht auf den Zweigen der Gefäße führen.
- Verwenden Sie Klammern, um die Mikro-Aorten Blutfluss zu stoppen. Legen Sie dieproximale Klemme, gefolgt von dem distalen Klemme.
- Entfernen Sie eine App. 0,5-0,7 mm Aortasegment und spülen Sie den restlichen Aorta mit Heparin (200 Einheiten).
- Nehmen Sie die IMA-Stent und verkürzen sie auf die angemessene Länge und positionieren Sie es in die Lücke.
- Verbinden Sie die IMA an den Empfänger Aorta, von einer fortlaufenden Naht mit 8-0 Prolene Nahtmaterial (Ethicon, Norderstedt, Deutschland).
- Öffnen Sie vorsichtig die ersten kranialen Klemme und dann die kaudalen Klemme.
- Es sollte ein sichtbar-Impuls in der transplantierten IMA und am distalen Ende der Aorta sein.
- Platzieren Sie den Darm wieder in den Bauch.
- Spülen Sie den Bauch mit vorgewärmten steriler Kochsalzlösung.
- Schließen Sie die Muskelschicht der Bauchwand mit 6-0 Prolene fortlaufenden Nähten (Ethicon, Norderstedt, Deutschland).
- Während die Ratte immer noch in der Anästhesie, injizieren 4-5 mg / kg subkutan Carprofen.
- Verwalten postoperativen Analgesie gegebenenfalls (zB Carprofen oder Meloxicam) für 3 Tage nach surgery.
3. Repräsentative Ergebnisse
Für die Histologie wurden die Proben in 4% Formalin, dehydratisiert in einer abgestuften Serie von Alkohol fixiert und infiltriert in einem Gemisch (MMA I) von 80% Methylmethacrylat und 20% Dibutylphthalat für 1 Tag, MMA I mit 1% Trockensubstanz Benzoylperoxid 1 Tag und MMA I mit 3% Trockensubstanz Benzoylperoxid (MMA III) für 1-2 Tage bei 4 ° C Danach wurden die Proben in frischem MMA III in Glasfläschchen in einem Wasserbad auf einer vorpolymerisierten Basis polymerisiert. Langsam wurde die Polymerisation, indem sie die Fläschchen bei 26 ° C über Nacht erreicht, Erhöhung der Temperatur auf 28 ° C am nächsten Morgen, und dann schrittweise Erhöhung der Temperatur um 0,5 ° C über 12 h, bis die Polymerisation aufgetreten. Die polymerisierten Blöcken wurden bei 5 mu m Dicke mit Hilfe eines MICROM HM 360 Mikrotom mit einer Wolframcarbid-Messer ausgestattet geschnitten.
Um den Ursprung der proliferierenden Zellen (1) zu identifizieren, skollidiert wurden mit Antikörpern identifiziert entweder das grün fluoreszierende Protein (GFP) oder Ratte gefärbt MHC-I und menschlichen glatten Muskelzellen. Für diese Studien wurde menschliches IMA mit dem GFP-Reportergen über Nacht unter Verwendung lentivirale Partikel für eine stabile Transduktion von IMA-Zellen inkubiert. Die Aufteilung Tochter Zellen aus menschlichen Ursprungs konnte durch Expression von GFP identifiziert werden. Nach der Entparaffinierung, wird die Wärme-induzierte Epitopdemaskierung durch Erhitzen der Folien in der Antigen-Retrieval-Lösung mit einem Dampfer durchgeführt. Der Image-iT FX Signal Enhancer kann für die Sperrung Schritt verwendet werden. Zellen menschlichen Ursprungs werden anhand der monoklonalen Maus-Antikörper gegen GFP (1:100 in primären Antibody Diluent (Dako), verdünnt), und weiter mit Ziege-anti-Maus-IgG, Alexa Fluor 488 (1:1000 verdünnt in sekundären Antikörper Verdünnungsmittel beschriftet ). Die glatten Muskelzellen wurden mit dem Kaninchen-polyklonale Anti-glatte Muskulatur α-Aktin (1:100 in primärem Antikörper verdünnt) markiert, gefolgt von Ziege-anti-Kaninchen-IgG, Alexa FluoR 555 (1:1000 in sekundären Antikörper Verdünnungsmittel verdünnt). Jeder Antikörper Inkubationsschritt bei 37 ° C für 1 Stunde mit PBS dreimal gewaschen zwischen durchgeführt. Die Zellkerne sind mit DAPI für 10 Minuten gefärbt. Nach der Montage der Folien mit Gold-Verlängern antifade Reagenz wurden die Proben analysiert mit Hilfe der konfokalen Mikroskopie.
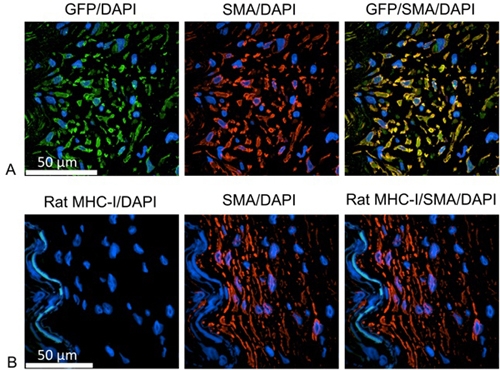
Abbildung 1. Die Neointima Zellen wie humanen glatten Muskelzellen A:.. Grün = anti-GFP, die Markierung von Zellen menschlichen Ursprungs; rot = anti menschliche glatte Muskelzellen Aktin; blau = DAPI, Identifizierung Zellkerne B: Grün = anti Ratte MHC-I-, Etikettier Zellen der Ratte Herkunft, rot = anti menschliche glatte Muskelzellen Aktin; blau = DAPI, Identifizierung Zellkerne. Proliferierenden Zellen werden als glatte Muskelzellen und positiv für GFP identifiziert, aber negativ für den Ratten-MHC-I-Molekül. Daher sind proliferierenden Zellen menschlichen Ursprungs.
Diskussion
Obwohl verschiedene In-vivo-Forschung werden bestehende Modelle, die Entwicklung der Intimahyperplasie nach Stentimplantation zu untersuchen, diese Modelle noch immer vor translationale Hürden zu überwinden. Darüber hinaus sind Großtiermodellen teure und spezielle Haltungsbedingungen sowie chirurgische Geräte ist nicht für alle Laboratorien zur Verfügung.
Mit Hilfe eines menschlichen IMA, um die Entwicklung der menschlichen Intimaproliferation und In-Stent Restenose zu studie...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren danken Christiane Pahrmann für ihren Beitrag. Besonderer Dank geht an Ethicon, Norderstedt, Hamburg (Deutschland) für die Bereitstellung des Nahtmaterial.
Finanzierung
Sonja Schrepfer hat ein Forschungsstipendium der Deutschen Forschungsgemeinschaft (DFG) (SCHR992 / 3 1 und SCHR992/4-1) erhalten haben.] Die Arbeit wurde von der ISHLT Shumway Career Development Grant 2010 und der Falk-Forschungsförderung (Stanford University) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| 2 Französisch Fogarty-Katheter | Baxter Healthcare, Deerfield, IL, USA | 120602F | |
| Yukon-Stent | Translumina GmbH, Hechingen, Deutschland | Verwenden Sie den Stent Ihrer Wahl nach Ihren Studienprotokoll | |
| RPMI-Medium | Biochrom | Nr.F1275 | |
| Heparin | Baxter | 2B0953 | |
| Isofluran | Abt | B506 | |
| Provo-Jod | Betadine Puredue Pharma | EAN: 5995327165830 | |
| 80% Ethanol | Geyer | ETV 80/0500 | |
| Micro Klemme | Harvard Apparatus | PY2-61 bis 0186 | |
| Nahtmaterial 8-0 | Johnson & Johnson, | 2808G | |
| Nahtmaterial 6-0 | Johnson & Johnson, | 1698 H | |
| Carprofen | Feizer Vet | PZN: 0110208 | |
| Metamizol | Ratiopharm | ||
| Target Retrieval Solution, pH 9 | Dako | S2368 | |
| Bild-iT FX Signal Enhancer | Invitrogen | I36933 | |
| monoklonalen Maus-Anti-GFP-Antikörper | BD Living Colors | 632381 | |
| Primärantikörper Verdünnungsmittel | Dako | S3022 | |
| Ziege-anti-Maus-IgG, Alexa Fluor 488 | Invitrogen | A11017 | |
| sekundären Antikörper Verdünnungsmittel | Dako | S0809 | |
| Kaninchen polyklonale anti-smooth muscle α-Aktin | Abcam, | ab5694 | |
| Ziege-Anti-Kaninchen-IgG, Alexa 555 | Invitrogen | A21430 | |
| Verlängern Sie Gold-Reagenz antifade | Invitrogen | P36930 |
Referenzen
- Deuse, T., Ikeno, F., Robbins, R. C., Schrepfer, S. Imaging In-Stent Restenosis: An Inexpensive, Reliable, and Rapid Preclinical Model. J. Vis. Exp. (31), e1346 (2009).
- Oyamada, S. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. J. Surg. Res. 166, e91-e95 (2011).
- Chamberlain, J. A novel mouse model of in situ stenting. Cardiovascular research. 85, 38-44 (2010).
- Deuse, T. Introducing the first polymer-free leflunomide eluting stent. Atherosclerosis. 200, 126-134 (2008).
- Finn, A. V. Differential healing after sirolimus, paclitaxel, and bare metal stent placement in combination with peroxisome proliferator-activator receptor gamma agonists: requirement for mTOR/Akt2 in PPARgamma activation. Circulation research. 105, 1003-1012 (2009).
- Tellez, A. Coronary bare metal stent implantation in homozygous LDL receptor deficient swine induces a neointimal formation pattern similar to humans. Atherosclerosis. 213, 518-524 (2010).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The pre-clinical animal model in the translational research of interventional cardiology. JACC Cardiovasc. Interv. 2, 373-383 (2009).
- Holt, C. M. Intimal proliferation in an organ culture of human internal mammary artery. Cardiovascular research. 26, 1189-1194 (1992).
- Swanson, N., Javed, Q., Hogrefe, K., Gershlick, A. Human internal mammary artery organ culture model of coronary stenting: a novel investigation of smooth muscle cell response to drug-eluting stents. Clin. Sci. (Lond). 103, 347-353 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten