A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
شفط Micropipette من خلايا الركيزة المرفقة لتقدير تصلب الخليوي
In This Article
Summary
نحن هنا وصف طريقة سريعة وبسيطة لقياس صلابة الخلية. المبدأ العام لهذا النهج هو لقياس تشوه الغشاء استجابة لضغوط واضحة المعالم من خلال تطبيق السلبية micropipette إلى سطح الخلية. هذا الأسلوب يوفر أداة قوية لدراسة خصائص النشاط الحيوي للخلايا الركيزة المرفقة.
Abstract
عدد متزايد من الدراسات تبين أن خصائص النشاط الحيوي لخلايا الفرد تلعب دورا هاما في الوظائف الخلوية متعددة، بما في ذلك انتشار الخلايا، والتمايز، والهجرة والتفاعلات الخلية الخلية. المعلمتين الرئيسية الميكانيكا الحيوية الخلوية هي قابلية تغيير الشكل الخلوية أو تصلب وقدرة الخلايا للتعاقد وتوليد القوة. نحن هنا وصف طريقة سريعة وبسيطة لتقدير صلابة الخلايا عن طريق قياس درجة تشوه الغشاء استجابة لضغوط سلبية تطبقها micropipette الزجاج إلى سطح الخلية، وهي تقنية تسمى شفط Micropipette أو Microaspiration.
يتم تنفيذ Microaspiration عن طريق سحب الزجاج الشعرية لإنشاء micropipette مع طرف صغيرة جدا (2-50 ميكرون قطر تبعا لحجم الخلية أو عينة الأنسجة)، وهذا مرتبط ثم إلى هوائي محول الضغط وتسببت في إغلاق محيط خلية تحت المجهر. عندماغيض من ماصة يمس خلية، وهي خطوة من الضغط السلبي يتم تطبيقها على ماصة من محول الضغط الهوائية توليد ضغط واضحة المعالم على غشاء الخلية. في استجابة للضغوط، ويستنشق الغشاء في تشوه الغشاء ماصة وتقدمية أو "غشاء الإسقاط" في يقاس ماصة بوصفها وظيفة من الزمن. المبدأ الأساسي لهذا النهج التجريبي هو أن درجة تشوه الغشاء استجابة لقوة ميكانيكية محددة هي وظيفة من تصلب الغشاء. وصلابة غشاء هو، وأبطأ معدل تشوه الغشاء وأقصر لا يمكن أن يؤديها في length.The طموح ثابت للدولة على خلايا معزولة تقنية، سواء في التعليق والركيزة المرفقة، العضيات كبيرة، والليبوزومات.
يتم تنفيذ تحليل الغشاء من خلال مقارنة التشوهات القصوى تتحقق في ظل ضغط معين للسكان مختلفة من الخلايا أو الظروف التجريبية. A "معامل صلابة" هو EStimated من التآمر على طول يستنشق من تشوه الغشاء بوصفها وظيفة من الضغوط التي مورست. وعلاوة على ذلك، يمكن للبيانات لمزيد من التحليل لتقدير معامل يونغ في الخلايا (E)، المعلمة الأكثر شيوعا لوصف صلابة المواد. من المهم أن نلاحظ أن ويمكن الاطلاع الأغشية البلازما من خلايا حقيقية النواة ونظام ثنائي مكون حيث underlied الغشاء طبقة ثنائية المادة الدهنية من الهيكل الخلوي غشاء شبه وأنه هو الذي يشكل الهيكل الخلوي السقالة الميكانيكية للغشاء ويسيطر على قابلية تغيير الشكل من المغلف الخلوية. هذا النهج، لذلك، يسمح تحقق خصائص النشاط الحيوي من الهيكل الخلوي الفرعي الغشاء.
Protocol
1. سحب الزجاج Micropipettes
المعدات: Micropipette بولير، Microforge.
الزجاج: الزجاج Boroscillicate الشعيرات الدموية (~ 1.5 مم القطر الخارجي، ~ 1.4 ملم القطر الداخلي).
- يتم سحبها Micropipettes باستخدام نفس النهج الأساسي الذي يستخدم لإعداد microelectrodes الزجاج للتسجيلات الكهربية. لفترة وجيزة، يتم تسخين الزجاج الشعرية في منتصف الزجاج وعندما يبدأ في الذوبان يتم سحبها من نصفي الشعرية توليد بصرف النظر micropipettes 2. جر التجارية متعددة متوفرة لتنفيذ هذه العملية بدءا من جر العمودي بسيطة نسبيا التي تستخدم الجاذبية لسحب ماصات باستثناء اثنين إلى درجة عالية من جر متطورة الأفقية التي توفر خيارات متعددة للبرمجة لتغيير السرعة وغيرها من المعالم من السحب. واستخدمت كلا النوعين من جر في تجاربنا.
- مطلبق للهندسة غيض ماصة: النصائح من ماصات المستخدمة في هذه التجارب عادة ما تتراوح بين 2 إلى 6 ميكرون القطر الخارجي اعتمادا على حجم الخلية. مقياس آخر مهم هو شكل من غيض والذي يتوقع أن أنبوب أسطواني تقريبي (انظر الشكل 1). ويمكن تحقيق هذا عن طريق الاستفادة المثلى من المعلمات سحب والتحقق من شكل الحافة تحت المجهر حتى يتم الحصول على الشكل المطلوب. طول الأمثل للعرقوب ماصة يعتمد على مقدار التشوه المتوقع: إذا كان تشوهات صغيرة <ميكرون 10، يكفي أن الجزء أسطوانات مثل ماصة للهو أيضا نسبي قصيرة (بنفس الترتيب من حيث الحجم)، للحصول على أكبر ضبط التشوهات تبعا لذلك. بشكل عام، وزيادة الحرارة و / أو زيادة في "سحب" يقلل من قطر الحافة. الزيادة في "سحب" يولد أيضا تلميح مع تفتق أطول. في تجاربنا، وذلك باستخدام ماصة P-97 الأفقي سوتر مجتذب، كان البرنامجالأمثل لالمعلمات التالية: حرارة 473؛ سحب 22؛ سرعة 22، الزمن 200؛ الضغط 500. ومن الممكن أيضا لخلق نصائح أسطواني عن طريق سحب ساق طويلة جدا ومن ثم كسر وتلميع ذلك. يتم إعطاء تعليمات مفصلة عن كيفية إعداد أنواع مختلفة من ماصات في دليل سوتر.
- Microforge: ويوصى أيضا لاطلاق النار وبولندا غيض من ماصة لإنشاء سطح الزجاج السلس الذي يجعل ختم جيدة لغشاء البلازما. يتم ذلك من خلال جلب غيض من ماصة إلى محيط الكرة الزجاج ساخنة لجزء من الثانية جدا باستخدام microforge. يستخدم بشكل روتيني لإعداد تقنية مماثلة لmicroelectrodes التسجيلات الكهربية.
- ملء Micropipette: ينبغي أن تملأ Micropipettes مع حل المالحة الفسيولوجية، مثل PBS النمو أو وسائل الإعلام غير الفلورسنت. يجب أن الأهم أن تستكمل مع مصل الحل 30٪ من شأنها أن تسمح للخلية مالغشاء للانتقال بسلاسة إلى ماصة. ويمكن استخدام نهجين للتخلص من فقاعات الهواء في غيض من ماصة: (ط) يمكن أن تكون مغمورة في غيض من ماصة في الحل الأول للسماح السائل لملء غيض من قبل قوات الشعرية تليها الردم ماصة من الطرف الآخر أو (الثاني) ويمكن ملء ماصة كله من النهاية الخلفية من خلال استغلال بلطف على عرقوب من ماصة لإزالة الفقاعات من طرف.
- ملاحظة: الماصات أن تكون على استعداد في يوم التجربة.
2. إعداد خلايا
- بذر الخلايا: يتم تنفيذ Microaspiration على خلايا مفردة التي يتم الاحتفاظ بها سواء في التعليق أو تعلق على الركيزة. لنضح الخلايا في التعليق، ورفع الخلايا من ركائز وpipetted في غرفة طولية الضحلة التي شنت على مجهر مقلوب الحق قبل التجربة. لنضح الركيزة المرفقة الخلايا، والخلاياوالمصنف على قسائم الصغيرة الغلاف (~ 10 مم القطر) التي يمكن أيضا أن توضع في غرفة microaspiration قبل التجربة. الأساس المنطقي لاستخدام غرفة طولية الضحلة هو السماح لmicropipette الاقتراب من الخلايا بزاوية ضحلة جدا، أقرب إلى الأفقي قدر الإمكان. يتم ذلك للسماح للغشاء سحبت في micropipette أن تصور على متن طائرة واحدة من التركيز (انظر الشكل 2).
- تصور غشاء الخلية: أن تراعي الإسقاط في الغشاء ماصة، ملطخة الأغشية الخلوية مع صبغة الفلورسنت ومحبة للدهون، مثل مبادرة ديزرتك الصناعية باستخدام بروتوكول تلطيخ القياسية.
- الحارة PBS الحل.
- تخفيف مبادرة ديزرتك الصناعية الأوراق المالية لتركيز العمل (5 ميكرومتر) مع الحل PBS حرارة.
- يصوتن لمدة 5 دقائق لكسر المجاميع صباغة.
- تدور باستمرار لمدة 5 دقائق واتخاذ طاف.
- غسل الخلايا في 3 مرات PBS، 5 دقائق لكل منهما.
- احتضان خلايا الصبغة مع ذلكlution لمدة 30 دقيقة في حاضنة 37 درجة مئوية.
- غسل الخلايا مع 3 مرات لمدة 5 دقائق PBS لكل منهما.
- ملاحظة: من الممكن أن تكون بديلا مبادرة ديزرتك الصناعية تلطيخ للغشاء مع تصور الهيكل الخلوي الفرعي الغشاء الذي يجري أيضا سحب جنبا إلى جنب مع الغشاء في ماصة. لا بد من أخذها في الحساب، مع ذلك، أن احداث بلبلة في الهيكل الخلوي قد يغير خصائص النشاط الحيوي للخلية. وعلاوة على ذلك، عند تنفيذ التجارب مع الخلايا microaspiration الركيزة المرفقة، فمن المستحسن استخدام التصوير 3D لتقدير طول الغشاء الإسقاط في ماصة أن يتم وضع في زاوية إلى المستوى البؤري للخلايا.
3. Microaspiration والحصول على صورة
المعدات: مجهر مقلوب نيون، ويفضل مع قدرات 3D deconvolution (زايس Axiovert 200M مع حركة الكمبيوتر Z-المحور رقابة من الاهدافES أو ما يعادلها)؛ كاميرا الفيديو وصله بجهاز الكمبيوتر (MRM AxioCam أو ما يعادلها)، الضغط على المفاتيح (بيوتيك أو ما يعادلها)، خالية من الاهتزاز محطة (TMD أو ما يعادلها)، مياداة مجهرية (Narishige، سوتر، بيرلي أو ما يعادلها؛ المتلاعبين يمكن أن تكون ميكانيكية هيدروليكية أو كهرضغطية). من المهم أيضا أن أؤكد أن لا يمكن أن يؤديها microaspiration باستخدام مجهر دون قدرات 3D لتقدير صلابة من الخلايا في التعليق، مثل خلايا الدم الحمراء أو 1،2 العدلات 3، العضيات معزولة، مثل نوى 4 أو اصطناعية الليبوزومات 5.
الصورة البرمجيات الاقتناء: زايس AxioVision أو ما يعادلها.
- تحميل الخلايا في غرفة microaspiration، كما هو موضح أعلاه، على المجهر الفلورسنت ومقلوب. وضع الخلايا اختيار خلية للتجربة ووضعها في وسط الميدان البصرية. من المهم أن perfoRM هذه التجارب في بيئة خالية من الاهتزاز، خاصة بالنسبة للتجارب مع الركيزة المرفقة الخلايا بسبب الاهتزازات الدقيقة التي تحدث عادة على المقاعد والطاولات العادية من المحتمل تماما لتقديم تنازلات إنشاء الختم، كسر غيض من micropipette أو تؤدي إلى تحولات كبيرة في موقف الطرف الذي سوف تحرف تحليل النتائج.
- وضع micropipette مليئة PBS / وسائل الإعلام ث / حل المصل إلى حامل ماصة متصلة محول الطاقة عن طريق أنابيب مرنة مع قطر تعديلها إلى اتصال لصاحب ماصة لتناسب ضيق. في بداية كل تجربة الضغط في ماصة هو معايرتها إلى الضغط الجوي. هي التي شنت على ماصة لمياداة مجهرية التي تسمح التحكم الدقيق للحركات ماصة في مجموعة ميكرون. وضع ماصة بزاوية ضحلة إلى الجزء السفلي من الغرفة وجلب غيض من ماصة إلى مركز المجال البصري. اليتم محاذاة عرقوب (ه) من ماصة، وهي جزء اسطواني من طرف ماصة الذي يستنشق في الغشاء، أفقيا إلى المستوى البؤري من قبل (1) ماصة لتحديد المواقع في ضحالة زاوية ممكنة (10-15 درجة) و(2) الثناء على عرقوب من ماصة ضد الجزء السفلي من الغرفة. لأن عرقوب رقيقة جدا من المرونة بما يكفي لينزلق على الجزء السفلي من الغرفة في حين تقترب من الخلية، كما هو مبين في الشكل 1 تخطيطي. جلب ببطء إلى أسفل micropipette إلى جانب خلية واحدة باستخدام تتلاعب بالطبع حتى قرب الطائرة من التركيز للخلية. ثم، وذلك باستخدام تتلاعب غرامة نقل micropipette إلى حافة الخلية حتى غيض من ماصة بلطف يلامس الغشاء. تأخذ صورة واحدة لمراقبة موقف ماصة. يتم إنشاء الأختام جيدة عندما غيض ماصة كله من هو على اتصال كامل مع سطح الخلية والاتصال مستقرة. لا يوجد معيار موضوعي قوي، ومع ذلك، حول كيفية جيدة الختم هو مريض بالحب EPT لفحص البصرية.
- تطبيق خطوة من الضغط السلبي باستخدام محول والحفاظ عليه حتى يتم إسقاط استقرت الغشاء. كمية الضغط اللازمة لنضح الغشاء في ماصة تختلف اعتمادا على نوع الخلية والظروف التجريبية المحددة. في تجاربنا، ويلاحظ عادة تشوه الأولية عند تطبيق الضغط في نطاق بين الزئبق إلى خفض 15mm -2. عندما يتم تطبيق الضغط، وتشوه الغشاء تدريجيا إلى ماصة حتى يتم ثبتت مدة معينة، وهي العملية التي عادة ما يستغرق 2-3 دقائق. خلال هذا الوقت، يتم الحصول على الصور من تشوه الغشاء كل ثانية 30 لتتبع تطور الغشاء الذي يتم سحبها في ماصة.
- زيادة الضغط إلى المستوى التالي في الخطوات 2-5 ملم زئبق وتكرار الإجراء بأكمله حتى إسقاط غشاء يفصل من الخلية وتنتقل إلى ماصة، وعند هذه النقطة تم إيقاف التجربة.
الطبقة = "jove_title"> 4. تحليل
لقياس درجة تشوه الغشاء، يتم قياس طول يستنشق (L) من غيض من ماصة إلى قمة الرأس للمحيط إسقاط الغشاء. من المهم أن نلاحظ، مع ذلك، أن أكبر ماصة ستطبق المزيد من القوة على غشاء الخلية على نفس المستوى من الضغط. لمراعاة التغيرات بين أقطار من ماصات، لذلك، يتم تطبيع طول يستنشق لقطر ماصة (D) قياس لكل تجربة.
ويمكن لمزيد من التحليل للبيانات باستخدام معيار خطي اللزجة نصف مساحة نموذج للخلية البطانية، كما هو موضح في دراسات سابقة 6،7. على وجه التحديد، قدر معامل المرونة للخلايا باستخدام المعادلة:
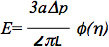
حيث E هو معامل يونغ، وهي الداخليةنصف قطر ماصة، Δp هو الفرق الضغط، L هو طول المقابلة يستنشق، وφ (η) هو جدار تعمل حسابها باستخدام نموذج قوة، كما وصفها آخرون Theret 7. من المهم أن نلاحظ أنه تم استخدام نماذج متعددة لتحليل البيانات microaspiration بما في ذلك نموذج العناصر المحدودة التي يفترض أن خلية هو مجال تشوه مع خصائص المواد موحد الخواص ومتجانسة ونماذج قطرة السائل، والتي تفترض أن الخلايا تشكل شكل كروي، يمكن أن تشوه باستمرار، واسترداد عند الإفراج عنهم، كما هو موضح في عدة ملاحظات ممتازة: 8-10. ويمكن أيضا أن تستخدم لMicroaspiration التحقيق المعلمات النشاط الحيوي أخرى من الخلايا والأنسجة، مثل خصائص اللزجة الخلوية، والتوتر القشرية ومساهمة مختلف العناصر الهيكلية للالميكانيكا الحيوية والأنسجة الخلية (انظر ملاحظات المذكورة أعلاه للحصول على مزيد من المعلومات).
5. ممثلالنتائج
في دراسات سابقة، أجريت micropipette الطموح إما على الليبوزومات 5 أو على الخلايا التي لم تعلق على الركيزة 2،11-13. في دراساتنا، ومع ذلك، وعادة ما تكون الخلايا وبقي تعلق على الركيزة لتجنب التغييرات في بنية هيكل الخلية التي من المحتمل أن تحدث عند فصل الخلايا 14-16. للتحقق من صحة استخدام تقنية microaspiration لالركيزة المرفقة الخلايا، اختبرنا ما إذا كان اضطراب F-الأكتين النتائج في انخفاض في تصلب الأبهر خلية من خلايا بطانة الأوعية الدموية البقري (BAECs)، حسب تقديرات هذا النهج. يبين الشكل 3 أن، كما هو متوقع ، وهذا هو الحاصل فعلا. على وجه التحديد، ويبين الشكل 3A سلسلة من الصور النمطية الفلورية لغشاء بطانة تمر تشوه التدريجي في استجابة للضغوط السلبية من خلال تطبيق micropipette. كما هو متوقع، ويستنشق تدريجيا الغشاء في ماصة للوaspiratإد طول يزيد بوصفها وظيفة من الضغوط التي مورست. والوقت دورات للمعرض أن تشوه تعطيل F-الأكتين زيادة كبيرة في أطوال يستنشق من التوقعات في ظل جميع ظروف الضغط (الشكل 3B) 14.
باستخدام هذا النهج، وجدنا أن صلابة الخلية يزيد عندما تستنفد الأغشية الخلوية من الكوليسترول في حين تخصيب الكولسترول لم يكن لها تأثير 14. ويبين الشكل 4 خلية الكولسترول التخصيب، خلية السيطرة، وخلية الكوليسترول المنضب بعد التوصل أطوال تطلع القصوى في -15 ملم زئبق (4A). التوقعات التي عادة لتطوير المعرضين لل10mmHg ويمكن قياس الوقت من الدورات تشوه الغشاء لضغوط سلبية من -15، -10 و -20 ملم زئبق (4B). أدى تطبيق الضغوط المذكورة في 25mmHg مفرزة من الإسقاط يستنشق تشكيل حويصلة منفصلة. كان مستوى الضغط الذي أسفر عن انفصال الغشاء similaR في ظل ظروف مختلفة الكولسترول. كان هذا ملاحظة غير متوقعة للغاية لأن الدراسات السابقة أظهرت أن طبقات ثنائية الدهون في غشاء زيادة في الكوليسترول تصلب الغشاء يزيد من الغشاء 5،17. أكدت الدراسات لدينا المزيد من هذه الملاحظات باستخدام نهج مستقلة عدة، بما في ذلك مجهر القوة الذرية 18،19 وقوة الجر المجهر 20.
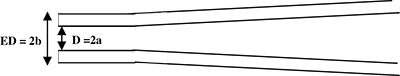
الشكل 1. عرض النظامي جانب ماصة التسجيل. يتم سحب ماصة لتوليد عرقوب في الطرف أسطواني (منظر جانبي). Micropipette المعلمات: D = 2A = القطر الداخلي وED 2B = = القطر الخارجي.

الشكل 2. Micropipette تقترب خلية الركيزة المرفقة (A) عرض الجانب التخطيطي، و. (B) صورة مشرقة على النقيض من ليالي micropipetteهانك لمس خلية على شكل يستخدم عادة في التجارب الطموح، (C) صورة نيون من نفس الخلية التي تحمل DiIC 18. وmicropipette لا تزال موجودة ولكن غير مرئي (من 14).
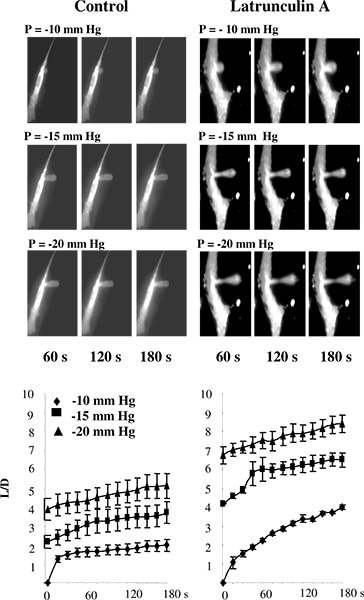
الشكل 3. التحقق من صحة قياس صلابة الركيزة الخلية في الخلايا باستخدام المرفقة microaspiration. A: صور تشوه الغشاء التدريجي للBAECs في ظل ظروف السيطرة وبعد التعرض لlatrunculin ماصة غير مرئية على الصور لأنه لا يتألق. تعرضت الخلايا لlatrunculin ميكرومتر 2 A لمدة 10 دقيقة، مما قلل بشكل كبير من كمية F-أكتين، مقاسا رودامين-phalloidin مضان (لا يظهر) ولكن لم يكن لها تأثير كبير على شكل الخلية. في خلية latrunculin المعالجة، وهناك غشاء رقيق من في منتصف الإسقاط يستنشق لكن لا تزال تعلق على الإسقاط إلى جells. B. تأثير latrunculin A على دورات وقت تشوه الغشاء حيث يستنشق L طول الغشاء والإسقاط D هو القطر من ماصة للخلايا التحكم (ن = 14) والخلايا المعرضة لlatrunculin ميكرومتر 2 A لمدة 10 دقيقة (ن = 5). ويستنشق الخلايا مع ملم زئبق -10 (الماس)، -15 ملم زئبق (المربعات) و -20 ملم زئبق (مثلثات). (من 14).
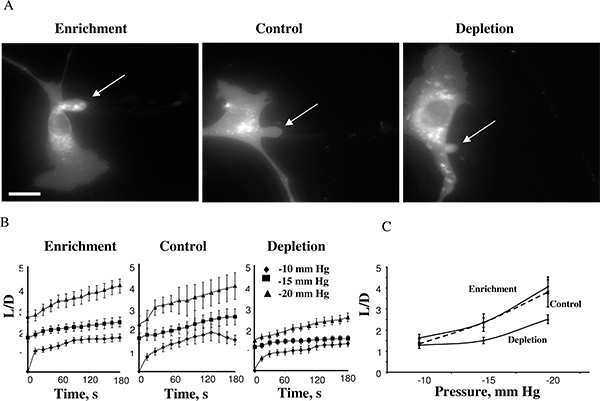
الشكل 4. تأثير مستويات الكولسترول الخلوية على غشاء تشوه BAECs. تعرضت A الصور النمطية تشوه الغشاء من اليورانيوم الكولسترول، الكولسترول والخلايا المنضب التحكم (السيطرة على الخلايا MβCD: MβCD الكوليسترول في نسبة 1:1 خليط أن لم يكن لها تأثير على مستوى الكوليسترول في الخلايا الحرة (انظر أقحم). الصور المبينة تصوير تشوه القصوى في -15 ملم زئبق. السهم يشير إلى موضع إسقاط يستنشق. شريط هو 30 ميكرومتر. B. متوسط الوقت من أطوال الدورات يستنشق للسكان 3 خلية التجريبية. C. رسم أطوال يستنشق القصوى بوصفها وظيفة من الضغوط التي مورست. كان طول القصوى تطبيع في الخلايا المنضب أقل بكثير من الخلايا السيطرة على الضغوط ملم زئبق -15 و -20 ملم زئبق (P <0.05). (من 14).
Discussion
Microaspiration يوفر طريقة بسيطة للغاية وقابلة للتكرار لتقدير صلابة الخلية / قابلية تغيير الشكل عن طريق تطبيق الضغط السلبي إلى غشاء الخلية وغشاء قياس قابلية تغيير الشكل استجابة لضغوط واضحة المعالم. وقد وضعت لأول مرة من قبل وميتشيسون سوان (1954) لوصف خصائص المرونة من قنفذ البح?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | كتالوج / موديل | تعليقات |
| سوتر ماصة مجتذب | سوتر الآلات | P-97 | |
| Microforge | Narishige | MF-830 | |
| نيون مجهر مقلوب | زايس | Axiovert 200M | وينبغي المجهر مجهزة يفضل مع قدرات 3D/deconvolution. |
| كاميرا الفيديو | زايس | AxioCam MRM | |
| الصورة اقتناء sotware | زايس | AxioVision | |
| هوائي الضغط على المفاتيح | بيوتيك | DPM-1B | ويمكن الآن DPM1B تستر محول هوائي يمكن العثور عليها من قبل FLUKE. |
| ماصة الزجاج | ريتشلاند | مخصصة الزجاج | كانت مخصصة ماصات التي يبلغ قطرها 1،2 الداخلي و 1.6 القطر الخارجي. |
| مبادرة ديزرتك الصناعية صبغ | إينفيتروجن | D282 | يذوب جيدا في DMSO |
References
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. I. Membrane stiffness and intracellular pressure. Biophys. J. 4, 115-135 (1964).
- Discher, D. E., Mohandas, N., Evans, E. A. Molecular maps of red cell deformation: hidden elasticity and in situ connectivity. Science. 266, 1032-1035 (1994).
- Schmid-Schönbein, G. W., Sung, K. L., Tözeren, H., Skalak, R., Chien, S. Passive mechanical properties of human leukocytes. Biophys. J. 36, 243-256 (1981).
- Guilak, F., Tedrow, J. R., Burgkart, R. Viscoelastic properties of the cell nucleus. Biochem. Biophys. Re.s Commun. 269, 781-786 (2000).
- Needham, D., Nunn, R. S. Elastic deformation and failure of lipid bilayer membranes containing cholesterol. Biophys. J. 58, 997-1009 (1990).
- Sato, M., Theret, D. P., Wheeler, L. T., Ohshima, N., Nerem, R. M. Application of the micropipette technique to the measurement of cultured porcine aortic endothelial cell viscoelastic properties. Journal of Biomechanical Engineering. 112, 263-268 (1990).
- Theret, D. P., Levesque, M. J., Sato, F., Nerem, R. M., Wheeler, L. T. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. J. of Biomechanical Engineering. 110, 190-199 (1988).
- Hochmuth, R. M. Micropipette aspiration of living cells. J. Biomech. 33, 15-22 (2000).
- Lim, C. T., Zhou, E. H., Quek, S. T. Mechanical models for living cells--a review. Journal of Biomechanics. 39, 195 (2006).
- Zhao, R., Wyss, K., Simmons, C. A. Comparison of analytical and inverse finite element approaches to estimate cell viscoelastic properties by micropipette aspiration. Journal of Biomechanics. 42, 2768 (2009).
- Chien, S., Sung, K. L., Skalak, R., Usami, S., Tozeren, A. Theoretical and experimental studies on viscoelastic properties of erythrocyte membrane. Biophys. J. 24, 463-487 (1978).
- Evans, E., Kuhan, B. Passive material behavior of granulocytes based on large deformation and recovery after deformation tests. Blood. 64, 1028-1035 (1984).
- Sato, M., Levesque, M. J., Nerem, R. M. Micropipette aspiration of cultured bovine aortic endothelial cells exposed to shear stress. Arteriosclerosis. 7, 276-286 (1987).
- Byfield, F., Aranda-Aspinoza, H., Romanenko, V. G., Rothblat, G. H., Levitan, I. Cholesterol depletion increases membrane stiffness of aortic endothelial cells. Biophys. J. 87, 3336-3343 (2004).
- Byfield, F. J., Hoffman, B. D., Romanenko, V. G., Fang, Y., Crocker, J. C., Levitan, I. Evidence for the role of cell stiffness in modulation of volume-regulated anion channels. Acta. Physiologica. 187, 285-294 (2006).
- Byfield, F. J., Reen, R. K., Shentu, T. -. P., Levitan, I., Gooch, K. J. Endothelial actin and cell stiffness is modulated by substrate stiffness in 2D and 3D. Journal of Biomechanics. 42, 1114 (2009).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. Journal of Physical Chemistry. 91, 4219-4228 (1987).
- Sun, M., Northup, N., Marga, F., Huber, T., Byfield, F. J., Levitan, I., Forgacs, G. The effect of cellular cholesterol on membrane-cytoskeleton adhesion. J. Cell. Sci. 120, 2223-2231 (2007).
- Shentu, T. P., Titushkin, I., Singh, D. K., Gooch, K. J., Subbaiah, P. V., Cho, M., Levitan, I. oxLDL-induced decrease in lipid order of membrane domains is inversely correlated with endothelial stiffness and network formation. Am. J. Physiol. Cell. Physiol. 299, 218-229 (2010).
- Norman, L. L., Oetama, R. J., Dembo, M., Byfield, F., Hammer, D. A., Levitan, I., Aranda-Espinoza, H. Modification of Cellular Cholesterol Content Affects Traction Force, Adhesion and Cell Spreading. Cell Mol. Bioeng. 3, 151-162 (2010).
- Mitchinson, J. M., Swann, M. M. The Mechanical Properties of the Cell Surface: I. The Cell Elastimeter. J. of Experimental Biology. 31, 443-460 (1954).
- Byfield, F. J., Tikku, S., Rothblat, G. H., Gooch, K. J., Levitan, I. OxLDL increases endothelial stiffness, force generation, and network formation. J. Lipid Res. 47, 715-723 (2006).
- Ohashi, T., Ishii, Y., Ishikawa, Y., Matsumoto, T., Sato, M. Experimental and numerical analyses of local mechanical properties measured by atomic force microscopy for sheared endothelial cells. Biomed. Mater. Eng. 12, 319-327 (2002).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453 (2007).
- Kowalsky, G. B., Byfield, F. J., Levitan, I. oxLDL facilitates flow-induced realignment of aortic endothelial cells. Am. J. Physiol. Cell. Physiol. 295, 332-340 (2008).
- Ketene, A. N., Schmelz, E. M., Roberts, P. C., Agah, M. The effects of cancer progression on the viscoelasticity of ovarian cell cytoskeleton structures. Nanomedicine: Nanotechnology, Biology and Medicine. , (2011).
- Kole, T. P., Tseng, Y., Huang, L., Katz, J. L., Wirtz, D. Rho kinase regulates the intracellular micromechanical response of adherent cells to rho activation. Mol. Biol. Cell. 15, 3475-3484 (2004).
- Hall, A. Rho GTPases and the Actin Cytoskeleton. Science. 279, 509-514 (1998).
- Okajima, T. Atomic Force Microscopy for the Examination of Single Cell Rheology. In. Methods Mol. Biol. 736, 303-329 (2011).
- Wang, N., Butler, J. P., Ingber, D. E. Mechanotransduction across the cell surface and through the cytoskeleton. Science. 260, 1124-1127 (1993).
- Fabry, B., Maksym, G. N., Butler, J. P., Glogauer, M., Navajas, D., Fredberg, J. J. Scaling the microrheology of living cells. Physical Review Letters. 87, 148102 (2001).
- Park, C. Y., Tambe, D., Alencar, A. M., Trepat, X., Zhou, E. H., Millet, E., Butler, J. P., Fredberg, J. J. Mapping the cytoskeletal prestress. American Journal of Physiology - Cell Physiology. 298, C1245-C1252 (2010).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophys. J. 80, 1744-1757 (2001).
- Wirtz, D. Particle-tracking microrheology of living cells: principles and applications. Annu. Rev. Biophys. 38, 301-326 (2009).
- Shin, D., Athanasiou, K. Cytoindentation for obtaining cell biomechanical properties. J. Orthop. Res. 17, 880-890 (1999).
- Ou-Yang, H. D., Wei, M. T. Complex fluids: probing mechanical properties of biological systems with optical tweezers. Annu. Rev. Phys. Chem. 61, 421-440 (2010).
- Hosu, B. G., Sun, M., Marga, F., Grandbois, M., Forgacs, G. Eukaryotic membrane tethers revisited using magnetic tweezers. Phys. Biol. 4, 67-78 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved