Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikropipette Aspiration von Substrat-attached Cells zu schätzen Zelle Stiffness
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine schnelle und einfache Methode, um Zellen Steifigkeit zu messen. Das allgemeine Prinzip dieser Methode besteht darin, Membranverformung in Reaktion auf wohldefinierte negativen Druck durch eine Mikropipette an die Zelloberfläche aufgebracht messen. Diese Methode bietet ein leistungsfähiges Werkzeug zur biomechanischen Eigenschaften von Substrat-anhaftenden Zellen zu studieren.
Zusammenfassung
Wachsende Zahl von Studien zeigen, dass biomechanischen Eigenschaften einzelner Zellen wichtige Rollen spielen an einer Vielzahl zellulärer Funktionen, einschließlich der Zellproliferation, Differenzierung, Migration und Zell-Zell-Interaktionen. Die beiden wichtigsten Parameter der zellulären Biomechanik sind zelluläre Verformbarkeit oder Steifigkeit und die Fähigkeit der Zellen, sich zusammenzuziehen und Kraft erzeugen. Hier beschreiben wir ein schnelles und einfaches Verfahren zu Zelle Steifigkeit durch Messen des Grades der Membranverformung in Reaktion auf negativen Druck mit einem Glas-Mikropipette zur Zelloberfläche, eine Technik, die Mikropipette oder Aspiration Mikroaspiration genannt aufgebracht abzuschätzen.
Mikroaspiration wird durch Ziehen einer Glaskapillare, eine Mikropipette mit einem sehr kleinen Spitze (2-50 Mikrometer Durchmesser in Abhängigkeit von der Größe einer Zelle oder einer Gewebeprobe), der dann an eine pneumatische Druckwandler verbunden ist und auf eine enge erstellen durchgeführt Nähe einer Zelle unter einem Mikroskop. Wenn derPipettenspitze berührt eine Zelle, ein Schritt der Unterdruck an der Pipette durch die pneumatische Druckwandler Erzeugen gut definierten Druck auf der Zellmembran aufgebracht. In Reaktion auf den Druck wird die Membran in die Pipette und progressive Membranverformung oder "-Membran Projektion" in die Pipette wird als Funktion der Zeit gemessen wird abgesaugt. Das Grundprinzip dieses experimentellen Ansatzes ist, dass der Grad der Verformung Membran als Reaktion auf eine definierte mechanische Kraft eine Funktion der Membran Steifigkeit ist. Je steifer die Membran ist, desto langsamer ist die Rate der Membranverformung und je kürzer die Steady-State-Aspiration length.The Technik kann auf isolierte Zellen, sowohl in Suspension und Substrat-verknüpften, große Organellen durchgeführt werden, und Liposomen.
Analyse durch Vergleichen maximalen Membran Verformungen unter einem vorgegebenen Druck für unterschiedliche Zellpopulationen oder experimentellen Bedingungen erreicht durchgeführt. A "Steifigkeitskoeffizienten" ist estimated durch Auftragen der angesaugten Länge Membranverformung als Funktion der angelegten Druck. Weiterhin können die Daten weiter analysiert werden, um den Elastizitätsmodul der Zellen (E), die häufigste Parameter Steifigkeit Materialien charakterisieren abzuschätzen. Es ist wichtig anzumerken, dass Plasmamembranen von eukaryotischen Zellen als Zweikomponenten-System, bei dem Lipiddoppelschicht-Membran von der Sub-Membran Zytoskeletts und dass es das Zytoskelett, die das mechanische Gerüst der Membran bildet und dominiert die Verformbarkeit underlied wird eingesehen werden des zellularen Umschlag. Dieser Ansatz ermöglicht daher Sondieren die biomechanischen Eigenschaften der Untergruppe Membran Zytoskelett.
Protokoll
Ein. Ziehen Glasmikropipetten
Ausstattung: Feinpipettenziehvorrichtung, Microforge.
Glass: Boroscillicate Glaskapillaren (~ 1,5 mm Außendurchmesser, ~ 1,4 mm Innendurchmesser).
- Mikropipetten gezogen werden über die gleichen grundlegenden Ansatz, der verwendet werden, um Glasmikroelektroden für die Elektrophysiologie Aufnahmen vorzubereiten. Kurz gesagt wird eine Glaskapillare in der Mitte erhitzt und wenn das Glas zu schmelzen beginnt die beiden Hälften der Kapillare auseinandergezogen Erzeugen zweier Mikropipetten. Mehrere kommerzielle Abzieher sind verfügbar, um diesen Vorgang im Bereich von relativ einfachen vertikalen Abzieher die Schwerkraft verwendet, um die zwei Pipetten auseinanderzuziehen, um hochentwickelte horizontalen Abzieher, der mehrere programmierbare Optionen, um die Geschwindigkeit und andere Parameter des Pull variieren bieten durchzuführen. Beide Arten von Abzieher wurden in unseren Experimenten verwendet.
- Anforderungs für die Geometrie der Pipettenspitze: Die Spitzen der Pipetten in diesen Experimenten verwendet typischerweise im Bereich zwischen 2 bis 6 um Außendurchmesser in Abhängigkeit von der Größe der Zelle. Ein weiterer wichtiger Parameter ist die Form der Spitze, die sollte ungefähr ein zylindrisches Rohr (siehe Abbildung 1). Dies kann durch die Optimierung der Parameter der Pull und Verifizieren der Form der Spitze unter dem Mikroskop, bis die gewünschte Form erhalten wird erreicht werden. Die optimale Länge der Pipette Schaft hängt von der Menge der zu erwartenden Verformung: wenn die Deformationen klein <10 um sind, ist es ausreichend, dass der zylinderartigen Teil der Pipette auch relativ kurze (der gleichen Größenordnung), für eine größere Verformungen entsprechend anpassen. Im allgemeinen Erhöhung der Wärme-und / oder Zunahme der "Pull" verringert sich der Durchmesser der Spitze. Die Erhöhung der "Pull" erzeugt auch eine Spitze mit einer längeren verjüngen. In unseren Experimenten unter Verwendung eines P-97 Sutter horizontalen Pipette Puller, war das Programmoptimiert, um die folgenden Parameter: Heat von 473; Pull 22; Velocity 22, Time 200; Druck 500. Es ist auch möglich, zylindrische Spitzen durch Ziehen eines sehr langem Schaft und dann Brechen und Polieren zu erzeugen. Detaillierte Anweisungen, wie die verschiedenen Arten von Pipetten Vorbereitung sind in der Sutter Handbuch.
- Microforge: Es wird auch empfohlen, um Feuer-polieren die Spitze der Pipette auf eine glatte Glasoberfläche, die eine gute Abdichtung ist an der Plasmamembran zu generieren. Dies wird erreicht, indem die Spitze der Pipette in die Nähe einer erwärmten Glaskugel für eine sehr Bruchteil einer Sekunde unter Verwendung einer microforge getan. Ähnliche Technik wird routinemäßig zur Herstellung Mikroelektroden für elektrophysiologische Ableitungen verwendet.
- Füllen der Mikropipette: Mikropipetten sollte mit einer physiologischen Kochsalzlösung, wie PBS oder nicht fluoreszierenden Wachstumsmedium gefüllt werden. Wichtig sollte die Lösung mit 30% Serum ergänzt werden, das Ihnen erlaubt die ZellmembranBrane für einen reibungslosen Übergang in die Pipette. Zwei Ansätze können verwendet werden, um loszuwerden Luftblasen in der Spitze der Pipette sind: (i) eine Spitze der Pipette in die Lösung eingetaucht werden erste, damit die Flüssigkeit um die Spitze durch die Kapillarkräfte durch die Verfüllung der Pipette gefolgt füllen vom anderen Ende oder (ii) die ganze Pipette kann vom hinteren Ende durch leichtes Klopfen auf den Schaft der Pipette, um die Blasen von der Spitze zu entfernen gefüllt werden.
- Hinweis: Pipetten müssen am Tag des Experiments vorbereitet werden.
2. Herstellung von Zellen
- Aussäen der Zellen: Mikroaspiration wird an einzelnen Zellen, die entweder in Suspension gehalten werden oder auf das Substrat befestigt durchgeführt. Um Zellen in Suspension absaugen werden Zellen aus ihren Substraten angehoben und in eine flache pipettiert Längskammer, die auf dem umgekehrten Mikroskop rechts vor dem Experiment montiert ist. Um Substrat anhaftenden Zellen, Zellen absaugensind auf kleinen Deckel-Slips ausgesät (~ 10 mm Durchmesser), die ebenfalls in die Kammer kann Mikroaspiration vor dem Experiment abgegeben werden. Das Grundprinzip, um eine flache Längskammer benutzen ist, damit eine Mikropipette, um die Zellen in einem sehr flachen Winkel und so nahe wie möglich an Horizontalen nähert. Dies geschieht, um die Membran in die Mikropipette zu sein auf einem einzigen Fokusebene visualisiert (siehe Abbildung 2) gezogen zu ermöglichen.
- Visualisieren Zellmembran: Um die Membran Vorsprung in die Pipette zu beobachten, sind zelluläre Membranen mit einem lipophilen Fluoreszenzfarbstoff wie DII Verwendung eines Standard Färbeprotokoll angefärbt.
- Warm PBS Lösung.
- Verdünnen Sie die Lager DII auf eine Arbeitskonzentration (5 uM) mit dem erwärmten PBS Lösung.
- Beschallen für 5 min auf Farbstoffaggregaten brechen.
- Spin-Down für 5 min und nehmen Überstand.
- Waschen der Zellen in PBS 3 mal, jeweils 5 min.
- Inkubieren von Zellen mit dem Farbstoff soLösung für 30 min in einem 37 ° C Inkubator.
- Waschen Sie die Zellen mit PBS 3 mal für jeweils 5 min.
- Anmerkung: Es ist möglich, DII Färbung der Membran mit Sichtbarmachen des Sub-Membran Zytoskeletts, die ebenfalls zusammen mit der Membran in die Pipette gezogen ersetzen. Es muss in die Rechnung getragen werden jedoch, dass eine Störung des Zytoskeletts kann die biomechanischen Eigenschaften der Zelle verändern. Wenn darüber hinaus Durchführen Mikroaspiration Experimenten mit Substrat anhaftenden Zellen, ist es empfehlenswert, 3D-Bildgebung zu verwenden, um die Länge der Membran Vorsprung in die Pipette, die in einem Winkel zur Brennebene der Zellen positioniert ist, zu schätzen.
3. Mikroaspiration und Image Acquisition
Ausstattung: Inverted Fluoreszenzmikroskop, vorzugsweise mit 3D-Dekonvolution Fähigkeiten (Zeiss Axiovert 200M mit computergesteuerten Z-Achsen-Bewegung des objektives oder gleichwertig); Videokamera an einen Computer angeschlossen (AxioCam MRm oder gleichwertig), Pressure Transducer (BioTek oder gleichwertig), Vibration-free-Station (TMD oder gleichwertig), Mikromanipulator (Narishige, Sutter, Burleigh oder gleichwertig; Manipulatoren kann mechanisch, hydraulisch oder piezoelektrisch). Es ist auch wichtig zu betonen, dass Mikroaspiration durchgeführt werden unter Verwendung eines Mikroskops ohne 3D-Funktionen, um die Steifigkeit von Zellen in Suspension, wie rote Blutkörperchen oder Neutrophile 1,2 3, getrennt Organellen, wie Kerne 4 oder künstlichen Liposomen 5 abzuschätzen.
Image Acquisition Software: Zeiss AxioVision oder ein Äquivalent.
- Montieren der Zellen in eine Mikroaspiration Kammer, wie oben beschrieben, auf einem inversen Fluoreszenzmikroskop. Positionieren Sie die Zellen der Auswahl eine Zelle für ein Experiment und legen Sie sie in der Mitte des Gesichtsfeldes. Es ist wichtig zu perform diese Experimente in einem vibrationsfreien Umwelt, insbesondere für die Experimente mit dem Substrat-attached Zellen, weil kleinste Vibrationen, die typischerweise auftreten, auf Bänken und Stammtischen wahrscheinlich komplett zu kompromittieren die Schaffung der Dichtung, brechen Sie die Spitze der Mikropipette oder zu stehen erhebliche Verschiebungen in der Position der Spitze, die wird skew die Analyse der Ergebnisse.
- Platzieren einer Mikropipette mit PBS / Medien w / Serumlösung in einen Pipettenhalter an einer Steckerleiste Wandlers durch flexible Schläuche mit dem Durchmesser eingestellt werden, um den Stecker des Pipettenhalter für einen sicheren Halt gefüllt. Zu Beginn jedes Experiments der Druck in der Pipette ist, äquilibriert auf den Atmosphärendruck. Die Pipette wird auf einem Mikromanipulator, die Feinsteuerung der Pipette Bewegungen in einer Mikrometer-Bereich ermöglicht montiert. Positionieren einer Pipette in einem flachen Winkel auf die Unterseite der Kammer und bringen die Spitze der Pipette in die Mitte des Gesichtsfeldes. The Schaft der Pipette, einen zylindrischen Teil der Pipettenspitze in dem die Membran abgesaugt wird horizontal zur Fokalebene von (1) Positionieren der Pipette an der flachsten Winkel möglich (10-15 °) und (2) durch ausgerichtete Biegen der Schaft der Pipette gegen den Boden der Kammer. Weil der Schaft ist sehr dünn, dass sie flexibel genug ist, um auf dem Boden der Kammer zu gleiten, während sich einer Zelle, wie sie schematisch in Abbildung 1 dargestellt. Langsam Senkung der Mikropipette an der Seite einer einzelnen Zelle unter Verwendung des natürlich Manipulators bis nahe der Fokusebene für die Zelle. Dann wird unter Verwendung eines feinen Manipulator bewegt die Mikropipette zum Rand der Zelle, bis die Spitze der Pipette vorsichtig berührt die Membran. Nehmen Sie ein Bild, um die Position der Pipette zu beobachten. Gute Abdichtungen werden erzeugt, wenn die ganze Spitze der Pipette in vollständigem Kontakt mit der Zelloberfläche und der Kontakt ist stabil. Es gibt keine starken objektives Kriterium, aber darüber, wie gut die Dichtung except für die visuelle Prüfung.
- Tragen Sie einen Schritt von Unterdruck mit dem Wandler und pflegen sie, bis Membran Projektion wird stabilisiert. Die Höhe der Druck erforderlich, um die Membran in die Pipette absaugen variiert je nach Zelltyp und spezifischen experimentellen Bedingungen. In unseren Experimenten wird Anfangsdeformation typischerweise beobachtet, wenn Druck im Bereich zwischen -2 und-15mm Hg beträgt. Wenn der Druck angelegt wird, wird die Membran in die Pipette allmählich verformt wird, bis es an einem bestimmten Länge, ein Prozess, der dauert typischerweise 2-3 Minuten stabilisiert wird. Während dieser Zeit werden die Bilder der Membranverformung alle 30 sec erworben, um das Fortschreiten der Membran, die in die Pipette gezogen wird verfolgen.
- Erhöhen Sie den Druck auf die nächste Stufe in 2-5 mm Hg Schritte und wiederholen Sie den gesamten Vorgang, bis Membran Projektion löst sich von der Zelle und bewegt sich in die Pipette, an welcher Stelle das Experiment gestoppt.
Um den Grad der Membranverformung quantifizieren, wird die angesaugte Länge (L) von der Spitze der Pipette auf den Scheitelpunkt des Umfangs der Membran Vorsprungs gemessen. Es ist wichtig, zu beachten ist jedoch, dass eine größere Pipette wird mehr Kraft auf die Zellmembran auf dem gleichen Niveau von Druck anzuwenden. Um die Variabilität zwischen den Durchmessern der Pipetten zu berücksichtigen, wird daher der angesaugten Länge für die Pipette Durchmesser (D) für jedes Experiment gemessen normalisiert.
Die Daten können weiter analysiert werden unter Verwendung eines Standard-Linear viskoelastische Halbraum Modell der Endothelzelle, wie in den früheren Studien 6,7 beschrieben. Speziell wurde der Elastizitätsmodul der Zellen unter Verwendung der Gleichung:
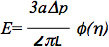
wobei E der Elastizitätsmodul ist, a die innerenRadius der Pipette, Ap die Druckdifferenz ist, L die entsprechende angesaugten Länge, und φ (η) eine Wand funktionieren errechnet Kraft Modells, wie durch Theret et al 7 beschrieben. Es ist wichtig anzumerken, dass mehrere Modelle wurden verwendet, um die Grunddaten eine Mikroaspiration Finite-Elemente-Modell, dass eine Zelle eine verformbare Kugel mit isotropen und homogenen Materialeigenschaften und Flüssigkeitstropfen-Modelle, die das Zellen eine Kugelform annehmen bilden ist annimmt analysieren, kontinuierlich verformen, und wieder bei der Freisetzung, wie in mehreren ausgezeichneten Bewertungen beschrieben: 8-10. Mikroaspiration kann auch verwendet werden, um anderen biomechanischen Parameter von Zellen und Geweben, wie zelluläre viskoelastischen Eigenschaften, kortikale Spannung und der Beitrag der verschiedenen strukturellen Elemente Zell-und Gewebekulturen Biomechanik (siehe die Bewertungen oben für weitere Informationen aufgeführt) zu untersuchen.
5. VertreterErgebnisse
In früheren Studien wurde Mikropipette Aspiration entweder auf Liposomen 5 oder auf Zellen, die nicht an dem Substrat befestigt 2,11-13 wurden durchgeführt. In unseren Studien, jedoch werden die Zellen typischerweise auf das Substrat aufrechterhalten angebracht, um Änderungen in der Zytoskelett-Struktur, die wahrscheinlich auftreten, wenn die Zellen abzulösen 14-16 sind zu vermeiden. Um die Verwendung von Mikroaspiration Technik für Substrat-anhaftenden Zellen zu überprüfen, untersuchten wir, ob Störungen des F-Aktin-Ergebnisse in der Abnahme in der Zelle Steifigkeit von Rindern Endothelzellen (BAECs), geändert durch dieses Ansatzes geschätzt. Abbildung 3 zeigt, dass, wie erwartet , ist dies tatsächlich der Fall ist. Insbesondere zeigt 3A eine typische Folge von Bildern eines fluoreszierenden Endothelmembran unterziehen progressive Verformung in Reaktion auf negativen Druck durch eine Mikropipette aufgebracht. Wie erwartet, wird die Membran stufenweise in die Pipette angesaugt und dem aspirated Länge erhöht als eine Funktion der angelegten Druck. Die Zeit-Verläufe der Verformung zeigen, dass Störungen der F-Actin erhöht deutlich die angesaugte Längen der Vorsprünge unter allen Druckbedingungen (3B) 14.
Unter Verwendung dieses Ansatzes entdeckten wir, dass Zelle Steifigkeit erhöht, wenn die Zellmembranen von Cholesterin aufgebraucht Erwägung Cholesterin Anreicherung hatte keine Wirkung 14. 4 zeigt eine angereicherte Cholesterol-Zelle, eine Steuerzelle, und eines Cholesterin-depletierten Zellen nach Erreichen maximaler Längen an Aspiration -15 mm Hg (4A). Die Vorsprünge typischerweise begonnen at-10mmHg entwickeln und die Zeit-Kursen Membranverformung könnte für die negative Drücke von -10, -15 und -20 mm Hg (4B) gemessen werden. Anwendung von Drücken oberhalb 25mmHg-Folge Ablösen der angesaugten Vorsprung Bilden einer separaten Vesikels. Das Druckniveau in der Membran Ablösung führte, war similar unter verschiedenen Cholesterin-Bedingungen. Diese Beobachtung war sehr unerwartet, weil frühere Studien zeigten, dass in der Membran Lipiddoppelschichten eine Erhöhung Membrancholesterin die Steifigkeit der Membran 5,17 erhöht. Unsere weiteren Studien bestätigt diese Beobachtungen mit mehreren unabhängigen Ansätzen, einschließlich Atomic Force Microscopy 18,19 und Force Microscopy Traction 20.
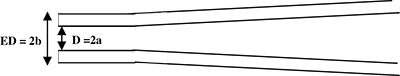
Abbildung 1. Schematische Seitenansicht einer Aufnahme Pipette. Die Pipette gezogen wird, um einen zylindrischen Schaft an der Spitze (Seitenansicht) zu erzeugen. Mikropipette Parameter: D = 2a = Innendurchmesser und ED = 2b = Außendurchmesser.

Abbildung 2. Mikropipette Annäherung an ein Substrat-attached Zelle (A) Schematische Seitenansicht;. (B) Bright kontrastreiches Bild einer Mikropipette shank Berühren eines typisch geformten Zelle in Aspiration Experimenten verwendet, (C) Fluoreszenzbild von der gleichen Zelle mit DiIC 18 bezeichnet. Die Mikropipette ist noch vorhanden, aber nicht sichtbar ist (von 14).
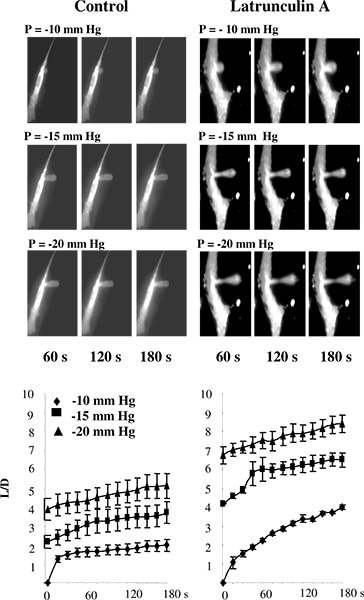
Abbildung 3. Validierung der Messzelle Steifheit in Substrat-anhaftenden Zellen mit Mikroaspiration. A: Die Bilder von progressiven Membranverformung BAECs unter Kontrollbedingungen und nach der Einwirkung Latrunculin Die Pipette ist unsichtbar auf die Bilder, weil es nicht fluoreszieren.. Die Zellen wurden auf 2 uM Latrunculin A für 10 min, die drastisch reduzierte die Menge an F-Aktin, wie Rhodamin-Phalloidin Fluoreszenz gemessen (nicht dargestellt) belichtet, jedoch hatte keine signifikante Wirkung auf die Zelle aufweist. In einer behandelten Latrunculin Zelle gibt es eine Ausdünnung der Membran in der Mitte der angesaugten Vorsprung aber der Vorsprung noch mit dem c angehängtEllen. B. Wirkung Latrunculin A auf den zeitlichen Verlauf der Membranverformung wobei L Länge der Membran Vorsprung und D angesaugt wird, ist der Durchmesser der Pipette für Kontrollzellen (n = 14) und Zellen, die 2 uM Latrunculin A für 10 Minuten (n = 5). Die Zellen wurden mit -10 mm Hg (Rauten), -15 mm Hg (Quadrate) und -20 mm Hg (Dreiecke) abgesaugt. (Ab 14).
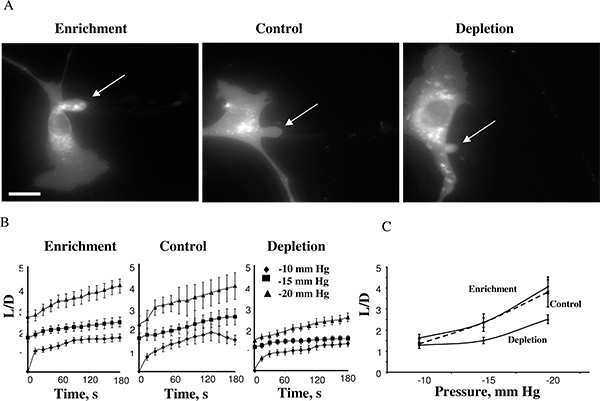
Abbildung 4. Wirkung von zellulären Cholesterinspiegel auf Membran Verformung BAECs. . Ein typisches Bild für Membranverformung von Cholesterin angereicherten, Cholesterin-abgereicherte und Kontrollzellen (Kontrollzellen wurden MßCD ausgesetzt: MßCD-Cholesterin Gemisch im Verhältnis 1:1, die keine Auswirkung auf die Menge an freiem Cholesterin in den Zellen hatten (siehe Einschub). Die gezeigten Bilder zeigen die maximale Verformung bei -15 mm Hg ist. Der Pfeil zeigt die Position des Vorsprungs aspirierten. Die Bar ist 30 um. B. Durchschnittliche Zeit-Kurse der angesaugten Längen für die drei experimentellen Zellpopulationen. C. Maximalen Längen aspirierten dargestellt als eine Funktion des angelegten Druck. Die maximale normierte Länge in Zellen verarmt war signifikant niedriger als die von Kontrollzellen für Drücke -15 mm Hg und 20 mm Hg (P <0,05). (Ab 14).
Diskussion
Mikroaspiration stellt eine einfache und hoch reproduzierbares Verfahren zur Zelle Steifigkeit / Verformbarkeit durch Anlegen von Unterdruck an eine Zellmembran und Meßmembran Verformbarkeit in Reaktion auf wohldefinierte Druck schätzen. Es wurde zuerst von Mitchison und Swann (1954) entwickelt, um die elastischen Eigenschaften von Seeigel-Eiern zu charakterisieren Einblicke in die Mechanismen der Zellteilung 21 und dann auf die mechanischen Eigenschaften der roten Blutkörperchen 1 aussehen gebe...
Offenlegungen
Keine Interessenskonflikte erklärt.
Materialien
| Name | Company | Catalog Number | Comments |
| Namen Reagenz | Firma | Katalog / Modellnummer | Kommentare |
| Sutter Pipette puller | Sutter Instruments | P-97 | |
| Microforge | Narishige | MF-830 | |
| Inverted Fluoreszenzmikroskop | Zeiss | Axiovert 200M | Das Mikroskop sollte vorzugsweise mit 3D/deconvolution Fähigkeiten ausgestattet werden. |
| Videocamera | Zeiss | AxioCam MRm | |
| Image Acquisition sotware | Zeiss | AxioVision | |
| Pneumatische Druck-Messumformer | BioTek | DPM-1B | DPM1B Pneumatische Transducer Tester können nun durch FLUKE gefunden werden. |
| Pipette aus Glas | Richland | Customized Glas | Pipetten wurden mit einer 1,2 Innendurchmesser und 1,6 Außendurchmesser angepasst. |
| DiI Dye | Invitrogen | D282 | Löst sich gut in DMSO |
Referenzen
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. I. Membrane stiffness and intracellular pressure. Biophys. J. 4, 115-135 (1964).
- Discher, D. E., Mohandas, N., Evans, E. A. Molecular maps of red cell deformation: hidden elasticity and in situ connectivity. Science. 266, 1032-1035 (1994).
- Schmid-Schönbein, G. W., Sung, K. L., Tözeren, H., Skalak, R., Chien, S. Passive mechanical properties of human leukocytes. Biophys. J. 36, 243-256 (1981).
- Guilak, F., Tedrow, J. R., Burgkart, R. Viscoelastic properties of the cell nucleus. Biochem. Biophys. Re.s Commun. 269, 781-786 (2000).
- Needham, D., Nunn, R. S. Elastic deformation and failure of lipid bilayer membranes containing cholesterol. Biophys. J. 58, 997-1009 (1990).
- Sato, M., Theret, D. P., Wheeler, L. T., Ohshima, N., Nerem, R. M. Application of the micropipette technique to the measurement of cultured porcine aortic endothelial cell viscoelastic properties. Journal of Biomechanical Engineering. 112, 263-268 (1990).
- Theret, D. P., Levesque, M. J., Sato, F., Nerem, R. M., Wheeler, L. T. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. J. of Biomechanical Engineering. 110, 190-199 (1988).
- Hochmuth, R. M. Micropipette aspiration of living cells. J. Biomech. 33, 15-22 (2000).
- Lim, C. T., Zhou, E. H., Quek, S. T. Mechanical models for living cells--a review. Journal of Biomechanics. 39, 195 (2006).
- Zhao, R., Wyss, K., Simmons, C. A. Comparison of analytical and inverse finite element approaches to estimate cell viscoelastic properties by micropipette aspiration. Journal of Biomechanics. 42, 2768 (2009).
- Chien, S., Sung, K. L., Skalak, R., Usami, S., Tozeren, A. Theoretical and experimental studies on viscoelastic properties of erythrocyte membrane. Biophys. J. 24, 463-487 (1978).
- Evans, E., Kuhan, B. Passive material behavior of granulocytes based on large deformation and recovery after deformation tests. Blood. 64, 1028-1035 (1984).
- Sato, M., Levesque, M. J., Nerem, R. M. Micropipette aspiration of cultured bovine aortic endothelial cells exposed to shear stress. Arteriosclerosis. 7, 276-286 (1987).
- Byfield, F., Aranda-Aspinoza, H., Romanenko, V. G., Rothblat, G. H., Levitan, I. Cholesterol depletion increases membrane stiffness of aortic endothelial cells. Biophys. J. 87, 3336-3343 (2004).
- Byfield, F. J., Hoffman, B. D., Romanenko, V. G., Fang, Y., Crocker, J. C., Levitan, I. Evidence for the role of cell stiffness in modulation of volume-regulated anion channels. Acta. Physiologica. 187, 285-294 (2006).
- Byfield, F. J., Reen, R. K., Shentu, T. -. P., Levitan, I., Gooch, K. J. Endothelial actin and cell stiffness is modulated by substrate stiffness in 2D and 3D. Journal of Biomechanics. 42, 1114 (2009).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. Journal of Physical Chemistry. 91, 4219-4228 (1987).
- Sun, M., Northup, N., Marga, F., Huber, T., Byfield, F. J., Levitan, I., Forgacs, G. The effect of cellular cholesterol on membrane-cytoskeleton adhesion. J. Cell. Sci. 120, 2223-2231 (2007).
- Shentu, T. P., Titushkin, I., Singh, D. K., Gooch, K. J., Subbaiah, P. V., Cho, M., Levitan, I. oxLDL-induced decrease in lipid order of membrane domains is inversely correlated with endothelial stiffness and network formation. Am. J. Physiol. Cell. Physiol. 299, 218-229 (2010).
- Norman, L. L., Oetama, R. J., Dembo, M., Byfield, F., Hammer, D. A., Levitan, I., Aranda-Espinoza, H. Modification of Cellular Cholesterol Content Affects Traction Force, Adhesion and Cell Spreading. Cell Mol. Bioeng. 3, 151-162 (2010).
- Mitchinson, J. M., Swann, M. M. The Mechanical Properties of the Cell Surface: I. The Cell Elastimeter. J. of Experimental Biology. 31, 443-460 (1954).
- Byfield, F. J., Tikku, S., Rothblat, G. H., Gooch, K. J., Levitan, I. OxLDL increases endothelial stiffness, force generation, and network formation. J. Lipid Res. 47, 715-723 (2006).
- Ohashi, T., Ishii, Y., Ishikawa, Y., Matsumoto, T., Sato, M. Experimental and numerical analyses of local mechanical properties measured by atomic force microscopy for sheared endothelial cells. Biomed. Mater. Eng. 12, 319-327 (2002).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453 (2007).
- Kowalsky, G. B., Byfield, F. J., Levitan, I. oxLDL facilitates flow-induced realignment of aortic endothelial cells. Am. J. Physiol. Cell. Physiol. 295, 332-340 (2008).
- Ketene, A. N., Schmelz, E. M., Roberts, P. C., Agah, M. The effects of cancer progression on the viscoelasticity of ovarian cell cytoskeleton structures. Nanomedicine: Nanotechnology, Biology and Medicine. , (2011).
- Kole, T. P., Tseng, Y., Huang, L., Katz, J. L., Wirtz, D. Rho kinase regulates the intracellular micromechanical response of adherent cells to rho activation. Mol. Biol. Cell. 15, 3475-3484 (2004).
- Hall, A. Rho GTPases and the Actin Cytoskeleton. Science. 279, 509-514 (1998).
- Okajima, T. Atomic Force Microscopy for the Examination of Single Cell Rheology. In. Methods Mol. Biol. 736, 303-329 (2011).
- Wang, N., Butler, J. P., Ingber, D. E. Mechanotransduction across the cell surface and through the cytoskeleton. Science. 260, 1124-1127 (1993).
- Fabry, B., Maksym, G. N., Butler, J. P., Glogauer, M., Navajas, D., Fredberg, J. J. Scaling the microrheology of living cells. Physical Review Letters. 87, 148102 (2001).
- Park, C. Y., Tambe, D., Alencar, A. M., Trepat, X., Zhou, E. H., Millet, E., Butler, J. P., Fredberg, J. J. Mapping the cytoskeletal prestress. American Journal of Physiology - Cell Physiology. 298, C1245-C1252 (2010).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophys. J. 80, 1744-1757 (2001).
- Wirtz, D. Particle-tracking microrheology of living cells: principles and applications. Annu. Rev. Biophys. 38, 301-326 (2009).
- Shin, D., Athanasiou, K. Cytoindentation for obtaining cell biomechanical properties. J. Orthop. Res. 17, 880-890 (1999).
- Ou-Yang, H. D., Wei, M. T. Complex fluids: probing mechanical properties of biological systems with optical tweezers. Annu. Rev. Phys. Chem. 61, 421-440 (2010).
- Hosu, B. G., Sun, M., Marga, F., Grandbois, M., Forgacs, G. Eukaryotic membrane tethers revisited using magnetic tweezers. Phys. Biol. 4, 67-78 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten