A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שאיפת micropipette של תאי מצע מצורפים להערכת נוקשות סלולריות
In This Article
Summary
כאן אנו מתארים שיטה פשוטה ומהירה למדידת נוקשות תא. העיקרון הכללי של גישה זו הוא למדוד עיוות קרום בתגובה ללחץ שלילי מוגדר היטב ליישם באמצעות micropipette על פני התא. שיטה זו מספקת כלי רב עצמה כדי לחקור את התכונות של תאי מצע biomechanical-מצורפים.
Abstract
מספר גדל והולך של מחקרים מראה כי מאפיינים ביומכניים של תאים בודדים לשחק תפקידים מרכזיים בתפקודים תאיים רבים, כולל תרבות של תאים, התמיינות, הגירה ואינטראקציות תא סלולרי. שני הפרמטרים המרכזיים של ביומכניקה הסלולרית הם deformability סלולרי או קשיחות והיכולת של התאים להתכווץ ולייצר כוח. כאן אנו מתארים שיטה מהירה ופשוטה להערכת נוקשות תא על ידי מדידת מידת עיוות קרום בתגובה ללחץ שלילי מיושם על ידי micropipette זכוכית לתא השטח, טכניקה שנקראת איפת micropipette או Microaspiration.
Microaspiration מתבצע על ידי משייכת זכוכית נימים ליצור micropipette עם טיפ קטן מאוד (2-50 קוטר מיקרומטר תלוי בגודל של תא או דגימת רקמה), אשר לאחר מכן הוא מחובר למתמר לחץ פנאומטי והביא לסיומו קרבת תא מתחת למיקרוסקופ. כאשרקצה פיפטה נוגע תא, שלב של לחץ שלילי יוחל על פיפטה ידי מתמר לחץ פנאומטי יצירת לחץ מוגדר היטב על קרום התא. בתגובה ללחץ, הממברנה להישאף לעיוות קרום פיפטה ומתקדמת או "היטל קרום" לתוך פיפטה נמדדת כפונקציה של זמן. העיקרון הבסיסי של גישה ניסויית זה הוא שמידת עיוות קרום בתגובה לכוח מכאני מוגדר היא פונקציה של קשיחות הממברנה. הקרום הוא נוקשה, השיעור האיטי יותר של עיוות קרום וטכניקת length.The שאיפת המצב יציב ניתן לבצע קצר בתאים מבודדים, היא בהשעיה ומצע-מצורפי האברונים, גדולים, וליפוזומים.
ניתוח מתבצע על ידי השוואת דפורמציות קרום מקסימליים שהושגו תחת לחץ נתון לאוכלוסיות תאים שונים או בתנאי ניסוי. "מקדם קשיחות" הוא estimated ידי התוויית האורך נשאף, של עיוות הממברנה כפונקציה של לחץ המופעל. יתר על כן, את הנתונים ניתן לנתח נוסף להעריך מודולוס של יאנג של התאים (ה '), הפרמטר הנפוץ ביותר לאפיון קשיחות של חומרים. חשוב לציין כי קרום פלזמה של תאים האיקריוטים יכול להיחשב כמערכת דו מרכיב בי bilayer שומני הממברנה underlied ידי cytoskeleton-קרום משנה ושזה cytoskeleton המהווה הפיגום המכאני של הקרום ושולט deformability של מעטפת התאים. גישה זו, אם כן, מאפשרת לחקור את התכונות של biomechanical cytoskeleton משנה הממברנה.
Protocol
1. מושך micropipettes זכוכית
ציוד: micropipette פולר, Microforge.
זכוכית: Boroscillicate זכוכית נימים (~ קוטר חיצוני 1.5 מ"מ, קוטר הפנימי ~ מ"מ 1.4).
- Micropipettes הם משכו באמצעות אותה הגישה הבסיסית המשמשת להכנת microelectrodes זכוכית להקלטות electrophysiology. בקצרה, זכוכית נימים מחוממת באמצע וכאשר הכוס מתחילה להמס את שני החצאים של הנימים הם משכו מלבד יצירת 2 micropipettes. מושכים מסחריים מרובים זמינים כדי לבצע תהליך זה החל ממושכים פשוטים יחסית אנכיים המשתמשים בכוח הכביד כדי להפריד בין שני pipettes למושכים-מתוחכמים אופקיים המציעים אפשרויות תכנות מרובות משתנות מהירות ופרמטרים נוספים של המשיכה. שני סוגים של מושכים שמשו בניסויים שלנו.
- דרישהשל לגיאומטריה של קצה פיפטה: הטיפים של pipettes משמש בניסויים אלה בדרך כלל נעים בין 2-6 מיקרומטר קוטר חיצוני תלוי בגודל של התא. פרמטר חשוב נוסף הוא הצורה של הקצה, שאמור משוער צינור גלילי (ראה תרשים 1). זו יכולה להיות מושגת על ידי אופטימיזציה של הפרמטרים של המשיכה ואימות הצורה של הקצה מתחת למיקרוסקופ עד לצורה הרצויה מתקבלת. האורך האופטימלי של שוק פיפטה תלויה בכמות של עיוות צפויה: אם את העיוותים הן <מיקרומטר קטן, 10, די בכך שחלק צילינדרים כמו של פיפטה הוא גם יחסית קצר (באותו סדר הגודל), עבור גדול עיוותים בהתאם. באופן כללי, הגדלת החום ו / או עלייה ב" למשוך "מקטינה את הקוטר של הקצה. העלייה ב" למשוך "גם מייצרת קצה עם להתחדד עוד. בניסויים שלנו, באמצעות P-97 פיפטה האופקית סאטר חולץ, התכנית הייתהמותאם לפרמטרים הבאים: החום של 473; 22 למשוך; Velocity 22, זמן 200; לחץ 500. כמו כן ניתן ליצור טיפים גליליים על ידי משייכת מוט ארוך מאוד ולאחר מכן שבירה וליטושה. הוראות מפורטות כיצד להכין סוגים שונים של pipettes ניתנות במדריך סאטר.
- Microforge: מומלץ גם לירות-ללטש קצה פיפטה ליצור משטח זכוכית חלקה שגורם לאטימה טובה קרום הפלזמה. הדבר נעשה על ידי הבאת קצה פיפטה לקרבת כדור זכוכית מחוממת למאוד שבריר שני באמצעות microforge. טכניקה דומה משמשת באופן שגרתי להכנת microelectrodes להקלטות אלקטרו.
- מילוי micropipette: micropipettes צריכה להיות מלאה בתמיסת מלח פיזיולוגית, כגון אס או בתקשורת צמיחה שאינה ניאון. חשוב לציין הפתרון צריך להיות בתוספת סרום 30% שיאפשר ממ התאbrane לעבור בצורה חלקה לתוך פיפטה. שתי גישות יכולות לשמש כדי להיפטר מבועות אוויר בקצה פיפטה: (i) קצה פיפטה יכול להיות שקוע בפתרון ראשון כדי לאפשר לנוזלים כדי למלא את הקצה על ידי כוחות הנימים אחרי למלא את משבצות פיפטה מהקצה השני או (ii) כל פיפטה יכולה להיות מלאה מהקצה האחורי על ידי קשה בעדינות על חוד להב של פיפטה כדי להסיר את הבועות מהקצה.
- הערה: פיפטות צריכה להיות מוכנה ביום של הניסוי.
2. הכנת התאים
- זריעת התאים: Microaspiration מבוצע על תאים בודדים שנשמרים גם בהשעיה או מצורפים למצע. כדי לשאוב תאים בתרחיף, תאים הרימו מהמצעים שלהם וpipetted אל חדר אורך רדוד שהוא רכוב על המיקרוסקופ ההפוך ממש לפני הניסוי. כדי לשאוב מצע מחוברים בתאים, תאיםהם זורעים ב- תלושי כיסוי קטנים (~ 10 מ"מ קוטר) שיכול גם להיות ממוקם בתוך תא microaspiration לפני הניסוי. הרציונל לשימוש קאמרי אורך רדוד הוא לאפשר micropipette להתקרב לתאים בזווית רדודה מאוד, קרובה לאופקיים ככל האפשר. הדבר נעשה כדי לאפשר את הממברנה נכנסה micropipette להיות דמיינו במישור אחד של פוקוס (ראה איור 2).
- Visualizing קרום תא: כדי לצפות בהקרנת הקרום לתוך פיפטה, ממברנות תאיהם מגואלות בצבע lipophilic ניאון, כגון diI באמצעות פרוטוקול מכתים סטנדרטי.
- פתרון PBS חם.
- דלל את diI המניות כדי ריכוז עבודה (5 מיקרומטר) עם פתרון PBS המחומם.
- Sonicate למשך 5 דקות כדי לשבור אגרגטים לצבוע.
- ספין למטה למשך 5 דקות ולקחת את supernatant.
- שטוף תאים ב3 פעמים PBS, 5 דקות כל אחד.
- דגירת תאים עם הצבע כל כךlution למשך 30 דקות ב37 מעלות צלזיוס חממה.
- לשטוף את התאים עם 3 פעמי PBS במשך 5 דקות כל אחד.
- הערה: אפשר להחליף מכתים diI של הקרום עם המחשת cytoskeleton-קרום משנה שגם הוא שמשך יחד עם הקרום לתוך פיפטה. זה צריך להילקח בחשבון, עם זאת, שמביך את cytoskeleton עלול לשנות את המאפיינים ביומכניים של התא. יתר על כן, בעת ביצוע ניסויי microaspiration עם תאי מצע מצורפים, מומלץ להשתמש בהדמית 3D ללאמוד את משך הקרנת קרום לתוך פיפטה שממוקמת בזווית למישור המוקד של התאים.
3. Microaspiration ויבוא תמונות
ציוד: מיקרוסקופ פלורסנט ההפוך, רצוי עם יכולות deconvolution 3D (Zeiss Axiovert 200 מ'עם תנועה מבוקרת מחשב Z-ציר objectives או שווה ערך); מצלמת וידאו המחובר למחשב (AxioCam MRM או שווה ערך), מתמר לחץ (BioTek או שווה ערך), תחנת רטט חינם (TMD או שווה ערך), micromanipulator (Narishige, סאטר, Burleigh או שווה ערך; המניפולטורים יכול להיות מכאני, הידראולי או פיזואלקטריים). כמו כן, חשוב להדגיש כי microaspiration יכול להתבצע באמצעות מיקרוסקופ ללא יכולות 3D להעריך את הנוקשות של תאים בתרחיף, כגון 1,2 דם אדום או תאי הנויטרופילים 3, אברוני מבודד, דוגמת גרעינים 4 או 5 יפוזומים מלאכותיים.
תוכנת תמונת רכישה: Zeiss AxioVision או שוות ערך.
- הר את התאים לתוך תא microaspiration, כפי שתואר לעיל, במיקרוסקופ פלואורסצנטי הפוך. מקם את התאים בוחרים תא לניסוי ולמקם אותו במרכז שדה הראייה. חשוב perform ניסויים אלה בסביבת רטט חופשיה, במיוחד עבור ניסויים עם תאי מצע-מצורפים בגלל תנודות זעירות המתרחשות בדרך כלל על ספסלים ושולחנות רגילים עשויות להתפשר לחלוטין יצירה של החותם, לשבור את קצה micropipette או בתוצאה משמרות משמעותיות בעמדת הקצה שיהיה להטות את ניתוח התוצאות.
- הנח micropipette מלא עם PBS / מדיה w / פתרון סרום לבעל פיפטה מחובר למתמר כוח בצינור גמיש בקוטר המותאם לconnecter של בעל פיפטה בהתקף חזק. בתחילתו של כל ניסוי הלחץ בפיפטה הוא מתאזן ללחץ אטמוספרי. פיפטה היא רכוב על micromanipulator המאפשר בקרה טובה יותר על תנועות פיפטה בטווח מיקרון. מקם פיפטה בזווית שטוחה לתחתית התא ולהביא את קצה פיפטה למרכז שדה הראייה. השוק הדואר של פיפטה, חלק גלילי של קצה פיפטה לתוכו הממברנה aspirated, מיושר אופקי למישור המוקד באמצעות (1) המיצוב פיפטה בזווית האפשרית הרדודה ביותר (10-15 °) ו (2) על ידי הגמשת השוק של פיפטה נגד התחתון של קאמרי. כי השוק הוא דק מאוד זה הוא גמיש מספיק כדי להחליק על התחתית של החדר בעת שהתקרב לתא, כפי שמוצגים באיור סכמטי 1. לאט לאט להפיל את micropipette לצד של תא בודד באמצעות מניפולטור כמובן עד סמוך למישור מוקד לתא. לאחר מכן, באמצעות מניפולטור בסדר לעבור micropipette לקצה התא עד קצה פיפטה נוגע בעדינות בקרום. קח תמונה אחת לצפות במיקום של פיפטה. חותמות טובות נוצרות כאשר כל קצה פיפטה היא במגע מלא עם תא השטח והקשר יציב. אין קריטריון אובייקטיבי חזק, לעומת זאת, על כמה טוב את החותם הוא exc EPT לבדיקה ויזואלית.
- החל שלב של לחץ שלילי באמצעות מתמר ולשמור עליו עד הקרנת קרום הוא התייצב. כמות הלחץ הדרוש כדי לשאוב את הקרום לתוך פיפטה משתנית בהתאם לסוג התא ותנאי ניסוי ספציפיים. בניסויים שלנו, עיוות ראשונית הוא ציין בדרך כלל כאשר הפעלת לחץ בטווח שבין -2 כספיים ל- 15mm. כאשר הלחץ מוחל, הקרום מעווה בהדרגה לתוך פיפטה עד שהוא התייצב באורך מסוים, תהליך שאורך בדרך כלל 2-3 דקות. במהלך תקופה זו, תמונות של עיוות הממברנה נרכשות כל שנייה 30 כדי לעקוב אחר ההתקדמות של הקרום שנמשך לתוך פיפטה.
- להגביר את הלחץ לרמה הבאה בצעדי 2-5 מ"מ כספיים וחזר על כל ההליך עד הקרנת קרום מתנתקת מהתא ועובר לפיפטה, ובשלב הניסוי הוא עצר.
class = "jove_title"> 4. אנליזה
כדי לכמת את מידת עיוות קרום, ונשאף האורך (L) נמדד מקצה פיפטה לקודקוד של היקף היטל הממברנה. חשוב לציין, עם זאת, שפיפטה גדולה תחול יותר כוח על קרום התא באותה הרמה של לחץ. כדי להסביר את השונות בין הקטרים של pipettes, ולכן, האורך ונשאף מנורמל לקוטר פיפטה (ד ') נמדד עבור כל ניסוי.
את הנתונים ניתן לנתח נוסף תוך שימוש במודל סטנדרטי ליניארי viscoelastic מחצית שטח של התא האנדותל, כפי שתואר במחקרים הקודמים 6,7. באופן ספציפי, מודולוס האלסטיות של התאים נאמד באמצעות משוואה:
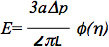
כאשר E היא מודולוס של יאנג, הוא פנימירדיוס של פיפטה, Δp הבדל הלחץ, L הוא האורך ונשאף מקביל, וφ (η) הוא קיר לתפקד מחושב באמצעות מודל הכח, כפי שתואר על ידי Theret et al 7. חשוב לציין כי דגמים רבים היו בשימוש כדי לנתח את נתוני microaspiration כולל מודל אלמנטים סופי המבוסס על הנחה שתא הוא תחום deformable עם מאפיינים איזוטרופיים והומוגנית חומרים ומודלי טיפה נוזליים, אשר מניחים כי תאים יוצרים צורה כדורית, יכול לעוות ברציפות, ולשחזר עם שחרור, כפי שתואר בכמה ביקורות מצוינות: 8-10. Microaspiration יכול גם לשמש כדי לחקור פרמטרי biomechanical אחרים של תאים ורקמות, כגון תכונות viscoelastic סלולריות, מתח קליפת המוח ותרומה של אלמנטים מבניים שונים לביומכניקה תאים ורקמות (ראה את הביקורות מפורטות לעיל לקבלת מידע נוסף).
5. נציגתוצאות
בשנת לימודים קודמים, שאיפת micropipette בוצעה גם על ליפוזומים 5 או בתאים שלא צורפו למצע 2,11-13. במחקרים שלנו, לעומת זאת, התאים בדרך כלל שמרו מצורפים למצע, כדי למנוע שינויים במבנה cytoskeletal שעשויים להתרחש כאשר תאים לנתק 14-16. כדי לאמת את השימוש בטכניקת microaspiration לתאי מצע מצורפים, בדקנו אם הפרעה לתוצאות ה-F-יקטין בירידה בנוקשות תא של תאי האנדותל (בקר אב עורקי BAECs), כפי שהוערכו על ידי גישה זו. איור 3 מראה כי, כצפוי , זה אכן כך. באופן ספציפי, האיור 3 א מציג סדרה טיפוסית של תמונות ניאון של קרום אנדותל עובר עיוות מתקדמת בתגובה ללחץ שלילי מיושם באמצעות micropipette. כצפוי, הממברנה aspirated הדרגה לתוך פיפטה וaspiratאורך ed גדל כפונקציה של לחץ מופעל. זמן הקורסים של תכנית העיוות שהשיבוש של F-תקטין מגביר באופן משמעותי את האורך של השאיפות של תחזיות בכל תנאי הלחץ (איור 3B) 14.
שימוש בגישה זו, גילתה שקשיחות תא עולה כאשר ממברנות תאים מתרוקנות מכולסטרול ואילו העשרת כולסטרול לא הייתה השפעה 14. איור 4 מראה תא כולסטרול מועשר, תא בקרה, ותא כולסטרול שהתרוקן לאחר שהגיע אורכי שאיפה מקסימליים ב -15 מ"מ כספי (4A). התחזיות בדרך כלל התחילו להתפתח ב- 10mmHg וזמן הקורסים של עיוות קרום יכולים להימדד ללחצים השליליים של -10, -15 ו-20 מ"מ כספי (4B). יישום של לחצים מעל-25mmHg הביא ניתוק של ההקרנה ונשאפה יוצרת שלפוחית נפרדת. רמת הלחץ שהביאה לניתוק קרום הייתה similar בתנאי כולסטרול שונים. תצפית זו הייתה צפויה מאוד, כי מחקרים קודמים הראו כי בbilayers שומני קרום עלייה בכולסטרול קרום מגבירה את הנוקשות של הקרום 5,17. המחקרים הנוספים שלנו אשרו תצפיות אלה באמצעות כמה גישות עצמאיות, כולל מיקרוסקופי כוח אטומי 18,19 ומיקרוסקופי גרירת חיל 20.
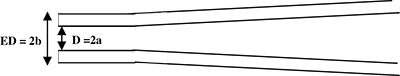
איור 1. מבט מצד סכמטי של פיפטה הקלטה. פיפטה היא משך ליצור שוק גלילי בקצה (מבט מצד). פרמטרי micropipette: D = 2a = הפנימי וקוטר ED = 2b = קוטר חיצוני.

איור 2. Micropipette מתקרב תא מצע מצורף () להציג צד סכמטי;. (ב ') תמונת ניגוד מוארת של micropipette שלהאנק נוגע תא בדרך כלל בצורה המשמש בניסויי שאיפה; (ג) תמונה של פלורסנט אותו התא מסומן עם המבת"ן 18. Micropipette עדיין קיים, אבל הוא בלתי נראה (מתוך 14).
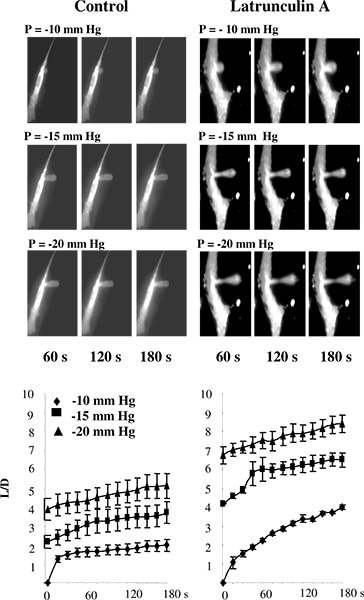
איור 3. אימות של מדידת נוקשות תא בתאי מצע-מצורפים באמצעות microaspiration. ת: תמונות של עיוות קרום ההדרגתית של BAECs בתנאי בקרה ואחרי החשיפה לlatrunculin פיפטה הוא בלתי נראה על התמונות כי זה לא לזרוח.. התאים נחשפו עד 2 מיקרומטר latrunculin למשך 10 דקות, שצומצמו באופן משמעותי את הכמות-F-תקטין, כפי שנמדדו על ידי rhodamine-phalloidin פלואורסצנטי (לא מוצג), אך לא הייתה השפעה משמעותית על צורת התא. בתא latrunculin טופל, יש דילול של הקרום באמצע ההקרנה ונשאפה, אך התחזית עדיין מחוברת לגאמות. ב. השפעת latrunculin על הקורסים בזמן של עיוות קרום שבו L aspirated אורך הקרנת הקרום ו-D היא הקוטר של פיפטה לתאי בקרה (n = 14) ותאים שנחשפו לlatrunculin 2 מיקרומטר למשך 10 דקות (n = 5). התאים היו עם aspirated -10 מ"מ כספי (יהלומים), -15 מ"מ כספי (ריבועים) ו-20 מ"מ כספי (משולשים). (מתוך 14).
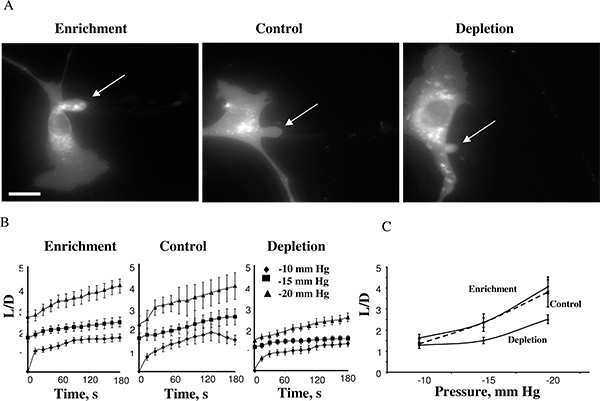
איור 4. השפעה של רמות כולסטרול סלולריים על עיוות הממברנה של BAECs. A. תמונות אופייניות של עיוות הממברנה של כולסטרול מועשר, כולסטרול מדולדל ותאי בקרה (תאי בקרה נחשפו לMβCD: תערובת MβCD-כולסטרול בביחס 1:1 שלא הייתה השפעה על רמת הכולסטרול חופשי בתאים (ראה הבלעה). בדמויות שהוצגו מתארות את העיוות המקסימלי ב-15 מ"מ כספי. החץ מציין את המיקום של ההקרנה ונשאפה. הבר הוא 30 מיקרומטר. B. זמן הממוצע לקורסים באורכים של שאיפות לשלוש אוכלוסיות התאים הניסיוניות. ג. אורכי שאיפות אוויר מקסימאליים זממו כפונקציה של לחץ המופעל. האורך המקסימאלי המנורמל בתאים מדולדלים היה נמוך באופן משמעותי מזה של תאי בקרה ללחצי -15 מ"מ כספי ו-20 מ"מ כספי (p <0.05). (מתוך 14).
Discussion
Microaspiration מספק שיטה פשוטה ולשעתק מאוד להעריך נוקשות תא / deformability על ידי הפעלת לחץ שלילי על קרום תא ומדידת deformability קרום בתגובה ללחץ מוגדר היטב. היא פותחה לראשונה על ידי Mitchison וסוואן (1954) כדי לאפיין את תכונות האלסטיות של ביצי קיפודי ים כדי לספק תובנה לתוך מנגנוני חלוקת תא
Disclosures
אין ניגודי האינטרסים הכריזו.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | קטלוג / דגם מספר | תגובות |
| סאטר פיפטה חולץ | סאטר מכשירים | P-97 | |
| Microforge | Narishige | MF-830 | |
| מיקרוסקופ פלורסנט ההפוך | Zeiss | Axiovert 200 מ' | מיקרוסקופ צריך להיות מצויד רצוי עם יכולות 3D/deconvolution. |
| מצלמת וידאו | Zeiss | AxioCam MRM | |
| תמונת הרכישה sotware | Zeiss | AxioVision | |
| מתמרים לחץ פניאומטיים | BioTek | DPM-1B | טסטר מתמר פניאומטיים DPM1B כעת ניתן למצוא על ידי FLUKE. |
| כוס טפטפה | Richland | כוס מותאמת אישית | Pipettes היה אישית עם קוטר פנימי 1.2 וקוטר חיצוני 1.6. |
| DiI דיי | Invitrogen | D282 | מתמוסס היטב בDMSO |
References
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. I. Membrane stiffness and intracellular pressure. Biophys. J. 4, 115-135 (1964).
- Discher, D. E., Mohandas, N., Evans, E. A. Molecular maps of red cell deformation: hidden elasticity and in situ connectivity. Science. 266, 1032-1035 (1994).
- Schmid-Schönbein, G. W., Sung, K. L., Tözeren, H., Skalak, R., Chien, S. Passive mechanical properties of human leukocytes. Biophys. J. 36, 243-256 (1981).
- Guilak, F., Tedrow, J. R., Burgkart, R. Viscoelastic properties of the cell nucleus. Biochem. Biophys. Re.s Commun. 269, 781-786 (2000).
- Needham, D., Nunn, R. S. Elastic deformation and failure of lipid bilayer membranes containing cholesterol. Biophys. J. 58, 997-1009 (1990).
- Sato, M., Theret, D. P., Wheeler, L. T., Ohshima, N., Nerem, R. M. Application of the micropipette technique to the measurement of cultured porcine aortic endothelial cell viscoelastic properties. Journal of Biomechanical Engineering. 112, 263-268 (1990).
- Theret, D. P., Levesque, M. J., Sato, F., Nerem, R. M., Wheeler, L. T. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. J. of Biomechanical Engineering. 110, 190-199 (1988).
- Hochmuth, R. M. Micropipette aspiration of living cells. J. Biomech. 33, 15-22 (2000).
- Lim, C. T., Zhou, E. H., Quek, S. T. Mechanical models for living cells--a review. Journal of Biomechanics. 39, 195 (2006).
- Zhao, R., Wyss, K., Simmons, C. A. Comparison of analytical and inverse finite element approaches to estimate cell viscoelastic properties by micropipette aspiration. Journal of Biomechanics. 42, 2768 (2009).
- Chien, S., Sung, K. L., Skalak, R., Usami, S., Tozeren, A. Theoretical and experimental studies on viscoelastic properties of erythrocyte membrane. Biophys. J. 24, 463-487 (1978).
- Evans, E., Kuhan, B. Passive material behavior of granulocytes based on large deformation and recovery after deformation tests. Blood. 64, 1028-1035 (1984).
- Sato, M., Levesque, M. J., Nerem, R. M. Micropipette aspiration of cultured bovine aortic endothelial cells exposed to shear stress. Arteriosclerosis. 7, 276-286 (1987).
- Byfield, F., Aranda-Aspinoza, H., Romanenko, V. G., Rothblat, G. H., Levitan, I. Cholesterol depletion increases membrane stiffness of aortic endothelial cells. Biophys. J. 87, 3336-3343 (2004).
- Byfield, F. J., Hoffman, B. D., Romanenko, V. G., Fang, Y., Crocker, J. C., Levitan, I. Evidence for the role of cell stiffness in modulation of volume-regulated anion channels. Acta. Physiologica. 187, 285-294 (2006).
- Byfield, F. J., Reen, R. K., Shentu, T. -. P., Levitan, I., Gooch, K. J. Endothelial actin and cell stiffness is modulated by substrate stiffness in 2D and 3D. Journal of Biomechanics. 42, 1114 (2009).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. Journal of Physical Chemistry. 91, 4219-4228 (1987).
- Sun, M., Northup, N., Marga, F., Huber, T., Byfield, F. J., Levitan, I., Forgacs, G. The effect of cellular cholesterol on membrane-cytoskeleton adhesion. J. Cell. Sci. 120, 2223-2231 (2007).
- Shentu, T. P., Titushkin, I., Singh, D. K., Gooch, K. J., Subbaiah, P. V., Cho, M., Levitan, I. oxLDL-induced decrease in lipid order of membrane domains is inversely correlated with endothelial stiffness and network formation. Am. J. Physiol. Cell. Physiol. 299, 218-229 (2010).
- Norman, L. L., Oetama, R. J., Dembo, M., Byfield, F., Hammer, D. A., Levitan, I., Aranda-Espinoza, H. Modification of Cellular Cholesterol Content Affects Traction Force, Adhesion and Cell Spreading. Cell Mol. Bioeng. 3, 151-162 (2010).
- Mitchinson, J. M., Swann, M. M. The Mechanical Properties of the Cell Surface: I. The Cell Elastimeter. J. of Experimental Biology. 31, 443-460 (1954).
- Byfield, F. J., Tikku, S., Rothblat, G. H., Gooch, K. J., Levitan, I. OxLDL increases endothelial stiffness, force generation, and network formation. J. Lipid Res. 47, 715-723 (2006).
- Ohashi, T., Ishii, Y., Ishikawa, Y., Matsumoto, T., Sato, M. Experimental and numerical analyses of local mechanical properties measured by atomic force microscopy for sheared endothelial cells. Biomed. Mater. Eng. 12, 319-327 (2002).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453 (2007).
- Kowalsky, G. B., Byfield, F. J., Levitan, I. oxLDL facilitates flow-induced realignment of aortic endothelial cells. Am. J. Physiol. Cell. Physiol. 295, 332-340 (2008).
- Ketene, A. N., Schmelz, E. M., Roberts, P. C., Agah, M. The effects of cancer progression on the viscoelasticity of ovarian cell cytoskeleton structures. Nanomedicine: Nanotechnology, Biology and Medicine. , (2011).
- Kole, T. P., Tseng, Y., Huang, L., Katz, J. L., Wirtz, D. Rho kinase regulates the intracellular micromechanical response of adherent cells to rho activation. Mol. Biol. Cell. 15, 3475-3484 (2004).
- Hall, A. Rho GTPases and the Actin Cytoskeleton. Science. 279, 509-514 (1998).
- Okajima, T. Atomic Force Microscopy for the Examination of Single Cell Rheology. In. Methods Mol. Biol. 736, 303-329 (2011).
- Wang, N., Butler, J. P., Ingber, D. E. Mechanotransduction across the cell surface and through the cytoskeleton. Science. 260, 1124-1127 (1993).
- Fabry, B., Maksym, G. N., Butler, J. P., Glogauer, M., Navajas, D., Fredberg, J. J. Scaling the microrheology of living cells. Physical Review Letters. 87, 148102 (2001).
- Park, C. Y., Tambe, D., Alencar, A. M., Trepat, X., Zhou, E. H., Millet, E., Butler, J. P., Fredberg, J. J. Mapping the cytoskeletal prestress. American Journal of Physiology - Cell Physiology. 298, C1245-C1252 (2010).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophys. J. 80, 1744-1757 (2001).
- Wirtz, D. Particle-tracking microrheology of living cells: principles and applications. Annu. Rev. Biophys. 38, 301-326 (2009).
- Shin, D., Athanasiou, K. Cytoindentation for obtaining cell biomechanical properties. J. Orthop. Res. 17, 880-890 (1999).
- Ou-Yang, H. D., Wei, M. T. Complex fluids: probing mechanical properties of biological systems with optical tweezers. Annu. Rev. Phys. Chem. 61, 421-440 (2010).
- Hosu, B. G., Sun, M., Marga, F., Grandbois, M., Forgacs, G. Eukaryotic membrane tethers revisited using magnetic tweezers. Phys. Biol. 4, 67-78 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved