JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
기판에 연결된 전지의 Micropipette의 열망은 셀 강성을 추정하기 위해
요약
여기 셀 강성을 측정 할 수있는 빠르고 간단한 방법을 설명합니다. 이 방법의 일반적인 원리는 세포 표면에 micropipette를 통해 적용 잘 정의 된 부정적인 압력에 대한 응답으로 막 변형을 측정하는 것입니다. 이 방법은 기판에 연결된 세포의 biomechanical 속성을 연구 할 수있는 강력한 도구를 제공합니다.
초록
연구 증가는 개별 세포의 biomechanical 속성이 세포 증식, 분화, 마이그레이션 및 세포 세포 상호 작용 등 여러 가지 세포 기능에 중요한 역할을 것으로 나타났습니다. 세포 biomechanics의 두 가지 주요 매개 변수 세포 deformability 또는 강성과 힘을 계약 생성하는 세포의 능력입니다. 여기 우리는 세포 표면에 유리 micropipette, Micropipette의 흡인 또는 Microaspiration라고 기술로 적용 부정적인 압력에 대한 응답으로 막 변형의 정도를 측정하여 세포 강성을 추정 할 수있는 빠르고 간단한 방법을 설명합니다.
Microaspiration는 다음 공기 압력 변환기에 연결 가까이로 이동하는 아주 작은 팁 (셀 또는 조직 샘플의 크기에 따라 2-50 μm의 직경)로 micropipette을 만들 모세관 잔을 당겨 수행 현미경으로 세포의 주변. 때피펫의 팁은 공기 압력 변환기는 세포막에 잘 정의 압력을 생성하여 피펫에 적용되는 셀, 부정적인 압력의 단계를 감동. 압력에 대응하여, 멤브레인은 피펫 및 프로그레시브 막 변형 또는 피펫은 시간의 함수로 측정됩니다에 "막 투사"로 흡입된다. 이 실험 방법의 기본 원리는 정의 된 기계 힘에 대한 응답으로 막 변형의 정도가 막 강성의 기능이라는 것입니다. 엄격한 멤브레인은 느린 막 변형의 속도와 짧은 정상 상태 흡인 length.The 기술은 정지하고 기판에 연결된, 큰 세포 소기관의 두 절연 셀에 수행 할 수 있으며, liposomes입니다.
분석은 다른 세포 집단 또는 실험 조건에 주어진 압력 하에서 달성 최대 막 변형을 비교하여 수행됩니다. A "강성 계수는"에스입니다적용 압력의 함수로 막 변형의 흡입 길이를 음모에 의해 timated. 또한, 데이터는 더욱 세포의 영 계수 (E), 재료의 강성을 특징하는 가장 일반적인 매개 변수를 추정하기 위해 분석 할 수 있습니다. 이 진핵 세포의 플라즈마 멤브레인은 막 지질 이중층은 하위 막 세포 골격으로하고 멤브레인의 기계적 비계를 구성 세포 골격이며, deformability을 지배 해당 underlied되어있는 이중 구성 요소 시스템으로 볼 수 있습니다하는 것이 중요합니다 세포 봉투. 이 방법은, 따라서, 서브 막 세포 골격의 biomechanical 속성을 탐색 할 수 있습니다.
프로토콜
1. 유리 Micropipettes를 당기는
장비 : Micropipette 풀러, Microforge.
유리 : Boroscillicate 유리 모세관 (~ 1.5 mm 외경 ~ 1.4 mm 내경).
- Micropipettes는 전기 생리학 녹음을 위해 유리 microelectrodes를 준비하는 데 사용되는 것과 동일한 기본 접근 방법을 사용하여 뽑아 있습니다. 간단히, 모세관 유리는 중간에 가열되어 유리가 녹기 시작할 때 모세의 두 절반은 두 명의 micropipettes을 생성 당겨 있습니다. 여러 상업 pullers는 풀의 속도 및 기타 매개 변수를 변경할 수있는 여러 프로그램 옵션을 제공합니다 높은 정교한 수평 pullers에 두 피펫를 분열하기 위해 중력을 이용해서 비교적 간단 수직 pullers 이르기까지이 과정을 수행 할 수 있습니다. pullers의 두 종류의 실험에 사용 하였다.
- 요구 사항S는 피펫 팁의 형상에 대한 이러한 실험에 사용 된 피펫의 팁은 일반적으로 6-2 사이 μm 세포의 크기에 따라 외부 직경을 다양합니다. 또 다른 중요한 매개 변수는, 끝의 모양입니다해야 대략 원통형 관 (그림 1 참조). 이것은 풀의 매개 변수를 최적화하고 원하는 형태를 얻을 때까지 현미경 팁의 모양을 확인하여 달성 될 수있다. 피펫 생크의 최적 길이는 예상 변형의 양에 따라 달라집니다 변형이 작은 <10 μm 경우,이 피펫의 실린더와 같은 부분이 짧은 (크기의 순서와 동일), 큰에도 상대적 것을 충분 변형이 적절하게 조정합니다. 일반적으로, "풀"에 열 및 / 또는 증가를 늘리면 끝의 직경을 감소시킵니다. "풀"의 증가는 더 이상 테이퍼가있는 팁을 생성합니다. 우리의 실험에서, 셔터 P-97 수평 피펫 풀러를 사용하여 프로그램이었습니다, 끌어 오기 22, 속도 22 시간 200, 압력 500 473의 열 다음 매개 변수를 최적화. 그것은 아주 긴 칼을 당겨하고 파괴하고 연마하여 원통형 팁을 생성 할 수도 있습니다. 피펫의 다른 유형을 준비하는 방법에 대한 자세한 지침은 셔터 설명서에 부여됩니다.
- Microforge : 그것은 또한 플라즈마 막에 좋은 실을 만드는 부드러운 유리 표면을 생성 할 수있는 피펫의 팁을 발사 - 폴란드어하는 것이 좋습니다. 이것은 microforge를 사용하여 두 번째의 아주 일부에 대한 온수 유리 공의 주변에 피펫의 팁을 가져 통해 이루어집니다. 비슷한 기술은 정기적으로 electrophysiological 레코딩을위한 microelectrodes을 준비하는 데 사용됩니다.
- Micropipette를 채운 : Micropipettes 이러한 PBS 또는 비 형광 성장 미디어와 같은 생리 생리 식염수, 가득해야합니다. 중요한 솔루션은 휴대 가상 할 수 있도록 그 30 %의 혈청 보충해야피펫으로 원활하게 이동 brane. 두 접근 방식은 피펫의 끝에서 기포를 제거하는 데 사용할 수 있습니다 :은 (i) 피펫의 팁은 액체가 피펫을 backfilling 다음 모세관 힘에 의해 팁을 작성 할 수 있도록 먼저 솔루션에 몰두 할 수 있습니다 다른 끝에서 또는 (ii) 전체 피펫은 부드럽게 끝에서 거품을 제거하기 위해 피펫의 칼에 활용하여 백 엔드에서 작성하실 수 있습니다.
- 참고 : 피펫은 실험 당일 준비해야합니다.
2. 셀의 준비
- 셀을 퍼 뜨리고 : Microaspiration이 중 정지 유지 또는 기판에 연결된 하나의 셀에 수행됩니다. 정지 세포를 대기음하기 위해 세포들은 기판에서 채취 오른쪽 실험 전에 역 현미경에 장착되어있는 얕은 세로 챔버에 pipetted 있습니다. 기판에 연결된 세포, 세포를 대기음하려면작은 커버 - 전표에 놓는 아르도 실험 전에 microaspiration 챔버에 배치 할 수 있습니다 (직경 ~ 10 ㎜). 얕은 종 방향 챔버를 사용하는 근거는 micropipette 가능한 수평에 가까이 아주 얕은 각도에서 셀을 접근 할 수 있도록하는 것입니다. 이것은 (그림 2 참조) 초점의 단일 비행기 시각화 될 수있는 micropipette으로 당겨 멤브레인을 허용하기위한 것입니다.
- 세포막 시각화 : 피펫에 막 투영을 관찰하기를, 휴대 멤브레인는 표준 얼룩 프로토콜을 사용하여 같은 diI 같은 lipophilic 형광 염료, 물들입니다.
- 따뜻한 PBS 솔루션입니다.
- 예열 PBS 솔루션으로 작업 농도 (5 μM)에 재고 diI을 희석.
- 염료 집계을 깨고 5 분에 Sonicate.
- 5 분을 위해 스핀 다운하고 표면에 뜨는보십시오.
- PBS 3 회, 5 분 각 셀을 씻으십시오.
- 그래서 염색으로 세포를 배양37 ° C 배양기에서 30 분에 lution.
- 5 분 각각에 대한 PBS 3 회와 세포를 씻으십시오.
- 참고 : 또한 피펫으로 막과 함께 당겨되고있는 서브 막 세포 골격을 시각화와 멤브레인의 diI의 착색을 대체 할 수 있습니다. 이 세포 골격을 perturbing하면 셀의 biomechanical 속성을 변경할 수 그러나, 고려되어야합니다. 또한, 기판 첨부 된 셀과 microaspiration 실험을 수행 할 때, 그것은 세포의 초점 평면에 각도로 위치 피펫으로 막 투영의 길이를 추정하기 위해 3D 이미지를 사용하는 것이 좋습니다.
3. Microaspiration 및 이미지 수집
장비 : 역 형광 현미경, 바람직하게는 3D deconvolution 기능 (objectiv의 컴퓨터 제어 Z-축 운동과 Zeiss Axiovert 200M로ES 또는 이에 상응하는 금액), manipulators, 컴퓨터 (AxioCam MRM 또는 이에 상응하는 금액), 압력 변환기 (BioTek 또는 이에 상응하는 금액), 진동이없는 역 (TMD 또는 이에 상응하는 금액), Micromanipulator (Narishige, 셔터, Burleigh 또는 동급에 연결 videocamera ), 기계 유압 또는 압전 수 있습니다. 그렇게 microaspiration 이러한 적혈구의 1,2 또는 호중구 3 등 핵 4 인조 liposomes 5와 절연 세포 소기관과 같은 정지 세포의 강성을 추정하기 위해 3D 기능이없는 현미경을 사용하여 수행 할 수 있습니다 강조하는 것도 중요합니다.
이미지 수집 소프트웨어 : Zeiss AxioVision 또는 유사한.
- 위에서 설명한대로 역 형광 현미경에, microaspiration 챔버에 세포를 탑재합니다. 실험을 위해 셀을 선택 셀을 위치와 시야의 중심에 배치합니다. 이 perfo 중요합니다특히 기판에 연결된 세포와 실험을위한 진동없는 환경에서 RM이 실험 일반적으로 벤치 및 정기적 인 테이블에서 발생하는 분 진동은 완전히 인감의 작성을 손상에 micropipette 또는 결과의 끝을 깰 가능성이 있기 때문에 결과의 분석됩니다 스큐 끝의 위치에 중대한 변화.
- 꼭 피팅을위한 피펫 소유자의 connecter으로 조정 직경 유연한 튜브하여 전력 변환기에 연결 피펫 홀더에 PBS / 미디어 w / 혈청 솔루션으로 가득한 micropipette를 놓습니다. 각 실험의 시작 부분에서 피펫의 압력이 대기 압력 equilibrated입니다. 피펫은 마이크론 범위에서 피펫 운동의 미세 제어를 할 수있는 micromanipulator에 장착된다. 챔버의 바닥에 얕은 각도로 피펫을 배치하고 시야의 중심에 피펫의 팁을 가져. 일피펫의 전자 생크, 멤브레인가 흡입되는에 피펫 팁의 원통형 부분은 가능한 가장 얕은 각도 (10-15 °)에서 (1) 위치 피펫으로 (2)에 의해 초점 평면에 수평으로 정렬되어 있습니다 챔버의 바닥에 대한 피펫의 칼을 flexing. 생크가 매우 얇은이기 때문에 그림 1에 개략적으로 도시 된 바와 같이 그것은 세포에 접근하는 동안 챔버의 하단에 밀어 정도로 유연하다. 천천히 셀에 대해 초점 비행기 근처까지 코스 속이는를 사용하여 단일 셀의 옆에 micropipette 내려 보내. 피펫의 끝이 부드럽게 막에 닿는 때까지, 좋은 속이는를 사용하면 셀의 가장자리에 micropipette 이동합니다. 피펫의 위치를 관찰 한 이미지를보세요. 피펫의 전체 끝이 세포 표면 전체에 접촉하고 연락이 안정되면 좋은 바다 표범이 만들어집니다. 더 강한 객관적인 기준은 봉인 실이 얼마나 좋은 약하지만,이 없습니다시각적 시험 ept.
- 변환기를 사용하여 부정적인 압력의 단계를 적용하고 막 프로젝션이 안정 될 때까지 그것을 유지하고 있습니다. 피펫으로 멤브레인을 대기음에 필요한 압력의 양이 세포 유형과 특정 실험 조건에 따라 다릅니다. -2로 - 15mm HG 사이의 범위에 압력을 적용 할 때 우리의 실험에서는 초기 변형은 일반적으로 관찰된다. 이 특정 길이, 일반적으로 2-3 분 소요하는 과정에서 안정화 될 때까지 압력이 적용되면, 멤브레인은 점차 피펫으로 변형된다. 이 기간 동안 막 변형의 이미지는 피펫으로 당겨 멤브레인의 진행을 추적 할 때마다 30 초를 획득합니다.
- 2~5mm HG 단계에서 다음 단계로 압력을 높이고 막 투영이 실험이 중지되는 시점에서 피펫으로 셀 이동에서 분리 될 때까지 모든 절차를 반복합니다.
막 변형의 정도를 수량화하기 위해 흡입 길이 (L)은 피펫의 끝에서 막 투영의 둘레의 정점에 측정됩니다. 그것은 큰 피펫은 압력의 동일한 수준에있는 세포막에 대한 자세한 힘을 적용 할 그러나, 유의하는 것이 중요합니다. 피펫의 직경 사이의 다양성을 위해 계정에 따라서, 흡입 길이는 각 실험 측정 피펫 직경 (D)에 대한 표준화되어 있습니다.
데이터는 더로 이전 연구 6,7에 설명 된 내피 세포의 표준 선형 점탄성 반 공간 모델을 사용하여 분석 할 수 있습니다. 특히, 세포의 탄성 계수는 식을 사용하여 추정되었다 :
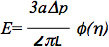
E는 영의 계수이고,이 내부입니다피펫 반경이 Δp는 압력 차이며, L은 해당 흡입 길이이며, φ (η)은 기능이 아니라 Theret 외 7에서 설명 된 힘 모델을 사용하여 계산 벽입니다. 그것은 여러 모델 셀 세포가 구형 모양을 형성 그 가정 등방성과 균일 한 재료 특성 및 액체 방울 모델과 변형 영역이 있다고 가정 유한 요소 모델을 포함하여 microaspiration 데이터를 분석하는 데 사용 된 점에 유의하는 것이 중요합니다 지속적으로 변형, 등 여러 뛰어난 리뷰에 설명 된 릴리스에 따라 복구 할 수 있습니다 : 8-10. Microaspiration는 또한 휴대 점탄성 특성, 세포 및 조직 biomechanics (자세한 내용은 위에 나열된 리뷰를 참조) 다른 구조 요소의 대뇌 피질의 긴장과 공헌 등의 세포와 조직의 다른 biomechanical 매개 변수를 조사하는 데 사용할 수 있습니다.
5. 대표하는결과
이전 연구에서, micropipette의 열망은 liposomes 5 일 또는 기판 2,11-13에 부착되지 않은 세포에서 중 수행되었다. 우리의 연구에서, 그러나, 세포는 일반적으로 세포가 14-16를 분리 할 때 발생할 가능성이있는 cytoskeletal 구조의 변화를 방지하기 위해 기판에 부착 유지됩니다. 기판에 연결된 셀에 대한 microaspiration 기술의 사용을 확인하기 위해, 우리는 예상과 같이,이 같은 이러한 접근 방식에 의해 추정 소 대동맥 내피 세포 (BAECs)의 세포 강성의 감소에 F-고를 결과의 장애가 발생했습니다. 그림 3 쇼 여부를 테스트 이 참 경우가 있습니다. 특히, 그림 3A는 micropipette를 통해 적용 부정적인 압력에 대응하여 점진적으로 변형을 겪고 내피 멤브레인의 형광 이미지의 전형적인 시리즈를 보여줍니다. 예상대로, 멤브레인은 점차 피펫과 aspirat에 흡입되어에드 길이는 적용 압력의 함수로 증가한다. F-고를의 중단이 크게 모든 압력 조건 (그림 3B) 14 세 미만 예측의 흡입 길이를 증가하는 변형 쇼의 시간 코스.
이 방법을 사용하여 우리는 콜레스테롤 강화가 더 효과가 14 없었다 반면에 세포 멤브레인은 콜레스테롤 고갈 될 때 세포 강성이 증가 발견했다. 그림 4에서 최대 흡인 길이에 도달 한 후 콜레스테롤 강화 셀, 제어 셀 및 콜레스테롤 고갈 세포를 보여줍니다 -15 mm HG (4A). 예측은 일반적으로-10mmHg에서 개발하기 시작하고 막 변형의 시간 코스는 -10, -15 및 -20 mm HG (4B)의 부정적인 압력에 대한 측정 될 수 있습니다. - 25mmHg 이상 압력의 적용은 별도의 소포를 형성 흡입 투영의 부대있었습니다. 막 분리의 결과 압력 수준은 simila했습니다다른 콜레스테롤 조건에서 연구. 이전 연구 막 지질 bilayers에 막 콜레스테롤의 증가는 막 5,17의 강성을 증가 것으로 나타났다 때문 관찰 매우 예기치했다. 우리 더 연구가 원자 힘 현미경 18,19 및 강제 견인 현미경 20 등 여러 가지 독립적 인 방법을 사용하여 이러한 관찰을 확인했다.
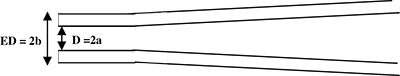
1 그림. 녹음 피펫의 개략적 인 측면보기는. 피펫은 팁 (사이드 뷰)에 원통형 칼을 생성하기 위해 당겨 있습니다. Micropipette 매개 변수 : D = 2A = 내부 직경 ED = 2B = 외부 직경.

그림 2. Micropipette은 기판에 연결된 셀을 접근 (A) 도식 쪽보기,. micropipette s의 (B) 밝은 명암 이미지행크는 흡인 실험에 사용되는 일반적으로 모양의 셀을 터치, DiIC 18라는 동일한 세포의 (C) 형광 이미지입니다. micropipette는 여전히 존재하지만, (14에서) 보이지 않는 것입니다.
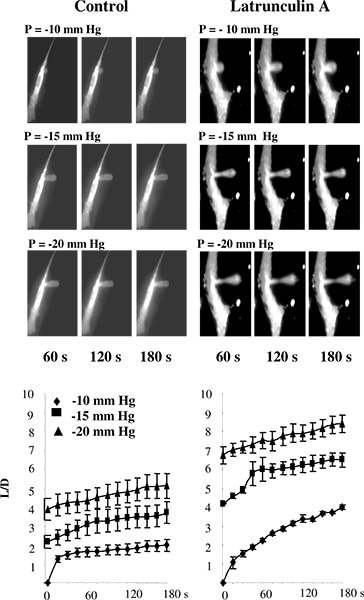
그림 3. microaspiration를 사용하여 기판에 연결된 셀에 셀 강성을 측정의 유효성을 검사. A : 제어 조건 및 latrunculin에 노출 후 BAECs의 진보적 인 막 변형의 이미지가 형광을하지 않기 때문에 피펫은 이미지에 보이지 않는 수 있습니다.. 세포는 같은 rhodamine-phalloidin 형광에 의해 측정 극적 F-고를의 양을 감소 10 분, (표시되지 않음)에 대해 2 μM latrunculin에 노출 된 셀 모양에 아무런 상당한 효과가 없습니다. latrunculin - 처리 셀에 흡입 투영의 중간에 막의 숱이 있지만 투영 여전히 C에 부착되는이있다ells. B. L은 막 투영 및 D의 길이를 흡입되어 막 변형의 시간 코스에 latrunculin의 효과는 제어 세포에 대한 피펫의 직경 (N = 14), 2 μM의 latrunculin에 노출 세포입니다 10 분에 (N = 5). 세포는 -10 mm HG (다이아몬드), -15 mm HG (광장) 및 -20 mm HG (삼각형)로 흡입했다. (14 일부터).
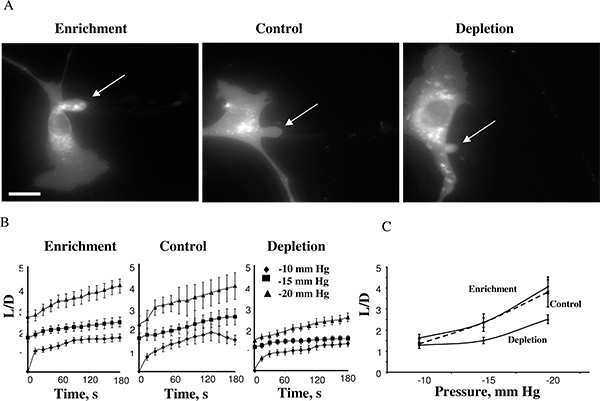
4 그림. BAECs의 막 변형에 대한 세포 콜레스테롤 수준의 효과. . 콜레스테롤 강화, 콜레스테롤 소모 및 제어 셀 (제어 세포의 막 변형의 전형적인 이미지는 MβCD에 노출 된 : 셀에서 무료 콜레스테롤의 수준에 아무런 영향을 미치지 않았다 1시 1분 비율 MβCD-콜레스테롤 혼합 (참조 ) 삽입. 표시된 이미지가 -15 mm HG에서 최대 변형을 도시한다. 화살표는 흡입 투영의 위치를 나타냅니다. 바는 30 μm이다. B는. 세 실험 세포 인구를위한 흡입 길이의 평균 시간 코스. C. 최대 흡입 길이는 적용 압력의 함수로 꾸몄다. 소진 셀의 최대 정규화 된 길이는 압력 -15 mm HG와 -20 mm HG (P <0.05)에 대한 제어 세포에 비해 훨씬 낮았다. (14 일부터).
토론
Microaspiration는 세포막에 제외 압력을 적용하고 잘 정의 된 압력에 대한 응답으로 막 deformability을 측정하여 세포 강성 / deformability을 추정 할 수있는 간단하고 높은 재현 방법을 제공합니다. 그것은 첫째 세포 분열 21 다음 적혈구 1 기계적 성질을 살펴 보의 메커니즘에 통찰력을 제공하기 위해 바다 성게 알의 탄성 속성을 특성화 Mitchison와 스완 (1954)에 의해 개발되었습니다. 이 방법...
공개
관심 없음 충돌이 선언 없습니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 / 모델 번호 | 코멘트 |
| 셔터 피펫 풀러 | 셔터 악기 | P-97 | |
| Microforge | Narishige | MF-830 | |
| 역 형광 현미경 | Zeiss | Axiovert 200M | 현미경은 바람직 3D/deconvolution 기능을 갖추고 있어야합니다. |
| Videocamera | Zeiss | AxioCam MRM | |
| 이미지 수집 sotware | Zeiss | AxioVision | |
| 공압 압력 변환기 | BioTek | DPM-1B | DPM1B 공압 변환기 테스터는 이제 우연으로 볼 수 있습니다. |
| 피펫 유리 | 리치 랜드 | 사용자 정의 유리 | 피펫은 1.2 내경 1.6 외경으로 정의했다. |
| DiI 염료 | Invitrogen | D282 | DMSO에 잘 녹여 |
참고문헌
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. I. Membrane stiffness and intracellular pressure. Biophys. J. 4, 115-135 (1964).
- Discher, D. E., Mohandas, N., Evans, E. A. Molecular maps of red cell deformation: hidden elasticity and in situ connectivity. Science. 266, 1032-1035 (1994).
- Schmid-Schönbein, G. W., Sung, K. L., Tözeren, H., Skalak, R., Chien, S. Passive mechanical properties of human leukocytes. Biophys. J. 36, 243-256 (1981).
- Guilak, F., Tedrow, J. R., Burgkart, R. Viscoelastic properties of the cell nucleus. Biochem. Biophys. Re.s Commun. 269, 781-786 (2000).
- Needham, D., Nunn, R. S. Elastic deformation and failure of lipid bilayer membranes containing cholesterol. Biophys. J. 58, 997-1009 (1990).
- Sato, M., Theret, D. P., Wheeler, L. T., Ohshima, N., Nerem, R. M. Application of the micropipette technique to the measurement of cultured porcine aortic endothelial cell viscoelastic properties. Journal of Biomechanical Engineering. 112, 263-268 (1990).
- Theret, D. P., Levesque, M. J., Sato, F., Nerem, R. M., Wheeler, L. T. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. J. of Biomechanical Engineering. 110, 190-199 (1988).
- Hochmuth, R. M. Micropipette aspiration of living cells. J. Biomech. 33, 15-22 (2000).
- Lim, C. T., Zhou, E. H., Quek, S. T. Mechanical models for living cells--a review. Journal of Biomechanics. 39, 195 (2006).
- Zhao, R., Wyss, K., Simmons, C. A. Comparison of analytical and inverse finite element approaches to estimate cell viscoelastic properties by micropipette aspiration. Journal of Biomechanics. 42, 2768 (2009).
- Chien, S., Sung, K. L., Skalak, R., Usami, S., Tozeren, A. Theoretical and experimental studies on viscoelastic properties of erythrocyte membrane. Biophys. J. 24, 463-487 (1978).
- Evans, E., Kuhan, B. Passive material behavior of granulocytes based on large deformation and recovery after deformation tests. Blood. 64, 1028-1035 (1984).
- Sato, M., Levesque, M. J., Nerem, R. M. Micropipette aspiration of cultured bovine aortic endothelial cells exposed to shear stress. Arteriosclerosis. 7, 276-286 (1987).
- Byfield, F., Aranda-Aspinoza, H., Romanenko, V. G., Rothblat, G. H., Levitan, I. Cholesterol depletion increases membrane stiffness of aortic endothelial cells. Biophys. J. 87, 3336-3343 (2004).
- Byfield, F. J., Hoffman, B. D., Romanenko, V. G., Fang, Y., Crocker, J. C., Levitan, I. Evidence for the role of cell stiffness in modulation of volume-regulated anion channels. Acta. Physiologica. 187, 285-294 (2006).
- Byfield, F. J., Reen, R. K., Shentu, T. -. P., Levitan, I., Gooch, K. J. Endothelial actin and cell stiffness is modulated by substrate stiffness in 2D and 3D. Journal of Biomechanics. 42, 1114 (2009).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. Journal of Physical Chemistry. 91, 4219-4228 (1987).
- Sun, M., Northup, N., Marga, F., Huber, T., Byfield, F. J., Levitan, I., Forgacs, G. The effect of cellular cholesterol on membrane-cytoskeleton adhesion. J. Cell. Sci. 120, 2223-2231 (2007).
- Shentu, T. P., Titushkin, I., Singh, D. K., Gooch, K. J., Subbaiah, P. V., Cho, M., Levitan, I. oxLDL-induced decrease in lipid order of membrane domains is inversely correlated with endothelial stiffness and network formation. Am. J. Physiol. Cell. Physiol. 299, 218-229 (2010).
- Norman, L. L., Oetama, R. J., Dembo, M., Byfield, F., Hammer, D. A., Levitan, I., Aranda-Espinoza, H. Modification of Cellular Cholesterol Content Affects Traction Force, Adhesion and Cell Spreading. Cell Mol. Bioeng. 3, 151-162 (2010).
- Mitchinson, J. M., Swann, M. M. The Mechanical Properties of the Cell Surface: I. The Cell Elastimeter. J. of Experimental Biology. 31, 443-460 (1954).
- Byfield, F. J., Tikku, S., Rothblat, G. H., Gooch, K. J., Levitan, I. OxLDL increases endothelial stiffness, force generation, and network formation. J. Lipid Res. 47, 715-723 (2006).
- Ohashi, T., Ishii, Y., Ishikawa, Y., Matsumoto, T., Sato, M. Experimental and numerical analyses of local mechanical properties measured by atomic force microscopy for sheared endothelial cells. Biomed. Mater. Eng. 12, 319-327 (2002).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453 (2007).
- Kowalsky, G. B., Byfield, F. J., Levitan, I. oxLDL facilitates flow-induced realignment of aortic endothelial cells. Am. J. Physiol. Cell. Physiol. 295, 332-340 (2008).
- Ketene, A. N., Schmelz, E. M., Roberts, P. C., Agah, M. The effects of cancer progression on the viscoelasticity of ovarian cell cytoskeleton structures. Nanomedicine: Nanotechnology, Biology and Medicine. , (2011).
- Kole, T. P., Tseng, Y., Huang, L., Katz, J. L., Wirtz, D. Rho kinase regulates the intracellular micromechanical response of adherent cells to rho activation. Mol. Biol. Cell. 15, 3475-3484 (2004).
- Hall, A. Rho GTPases and the Actin Cytoskeleton. Science. 279, 509-514 (1998).
- Okajima, T. Atomic Force Microscopy for the Examination of Single Cell Rheology. In. Methods Mol. Biol. 736, 303-329 (2011).
- Wang, N., Butler, J. P., Ingber, D. E. Mechanotransduction across the cell surface and through the cytoskeleton. Science. 260, 1124-1127 (1993).
- Fabry, B., Maksym, G. N., Butler, J. P., Glogauer, M., Navajas, D., Fredberg, J. J. Scaling the microrheology of living cells. Physical Review Letters. 87, 148102 (2001).
- Park, C. Y., Tambe, D., Alencar, A. M., Trepat, X., Zhou, E. H., Millet, E., Butler, J. P., Fredberg, J. J. Mapping the cytoskeletal prestress. American Journal of Physiology - Cell Physiology. 298, C1245-C1252 (2010).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophys. J. 80, 1744-1757 (2001).
- Wirtz, D. Particle-tracking microrheology of living cells: principles and applications. Annu. Rev. Biophys. 38, 301-326 (2009).
- Shin, D., Athanasiou, K. Cytoindentation for obtaining cell biomechanical properties. J. Orthop. Res. 17, 880-890 (1999).
- Ou-Yang, H. D., Wei, M. T. Complex fluids: probing mechanical properties of biological systems with optical tweezers. Annu. Rev. Phys. Chem. 61, 421-440 (2010).
- Hosu, B. G., Sun, M., Marga, F., Grandbois, M., Forgacs, G. Eukaryotic membrane tethers revisited using magnetic tweezers. Phys. Biol. 4, 67-78 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유