需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
基质贴壁细胞的微管吸吮的估计单元刚度
摘要
在这里,我们描述了一个快速和简单的方法来测量细胞的刚度。这种方法的一般原则是响应于施加到细胞表面通过微量吸移管的良好定义的负压来测量膜变形。这种方法提供了一个功能强大的工具,研究基板贴壁细胞的生物力学特性。
摘要
越来越多的研究表明,在多种细胞功能,包括细胞增殖,分化,迁移和细胞间的相互作用,单个细胞的生物力学性能中扮演重要角色。细胞生物力学的两个关键参数是细胞的变形能力,刚度和能力的细胞收缩,产生力量。在这里,我们描述了一种快速和简单的方法来估计细胞通过测量在由玻璃微到细胞表面,被称为微吸管或Microaspiration一种技术,响应于施加的负压的程度的膜变形的刚度。
通过拉动玻璃毛细管创建一个微量吸移管,用一个非常小的尖端(2-50微米直径的细胞或组织样本的大小取决于),然后将其连接到一个气动压力换能器,并带来了一个密切进行microaspiration周边的细胞在显微镜下观察。当的移液管的尖端接触的细胞,负压的工序,被施加到吸液管的充气产生良好定义的细胞膜上的压力的压力传感器。以响应于压力,膜被吸入到吸液管和渐进的的膜变形或进入吸移管被作为时间的函数的测量的“膜投影”。本实验的方法的基本原则是,响应于定义的机械力的膜的变形程度是一个函数的膜刚度。更硬的膜,膜变形和率越慢越短的稳态的抽吸length.The技术可以执行分离的细胞,无论是在悬浮液和基板连接,大的细胞器,和脂质体。
进行分析,通过比较不同的细胞群或实验条件下,一个给定的压力下实现最大的膜的变形。 A“刚性系数”是EStimated通过绘制送气膜变形长度作为所施加的压力的函数。此外,可以进一步分析数据来估计细胞的杨氏模量(E),最常见的参数来表征的材料的刚度。重要的是要注意,可以被看作是真核细胞的质膜,其中深层次的由子膜细胞骨架,它是细胞骨架构成的膜的机械支架,占主导地位的可变形膜的脂质双层的双组分系统的蜂窝的信封。这种做法,因此,可以探测子膜细胞骨架的生物力学特性。
研究方案
1。拉玻璃微
设备::微管拔轮器,Microforge。
玻璃:Boroscillicate玻璃毛细管(〜1.5毫米的外部直径,〜1.4毫米的内直径)。
- 微量被拉到使用相同的基本方法,是用于制备玻璃微电极电生理录音。简要地说,在中间加热的玻璃毛细管,和当玻璃开始熔融时的两个半体的毛细管被拉开产生两个微量。多个商业的车夫是可以执行此过程,从相对简单的垂直拉拔器,利用重力拉两个移液器除了高尖端水平的车夫,提供多种可编程选项,以不同的速度和其他参数的拉。在我们的实验中使用这两种类型的拉制机。
- 需求s的移液管尖端部的几何形状:在这些实验中所使用的移液管的尖端测量范围通常为2至6微米的外径,根据细胞的大小。另一个重要参数是的前端的形状,应近似为圆筒形管(参见图1)。这可以通过以下来实现优化的参数的拉动和验证在显微镜下的前端的形状,直到获得所需的形状。吸移管柄的最佳长度取决于预期的变形的量:如果变形小<10微米,它是足够的移液管的圆筒状的部分也相对短的(相同的量级),对于较大的变形进行相应的调整。在一般情况下,在“拉”增加的热和/或增加,减小的直径的前端。在“拉”的增加还生成具有更长的锥形的前端。在我们的实验中,使用一个萨特P-97的水平吸管车夫,该方案优化,以下列参数:473热拉22,速度22,时间200,压力500。另外,也可以创建圆柱形提示通过拉动一个很长的柄和然后打破和抛光。在萨特手册中给出的详细说明如何准备不同类型的移液管。
- microforge:此外,还建议火抛光到质膜,使一个很好的密封,以产生平滑的玻璃表面的吸移管的前端。这是通过为一个非常的一小部分的第二使用microforge带来的移液管的前端的附近的一个加热的玻璃球。类似的技术经常用于制作微电极电生理记录。
- 填充微管 :移液器应该充满生理盐水溶液,如PBS或非荧光的生长介质。重要的是,溶液中应补充30%的血清,将允许细胞MEM膜上移动顺利地进入吸液管。两种方法摆脱气泡的移液管的前端,可以使用:(ⅰ)的移液管的尖端可以浸渍在溶液中首先让液体接着回填吸移管由毛细作用力填补的小费从另一端,或(ii)可填充整个移液器从后端通过轻轻拍打从前端的移液管上的柄部,以除去气泡。
- 注 :移液器必须准备好一天的实验。
2。制备细胞
- 接种细胞 :Microaspiration被保持在悬浮液中,或附着到基板上进行单细胞。为了吸出悬浮液中的细胞,细胞被提升从它们的基板,并吸移到一个浅的纵向腔室,其安装在实验之前,在倒置显微镜。吸基板贴壁细胞,细胞被接种于小的覆盖片(〜10毫米直径),也可以放在实验前到microaspiration室。使用一个浅的纵向腔室的基本原理是允许微量接近在一个非常浅的角度,尽可能接近水平的细胞。这样做是为了使被拉入的微量吸移管被可视化的单一平面上的焦点(参见图2)的膜。
- 可视化细胞膜 :观察到移液管的膜突起,细胞膜染色与一种亲脂性的荧光染料,如DII使用一个标准的染色协议。
- 暖的PBS的解决方案。
- 股票DII稀释到工作浓度(5μM)与加温的PBS溶液。
- 超声波清洗5分钟,破坏染料的聚集。
- 旋转5分钟,取上清液。
- 洗涤细胞,在PBS中3次,每次5分钟。
- 孵育细胞与染料,使lution在37℃培养箱中培养30分钟。
- 洗涤细胞,用PBS 3次各5分钟。
- 注:这是可以替代可视化也被拉到一起进入移液管与膜的子膜细胞骨架的膜的DII染色。它需要被考虑到的帐户,但是,干扰细胞骨架可能改变的细胞的生物力学特性。此外,当执行microaspiration与基板附着的细胞的实验时,建议使用3D成像技术来估计膜突起的长度被定位在的细胞的焦平面成一角度进入移液管。
3。 Microaspiration和图像采集
设备:倒置荧光显微镜,最好用的3D的反卷积能力(有电脑控制Z轴运动的目标的蔡司Axiovert 200MES或同等学历);视讯摄影机连接到一台计算机(AxioCam MRM或同等学历),压力传感器(BIOTEK或同等学历),无振动台(TMD或同等),微操作机器人(成茂,萨特,伯利或同等学历;操纵可以是机械的,液压的或压电)。同样重要的是可以进行强调microaspiration的使用没有3D功能的显微镜,在悬浮液中的细胞,如红血细胞的1,2或嗜中性粒细胞3,孤立的细胞器,如核4或人工脂质体5来估计的刚度。
图像采集软件:蔡司AxioVision或等效的。
- 挂载细胞成microaspiration室中,如上所述,在倒置荧光显微镜上。的位置选择一个单元格的单元格的一个实验,并把它的视场的中心。这是非常重要的射孔RM这些实验中无振动的环境中,特别是与基板贴壁细胞的实验,因为有可能完全破坏创作的印章,打破微吸管尖端或导致微小的振动,通常会出现的长凳上和常规表显着变化中的位置的提示,将歪斜的分析结果。
- 放置一个微量吸移管与PBS /媒体瓦特/血清溶液填充到吸移管支架与直径调整到的吸液管保持紧配合连接器,通过柔性管连接到电源变换器。在每次实验开始的移液管中的压力平衡到大气压。吸液管被安装在一台显微操作,能够很好地控制在微米范围内的吸液管的运动。用移液管定位在该室的底部的一个浅的角度和带来的移液管的尖端的视场的中心。钍Ê柄部的移液管,被吸入到其中的膜的移液管尖的圆柱形部分,是水平对齐到焦平面的,由(1)定位在最浅的角度可能的(10-15℃)的吸移管,及(2)由在腔室的底部的吸移管对弯曲柄。由于柄是非常薄的,它具有足够的灵活性,该室的底部上,而滑动接近细胞,如在图1中示意性地示出。慢慢降低的微量吸移管的使用过程中操纵直至接近焦点的单元格的平面侧的一个单一的细胞。然后,使用细的操纵器移动到小区边缘的微量吸移管,直到前端的移液管轻轻触摸膜。以一个图像观察的移液管的位置。良好的密封创建整个前端的移液管时,是在细胞表面的充分接触的接触是稳定的。没有强大的客观的标准,但是,良好的密封EXCEPT的视觉检查。
- 应用步骤,使用的换能器的负压,并保持它,直到膜突起稳定。进入移液管吸出膜所需要的压力而变化,这取决于细胞的类型和特定的实验条件下。在我们的实验中,初始变形通常是施加压力时,在-2至-15mm的汞柱之间的范围内观察到。当施加压力时,该膜逐渐进入移液管变形,直到它被稳定在一定的长度,一个过程,通常需要2-3分钟。在这段时间内,膜的变形的图像获取每30秒跟踪被拉入到吸移管的膜的进展。
- 增加的压力在2-5毫米汞柱的步骤到下一级,重复整个过程,直到膜突起分离从细胞和进入吸移管,在该点停止实验。
要量化的程度的膜变形,测量抽吸的长度(L)从吸移管的前端到顶点的膜突起的外周。重要的是要注意,但是,更大范围内的吸移管将在细胞膜上施加更大的力,在相同的压力水平。为了解释的移液管的直径之间的可变性,因此,抽吸长度被归为吸液管直径(D)测定每个实验。
这些数据可以被进一步的分析,使用了一个标准的线性粘弹性的半空间模型的血管内皮细胞中,如中描述的早期的研究6,7。具体而言,细胞的弹性模量的估计,使用公式:
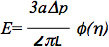
其中 ,E是杨氏模量,a是内吸移管的半径,Δp为压力差,L是相应的送气长度,φ(η)是功能计算使用的力的模型,如由Theret 等 7所述的壁。重要的是要注意,多个模型已被用于分析microaspiration数据包括一个有限元模型,假定与各向同性和同质的材料属性和液滴模型,假设细胞形成一个球状的细胞是一个变形的球体,可以不断变形,并恢复释放后,如在一些优秀的评论:8-10。 microaspiration也可以被用于研究的细胞和组织,如细胞的粘弹性性质,细胞和组织生物力学(请参阅上面列出有关详细信息,评论)皮质张力和不同的结构元素的贡献的其他生物力学参数。
5。代表结果
在早期的研究中,微吸管进行第5脂质体或细胞不连接到基板2,11 ~~ 13。然而,在我们的研究中,细胞通常是保持了附着在基板上,以避免在细胞骨架结构的变化,有可能发生时,细胞分离14-16。为了验证使用microaspiration技术基板附着的细胞中,我们测试是否中断,F-肌动蛋白的查询结果在细胞牛主动脉内皮细胞(BAECs),用这样的方法估计的刚度下降。 图3示出的是,如预期,这是真实的情况。具体而言, 图3A示出的一系列典型的渐进变形经历响应于施加负压通过微量内皮膜的荧光图像。正如预期的那样,将膜逐渐成移液器和aspirat的吸气编长度随着施加的压力的函数。变形表明,F-肌动蛋白的破坏显着增加了送气所有压力条件下( 图3B)14下的突起长度的时间课程。
使用这种方法,我们发现,细胞的刚度增加,当细胞膜被耗尽的胆固醇,而胆固醇富集有没有影响14。后达到最大抽吸长度在图4示出了富含胆固醇的细胞,一个控制单元,和胆固醇耗尽细胞-15毫米汞柱(4A)。突起通常在-10mmHg的开始发展,-10,-15和-20毫米汞柱(4B)的负压力,可以测量的膜变形的时间课程。 -25mmHg以上的压力中的应用导致脱离抽吸凸起,形成一个单独的囊泡。压力水平,导致膜脱离similaR下不同的胆固醇条件。这个观察是非常意外的,因为以前的研究表明,在膜的脂质双层膜胆固醇增加膜5,17的刚度增加。我们进一步的研究证实了这些意见,使用多个独立的方法,包括原子力显微镜18,19和力量牵引显微镜20。
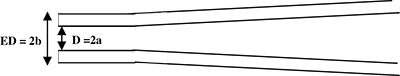
图1。的记录移液管的示意性侧视图。移液器被拉至生成的圆筒状的柄部的前端(侧视图)。微管参数:D = 2A =内部直径和ED = 2B =外部直径。

图2。微管接近基板连接的细胞。原理图侧视图(A),(B)鲜明的对比图像的微管小号绞纱触摸抽吸实验中使用的一个典型的形电池(C)的荧光图像的介质隔离集成电路18相同的细胞标记。微管仍然存在,但,是无形(14日 )。
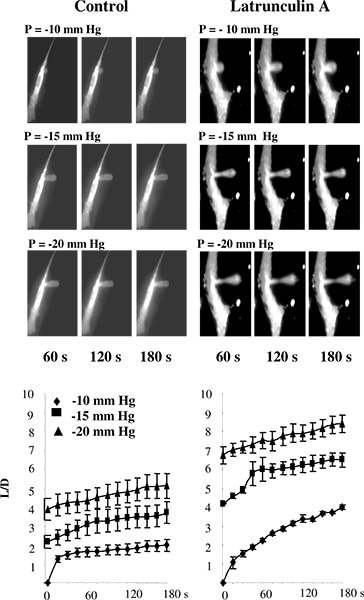
图3。验证测量细胞在基板贴壁细胞microaspiration刚度。答 :渐进膜变形的牛主动脉内皮细胞在控制条件下,后暴 露latrunculin图像的移液管上的图像是不可见的,因为它不发出荧光。将细胞暴露到2的μMlatrunculin甲10分钟,其中F-肌动蛋白的量显着降低,如由若丹明鬼笔环肽荧光测量(图中未示出),但并无显着影响细胞的形状。在一个latrunculin-处理的细胞中,有一个抽吸凸起的中间膜变薄,但突起仍连接到c英语学习者B。膜的变形,其中,L是吸气膜突起和D的长度的时间课程的影响latrunculin甲阿10分钟的移液管的直径用于控制细胞组(n = 14)和细胞暴露到2μMlatrunculin的组(n = 5)。 将细胞吸出-10毫米汞柱(菱形),-15毫米汞柱(正方形)和-20毫米汞柱(三角形)。 (14日 )。
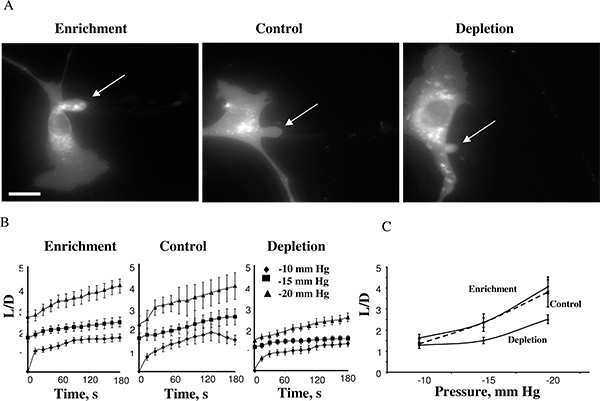
图4。影响膜变形的牛主动脉内皮细胞的细胞内胆固醇的水平上。富含胆固醇,胆固醇贫和对照细胞(对照细胞的膜变形。典型图像暴露MβCD:的MβCD胆固醇混合物以1:1的比例,有在细胞内游离胆固醇的水平没有影响(见插图)。所示的图像描绘在-15毫米汞柱的最大变形。箭头表示的位置的送气投影。酒吧是30微米。B。吸气的长度为三个实验的细胞群的平均时间课程。C。极大送气长度作为所施加的压力的函数绘制的。耗尽的电池的最大归一化的长度显着低于压力-15毫米汞柱和-20毫米汞柱(P <0.05)对照组细胞。 (14日 )。
讨论
microaspiration提供了一种简单和高重现性的方法来估计细胞的刚度/可变形性,通过施加负压力至细胞膜和测量细胞膜变形响应于良好定义的压力。它最早是由Mitchison和斯旺(1954年)的海胆卵的弹性性能特征的精辟见解的机制,细胞分裂21,然后看在红血细胞的机械性能。这种方法已被用于多项研究评估的生物力学特性不同的细胞类型( 如 2,3,12,13)。我们最近的研究扩展了?...
披露声明
没有利益冲突的声明。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 产品/型号 | 评论 |
| 萨特吸管拉马 | 萨特仪器 | P-97 | |
| Microforge | 成重 | MF-830 | |
| 倒置荧光显微镜 | 蔡司 | Axiovert 200M | 该显微镜应优选配备3D/deconvolution能力。 |
| 视讯摄影机 | 蔡司 | AxioCam MRM | |
| 图像采集sotware | 蔡司 | AxioVision | |
| 气动压力传感器 | 百特 | DPM-1B | 现在可以DPM1B气压传感器测试仪FLUKE。 |
| 用移液管玻璃 | 丽晶 | 定制玻璃 | 移液器定制的1.2内径1.6外径。 |
| DiI荧光染料 | Invitrogen公司 | D282 | 溶解在DMSO |
参考文献
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. I. Membrane stiffness and intracellular pressure. Biophys. J. 4, 115-135 (1964).
- Discher, D. E., Mohandas, N., Evans, E. A. Molecular maps of red cell deformation: hidden elasticity and in situ connectivity. Science. 266, 1032-1035 (1994).
- Schmid-Schönbein, G. W., Sung, K. L., Tözeren, H., Skalak, R., Chien, S. Passive mechanical properties of human leukocytes. Biophys. J. 36, 243-256 (1981).
- Guilak, F., Tedrow, J. R., Burgkart, R. Viscoelastic properties of the cell nucleus. Biochem. Biophys. Re.s Commun. 269, 781-786 (2000).
- Needham, D., Nunn, R. S. Elastic deformation and failure of lipid bilayer membranes containing cholesterol. Biophys. J. 58, 997-1009 (1990).
- Sato, M., Theret, D. P., Wheeler, L. T., Ohshima, N., Nerem, R. M. Application of the micropipette technique to the measurement of cultured porcine aortic endothelial cell viscoelastic properties. Journal of Biomechanical Engineering. 112, 263-268 (1990).
- Theret, D. P., Levesque, M. J., Sato, F., Nerem, R. M., Wheeler, L. T. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. J. of Biomechanical Engineering. 110, 190-199 (1988).
- Hochmuth, R. M. Micropipette aspiration of living cells. J. Biomech. 33, 15-22 (2000).
- Lim, C. T., Zhou, E. H., Quek, S. T. Mechanical models for living cells--a review. Journal of Biomechanics. 39, 195 (2006).
- Zhao, R., Wyss, K., Simmons, C. A. Comparison of analytical and inverse finite element approaches to estimate cell viscoelastic properties by micropipette aspiration. Journal of Biomechanics. 42, 2768 (2009).
- Chien, S., Sung, K. L., Skalak, R., Usami, S., Tozeren, A. Theoretical and experimental studies on viscoelastic properties of erythrocyte membrane. Biophys. J. 24, 463-487 (1978).
- Evans, E., Kuhan, B. Passive material behavior of granulocytes based on large deformation and recovery after deformation tests. Blood. 64, 1028-1035 (1984).
- Sato, M., Levesque, M. J., Nerem, R. M. Micropipette aspiration of cultured bovine aortic endothelial cells exposed to shear stress. Arteriosclerosis. 7, 276-286 (1987).
- Byfield, F., Aranda-Aspinoza, H., Romanenko, V. G., Rothblat, G. H., Levitan, I. Cholesterol depletion increases membrane stiffness of aortic endothelial cells. Biophys. J. 87, 3336-3343 (2004).
- Byfield, F. J., Hoffman, B. D., Romanenko, V. G., Fang, Y., Crocker, J. C., Levitan, I. Evidence for the role of cell stiffness in modulation of volume-regulated anion channels. Acta. Physiologica. 187, 285-294 (2006).
- Byfield, F. J., Reen, R. K., Shentu, T. -. P., Levitan, I., Gooch, K. J. Endothelial actin and cell stiffness is modulated by substrate stiffness in 2D and 3D. Journal of Biomechanics. 42, 1114 (2009).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. Journal of Physical Chemistry. 91, 4219-4228 (1987).
- Sun, M., Northup, N., Marga, F., Huber, T., Byfield, F. J., Levitan, I., Forgacs, G. The effect of cellular cholesterol on membrane-cytoskeleton adhesion. J. Cell. Sci. 120, 2223-2231 (2007).
- Shentu, T. P., Titushkin, I., Singh, D. K., Gooch, K. J., Subbaiah, P. V., Cho, M., Levitan, I. oxLDL-induced decrease in lipid order of membrane domains is inversely correlated with endothelial stiffness and network formation. Am. J. Physiol. Cell. Physiol. 299, 218-229 (2010).
- Norman, L. L., Oetama, R. J., Dembo, M., Byfield, F., Hammer, D. A., Levitan, I., Aranda-Espinoza, H. Modification of Cellular Cholesterol Content Affects Traction Force, Adhesion and Cell Spreading. Cell Mol. Bioeng. 3, 151-162 (2010).
- Mitchinson, J. M., Swann, M. M. The Mechanical Properties of the Cell Surface: I. The Cell Elastimeter. J. of Experimental Biology. 31, 443-460 (1954).
- Byfield, F. J., Tikku, S., Rothblat, G. H., Gooch, K. J., Levitan, I. OxLDL increases endothelial stiffness, force generation, and network formation. J. Lipid Res. 47, 715-723 (2006).
- Ohashi, T., Ishii, Y., Ishikawa, Y., Matsumoto, T., Sato, M. Experimental and numerical analyses of local mechanical properties measured by atomic force microscopy for sheared endothelial cells. Biomed. Mater. Eng. 12, 319-327 (2002).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453 (2007).
- Kowalsky, G. B., Byfield, F. J., Levitan, I. oxLDL facilitates flow-induced realignment of aortic endothelial cells. Am. J. Physiol. Cell. Physiol. 295, 332-340 (2008).
- Ketene, A. N., Schmelz, E. M., Roberts, P. C., Agah, M. The effects of cancer progression on the viscoelasticity of ovarian cell cytoskeleton structures. Nanomedicine: Nanotechnology, Biology and Medicine. , (2011).
- Kole, T. P., Tseng, Y., Huang, L., Katz, J. L., Wirtz, D. Rho kinase regulates the intracellular micromechanical response of adherent cells to rho activation. Mol. Biol. Cell. 15, 3475-3484 (2004).
- Hall, A. Rho GTPases and the Actin Cytoskeleton. Science. 279, 509-514 (1998).
- Okajima, T. Atomic Force Microscopy for the Examination of Single Cell Rheology. In. Methods Mol. Biol. 736, 303-329 (2011).
- Wang, N., Butler, J. P., Ingber, D. E. Mechanotransduction across the cell surface and through the cytoskeleton. Science. 260, 1124-1127 (1993).
- Fabry, B., Maksym, G. N., Butler, J. P., Glogauer, M., Navajas, D., Fredberg, J. J. Scaling the microrheology of living cells. Physical Review Letters. 87, 148102 (2001).
- Park, C. Y., Tambe, D., Alencar, A. M., Trepat, X., Zhou, E. H., Millet, E., Butler, J. P., Fredberg, J. J. Mapping the cytoskeletal prestress. American Journal of Physiology - Cell Physiology. 298, C1245-C1252 (2010).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophys. J. 80, 1744-1757 (2001).
- Wirtz, D. Particle-tracking microrheology of living cells: principles and applications. Annu. Rev. Biophys. 38, 301-326 (2009).
- Shin, D., Athanasiou, K. Cytoindentation for obtaining cell biomechanical properties. J. Orthop. Res. 17, 880-890 (1999).
- Ou-Yang, H. D., Wei, M. T. Complex fluids: probing mechanical properties of biological systems with optical tweezers. Annu. Rev. Phys. Chem. 61, 421-440 (2010).
- Hosu, B. G., Sun, M., Marga, F., Grandbois, M., Forgacs, G. Eukaryotic membrane tethers revisited using magnetic tweezers. Phys. Biol. 4, 67-78 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。