Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Substrat bağlı Hücrelerinin Mikropipet Aspirasyon Hücre Rijitlik tahmin etmek
Özet
İşte biz cep sertliği ölçmek için hızlı ve basit bir yöntem sunduk. Bu yaklaşımın genel prensip hücre yüzeyine bir mikropipet yoluyla uygulanan iyi tanımlanmış bir negatif basınca tepki olarak zar deformasyon ölçmektir. Bu yöntem substrat bağlı hücrelerin biyomekanik özelliklerini incelemek için güçlü bir araç sağlar.
Özet
Çalışmalar artan sayıda bireysel hücrelerin biyomekanik özellikleri hücre proliferasyonu, farklılaşması, göç ve hücre-hücre etkileşimleri dahil çoklu hücresel fonksiyonları, önemli rol oynadığını göstermektedir. Hücresel biyomekanik iki anahtar parametreler hücresel şekil değiştirebilirlik veya sertlik ve güç kasılıp oluşturmak için hücrelerinin yeteneği vardır. Burada hücre yüzeyine bir cam mikropipet, Mikropipet Aspirasyon veya Microaspiration denir bir teknikle uygulanan negatif basınç yanıt olarak membran deformasyon derecesini ölçerek hücreye sertlik tahmin etmek için hızlı ve basit bir yöntem sunduk.
Microaspiration sonra bir pnömatik basınç transdüktörüne bağlı ve bir yakın getirilir çok küçük bir uç (bir hücre ya da bir doku örneği boyutuna bağlı olarak, 2-50 mikron çap) ile bir mikropipet oluşturmak için kılcal bir cam çekerek gerçekleştirilir mikroskop altında bir hücre civarı. Nepipet ucu pnömatik basınç transdüseri hücre zarı üzerinde iyi tanımlanmış bir basınç oluşturarak pipet tatbik edilen bir hücre, bir negatif basınç adım dokunur. Basınç yanıt olarak, zar, pipet ve ilerici zar deformasyon ya da pipet zamanın bir fonksiyonu olarak ölçülür içine "membran projeksiyon" aspire edilir. Bu deneysel yaklaşım oluşturmanın temel ilkesi, bir tanımlanmış mekanik kuvvete yanıt olarak zar deformasyon derecesi zar sertliğinin bir fonksiyonu olmasıdır. Katı membran yavaş membran deformasyon oranı ve kısa kararlı durum aspirasyon length.The tekniği süspansiyon ve substrat bağlı, büyük organeller hem izole edilmiş hücreler üzerinde de yapılabilir ve lipozomlar vardır.
Analiz farklı hücre popülasyonu veya deneysel koşulları için belirli bir basınç altında gerçekleştirilen azami membran deformasyonlar karşılaştırılarak gerçekleştirilir. Bir "katılık katsayısı" es olduğunuuygulanan basıncın bir işlevi olarak zar deformasyon uzunluğunu aspire çizim ile tahmin edilir. Dahası, veriler ayrıca hücrelerin en Young modülü (E), malzemenin sertliği karakterize etmek için, en yaygın parametre tahmin için analiz edilebilir. Bu ökaryotik hücrelerin plazma membranları membran lipid bilayeri alt membran hücre iskeleti tarafından ve membranın mekanik iskele oluşturan iskeleti ve deformabilitesi hakim olduğunu underlied bir iki bileşenli bir sistem olarak görülebilir dikkat etmek önemlidir hücresel Zarfın. Bu yaklaşım, bu nedenle, alt-zar iskelet biyomekanik özelliklerini tarama izin verir.
Protokol
1. Cam Mikropipetler Çekme
Ekipman: Mikropipet Çektirme, Microforge.
Cam: Boroscillicate cam kapilerleri (~ 1.5 mm dış çapı, ~ 1.4 mm iç çapı).
- Mikropipetler elektrofizyolojik kayıtları için cam mikroelektrot hazırlamak için kullanılan aynı temel yaklaşımı kullanılarak çekilir. Kısaca, bir kılcal cam orta ısıtılır ve cam erime başladığında kılcal iki yarısı ayrı iki mikropipetler üreten çekilir. Birden ticari Elcikler çekme hızı ve diğer parametreleri değiştirmek için birden fazla programlanabilir seçenekleri sunmak son derece sofistike yatay Elcikler için iki pipetler uzaklaşmayı yerçekimi kullanımı nispeten basit dikey Elcikler kadar bu işlemi gerçekleştirmek için kullanılabilir. Çekiciler Her iki tip deneylerde kullanılan edildi.
- Gerekliliks pipet ucu geometri için: Bu deneylerde kullanılan pipet uçları tipik olarak 6-2 um arasında hücre boyutuna bağlı olarak, dış çap arasında değişir. Başka bir önemli parametre, uç şekli olan gereken yaklaşık olarak silindirik bir tüp (bkz. Şekil 1). Bu çekme parametrelerini optimize etmek ve istenen şekli elde edilene kadar mikroskop altında ucunun şeklini kontrol edilmesiyle elde edilebilir. Pipet gövdesinin optimum uzunluğu beklenen deformasyon miktarına bağlıdır: deformasyonların küçük <10 um olup, bu pipet silindir benzeri parça kısa (büyüklükte aynı sıra), daha büyük için de göreceli olduğu yeterlidir deformasyonlar buna göre ayarlayın. Genel olarak, "çekme" olarak ısı arttırır ve / veya artan uç çapı azalır. "Çekme" artış da daha uzun bir konik bir ipucu oluşturur. Deneylerde, bir Sutter P-97 yatay pipet çektirmenin kullanarak, programı oldu; Çekme 22; Velocity 22 Saat 200; Basıncı 500 473 Isı: Aşağıdaki parametreleri optimize. Bu çok uzun bir sap çekilmesi ve daha sonra kırma ve parlatma ile silindirik ipuçları oluşturmak da mümkündür. Pipetler farklı hazırlamak için nasıl ayrıntılı talimatlar Sutter manuel olarak verilmektedir.
- Microforge: Aynı zamanda, plazma zarının iyi bir sızdırmazlık sağlayan bir düz cam yüzey oluşturmak için pipet ucu yangın-parlatmak için tavsiye edilir. Bu, bir microforge kullanılarak bir ikinci bir çok bir kısmı için bir ısıtılmış cam bilye ve çevresinde pipet ucuyla getirilmesi ile yapılır. Benzer teknik rutin elektrofizyolojik kayıtları için mikroelektrot hazırlamak için kullanılır.
- Mikropipet doldurulması: mikropipetler böyle PBS veya floresan olmayan büyüme ortamı olarak bir fizyolojik tuzlu su çözeltisi ile doldurulur. Önemli bir çözelti hücre mem izin verecek% 30 serum ilave edilmelidirpipeti içine düzgün hareket etmek Brane. Iki yaklaşım pipet ucu içinde hava kabarcıkları kurtulmak için kullanılabilir: (i) bir pipet ucu sıvı pipet dolgu ardından kılcal güçler yoluyla uç doldurmak için izin vermek için birinci solüsyon içinde daldırılarak diğer ucundan da (ii) bütün pipet yavaşça ucundan kabarcıklarını çıkarmak için pipet sap dokunarak arka ucundan doldurulabilir.
- Not: Pipetler deney gününde hazırlanması gerekmektedir.
2. Hücre Hazırlanması
- Tohum hücreleri: Microaspiration ya da süspansiyon içinde muhafaza edilir ya da alt tabakaya bağlı olan tek bir hücre üzerinde gerçekleştirilir. Süspansiyon hücreleri aspire etmek, hücre, kendi substratları kaldırdı ve sağ deneyden önce inverted mikroskop üzerine monte edilir sığ bir uzunlamasına odasına pipetlenir. Alt tabaka tutturulmuş hücreler, hücre aspireküçük bir kapak-slip numaralı seribaşı da deneyden önce microaspiration odasına yerleştirilebilir (çapı ~ 10 mm). Sığ bir boyuna bölme kullanmak için gerekçe mikropipet mümkün olduğunca yatay olarak yakın bir çok sığ açıyla hücreleri yaklaşım sağlamaktır. Bu (bkz. Şekil 2) odak tek bir düzlem üzerinde görselleştirildiği gibi mikropipet içine çekilir zar izin vermek için yapılır.
- Hücre zarı Görselleştirme: pipet içine membran projeksiyon gözlemlemek için, hücre zarının bir standart boyama protokolü kullanarak böyle Dii gibi bir lipofilik floresan boya ile boyanmış.
- Sıcak PBS çözeltisi.
- Ilık PBS solüsyonu ile bir çalışma konsantrasyonu (5 mcM) için stok Dii seyreltin.
- Boya agrega kırmaya 5 dakika sonikasyon.
- 5 dakika aşağı spin ve süpernatant alır.
- PBS 3 kez, her biri 5 dakika içinde hücreleri yıkayın.
- Böylece boya sahip hücreler inkübebir 37 ° C kuluçka makinesi içinde 30 dakika için geçirdikleri evrim.
- 5 dakika her PBS 3 kez hücreleri yıkayın.
- Not: Bu da pipet içine zar ile birlikte çekilmektedir alt zar, hücre iskeleti görüntülenmesi ile membran arasında uçucu, boyama ikame etmek mümkündür. Bu, hücre iskeleti dalgalanmayla hücrenin biyomekanik özelliklerini değiştirebilir ki, göz önüne alınması gerekmektedir. Ayrıca, alt tabaka tutturulmuş hücreler ile microaspiration deneyler, bu hücrelerin odak düzlemi ile bir açı ile konumlandırılmış pipet içine çıkıntı zar uzunluğu tahmin etmek için 3 boyutlu görüntüleme kullanılması tavsiye edilir.
3. Microaspiration ve Image Acquisition
Ekipman: Ters Floresan Mikroskop, tercihen 3D Dekonvolüsyonun yetenekleri (objectiv bilgisayar kontrollü Z ekseni hareketi ile Zeiss Axiovert 200Mes veya eşdeğeri); manipülatörler, bir bilgisayar (AxioCam MRM veya eşdeğeri), Basınç Transducer (Biotek veya eşdeğeri), Titreşimsiz istasyonu (TMD veya eşdeğeri), Mikromanipülatör (Narishige, Sutter, Burleigh veya eşdeğer bağlı video kamera ), mekanik, hidrolik veya piezoelektrik olabilir. O microaspiration, kırmızı kan hücreleri 1,2 veya nötrofiller 3 gibi çekirdekler 4 veya yapay lipozomlar 5 olarak izole organelleri gibi süspansiyon hücrelerinin sertliği, tahmin etmek 3D yetenekleri olmayan bir mikroskop kullanılarak yapılabilir vurgulanması da önemlidir.
Image Acquisition yazılımı: Zeiss AxioVision veya eşdeğer.
- Yukarıda tarif edildiği gibi bir ters flüoresan mikroskop üzerinde, bir microaspiration odasına hücreleri monte edin. Bir deney için bir hücreyi seçerek hücreleri konumlandırın ve görme alanının merkezinde yerleştirin. Bu perfo önemlidirözellikle substrat bağlı hücreleri ile deneyler için titreşimsiz ortamda rm Bu deneylerde, tipik banklar ve normal tablolar üzerinde meydana dakikalık titreşimler tamamen mühür oluşturulması tehlikeye içinde mikropipet veya sonucun ucu kırmak için muhtemeldir, çünkü Sonuçların analizi olacak eğriltme ucunun konumunu önemli kaymalar.
- Sıkı bir uyum için pipet tutucu bağlayıcı ayarlanmış çapa sahip esnek boru vasıtası ile bir güç dönüştürücüye bağlı bir pipet tutucu içine PBS / medya w / serum çözeltisi ile doldurulmuş bir mikropipet yerleştirin. Her denemenin başında pipet içindeki basınç atmosfer basıncına dengelenmiş olduğunu. Pipet mikron aralığında bir pipet hareketlerinin kontrol sağlar bir micromanipulator üzerine monte edilir. Odasının altına sığ bir açıda bir pipet yerleştirin ve görme alanı merkeze pipet ucu getirmek. Thpipet e sap, zar aspire edilir içine pipet ucu bir silindirik kısmı, olası en sığ açı (10-15 °) (1) konumlandırma pipet ile ve (2) odak düzlemi yatay olarak hizalanmıştır odasının alt karşı pipet sap esnemektedir. Sap çok ince olduğu için Şekil 1 'de şematik olarak gösterildiği gibi, bir hücre yaklaşırken odasının alt kayma için yeterince esnektir. Yavaşça hücre için odak düzlemi yakınında kadar derse manipülatör kullanılarak tek bir hücrenin yan mikropipet getir. Pipet ucu hafifçe membran temas edene kadar sonra, ince bir manipülatör kullanılarak hücre kenarına mikropipet hareket eder. Pipet yerini incelemek için bir imge al. Pipet ucu bütün hücre yüzeyi ile tam temas etmesini ve temas kararlı olduğu zaman iyi sızdırmazlık oluşturulur. Güçlü bir nesnel ölçüt mühür exc ne kadar iyi olduğunu, ancak varGörsel inceleme için EPT.
- Transdüser kullanılarak negatif basınç bir adım uygulayın ve membran projeksiyon stabilize oluncaya kadar onu korumak. Pipet içine zar aspire için gerekli basınç miktarı hücre tipine ve özel deneysel koşullara bağlı olarak değişir. -2-15mm Hg aralığında basınç uygulayarak zaman bizim deneylerde, ilk deformasyon genellikle gözlenmektedir. Bu belirli bir uzunluk, genellikle 2-3 dakika sürer bir işlem de stabilize oluncaya kadar basınç uygulandığı zaman, kademeli olarak zar pipet içine deforme olur. Bu süre zarfında, membran deformasyon görüntüleri pipeti içine çekilir membran ilerlemesini izlemek için her 30 sn elde edilir.
- 2-5 mm Hg adımlarla sonraki seviyeye basıncını arttırın ve membran projeksiyon deneme durduğu noktada pipet içine hücre ve hamle, ayrılana kadar bu işlemi tekrarlayın.
Membran deformasyon derecesi ölçmek için, aspire uzunluk (L) pipetin ucundan zarın projeksiyon çevresinin tepe ile ölçülür. Bu, bir daha büyük bir pipet basınç ile aynı düzeyde hücre zarı üzerinde daha fazla kuvvet uygulanır ki, dikkat etmek önemlidir. Pipet çapları arasında değişkenlik dikkate almak için, bu nedenle, aspire uzunluğu her bir deney için ölçülen pipet çapı (D) için normalleştirilir.
Bu veriler ayrıca olarak daha önceki çalışmalarda 6,7 tarif edilen endotelyal hücre, bir standart doğrusal viskoelastik bir yarı-uzay modeli kullanılarak analiz edilebilir. Spesifik olarak, hücrelerin elastik modül denklemi kullanılarak tahmin edildi:
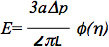
E Young modülü olduğu durumlarda, bir iç olduğupipet yarıçapı, Δp basınç farkı, L karşılık gelen aspire uzunluğu, ve φ (η) işlev olarak Theret ve diğerleri tarafından tarif 7 kuvvet model kullanılarak hesaplanmıştır bir duvar. Bu, birden fazla model bir hücre hücreleri küresel bir şekil oluşturduğunu varsayalım izotropik ve homojen malzeme özellikleri ve sıvı damlası modeli, bir deforme küre olduğunu varsayan bir sonlu eleman modeli de dahil olmak üzere microaspiration verilerini analiz etmek için kullanılmış olduğunu not etmek önemlidir sürekli deforme, ve gibi birçok mükemmel değerlendirmeleri açıklanan sürüm, üzerine kurtarabilirsiniz: 8-10. Microaspiration aynı zamanda bu tür hücresel viskoelastik özellikleri, hücre ve doku biyomekanik (Daha fazla bilgi için yukarıda listelenen değerlendirme bakınız) farklı yapısal elemanların kortikal gerilim ve katkı olarak hücreler ve dokular, diğer biyomekanik parametreler araştırmak için kullanılabilir.
5. TemsilciSonuçlar
Daha önceki çalışmalarda, mikropipet aspirasyon lipozomlar, 5 ya da alt tabaka 2,11-13 bağlı değildi hücreleri üzerinde ya da uygulandı. Çalışmalarımızda Bununla birlikte, hücreler tipik olarak 14-16 hücreleri ayırmak zaman meydana gelebilir iskelet yapısı değişiklikleri önlemek için alt tabaka ile bağlı tutulur. Substrat bağlı hücreleri için microaspiration tekniğin kullanımını doğrulamak için, beklendiği gibi, bu kadar bu yaklaşım ile tahmin sığır aort endotel hücreleri (BAECs), hücre sertliğinin azalması F-aktin sonuçları bozulması. Şekil 3 gösterileri olmadığını test , bu gerçekten böyledir. Spesifik olarak, Şekil 3A, bir mikropipet yoluyla uygulanan negatif basınca tepki olarak ilerleyen deformasyon geçirmekte olan endotelyal membran floresan görüntü tipik bir dizi gösterilmektedir. Beklendiği gibi, zar kademeli olarak pipet ile aspirat aspire edilired uzunluk uygulanan basıncın bir işlevi olarak artar. F-aktin bozulması önemli tüm basınç koşullarında (Şekil 3B) 14 yaşın altındaki projeksiyonlar aspire uzunlukları artar deformasyon gösterinin zaman içerisinde.
Bu yaklaşımı kullanarak, biz kolesterol zenginleştirme hiçbir etkisi 14 sahipti, oysa hücre zarının kolesterol tükenmiş olduğunda hücre sertliği artar keşfetti. Şekil 4'te maksimum aspirasyon uzunlukları ulaştıktan sonra bir kolesterol zenginleştirilmiş hücre, bir kontrol hücresi, ve kolesterol tükenmiş hücre gösterir -15 mm Hg (4A). Projeksiyonlar genellikle-10mmHg de gelişmeye başlamış ve membran deformasyon zaman kurslar -10, -15 ve -20 mm Hg (4B) ve negatif basınçları için ölçülen olabilir. -25mmHg üzerindeki basınçlarda uygulama ayrı bir vesikül şekillendirme aspire projeksiyon ayrılması ile sonuçlanmıştır. Membran dekolmanı sonuçlandı basınç seviyesi VB olduFarklı koşullar altında kolesterol r. Önceki çalışmalar membran lipid Bilayerlar membran kolesterol artış membran 5,17 sertliğini artırdığını göstermiştir çünkü bu gözlem son derece beklenmedik bir şeydi. Bizim ileri çalışmalar Atomik Kuvvet Mikroskobu 18,19 ve Kuvvet Traksiyon Mikroskopi 20 de dahil olmak üzere birçok bağımsız yaklaşımlar kullanarak bu gözlemleri doğruladı.
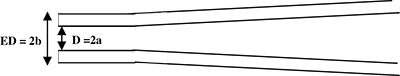
Şekil 1. Bir kayıt pipet şematik yandan görünüşüdür. Pipet ucu (yandan görünüm) bir silindirik sap oluşturmak için çekilir. Mikropipet parametreleri: D = 2a = iç çapı ve ED = 2b = dış çapı.

Şekil 2. Mikropipet bir alt tabaka bağlı hücre yaklaşan (A) şematik yan görünüşüdür;. Bir mikropipet s (B) Parlak görüntü kontrastHank aspirasyon deneylerde kullanılan tipik bir hücre şeklinde dokunma; DiIC 18 etiketli aynı hücre (C) floresan imaj. Mikropipet hala mevcut ancak (14 Gönderen) görünmez.
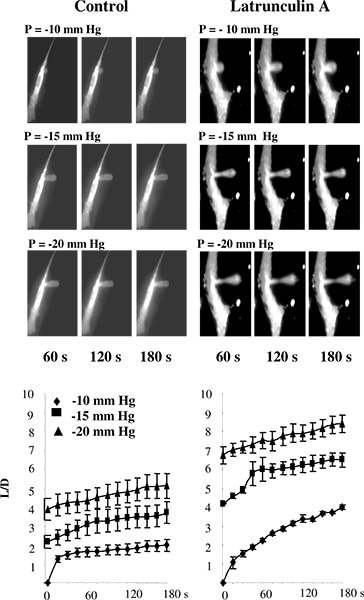
Şekil 3,. Microaspiration kullanarak substrat bağlı hücrelerinde hücre sertlik ölçme Doğrulama. A: Kontrol koşullarında ve latrunculin maruz kaldıktan sonra BAECs ilerleyici membran deformasyon Görüntüleri bunu floresan değil çünkü pipet görüntülerde görünmez.. Hücreleri gibi rodamin-phalloidin floresan ile ölçülen ölçüde F-aktin miktarı azalır 10 dakika, (gösterilmemiş) için 2 uM latrunculin A maruz fakat hücre şekli üzerinde belirgin bir etkisi yoktur edildi. Bir latrunculin işleme tabi tutulmuş hücre, bir aspire projeksiyon ortasında membran inceltme ancak yine de projeksiyon c iliştirilirarşın. B. L ve D yansıtma zar uzunluğu aspire edilir zar deformasyon sırasında içerisinde latrunculin üzerinde bir etkisi kontrol hücreleri için pipet çapı (n = 14), 2 uM latrunculin maruz kalan hücrelerin olan bir 10 dakika için (n = 5). Hücreleri -10 mm Hg (karo), -15 mm Hg (kareler) ve -20 mm Hg (üçgen) ile aspire edildi. (14 Gönderen.)
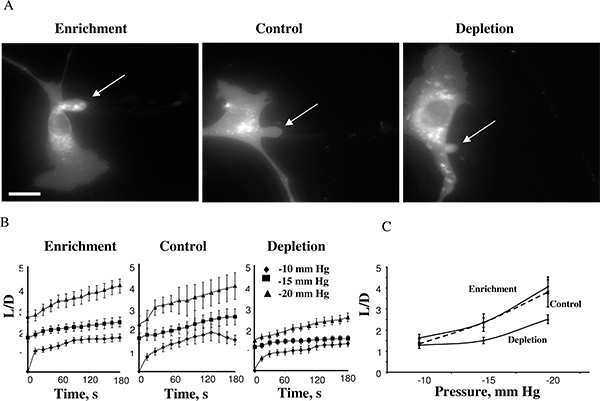
Şekil 4. BAECs membran deformasyon hücresel kolesterol düzeylerinin etkisi. . Kolesterol ile zenginleştirilmiş, kolesterol-azalmış ve kontrol hücreler (kontrol hücrelerinin membran deformasyon bir Tipik görüntüleri MβCD maruz bırakıldı: hücrelerinde serbest kolesterol seviyesi üzerinde herhangi bir etkiye sahip 1:1 oranında MβCD-kolesterol karışımı (bakınız ) inset. gösterilen görüntüler -15 mm Hg maksimal deformasyon betimliyor. ok aspire projeksiyon konumunu gösterir. Bar 30 mikron. B. Üç deneysel hücre popülasyonlarının için aspire uzunlukları ortalama zaman kurslar. C. Maksimal uzunluk aspire uygulanan basıncın bir fonksiyonu olarak çizilmiştir. Tükenmiş hücrelerinde maksimal normalleştirilmiş uzunluğu basınçları -15 mm Hg ve -20 mm Hg (p <0.05) kontrol hücrelerinin daha düşüktü. (14 Gönderen.)
Tartışmalar
Microaspiration bir hücre zarı negatif basınç uygulayarak ve iyi tanımlanmış bir baskıya tepki olarak membran deformabilite ölçüm yaparak hücre sertlik / deformabilitesi tahmin etmek için basit ve son derece tekrarlanabilir bir yöntem sağlar. İlk hücre bölünmesi 21 ve daha sonra kırmızı kan hücreleri 1 mekanik özelliklerine bakmak için mekanizmaları hakkında bilgi sağlamayı, deniz kestanesi yumurtalarının elastik özelliklerini karakterize etmek için Mitchison ve Swa...
Açıklamalar
Çıkar çatışması ilan etti.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog / Model Numarası | Yorumlar |
| Sutter pipet çektirmesi | Sutter Aletleri | P-97 | |
| Microforge | Narishige | MF-830 | |
| Ters Floresan Mikroskop | Zeiss | Axiovert 200M | Mikroskop tercihen 3D/deconvolution yetenekleri ile donatılmış olmalıdır. |
| Video kamera | Zeiss | AxioCam MRM | |
| Image Acquisition sotware | Zeiss | AxioVision | |
| Pnömatik Basınç Düşürücü | Biotek | DPM-1B | DPM1B Pnömatik Dönüştürücü Tester şimdi FLUKE bulunabilir. |
| Pipet cam | Richland | Özelleştirilmiş cam | Pipetler 1.2 iç çapı ve dış çapı 1,6 ile özelleştirilmiş. |
| DII Boya | Invitrogen | D282 | DMSO içinde erir |
Referanslar
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. I. Membrane stiffness and intracellular pressure. Biophys. J. 4, 115-135 (1964).
- Discher, D. E., Mohandas, N., Evans, E. A. Molecular maps of red cell deformation: hidden elasticity and in situ connectivity. Science. 266, 1032-1035 (1994).
- Schmid-Schönbein, G. W., Sung, K. L., Tözeren, H., Skalak, R., Chien, S. Passive mechanical properties of human leukocytes. Biophys. J. 36, 243-256 (1981).
- Guilak, F., Tedrow, J. R., Burgkart, R. Viscoelastic properties of the cell nucleus. Biochem. Biophys. Re.s Commun. 269, 781-786 (2000).
- Needham, D., Nunn, R. S. Elastic deformation and failure of lipid bilayer membranes containing cholesterol. Biophys. J. 58, 997-1009 (1990).
- Sato, M., Theret, D. P., Wheeler, L. T., Ohshima, N., Nerem, R. M. Application of the micropipette technique to the measurement of cultured porcine aortic endothelial cell viscoelastic properties. Journal of Biomechanical Engineering. 112, 263-268 (1990).
- Theret, D. P., Levesque, M. J., Sato, F., Nerem, R. M., Wheeler, L. T. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. J. of Biomechanical Engineering. 110, 190-199 (1988).
- Hochmuth, R. M. Micropipette aspiration of living cells. J. Biomech. 33, 15-22 (2000).
- Lim, C. T., Zhou, E. H., Quek, S. T. Mechanical models for living cells--a review. Journal of Biomechanics. 39, 195 (2006).
- Zhao, R., Wyss, K., Simmons, C. A. Comparison of analytical and inverse finite element approaches to estimate cell viscoelastic properties by micropipette aspiration. Journal of Biomechanics. 42, 2768 (2009).
- Chien, S., Sung, K. L., Skalak, R., Usami, S., Tozeren, A. Theoretical and experimental studies on viscoelastic properties of erythrocyte membrane. Biophys. J. 24, 463-487 (1978).
- Evans, E., Kuhan, B. Passive material behavior of granulocytes based on large deformation and recovery after deformation tests. Blood. 64, 1028-1035 (1984).
- Sato, M., Levesque, M. J., Nerem, R. M. Micropipette aspiration of cultured bovine aortic endothelial cells exposed to shear stress. Arteriosclerosis. 7, 276-286 (1987).
- Byfield, F., Aranda-Aspinoza, H., Romanenko, V. G., Rothblat, G. H., Levitan, I. Cholesterol depletion increases membrane stiffness of aortic endothelial cells. Biophys. J. 87, 3336-3343 (2004).
- Byfield, F. J., Hoffman, B. D., Romanenko, V. G., Fang, Y., Crocker, J. C., Levitan, I. Evidence for the role of cell stiffness in modulation of volume-regulated anion channels. Acta. Physiologica. 187, 285-294 (2006).
- Byfield, F. J., Reen, R. K., Shentu, T. -. P., Levitan, I., Gooch, K. J. Endothelial actin and cell stiffness is modulated by substrate stiffness in 2D and 3D. Journal of Biomechanics. 42, 1114 (2009).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. Journal of Physical Chemistry. 91, 4219-4228 (1987).
- Sun, M., Northup, N., Marga, F., Huber, T., Byfield, F. J., Levitan, I., Forgacs, G. The effect of cellular cholesterol on membrane-cytoskeleton adhesion. J. Cell. Sci. 120, 2223-2231 (2007).
- Shentu, T. P., Titushkin, I., Singh, D. K., Gooch, K. J., Subbaiah, P. V., Cho, M., Levitan, I. oxLDL-induced decrease in lipid order of membrane domains is inversely correlated with endothelial stiffness and network formation. Am. J. Physiol. Cell. Physiol. 299, 218-229 (2010).
- Norman, L. L., Oetama, R. J., Dembo, M., Byfield, F., Hammer, D. A., Levitan, I., Aranda-Espinoza, H. Modification of Cellular Cholesterol Content Affects Traction Force, Adhesion and Cell Spreading. Cell Mol. Bioeng. 3, 151-162 (2010).
- Mitchinson, J. M., Swann, M. M. The Mechanical Properties of the Cell Surface: I. The Cell Elastimeter. J. of Experimental Biology. 31, 443-460 (1954).
- Byfield, F. J., Tikku, S., Rothblat, G. H., Gooch, K. J., Levitan, I. OxLDL increases endothelial stiffness, force generation, and network formation. J. Lipid Res. 47, 715-723 (2006).
- Ohashi, T., Ishii, Y., Ishikawa, Y., Matsumoto, T., Sato, M. Experimental and numerical analyses of local mechanical properties measured by atomic force microscopy for sheared endothelial cells. Biomed. Mater. Eng. 12, 319-327 (2002).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453 (2007).
- Kowalsky, G. B., Byfield, F. J., Levitan, I. oxLDL facilitates flow-induced realignment of aortic endothelial cells. Am. J. Physiol. Cell. Physiol. 295, 332-340 (2008).
- Ketene, A. N., Schmelz, E. M., Roberts, P. C., Agah, M. The effects of cancer progression on the viscoelasticity of ovarian cell cytoskeleton structures. Nanomedicine: Nanotechnology, Biology and Medicine. , (2011).
- Kole, T. P., Tseng, Y., Huang, L., Katz, J. L., Wirtz, D. Rho kinase regulates the intracellular micromechanical response of adherent cells to rho activation. Mol. Biol. Cell. 15, 3475-3484 (2004).
- Hall, A. Rho GTPases and the Actin Cytoskeleton. Science. 279, 509-514 (1998).
- Okajima, T. Atomic Force Microscopy for the Examination of Single Cell Rheology. In. Methods Mol. Biol. 736, 303-329 (2011).
- Wang, N., Butler, J. P., Ingber, D. E. Mechanotransduction across the cell surface and through the cytoskeleton. Science. 260, 1124-1127 (1993).
- Fabry, B., Maksym, G. N., Butler, J. P., Glogauer, M., Navajas, D., Fredberg, J. J. Scaling the microrheology of living cells. Physical Review Letters. 87, 148102 (2001).
- Park, C. Y., Tambe, D., Alencar, A. M., Trepat, X., Zhou, E. H., Millet, E., Butler, J. P., Fredberg, J. J. Mapping the cytoskeletal prestress. American Journal of Physiology - Cell Physiology. 298, C1245-C1252 (2010).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophys. J. 80, 1744-1757 (2001).
- Wirtz, D. Particle-tracking microrheology of living cells: principles and applications. Annu. Rev. Biophys. 38, 301-326 (2009).
- Shin, D., Athanasiou, K. Cytoindentation for obtaining cell biomechanical properties. J. Orthop. Res. 17, 880-890 (1999).
- Ou-Yang, H. D., Wei, M. T. Complex fluids: probing mechanical properties of biological systems with optical tweezers. Annu. Rev. Phys. Chem. 61, 421-440 (2010).
- Hosu, B. G., Sun, M., Marga, F., Grandbois, M., Forgacs, G. Eukaryotic membrane tethers revisited using magnetic tweezers. Phys. Biol. 4, 67-78 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır