A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
اللعاب، الغدد اللعابية، وجمع اللمف الدموي من القراد اللبود الكتفي
In This Article
Summary
جمع الدملمف القراد المصابة، والغدد اللعابية، واللعاب مهم لدراسة كيفية ينقلها القراد مسببات الأمراض تسبب المرض. في هذا البروتوكول نحن لشرح كيفية جمع الدملمف والغدد اللعابية من تغذية اللبود الكتفي الحوريات. علينا أن نبرهن أيضا جمع اللعاب من الإناث أولا الكتفي الكبار.
Abstract
تم العثور على القراد في جميع أنحاء العالم وتصيب البشر الذين يعانون من أمراض التي تنتقل بواسطة القراد كثيرة. القراد هي الناقلة لمسببات الأمراض التي تسبب مرض لايم والتي ينقلها القراد الحمى الراجعة (البورلية SPP).، الجبال الصخرية المبقعة (الريكتسية الريكتسية)، ehrlichiosis (الإيرليخية chaffeensis الخيلية وهاء)، anaplasmosis (Anaplasma phagocytophilum)، والتهاب الدماغ (القراد التي تنتقل عن طريق فيروس التهاب الدماغ)، البابيزيا (البابسية النيابة.)، كولورادو حمى القراد (Coltivirus)، وحمى الأرانب (الفرنسيسيلة التولارية) 1-8. إلى أن تنتقل بشكل صحيح في استضافة هذه العوامل المعدية تنظيم تفاضلي التعبير الجيني، والتفاعل مع البروتينات القراد، والهجرة من خلال وضع علامة 3،9-13. على سبيل المثال، وكيل مرض لايم، البورلية burgdorferi، يتكيف من خلال التعبير الجيني الفارق الى مراحل وليمة ومجاعة من دورة القراد في متوطن بالحيوانات 14،15. وعلاوة على ذلك، باعتباره علامة اللبود يستهلكbloodmeal البورلية تكرار والهجرة من المعى المتوسط في الجوف الدموي الأمامي، حيث يسافرون إلى الغدد اللعابية وتنتقل إلى المضيف مع لعاب طرد 9،16-19.
كما وضع علامة يغذي المضيف يستجيب عادة مع استجابة مناعية قوية مرقئ والفطرية 11،13،20-22. على الرغم من هذه الردود المضيفة، I. ويمكن تغذية الكتفي لعدة أيام بسبب لعاب القرادة يحتوي على البروتينات التي هي المناعية، وكلاء التحللي، مضادات التخثر، وfibrinolysins للمساعدة في تغذية 3،11،20،21،23 القراد. الأنشطة المناعية التي تمتلكها لعاب القراد أو مستخلص الغدة اللعابية (SGE) تسهيل انتقال والانتشار، ونشر مسببات الأمراض التي تنتقل بواسطة القراد العديد من 3،20،24-27. لمزيد من فهم الكيفية التي تنتقل بواسطة القراد العوامل المعدية تسبب المرض لا بد من تشريح بنشاط تغذية القراد وجمع لعاب القراد. هذا الفيديو يشرح تقنيات بروتوكول للتشريحجمع الدملمف وإزالة الغدد اللعابية من تغذية بنشاط أولا الحوريات الكتفي بعد 48 و 72 فأر آخر التنسيب ساعات. علينا أن نبرهن أيضا جمع اللعاب من I. البالغات الكتفي القراد.
Protocol
1. جمع الدملمف لإعداد الشرائح
(فيلم 1)
- إزالة القراد بلطف بنشاط تغذية من حيوان ومكان في 3٪ بيروكسيد الهيدروجين موضعي لمدة 5 دقائق ثم في الايثانول 70٪ لمدة 10 دقائق على سطح تعقيم.
- مع القلم حلمة الثدي رسم دائرة على شريحة المجهر المغلفة silane ووضع علامة داخل حلمة الثدي دائرة من ركلة جزاء.
- وتستخدم الشرائح المغلفة Silane للحصول على أفضل تمسك الدملمف إلى الشريحة المجهر.
- عرض القراد تحت المجهر تشريح (1X الهدف، العدسة 10X، التكبير الإصدار 3.5x).
- دفع برفق لأسفل على ظهر القراد مع ملقط لتباعد الساقين القراد وجمد القراد.
ملاحظة: عندما شل حركة القراد لا تضغط من الصعب جدا لأن هذا قد يعطل المعي المتوسط أو ثقب القراد وتلوث الدملمف.
- بتر ساق القراد أو الساقين في اله مشترك مع القاصي نقطة غرامة مشرط القابل للتصرف. لتحديد العدوى عن طريق اللمف فقط 1 ساقه يحتاج إلى بتر. قد لجمع الدملمف على شريحة يتم بتر ساقيه عدة.
ملاحظة: لا قطع الساق قريبة جدا من الجسم، لأن هذا قد يسبب تلوث المعي المتوسط من اللمف.
- بعد أن يتم قطع الساق أو الساقين الاستمرار في تطبيق الضغط بلطف على ظهر القراد في لالدملمف لإفراز من ساقيه على الشريحة. تحرك بلطف القراد حول على الشريحة لنشر الدملمف.
2. إزالة الغدة اللعابية
(أفلام 2 و 3)
- مخزنة بقعة عدة برك 25 ميكرولتر من الفوسفات المالحة (PBS) على شريحة المجهر ووضع علامة في واحدة من برك برنامج تلفزيوني.
- عرض القراد تحت المجهر تشريح (1X الهدف، العدسة 10X، التكبير الإصدار 3.5x).
- استقرار القراد مع forcep الرؤوس غرامةق من خلال عقد رؤيس أساس (أجزاء الفم) أو الجزء الخلفي من القراد.
- إدراج ملقط غرامة يميل إلى الجزء الخلفي من التجزئة وشريحة تصل القراد ما ظهر لكشف الأجهزة. ويمكن إذا رغبت يمكن إزالة المعي المتوسط في هذا الوقت، ونقل إلى مجموعة جديدة من برنامج تلفزيوني على شريحة مجهر أو إلى أنبوب microfuge التي تحتوي على برنامج تلفزيوني.
- العثور على زوج من الغدد اللعابية (مثل عناقيد العنب) الواقعة بجانب ثنائي الساقين من القراد. إذا الغدد اللعابية ليست واضحة بين الركام القراد نقل جزء التجزئة الرئيسية، والتي لا تزال تتضمن الغدد اللعابية، إلى مجموعة جديدة من برنامج تلفزيوني للحد من الفوضى وفقدان الغدد اللعابية.
ملاحظة: في وقت سابق في التغذية، والغدد اللعابية هي أصعب لتحديد مكان لأنهم ليسوا كما وضعت مقارنة في وقت لاحق في التغذية.
- إزالة الغدد اللعابية من القراد مع ملقط الرؤوس وغرامة مكان في بركة جديدة من برنامج تلفزيوني.
- واييميل ال غرامة ملقط نقل الغدد اللعابية إلى أخرى نظيفة 25 تجمع PBS ميكرولتر، كرر هذه الخطوة غسيل 3-4 مرات أكثر لإزالة أي الكائنات الحية الدقيقة الخارجي والحطام القراد.
ملاحظة: تغسل عناقيد الغدة اللعابية بلطف للحد من الخسائر وتعطل الغدد اللعابية الفردية.
- وضع الغدد في بركة نظيفة من برنامج تلفزيوني على شريحة المغلفة silane أو في أنبوب microfuge التي تحتوي على برنامج تلفزيوني.
3. لعاب جمع
(فيلم 4)
- إزالة القراد بلطف البالغات من الأرنب أو المضيفة الأخرى باستخدام ملقط الرؤوس غرامة قبل قليل من غلبه النعاس محتقن تماما، 5-7 أيام تقريبا في مرحلة ما بعد المرفق.
- تلتزم القراد محتقن تقريبا على واحدة من نهاية شريحة المجهر مع لاصق شفاف. يجب وضع الشريط حوالي ثلاث أرباع الطريق حتى ظهر القراد تجاه رأسه، وترك رؤيس القراد في الأساس (أجزاء الفم) عرضة للخطر.
- حيث يلتقي الشريط حافة الأمامي من ميكرولتر القراد السطح الظهري 5 الماصة من حل بيلوكاربين 5٪ (في الميثانول). السماح للشريط على ذبالة من بيلوكاربين على القراد وظهر، دون السماح للبيلوكاربين لتأتي في اتصال مع رؤيس أساس القراد و.
- تركيب قطعة من الصلصال غير سامة على الشريحة مجهر حوالي بوصة واحدة من فمها القراد و.
- باستخدام ملقط الرؤوس غرامة قطع رأس أنبوب شعري وسحبت 28 إلى القطر المطلوب.
- عرض رؤيس القراد في الأساس تحت المجهر تشريح.
- تناسب بلطف الكارح القراد حيز الأنبوب الشعرية سحبت السماح للpalps العلوية الموجودة على السطح الخارجي للأنبوب شعري.
- اضغط على الطرف الآخر من الأنابيب الشعرية في الصلصال لعقد أنبوب شعري في مكان.
- ضع علامة شنت الترويل داخل غرفة مظلمة مع ارتفاع نسبة الرطوبة (على سبيل المثال، مربع الستايروفوم بغطاء اصطف مع حلمة الثدي الرطب المناشف إيه). إمالة الشريحة وبالتالي فإن نقاط الكارح إلى أسفل الحاوية، والسماح الجاذبية للمساعدة في جمع اللعاب.
- وضع الحاوية في درجة حرارة الغرفة.
- ترصد عن كثب القراد عاب لأول ساعة، وجمع اللعاب كما هي ولدت عن طريق طرد عليه للخروج من أنابيب شعرية مع لمبة الماصة باستور. بعد الساعة الأولى، تحقق تراكم كل ساعة ما لا يقل عن 4 ساعات. الاستمرار في جمع لعاب كما هي ولدت.
ملاحظة: يمكن وقفها اكتساب اللعاب مرة واحدة ويتم جمع ما يكفي من اللعاب لهذه الدراسة التي يتم تنفيذها.
- إذا القراد لا عاب أو إذا كان المطلوب أكثر اللعاب، ويمكن أن يتسبب في بعض الأحيان اللعاب باستخدام الأنابيب الشعرية لتدليك الكارح.
- إضافة 0.1 أحجام كوكتيل مثبط البروتياز لعاب ومخزن في -80 درجة مئوية لحين الحاجة إليها.
4. ممثل النتائج
e_content "> فيلم 1 يوضح كيفية اجراء حورية أولا يتغذى جزئيا الكتفي وبتر الساقين لجمع الدملمف على شريحة المجهر. وحالما يتم بتر الساق أو الساقين ويفرز السائل واضح (الشكل 1A و 1B). وإذا كان المعي المتوسط يتمزق الدملمف يبدو غائما كما هو يخرج من بتر ساقه (ق) (1C شخصية و1D).ويتجلى استخراج الغدد اللعابية بعد حورية تم تغذية لمدة 48 أو 72 ساعة في أفلام 2 و 3. بعد ثقب القراد هناك عادة الكثير من الحطام (تتألف من القصبة الهوائية، مالبيغي الأنابيب والدم والأنسجة الضامة وغيرها)، لمنع فقدان أو اختلال في الغدد اللعابية تحريك علامة على مجموعة جديدة من برنامج تلفزيوني. وتظهر الأرقام 2A 2B حيث توجد الغدد اللعابية بعد أن تم قطع حورية مفتوحة ويوضح الشكل 2C إزالة كتل الغدد اللعابية في بركة من برنامج تلفزيوني.
جمع اللعاب من إعداد أولا الإناث البالغات الكتفي أنا ق هو مبين في فيلم (4) والشكل (3). ويلاحظ وجود علامة الترويل في أنبوب شعري في الفيلم 5. هذه الطريقة في جمع اللعاب المستخدمة بيلوكاربين لتحفيز اللعاب ويمكن أن تسفر عن أكثر من 20 ميكرو لتر من اللعاب في القراد البالغات.
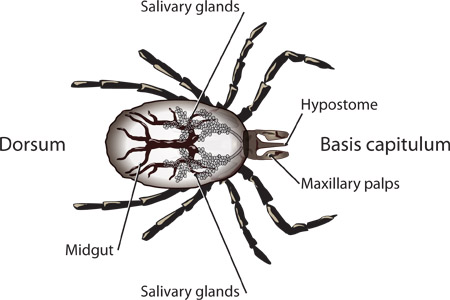
الشكل 1. الهياكل إعتبر من حورية الكتفي أولا.
فيلم 1. اللبود جمع الدملمف الكتفي. اضغط هنا لمشاهدة الفيلم .

الشكل 2. غير ملوثة (A & B)، والملوثة (C & D) الدملمف تنزح من مباراة الذهاب في لحورية.
فيلم 2. استخراج الغدة اللعابية من I. ساعة الاحتياطي الفيدرالي 48 الكتفي حورية.pload/3894/3894movie2.avi "> اضغط هنا لمشاهدة الفيلم.
فيلم 3. استخراج الغدة اللعابية من I. ساعة الاحتياطي الفيدرالي 72 حورية الكتفي. اضغط هنا لمشاهدة الفيلم .
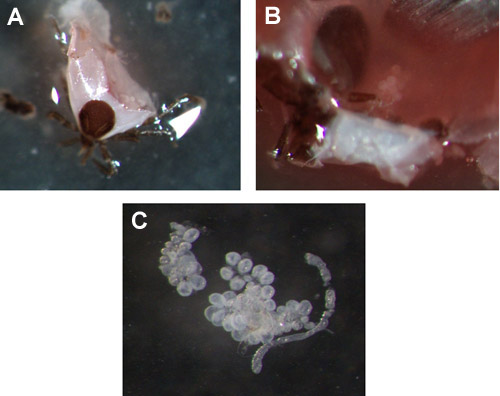
الشكل 3. اللبود الكتفي الغدد اللعابية حورية. (A & B) أمثلة من الغدد اللعابية في حورية ساعة تغذيها 72، قبل الاستخراج. (ج) إزالة الغدة اللعابية العنقودية.
فيلم 4. جمع اللعاب إعداد أولا من الكبار القراد الإناث الكتفي. اضغط هنا لمشاهدة الفيلم .

الشكل 4. جمع اللعاب من الكبار أولا الإناث تي الكتفيicks. (أ و ب) ضع علامة توضع على شريحة مع الكارح لها في النهاية انسحبت من الأنابيب الشعرية مع نهاية unpulled من الأنابيب الشعرية التي عقدها الصلصال. (C & D) غرفة تحتوي على مرطب الترويل أولا الكبار أنثى القراد الكتفي.
فيلم 5. اللبود الكتفي القراد الإناث الترويل في أنبوب شعري. اضغط هنا لمشاهدة الفيلم .
Discussion
جمع الدملمف القراد، الغدد اللعابية، واللعاب مهم في دراسة ينقلها القراد انتقال مسببات المرض وانتشاره، ونشر، والانتشار، والمثابرة في التجزئة على حد سواء والمضيف 6،11-13،20،23،29. هناك عدة طرق لتشريح وضع علامة 30،31. ومع ذلك، عندما جمع الغدد اللعابية من الأهمية ب?...
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
الكتاب أود أن أشكر شعبة المحمولة بالنواقل فرع أمراض الثروة الحيوانية، وتحديدا اندريا بيترسون، ليزا المسعودي، اوبراين فيرنا، وجون ليدل لرعايتهم والحفاظ على الفئران والارانب. ونود أيضا أن نشكر ايمي أولمان، تيريزا راسيل، وباربرا جونسون J. لما قدموه من مساهمات لتحقيق هذا المخطوط. أخيرا، نود أن نعترف العيسى إيكرت في مكتب المدير المساعد للاتصالات في مركز السيطرة على الأمراض لإنتاج الرسوم البيانية والرسوم التوضيحية لافيل جودي لتوجيه جميع الجوانب القانونية المرتبطة تصوير هذا المخطوط.
Materials
| Name | Company | Catalog Number | Comments |
| الكاشف | شركة | فهرس العدد | |
| ماء الأوكسجين | الصياد | H312-500 | |
| الإيثانول | Acros | 61509-5000 | |
| برنامج تلفزيوني | المنتجات الاحيائية بوسطن | BM-2205 | |
| دومون الجميلة ملقط (3C) | الصياد | NC9906085 | |
| Silane شرائح المجهر المعالجة | Bioworld | 42763007-1 | |
| حلمة الثدي القلم | Bioworld | 21750008-1 | |
| سوبر الصقيع بالإضافة إلى شرائح المجهر | الصياد | 12-550-18 | |
| بيلوكاربين | سيغما | P6503-5G | |
| البروتيني المانع كوكتيل | سيغما | P2714 | |
| # 11 القابل للتصرف مشرط | ريشة | 2975 # 11 | |
| غير سام النمذجة طين | فيشر | S17307 | |
| الشعرية أنابيب | مطاردة العلمية زجاج، وشركة | 40A502 |
References
- Quach, K. A., Boctor, F. N., Elston, D. M. What's eating you? Hyalomma ticks. Cutis. 87, 165-167 (2011).
- Graham, J., Stockley, K., Goldman, R. D. Tick-borne illnesses: a CME update. Pediatr. Emerg. Care. 27, 141-147 (2011).
- Nuttall, P. A., Paesen, G. C., Lawrie, C. H., Wang, H. Vector-host interactions in disease transmission. J. Mol. Microbiol. Biotechnol. 2, 381-386 (2000).
- Estrada-Pena, A., Jongejan, F. Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. Exp. Appl. Acarol. 23, 685-715 (1999).
- Nuttall, P. A. Pathogen-tick-host interactions: Borrelia burgdorferi and TBE virus. Zentralbl Bakteriol. 289, 492-505 (1999).
- Jones, L. D., Hodgson, E., Nuttall, P. A. Enhancement of virus transmission by tick salivary glands. J. Gen. Virol. 70, 1895-1898 (1989).
- Labuda, M., Nuttall, P. A. Tick-borne viruses. Parasitol. 129, 221-245 (2004).
- Socolovschi, C., Mediannikov, O., Raoult, D., Parola, P. Update on tick-borne bacterial diseases in Europe. Parasite. 16, 259-273 (2009).
- Zhang, L., et al. Molecular Interactions that Enable Movement of the Lyme Disease Agent from the Tick Gut into the Hemolymph. PLoS Pathog. 7, e1002079 (2011).
- Piesman, J., Schneider, B. S. Dynamic changes in Lyme disease spirochetes during transmission by nymphal ticks. Exp. Appl. Acarol. 28, 141-145 (2002).
- Brossard, M., Wikel, S. K. Tick immunobiology. Parasitol. , S161-S176 (2004).
- Machackova, M., Obornik, M., Kopecky, J. Effect of salivary gland extract from Ixodes ricinus ticks on the proliferation of Borrelia burgdorferi sensu stricto in vivo. Folia Parasitol. 53, 153-158 (2006).
- Nuttall, P. A., Labuda, M. Tick-host interactions: saliva-activated transmission. Parasitol. 129, 177-189 (2004).
- Anguita, J., Hedrick, M. N., Fikrig, E. Adaptation of Borrelia burgdorferi in the tick and the mammalian host. FEMS Microbiol. Rev. 27, 493-504 (2003).
- Hovius, J. W., van Dam, A. P., Fikrig, E. Tick-host-pathogen interactions in Lyme borreliosis. Trends Parasitol. 23, 434-438 (2007).
- Dunham-Ems, S. M., et al. Live imaging reveals a biphasic mode of dissemination of Borrelia burgdorferi within ticks. Journal Clin. Invest. 119, 3652-3665 (2009).
- Ribeiro, J. M., Mather, T. N., Piesman, J., Spielman, A. Dissemination and salivary delivery of Lyme disease spirochetes in vector ticks (Acari: Ixodidae). J. Med. Entomol. 24, 201-205 (1987).
- Piesman, J. Transmission of Lyme disease spirochetes (Borrelia burgdorferi. Exp. Appl. Acarol. 7, 71-80 (1989).
- De Silva, A. M., Fikrig, E. Growth and migration of Borrelia burgdorferi in Ixodes ticks during blood feeding. Am. J. Trop. Med. Hyg. 53, 397-404 (1995).
- Horka, H., Cerna-Kyckova, K., Skallova, A., Kopecky, J. Tick saliva affects both proliferation and distribution of Borrelia burgdorferi spirochetes in mouse organs and increases transmission of spirochetes to ticks. Int. J. Med. Microbiol. 299, 373-380 (2009).
- Brossard, M., Wikel, S. K. Immunology of interactions between ticks and hosts. Med. Vet. Entomol. 11, 270-276 (1997).
- Wikel, S. K. Tick modulation of host immunity: an important factor in pathogen transmission. Int. J. Parasitol. 29 (99), 851-859 (1999).
- Binnington, K. C., Kemp, D. H. Role of tick salivary glands in feeding and disease transmission. Adv. Parasitol. 18, 315-339 (1980).
- Guo, X., et al. Inhibition of neutrophil function by two tick salivary proteins. Infect. Immun. 77, 2320-2329 (2009).
- Montgomery, R. R., Lusitani, D., De Boisfleury Chevance, A., Malawista, S. E. Tick saliva reduces adherence and area of human neutrophils. Infect. Immun. 72, 2989-2994 (2004).
- Lima, C. M., et al. Differential infectivity of the Lyme disease spirochete Borrelia burgdorferi derived from Ixodes scapularis salivary glands and midgut. J. Med. Entomol. 42, 506-510 (2005).
- Severinova, J., et al. Co-inoculation of Borrelia afzelii with tick salivary gland extract influences distribution of immunocompetent cells in the skin and lymph nodes of mice. Folia Microbiol. 50, 457-463 (2005).
- Labuda, M., Jones, L. D., Williams, T., Nuttall, P. A. Enhancement of tick-borne encephalitis virus transmission by tick salivary gland extracts. Med. Vet. Entomol. 7, 193-196 (1993).
- Kariu, T., Coleman, A. S., Anderson, J. F., Pal, U. Methods for Rapid Transfer and Localization of Lyme Disease Pathogens Within the Tick Gut. J. Vis. Exp. (48), e2544 (2011).
- Edwards, K. T., Goddard, J., Varela-Stokes, A. S. Examination of the internal morphology of the Ixodid tick Amblyomma maculatum koch, (Acari:Ixodidae); a "How-to" pictorial dissection guide. Midsouth Entomologist. 2, 28-39 (2009).
- Ledin, K. E., et al. Borreliacidal activity of saliva of the tick Amblyomma americanum. Med. Vet. Entomol. 19, 90-95 (2005).
- Ribeiro, J. M., Zeidner, N. S., Ledin, K., Dolan, M. C., Mather, T. N. How much pilocarpine contaminates pilocarpine-induced tick saliva?. Med. Vet. Entomol. 18, 20-24 (2004).
- Barker, R. W., Burris, E., Sauer, J. R., Hair, J. A. Composition of tick oral secretions obtained by three different collection methods. J. Med. Entomol. 10, 198-201 (1973).
- Burgdorfer, W. Hemolymph test. A technique for detection of rickettsiae in ticks. Am. J. Trop. Med. Hyg. 19, 1010-1014 (1970).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved