A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
רוק, בלוטות הרוק, וכן אוסף Hemolymph מ קרציות קרצית Scapularis
In This Article
Summary
אוסף של hemolymph לתקתק נגוע, בלוטות הרוק, ורוק חשוב ללמוד איך לתקתק נישאים פתוגנים לגרום למחלה. בפרוטוקול זה אנו מדגימים כיצד לאסוף את בלוטות הרוק hemolymph ו מ האכלה קרצית scapularis נימפות. כמו כן, אנו מראים אוסף הרוק הנשי מ א scapularis מבוגרים.
Abstract
קרציות נמצאות ברחבי העולם ליסר בני האדם עם קרצייה שמקורן מחלות רבות. קרציות הן וקטורים של פתוגנים הגורמים מחלת ליים וקרציות נישאים חום ההתקפי (Borrelia spp.), Rocky Mountain חום מנוקד (Rickettsia rickettsii), ehrlichiosis (Ehrlichia chaffeensis וא 'שוה), anaplasmosis (Anaplasma phagocytophilum), דלקת קרום המוח (קרציות וירוס דלקת המוח נישאים), babesiosis (Babesia spp.), קדחת קרציות קולורדו (Coltivirus), ו tularemia (Francisella tularensis) 1-8. כדי להיות מועבר כראוי לתוך המארח אלה גורמים מזהמים דיפרנציאלי לווסת את ביטוי הגנים, אינטראקציה עם חלבונים שנתות, ולהעביר דרך קרציות 3,9-13. כך, למשל, סוכן מחלת ליים, Borrelia burgdorferi, מתאים את עצמו דרך ביטוי גנים ההפרש לשלבים חג ורעב של מחזור enzootic של טיק 14,15. יתר על כן, כמו קרצייה קרצית צורכתbloodmeal Borrelia לשכפל לעבור מ midgut אל hemocoel, הם נוסעים בלוטות הרוק, והם מועברים אל המחשב המארח עם הרוק גורשו 9,16-19.
כמו קרציה הזנות מארח בדרך כלל מגיב בתגובה חיסונית חזקה עוצר דמום ובסיסיות 11,13,20-22. למרות תגובות אלה המארחות, י scapularis יכול להאכיל במשך כמה ימים, כי הרוק מכיל לתקתק חלבונים המערכת החיסונית, סוכני ממס, תרופות נגד קרישת דם, ו fibrinolysins כדי לסייע לתקתק האכלה 3,11,20,21,23. את פעילות המערכת החיסונית שבידי רוק לתקתק או תמצית בלוטת הרוק (SGE) להקל, העברת התרבות, והפצה של טיק שמקורן פתוגנים רבים 3,20,24-27. כדי להמשיך להבין כיצד לתקתק נישאים גורמים מזהמים גורמים למחלות חשוב לנתח באופן פעיל האכלה קרציות ולאסוף רוק לתקתק. זה פרוטוקול וידאו מדגים טכניקות הנתיחה עבוראוסף של hemolymph והסרת בלוטות הרוק של פעיל להאכיל א נימפות scapularis לאחר 48 ו - 72 שעות מיקום העכבר הודעה. כמו כן, אנו מראים אוסף הרוק מן הנקבה הבוגרת הראשונה scapularis לתקתק.
Protocol
1. Hemolymph אוסף להכנת שקופיות
(סרט 1)
- הוצא בעדינות פעיל קרציות האכלה של בעל חיים ומניחים מי חמצן 3% מימן אקטואלי במשך 5 דקות ואז באתנול 70% במשך 10 דקות לפני השטח לעקר.
- עם עט פאפ צייר עיגול לשקופית מיקרוסקופ silane מצופה למקם את ציטוט במעגל עט פאפ.
- שקופיות מצופה silane משמשים דבקות מיטב hemolymph לשקופית מיקרוסקופ.
- הצג את תקתוק תחת מיקרוסקופ לנתח (1X אובייקטיבי, העינית 10X, הגדלה 3.5x).
- דחף בעדינות על dorsum של טיק עם מלקחיים כדי ללכסן את הרגליים של שנתות ו לשתק את ציטוט.
הערה: משתק את הקרצייה לא ללחוץ חזק מדי כי זה עלול לשבש את midgut או לנקב את ציטוט ולזהם hemolymph.
- לקטוע את רגלו של טיק או רגליים על הדואר משותפת דיסטלי עם נקודת קנס אזמל חד פעמי. כדי לקבוע infectivity דרך hemolymph רק 1 רגל צריך להיות קטוע. עבור אוסף של hemolymph בשקופית הרגליים כמה אפשר לקטוע.
הערה: לא לחתוך את הרגל קרוב מדי לגוף, כיוון שהדבר עלול לגרום לזיהום של midgut hemolymph.
- לאחר הרגל או הרגליים נחתכות להמשיך בעדינות כדי להפעיל לחץ dorsum של טיק עבור hemolymph להפריש החוצה את הרגליים על גבי השקופית. בעדינות להעביר את ציטוט סביב בשקופית להפיץ hemolymph.
2. הסרת בלוטות הרוק
(סרטים 2 & 3)
- מספר ספוט 25 בריכות μl של בופר פוספט מלוחים (PBS) לשקופית מיקרוסקופ ומניחים לתקתק לאחת הבריכות PBS.
- הצג את תקתוק תחת מיקרוסקופ לנתח (1X אובייקטיבי, העינית 10X, הגדלה 3.5x).
- לייצב את תקתוק עם המלקחיים היטה בסדרים על ידי החזקת capitulum בסיס (חלקי הפה) או האחורי של קרציות.
- הכנס את מלקחיים שקצהו דקות לתוך החלק האחורי של טיק טיק ופורסים את זה dorsum לחשוף את האיברים. אם תרצה midgut ניתן להסיר בשלב זה והועברו בריכה טריים של PBS על המיקרוסקופ שקופית או צינור microfuge המכיל PBS.
- מצא זוג בלוטות הרוק (כמו אשכולות ענבים) הממוקמים בילטרלי לצד רגליו של טיק. אם בלוטות הרוק אינן גלויות לעין בין פסולת טיק טיק להעביר את החלק העיקרי, עדיין המכילה בלוטות הרוק, למאגר חדש של PBS לצמצם את שיבוש והפסד של בלוטות הרוק.
הערה: בתחילת ההנקה, בלוטות הרוק קשה יותר לאתר כי הם לא מפותחים כמו בהשוואה בהמשך ההנקה.
- הסרת בלוטות הרוק של הקרצייה עם מלקחיים שקצהו בסדר ומקום בבריכה חדשה של PBS.
- אינטרנט אלחוטיה בסדר היטה מלקחיים להעביר את בלוטות הרוק לאחר הבריכה נקייה 25 PBS μl, חזור על שלב זה לשטוף 3-4 פעמים נוספות כדי להסיר כל מיקרואורגניזמים חיצוניים ופסולת לתקתק.
הערה: לשטוף את אשכולות בלוטות הרוק בעדינות כדי לצמצם את אובדן הפרעה בבלוטות הרוק בודדים.
- מניחים את בלוטות לבריכה נקייה של PBS בשקופית מצופה silane או בצינור microfuge המכיל PBS.
3. אוסף רוק
(סרט 4)
- הוצא בעדינות קרציות נקבה בוגרת של ארנב או מארחים אחרים באמצעות מלקחיים שקצהו בסדר גמור לפני שהם טיפה את צבה מלא, כ 5-7 ימים לאחר ההתקשרות.
- ציית לתקתק התפוח כמעט על קצה אחד של המיקרוסקופ שקופית עם נייר דבק. הסרט צריך להיות ממוקם כ ¾ הדרך לכיוון הראש dorsum של קרצייה, עוזב capitulum בסיס של טיק (חלקי הפה) חשוף.
- שם הסרט פוגש את הקצה הקדמי של μl pipet הגב קרציות 5 פני פתרון pilocarpine 5% (ב מתנול). אפשר סרט על הפתיל pilocarpine על טיק של dorsum, מבלי לאפשר pilocarpine לבוא במגע עם capitulum בסיס של טיק.
- הר פיסת חומר רעיל דוגמנות לשקופית מיקרוסקופ כ 1 ס"מ בין איברי הפה של שנתות.
- השתמש במלקחי שקצהו בסדר לנתק את קצה צינור נימי משך 28 לקוטר הרצוי.
- צפה capitulum בסיס של טיק תחת מיקרוסקופ לנתח.
- בעדינות להתאים hypostome של תקתוק לתוך צינור נימי משך המאפשר palps לסתי להתגורר בצד החיצוני של צינור נימי.
- לחץ על הקצה השני של צינור נימי לתוך חימר דוגמנות להחזיק צינור נימי במקום.
- מניחים את תקתוק ריר מותקן בתוך חדר חשוך עם לחות גבוהה (למשל, התיבה עפעפיים קלקר מצופה פאפ רטוב אה מגבות). הטה את השקופית כך את הנקודות hypostome אל החלק התחתון של המיכל, המאפשר כוח הכבידה כדי לסייע אוסף הרוק.
- הנח את המיכל בטמפרטורת החדר.
- לעקוב מקרוב אחר קרציות ריר עבור השעה הראשונה, לאסוף את הרוק כפי שהוא מופק על ידי גירוש זה של צינורות נימי עם נורת pipet פסטר. לאחר השעה הראשונה, בדוק הצטברות כל שעה במשך 4 שעות לפחות. ממשיכים לאסוף את הרוק כפי שהוא נוצר.
הערה: רכישה הרוק ניתן לעצור פעם אחת הרוק מספיק נאסף למחקר מתבצע.
- אם קרציות אינן ריר או רוק יותר נדרש, הפרשת ריר יכול לעיתים להיגרם על ידי שימוש בצינור נימי לעסות hypostome.
- הוסף 0.1 כרכים של קוקטייל מעכבי פרוטאז לרוק וחנות ב -80 ° C עד הצורך.
4. נציג תוצאות
e_content "> סרט 1 מדגים איך להחזיק הנימפה ניזון באופן חלקי א scapularis ו לקטוע את רגליו כדי לאסוף hemolymph לשקופית מיקרוסקופ. לאחר הרגל או הרגליים קטוע נוזל צלול מופרש (איור 1A ו-1B). אם midgut מקרע hemolymph נראה מעונן כפי שהוא יוצא של הרגל הקטועה (ים) (1 ג הדמות 1D).החילוץ של בלוטות הרוק לאחר הנימפה כבר להאכיל במשך 48 או 72 שעות באה לידי ביטוי בסרטים 2 ו -3. אחרי טיק הוא ניקב יש בדרך כלל הרבה פסולת (המורכב קנה הנשימה, malpighian tubules, דם, רקמת חיבור וכו '), כדי למנוע אובדן או שיבוש של בלוטות הרוק להעביר את ציטוט למאגר חדש של PBS. דמויות 2a ו-2B הצג שבו בלוטות הרוק הממוקמות אחרי הנימפה נחתך פתוח ודמות 2C מראה הסיר אשכולות בלוטות הרוק בבריכה של PBS.
אוסף הרוק להגדיר מ א נקבות בוגרות scapularis אני זה שמוצג בסרט 4 ואיור 3. לתקתק ריר לתוך צינור נימי הוא נצפה בסרט 5. שיטה זו של איסוף הרוק משמש pilocarpine לעודד את הפרשת הרוק ואת יכולה להניב מעל 20 μl של רוק לכל קרצייה נקבה בוגרת.
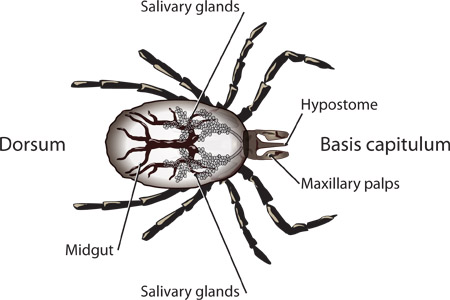
באיור 1. מבנים שכותרתו של נימפה scapularis א.
1. סרט קרצית אוסף scapularis hemolymph. לחץ כאן כדי לצפות בסרט .

איור 2. מזוהמת (A & B) מזוהמים (C & D) hemolymph מקרין מהרגל של נימפה.
2. הסרט מיצוי בלוטת הרוק מ 48 שעות הפד א scapularis נימפה.pload/3894/3894movie2.avi "> לחץ כאן כדי לצפות בסרט.
סרט 3. בלוטת הרוק החילוץ מ 72 שעות הפד א נימפה scapularis. לחץ כאן כדי לצפות בסרט .
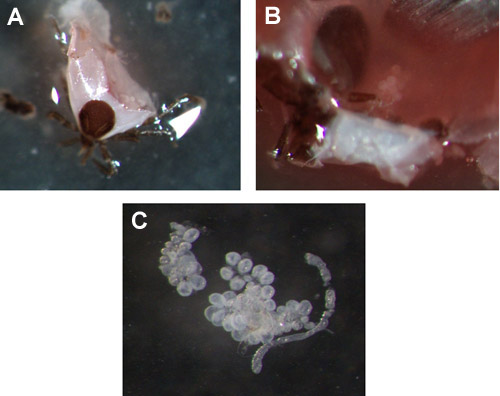
איור 3. קרצית בלוטות הרוק scapularis הבובה ומשכה. (A & B) דוגמאות של בלוטות הרוק 72 שעות הפד נימפה, לפני מיצוי. (ג) הוסר אשכול בלוטות הרוק.
סרט 4. אוסף הרוק להגדיר מ י למבוגרים קרצייה נקבה scapularis. לחץ כאן כדי לצפות בסרט .

איור 4. הרוק אוסף של מבוגר ממני לא נשים scapularisicks. (A & B) סמן רכוב על שקופית עם hypostome שלה בסופו של דבר משך את צינור נימי עם תום unpulled של צינור נימי בידי פלסטלינה. (C & D) תא Humidified המכיל הבוגרת א ריר קרציות נשים scapularis.
סרט 5. קרצית קרציה נקבה scapularis ריר לתוך צינור נימי. לחץ כאן כדי לצפות בסרט .
Discussion
אוסף של hemolymph לתקתק, בלוטות הרוק, ורוק חשוב במחקר של שידור-Tick נישאים הפתוגן, שכיחות ההפצה, התפשטות, והתמדה לתקתק וגם מארח 6,11-13,20,23,29. ישנן מספר דרכים לנתח לתקתק 30,31. עם זאת, כאשר איסוף בלוטות הרוק חיוני לנתח לתקתק כמו שצריך אז בלוטות הרוק לא נקרע או אבד שרידים ש...
Disclosures
אין לנו מה למסור.
Acknowledgements
המחברים מבקשים להודות חלוקת וקטור נישאים סניף מחלות בעלי חיים משאבים, במיוחד אנדראה פטרסון, ליסה Massoudi, ורנה או 'בראיין, וג'ון לידל עבור הטיפול בהם ותחזוקה של עכברים וארנבים. אנו רוצים גם להודות איימי אולמן, תרזה ראסל, ברברה ג''ונסון על תרומתם כלפי כתב היד הזה. לבסוף, ברצוננו להודות אליסה אקרט במשרד של מנהל שותף של תקשורת ב-CDC להפקת איורים גרפיים וג'ודי Lavelle על בימוי בכל העניינים המשפטיים הקשורים הצילומים של כתב היד הזה.
Materials
| Name | Company | Catalog Number | Comments |
| מגיב | חברה | מספר קטלוגי | |
| מי חמצן | דיג | H312-500 | |
| אתנול | Acros | 61509-5000 | |
| PBS | בוסטון Bioproducts | BM-2205 | |
| דומון פיין מלקחיים (3C) | דיג | NC9906085 | |
| Silane מיקרוסקופ שקופיות שטופלו | Bioworld | 42763007-1 | |
| פאפ עט | Bioworld | 21750008-1 | |
| סופר פרוסט בתוספת שקופיות מיקרוסקופ | דיג | 12-550-18 | |
| Pilocarpine | סיגמא | P6503-5G | |
| מעכבי פרוטאז קוקטייל | סיגמא | P2714 | |
| # 11 הפנויה אזמל | נוצה | 2975 # 11 | |
| מודלים רעילים חימר | פישר | S17307 | |
| נימי צינורות | המרדף המדעי זכוכית, Inc | 40A502 |
References
- Quach, K. A., Boctor, F. N., Elston, D. M. What's eating you? Hyalomma ticks. Cutis. 87, 165-167 (2011).
- Graham, J., Stockley, K., Goldman, R. D. Tick-borne illnesses: a CME update. Pediatr. Emerg. Care. 27, 141-147 (2011).
- Nuttall, P. A., Paesen, G. C., Lawrie, C. H., Wang, H. Vector-host interactions in disease transmission. J. Mol. Microbiol. Biotechnol. 2, 381-386 (2000).
- Estrada-Pena, A., Jongejan, F. Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. Exp. Appl. Acarol. 23, 685-715 (1999).
- Nuttall, P. A. Pathogen-tick-host interactions: Borrelia burgdorferi and TBE virus. Zentralbl Bakteriol. 289, 492-505 (1999).
- Jones, L. D., Hodgson, E., Nuttall, P. A. Enhancement of virus transmission by tick salivary glands. J. Gen. Virol. 70, 1895-1898 (1989).
- Labuda, M., Nuttall, P. A. Tick-borne viruses. Parasitol. 129, 221-245 (2004).
- Socolovschi, C., Mediannikov, O., Raoult, D., Parola, P. Update on tick-borne bacterial diseases in Europe. Parasite. 16, 259-273 (2009).
- Zhang, L., et al. Molecular Interactions that Enable Movement of the Lyme Disease Agent from the Tick Gut into the Hemolymph. PLoS Pathog. 7, e1002079 (2011).
- Piesman, J., Schneider, B. S. Dynamic changes in Lyme disease spirochetes during transmission by nymphal ticks. Exp. Appl. Acarol. 28, 141-145 (2002).
- Brossard, M., Wikel, S. K. Tick immunobiology. Parasitol. , S161-S176 (2004).
- Machackova, M., Obornik, M., Kopecky, J. Effect of salivary gland extract from Ixodes ricinus ticks on the proliferation of Borrelia burgdorferi sensu stricto in vivo. Folia Parasitol. 53, 153-158 (2006).
- Nuttall, P. A., Labuda, M. Tick-host interactions: saliva-activated transmission. Parasitol. 129, 177-189 (2004).
- Anguita, J., Hedrick, M. N., Fikrig, E. Adaptation of Borrelia burgdorferi in the tick and the mammalian host. FEMS Microbiol. Rev. 27, 493-504 (2003).
- Hovius, J. W., van Dam, A. P., Fikrig, E. Tick-host-pathogen interactions in Lyme borreliosis. Trends Parasitol. 23, 434-438 (2007).
- Dunham-Ems, S. M., et al. Live imaging reveals a biphasic mode of dissemination of Borrelia burgdorferi within ticks. Journal Clin. Invest. 119, 3652-3665 (2009).
- Ribeiro, J. M., Mather, T. N., Piesman, J., Spielman, A. Dissemination and salivary delivery of Lyme disease spirochetes in vector ticks (Acari: Ixodidae). J. Med. Entomol. 24, 201-205 (1987).
- Piesman, J. Transmission of Lyme disease spirochetes (Borrelia burgdorferi. Exp. Appl. Acarol. 7, 71-80 (1989).
- De Silva, A. M., Fikrig, E. Growth and migration of Borrelia burgdorferi in Ixodes ticks during blood feeding. Am. J. Trop. Med. Hyg. 53, 397-404 (1995).
- Horka, H., Cerna-Kyckova, K., Skallova, A., Kopecky, J. Tick saliva affects both proliferation and distribution of Borrelia burgdorferi spirochetes in mouse organs and increases transmission of spirochetes to ticks. Int. J. Med. Microbiol. 299, 373-380 (2009).
- Brossard, M., Wikel, S. K. Immunology of interactions between ticks and hosts. Med. Vet. Entomol. 11, 270-276 (1997).
- Wikel, S. K. Tick modulation of host immunity: an important factor in pathogen transmission. Int. J. Parasitol. 29 (99), 851-859 (1999).
- Binnington, K. C., Kemp, D. H. Role of tick salivary glands in feeding and disease transmission. Adv. Parasitol. 18, 315-339 (1980).
- Guo, X., et al. Inhibition of neutrophil function by two tick salivary proteins. Infect. Immun. 77, 2320-2329 (2009).
- Montgomery, R. R., Lusitani, D., De Boisfleury Chevance, A., Malawista, S. E. Tick saliva reduces adherence and area of human neutrophils. Infect. Immun. 72, 2989-2994 (2004).
- Lima, C. M., et al. Differential infectivity of the Lyme disease spirochete Borrelia burgdorferi derived from Ixodes scapularis salivary glands and midgut. J. Med. Entomol. 42, 506-510 (2005).
- Severinova, J., et al. Co-inoculation of Borrelia afzelii with tick salivary gland extract influences distribution of immunocompetent cells in the skin and lymph nodes of mice. Folia Microbiol. 50, 457-463 (2005).
- Labuda, M., Jones, L. D., Williams, T., Nuttall, P. A. Enhancement of tick-borne encephalitis virus transmission by tick salivary gland extracts. Med. Vet. Entomol. 7, 193-196 (1993).
- Kariu, T., Coleman, A. S., Anderson, J. F., Pal, U. Methods for Rapid Transfer and Localization of Lyme Disease Pathogens Within the Tick Gut. J. Vis. Exp. (48), e2544 (2011).
- Edwards, K. T., Goddard, J., Varela-Stokes, A. S. Examination of the internal morphology of the Ixodid tick Amblyomma maculatum koch, (Acari:Ixodidae); a "How-to" pictorial dissection guide. Midsouth Entomologist. 2, 28-39 (2009).
- Ledin, K. E., et al. Borreliacidal activity of saliva of the tick Amblyomma americanum. Med. Vet. Entomol. 19, 90-95 (2005).
- Ribeiro, J. M., Zeidner, N. S., Ledin, K., Dolan, M. C., Mather, T. N. How much pilocarpine contaminates pilocarpine-induced tick saliva?. Med. Vet. Entomol. 18, 20-24 (2004).
- Barker, R. W., Burris, E., Sauer, J. R., Hair, J. A. Composition of tick oral secretions obtained by three different collection methods. J. Med. Entomol. 10, 198-201 (1973).
- Burgdorfer, W. Hemolymph test. A technique for detection of rickettsiae in ticks. Am. J. Trop. Med. Hyg. 19, 1010-1014 (1970).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved