JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Ixodes Scapularis 진드기의 타액, 침샘 및 Hemolymph 컬렉션
요약
감염된 진드기의 hemolymph, 침샘, 그리고 타액의 컬렉션 병원균이 질병을 일으킬 방법 진드기 매개로 공부하는 것이 중요합니다. 이 프로토콜에서는 먹이로부터 hemolymph과 침샘을 수집하는 방법을 보여줍니다 scapularis을 Ixodes nymphs. 우리는 또한 여성에서 타액 수집을 보여줍니다 전 scapularis 성인.
초록
진드기는 전세계 찾은 많은 진드기 매개로 질병으로 인간을 괴롭히다하고 있습니다. 진드기 라임 병 및 진드기 매개로 회귀열 (Borrelia SPP.), 록키 마운틴 뇌척수 막염 (Rickettsia rickettsii), ehrlichiosis (Ehrlichia chaffeensis와 E 동등), anaplasmosis (Anaplasma phagocytophilum), 뇌염 (똑딱똑딱의 원인 병원체에 대한 벡터입니다 매개 뇌염 바이러스), babesiosis (Babesia SPP.), 콜로라도 진드기 열 (Coltivirus) 및 tularemia (Francisella tularensis) 1-8. 제대로 호스트로 전송하기 위해서는 이러한 전염성 요원들은 differentially, 유전자 발현을 조절 진드기 단백질과 상호 작용하고, 진드기 3,9-13을 통해 마이 그 레이션. 예를 들어, 라임 병 에이전트, Borrelia burgdorferi는 진드기의 enzootic 사이클 14,15의 향연과 기근 단계로 차등 유전자 발현을 통해 적응. 또한, Ixodes의 진드기와 같은가를 소비bloodmeal Borrelia은 복제 및 midgut에서 그들이 침샘을 여행하고 퇴학 타액 9,16-19있는 호스트로 전송될 hemocoel,로 마이 그 레이션.
진드기는 피드로서 호스트는 일반적으로 강한 hemostatic와 타고난 면역 반응 11,13,20-22로 응답합니다. 이러한 호스트 반응에도 불구하고, 전 진드기의 타액은 3,11,20,21,23 먹이 진드기들을위한 immunomodulatory있는 단백질, lytic 대리인, anticoagulants 및 fibrinolysins가 포함되어 있기 때문에 scapularis는 몇 일 동안 먹을 수 있습니다. 진드기의 타액이나 침샘 추출물 (SGE)에 의해 점령 immunomodulatory 활동이 많은 진드기 매개로 병원균 3,20,24-27의 전염, 확산 및 보급을 촉진. 더 이상 그것이 진드기 먹이 적극적으로 해부하고 진드기의 타액을 수집하는 데 필수적이며 전염성 요원들이 질병을 일으킬 방법 진드기 매개로 이해하기 위해서. 이 비디오 프로토콜에 대한 해부 기술을 보여줍니다hemolymph의 수집 및 적극적 나도 먹이로부터 침샘의 제거 scapularis nymphs 48 후 72 시간 포스트 마우스 배치. 우리는 또한 성인 여성 I.에서 타액 수집을 보여줍니다 scapularis 눈금.
프로토콜
1. 슬라이드 준비 Hemolymph 컬렉션
(동영상 1)
- 부드럽게 표면이 멸균을 위해 10 분간 70 % 에탄올에 나서 5 분 3퍼센트 국소 과산화수소의 동물과 장소에서 적극적으로 먹이 진드기를 제거합니다.
- 자궁 펜은 실란 코팅 현미경 슬라이드에 동그라미를 그려와 자궁 펜 서클 내에서 움직이게 장소.
- 실란 코팅 슬라이드는 현미경 슬라이드에 hemolymph 최고의 준수를 위해 사용됩니다.
- 해부 현미경 (1X 목적, 10X 접안 렌즈, 3.5X 배율)에서 진드기를 볼 수 있습니다.
- 부드럽게 진드기의 다리를 넓히다하고 움직이게 고정하기 위해 집게로 진드기의 dorsum 아래로 밀어.
참고 :이 midgut 또는 주사를 움직이게 방해하고 hemolymph을 오염시킬 수 있기를 움직이게 immobilizing가 너무 열심히 누르지 때.
- 일시 진드기의 다리 또는 다리를 절단일회용 메스 벌금 포인트와 전자 말초 관절. 감염을 확인하려면 hemolymph 통해 불과 1 다리는 절단해야합니다. 슬라이드에 hemolymph를 수집 몇 다리를 잘라야 수 있습니다.
참고 :이 hemolymph의 midgut 오염을 일으킬 수 있기 때문에 몸 가까이에 다리를 절단하지 마십시오.
- 다리 또는 다리가 절단되고 나면 부드럽게 슬라이드를 향해 다리를 밖으로 분비하는 hemolymph 위해 진드기의 dorsum에 압력을 적용하는 것을 계속한다. 부드럽게 hemolymph을 확산하기 위해 슬라이드에 주위를 움직이게 이동합니다.
2. 침샘 제거
(영화 2 및 3)
- 인산염의 명소 몇 25 μl 수영장 현미경 슬라이드 위에 식염수 (PBS)를 버퍼와 PBS의 수영장 중 하나에 진드기를 놓습니다.
- 해부 현미경 (1X 목적, 10X 접안 렌즈, 3.5X 배율)에서 진드기를 볼 수 있습니다.
- 미세 스쳐 forcep과 진드기를 안정화기준 capitulum (입 부분)이나 진드기의 후면을 개최하여의.
- 진드기의 후면에 벌금 스쳐 포셉를 삽입하고 진드기가 장기를 노출 dorsum있어 최대 썰어. 원하는 경우 midgut이 시간에 제거하고 현미경 슬라이드에 PBS의 신선한 수영장 또는 PBS를 포함 microfuge 튜브로 전송할 수 있습니다.
- 양자 진드기의 다리 옆에 위치한 침샘 (포도 같은 클러스터)의 쌍을 찾아보십시오. 침샘은 진드기의 잔해가 침샘의 파괴와 손실을 줄이기 위해 PBS의 신선한 풀에 여전히 침샘을 포함하는, 주요 진드기 부분을 이동 사이에서 볼 수없는 경우.
참고 : 이전 먹이에 침샘에 오신 것을 나중에 먹이의에 비해 그들로 개발되지 않았기 때문에 찾을 어렵습니다.
- 미세 스쳐 포셉와 PBS의 신선한 수영장에서 장소와 진드기의 침샘을 제거합니다.
- 무선좋은 일은 포셉 어떤 외부 미생물과 진드기의 부스러기를 제거하려면이 세차 스텝에게 3-4 번 이상을 반복, 또 다른 깨끗한 25 μl PBS 수영장으로 침샘을 전송 줬지.
참고 : 각각의 침샘의 손실과 혼란을 줄이기 위해 부드럽게 침샘 클러스터를 씻으십시오.
- 실란 코팅 슬라이드에 PBS의 깨끗한 수영장으로 또는 PBS를 포함 microfuge 관의 분비를 놓습니다.
3. 침이 수집
(영화 4)
- 부드럽게 토끼 또는 완전히 부풀어 오른 그들이 내려준 직전 벌금 스쳐 포셉, 약 5~7일 후 첨부 파일을 사용하여 다른 호스트에서 성인 여성의 진드기를 제거합니다.
- 스카치 테이프와 현미경 슬라이드의 한쪽 끝을 향해 거의 부풀어 오른 무슨일을 준수합니다. 테이프는 대략 위치해야 일정한 머리쪽으로 진드기의 dorsum까지 방식 때문에, 진드기의 기준 capitulum (입 부분)가 노출 떠난다.
- 테이프가 5 % pilocarpine 솔루션의 진드기 등 부분의 표면 pipet 5 μl (메탄올에서)의 앞부분은 가장자리를 만나는 곳. 테이프가 pilocarpine은 진드기의 기준 capitulum 접촉 수없이 진드기의 dorsum 이상 pilocarpine을 심하도록 허용합니다.
- 현미경 슬라이드를 향해 무독성 모델링 찰흙 조각 진드기의 mouthparts에서 약 1 인치를 탑재합니다.
- 좋은 스쳐 포셉 원하는 직경으로 뽑았 모세관 28 팁을 끊다 사용합니다.
- 해부 현미경 진드기의 기준 capitulum를 볼 수 있습니다.
- 부드럽게 상악 palps는 모세관 튜브의 외부에있는 수 있도록 뽑아 모세관으로 진드기의 hypostome 맞네요.
- 모세관 장소에서 잡고 모델링 찰흙으로 모세관 튜브의 반대쪽 끝을 누르십시오.
- 높은 습도 (예, 젖은 아빠 줄지어 lidded 스티로폼 상자와 어두운 챔버 내부에 탑재된 침 진드기를 배치 어 수건). 중력이 타액 수집을 도울 수 있도록 hypostome 점 때문에 컨테이너의 하단에 슬라이드를 기울이십시오.
- 상온에서 컨테이너를 배치합니다.
- 밀접하게 1 시간 침 진드기를 모니터링하고, 그것이 파스퇴르의 pipet 벌브와 모세관 튜브 밖으로 추방에 의해 생성되기 때문에 타액을 수집합니다. 첫 번째 시간 후 최소 4 시간 동안 축적 매 시간을 확인합니다. 그것이 생성되기 때문에 타액을 수집하기 위해 계속합니다.
참고 : 충분한 타액이 수행되고있는 연구를 위해 수집되면 타액 수집이 중지됩니다.
- 진드기 침되지 않는 이상 타액이 필요할 경우, 타액의 분비는 가끔 hypostome 마사지하는 모세관 튜브를 사용하여 유도된 수있다면.
- 필요한 ° C까지 -80시 타액과 저장소에 테아제 억제제 칵테일의 0.1 볼륨을 추가합니다.
4. 대표 결과
e_content은 "> 영화 1은 부분적으로 싫증이 난 scapularis 요정을 보유하고 현미경 슬라이드에 hemolymph를 수집하기 위해 다리를 절단하는 방법을 보여줍니다. 다리 또는 다리가 맑은 액체가 (그림 1A와 1B) 분비되어 절단되면. 경우 midgut hemolymph 그것이 그대로 흐린 나타나는 절단 다리 (들) (그림 1C 및 1D)로 나오는 파열된다.요정 48 또는 72 시간 동안 수유 후에도 침샘의 추출이 영화는 2와 3에서 증명된다. 진드기가 파편이 많이 일반적으로이 구멍되면 (기관, malpighian tubules, 혈액 구성되어, 결합 조직 등) 침샘의 손실이나 파괴를 방지하기는 PBS의 신선한 풀에 진드기 이동합니다. 요정이 오픈 컷 후 침샘이있는 그림 2A와 2B 쇼와 그림 2C는 PBS의 수영장에 침샘 클러스터를 제거 보여줍니다.
침이 컬렉션 전에서 설정 scapularis 성인 여성 전 s의 영화 4 그림 3. 모세관 튜브에 침 진드기가 영화 5에서 관찰된다. 타액의 분비를 자극하고, 성인 여성 진드기 당 타액의 20 μl를 통해 얻을 수있는 pilocarpine를 사용한 타액 수집이 메서드는.
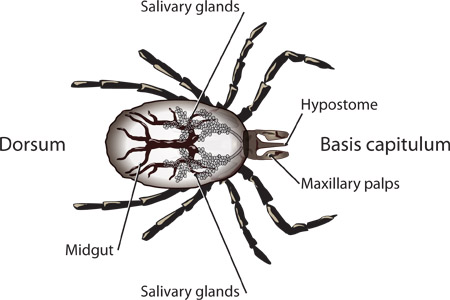
그림 1. I.의 scapularis의 요정의 라벨 구조.
영화 1. Ixodes scapularis hemolymph 컬렉션은. 영화를 시청하려면 여기를 클릭하십시오 .

그림 2. 오염 (& B)와 요정의 다리에서 exuding (C & D) hemolymph를 오염.
48시간 먹이기 전의 영화 2. 침샘 추출 scapularis 요정.pload/3894/3894movie2.avi은 "> 영화를보고하려면 여기를 클릭하십시오.
72시간 먹이기 전의 영화 3. 침샘 추출 scapularis 요정. 영화를 시청하려면 여기를 클릭하십시오 .
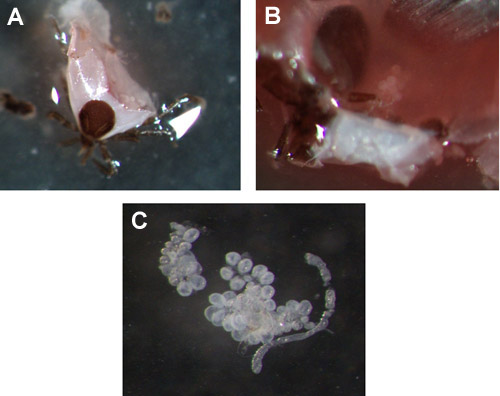
그림 3. Ixodes scapularis 요정 침샘. (& B)를 사전에 추출에 72시간 수사관 요정의 침샘의 예. (C) 침샘 클러스터를 삭제했습니다.
영화 4. 침이 컬렉션은 성인 전에서 설정 scapularis 여성 눈금. 영화를 시청하려면 여기를 클릭하십시오 .

성인 전에서 그림 4. 타액 수집 scapularis여 ticks. (& B) 모델링 클레이 주최 모세관 튜브의 unpulled 끝에있는 모세관 튜브 뽑아 결국 그 hypostome있는 슬라이드 마운트 틱. (C & D) 침 성인 전을 포함한 Humidified 챔버 scapularis 여성 가고 있습니다.
영화 5. 모세관 튜브에 침 scapularis 여성 무슨일을 Ixodes. 영화를 시청하려면 여기를 클릭하십시오 .
토론
진드기의 hemolymph, 침샘, 그리고 타액의 컬렉션 진드기 매개로 병원체 전송 연구에 중요하다, 유행, 보급, 확산, 그리고 진드기 및 호스트 6,11-13,20,23,29 모두에서 끈기. 진드기 30,31 해부하는 방법에는 여러 가지가 있습니다. 그러나 침샘을 수집했을 때 제대로 때문에 침샘이 파열이나 진드기의 유골이 안되는 진드기를 해부하는 것이 중요합니다. 침샘들이 midgut 오염을 제거하고 침?...
공개
우리는 공개 할게 없다.
감사의 말
저자는 벡터 매개로 질환 동물 리소스 지점 부문 감사드립니다, 특히 안드레아 피터슨, 리사 Massoudi, Verna 오브라이언, 그리고 생쥐와 토끼들의 관심과 유지 보수를위한 존 Liddell. 우리는 또한이 원고 향한 그들의 공헌에 대해 에이미 Ullmann, 테레사 러셀, 그리고 바바라 J. 존슨 감사드립니다. 마지막으로, 우리는이 원고의 촬영과 관련된 모든 위법를 찍는 동안 그래픽 삽화와 주디 Lavelle를 생산 CDC에서 커뮤니케이 션을위한 준회원 이사의 사무실에 Alissa Eckert을 인정하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약 | 회사 | 카탈로그 번호 | |
| 과산화수소 | 어부 | H312-500 | |
| 에탄올 | Acros | 61509-5000 | |
| PBS | 보스턴 Bioproducts | BM-2205 | |
| 뒤몽 파인 포셉 (3C) | 어부 | NC9906085 | |
| 실란 처리 현미경 슬라이드 | Bioworld | 42763007-1 | |
| 자궁 펜 | Bioworld | 21750008-1 | |
| 슈퍼 서리 플러스 현미경 슬라이드 | 어부 | 12-550-18 | |
| Pilocarpine | 시그마 | P6503-5G | |
| 테아제 억제제 칵테일 | 시그마 | P2714 | |
| # 11 메스 일회용 | 깃털 | 2975 # 11 | |
| 독성 모델링 점토 | 피셔 | S17307 | |
| 모세관 튜브 | 체이스 과학적 유리, INC | 40A502 |
참고문헌
- Quach, K. A., Boctor, F. N., Elston, D. M. What's eating you? Hyalomma ticks. Cutis. 87, 165-167 (2011).
- Graham, J., Stockley, K., Goldman, R. D. Tick-borne illnesses: a CME update. Pediatr. Emerg. Care. 27, 141-147 (2011).
- Nuttall, P. A., Paesen, G. C., Lawrie, C. H., Wang, H. Vector-host interactions in disease transmission. J. Mol. Microbiol. Biotechnol. 2, 381-386 (2000).
- Estrada-Pena, A., Jongejan, F. Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. Exp. Appl. Acarol. 23, 685-715 (1999).
- Nuttall, P. A. Pathogen-tick-host interactions: Borrelia burgdorferi and TBE virus. Zentralbl Bakteriol. 289, 492-505 (1999).
- Jones, L. D., Hodgson, E., Nuttall, P. A. Enhancement of virus transmission by tick salivary glands. J. Gen. Virol. 70, 1895-1898 (1989).
- Labuda, M., Nuttall, P. A. Tick-borne viruses. Parasitol. 129, 221-245 (2004).
- Socolovschi, C., Mediannikov, O., Raoult, D., Parola, P. Update on tick-borne bacterial diseases in Europe. Parasite. 16, 259-273 (2009).
- Zhang, L., et al. Molecular Interactions that Enable Movement of the Lyme Disease Agent from the Tick Gut into the Hemolymph. PLoS Pathog. 7, e1002079 (2011).
- Piesman, J., Schneider, B. S. Dynamic changes in Lyme disease spirochetes during transmission by nymphal ticks. Exp. Appl. Acarol. 28, 141-145 (2002).
- Brossard, M., Wikel, S. K. Tick immunobiology. Parasitol. , S161-S176 (2004).
- Machackova, M., Obornik, M., Kopecky, J. Effect of salivary gland extract from Ixodes ricinus ticks on the proliferation of Borrelia burgdorferi sensu stricto in vivo. Folia Parasitol. 53, 153-158 (2006).
- Nuttall, P. A., Labuda, M. Tick-host interactions: saliva-activated transmission. Parasitol. 129, 177-189 (2004).
- Anguita, J., Hedrick, M. N., Fikrig, E. Adaptation of Borrelia burgdorferi in the tick and the mammalian host. FEMS Microbiol. Rev. 27, 493-504 (2003).
- Hovius, J. W., van Dam, A. P., Fikrig, E. Tick-host-pathogen interactions in Lyme borreliosis. Trends Parasitol. 23, 434-438 (2007).
- Dunham-Ems, S. M., et al. Live imaging reveals a biphasic mode of dissemination of Borrelia burgdorferi within ticks. Journal Clin. Invest. 119, 3652-3665 (2009).
- Ribeiro, J. M., Mather, T. N., Piesman, J., Spielman, A. Dissemination and salivary delivery of Lyme disease spirochetes in vector ticks (Acari: Ixodidae). J. Med. Entomol. 24, 201-205 (1987).
- Piesman, J. Transmission of Lyme disease spirochetes (Borrelia burgdorferi. Exp. Appl. Acarol. 7, 71-80 (1989).
- De Silva, A. M., Fikrig, E. Growth and migration of Borrelia burgdorferi in Ixodes ticks during blood feeding. Am. J. Trop. Med. Hyg. 53, 397-404 (1995).
- Horka, H., Cerna-Kyckova, K., Skallova, A., Kopecky, J. Tick saliva affects both proliferation and distribution of Borrelia burgdorferi spirochetes in mouse organs and increases transmission of spirochetes to ticks. Int. J. Med. Microbiol. 299, 373-380 (2009).
- Brossard, M., Wikel, S. K. Immunology of interactions between ticks and hosts. Med. Vet. Entomol. 11, 270-276 (1997).
- Wikel, S. K. Tick modulation of host immunity: an important factor in pathogen transmission. Int. J. Parasitol. 29 (99), 851-859 (1999).
- Binnington, K. C., Kemp, D. H. Role of tick salivary glands in feeding and disease transmission. Adv. Parasitol. 18, 315-339 (1980).
- Guo, X., et al. Inhibition of neutrophil function by two tick salivary proteins. Infect. Immun. 77, 2320-2329 (2009).
- Montgomery, R. R., Lusitani, D., De Boisfleury Chevance, A., Malawista, S. E. Tick saliva reduces adherence and area of human neutrophils. Infect. Immun. 72, 2989-2994 (2004).
- Lima, C. M., et al. Differential infectivity of the Lyme disease spirochete Borrelia burgdorferi derived from Ixodes scapularis salivary glands and midgut. J. Med. Entomol. 42, 506-510 (2005).
- Severinova, J., et al. Co-inoculation of Borrelia afzelii with tick salivary gland extract influences distribution of immunocompetent cells in the skin and lymph nodes of mice. Folia Microbiol. 50, 457-463 (2005).
- Labuda, M., Jones, L. D., Williams, T., Nuttall, P. A. Enhancement of tick-borne encephalitis virus transmission by tick salivary gland extracts. Med. Vet. Entomol. 7, 193-196 (1993).
- Kariu, T., Coleman, A. S., Anderson, J. F., Pal, U. Methods for Rapid Transfer and Localization of Lyme Disease Pathogens Within the Tick Gut. J. Vis. Exp. (48), e2544 (2011).
- Edwards, K. T., Goddard, J., Varela-Stokes, A. S. Examination of the internal morphology of the Ixodid tick Amblyomma maculatum koch, (Acari:Ixodidae); a "How-to" pictorial dissection guide. Midsouth Entomologist. 2, 28-39 (2009).
- Ledin, K. E., et al. Borreliacidal activity of saliva of the tick Amblyomma americanum. Med. Vet. Entomol. 19, 90-95 (2005).
- Ribeiro, J. M., Zeidner, N. S., Ledin, K., Dolan, M. C., Mather, T. N. How much pilocarpine contaminates pilocarpine-induced tick saliva?. Med. Vet. Entomol. 18, 20-24 (2004).
- Barker, R. W., Burris, E., Sauer, J. R., Hair, J. A. Composition of tick oral secretions obtained by three different collection methods. J. Med. Entomol. 10, 198-201 (1973).
- Burgdorfer, W. Hemolymph test. A technique for detection of rickettsiae in ticks. Am. J. Trop. Med. Hyg. 19, 1010-1014 (1970).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유