需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
唾液,唾液腺,淋巴收集肩突硬蜱蜱
摘要
蜱血淋巴感染,唾液腺和唾液的收集是非常重要的研究蜱传病原体引起疾病。在这个协议中,我们演示了如何收集喂血淋巴和唾液腺肩突硬蜱若虫。我们还表明,从女性的唾液收集一。肩胛成年人。
摘要
蜱遍布世界各地,并与许多蜱传疾病的折磨人类。蜱是莱姆病和蜱传回归热( 伯氏菌),洛矶山斑疹热( 立克次氏体 ),埃立克体病( 查菲埃立克体和E.球菌 ),无形体病( 嗜吞噬细胞无形体 ),脑炎(蜱的病原体引起的载体森林脑炎病毒),巴贝斯虫病( 巴贝斯虫属),科罗拉多蜱热(Colti病毒),兔热病( 弗朗西斯tularensis)1-8。要正确传输到主机,这些传染性病原体的差异调节基因表达,与蜱蛋白质交互,并通过蜱3,9-13迁移。例如,莱姆病代理, 莱姆病 ,蜱的地方性周期14,15盛宴和饥荒阶段适应,通过基因差异表达。此外,作为硬蜱蜱消耗吸血伯从肠到的hemocoel,他们前往唾液腺,并传送到主机与被驱逐的唾液9,16-19复制和迁移。
由于蜱送入主机通常响应与一个强大的止血和先天免疫反应11,13,20-22。尽管这些宿主反应, 一肩胛可以养活了好几天,因为蜱唾液中含有的免疫调节的蛋白质,溶解剂,抗凝血剂,并fibrinolysins帮助蜱喂养3,11,20,21,23。由蜱唾液或唾液腺提取物(SGE)具有免疫调节活动方便,众多的蜱传病原体3,20,24-27的传输,扩散和传播。为了进一步了解如何蜱传播的传染性病原体引起的疾病,它是必不可少的积极剖析饲养蜱和收集蜱唾液。这个视频协议演示的夹层技术从积极喂养一血淋巴的收集和唾液腺的去除肩胛若虫后,48和72小时后鼠标的位置。我们还表明,从一成年女性唾液收集肩胛蜱。
研究方案
1。幻灯片准备的淋巴集合
(电影1)
- 动物和外用3%过氧化氢的地方,轻轻地从积极喂养蜱5分钟,然后在70%乙醇10分钟,到表面消毒。
- 与PAP笔硅烷涂层显微镜幻灯片上绘制一个圆,并放置在PAP笔圈的刻度。
- 硅烷涂层幻灯片用最好的淋巴坚持显微镜幻灯片。
- 在解剖显微镜下(1X目标,10X目镜,放大倍率3.5X)蜱。
- 用钳子轻轻地往下推,瘫倒蜱的腿和固定滴答滴答的背部。
注:固定蜱时不要按太硬,因为这可能会破坏肠或穿刺蜱和污染淋巴。
- 截肢日蜱的腿或腿é远端关节用细点,一次性手术刀。要确定传染性,通过淋巴只有1腿需要截肢。为幻灯片上的淋巴集合几个腿被截肢。
注:切不要太靠近身体的腿,因为这可能会导致肠污染的淋巴。
- 腿或腿被切断后,继续为淋巴分泌到幻灯片的腿轻轻涂抹蜱的背部的压力。轻轻移动在幻灯片上的刻度,周围传播的淋巴。
2。唾液腺切除
(电影2及3)
- 现场数25μL池磷酸盐缓冲液(PBS),并放置到显微镜玻片PBS的池成蜱。
- 在解剖显微镜下(1X目标,10X目镜,放大倍率3.5X)蜱。
- 与精尖夹钳稳定的刻度S由控股的基础上花序(口器)或蜱背面。
- 插入蜱背面的细尖镊子和切片,蜱的背部暴露的器官。如果需要的肠可以被删除在这个时候,转移到新鲜的PBS在显微镜幻灯片池或含PBS到离心管。
- 找到一双位于双边沿着腿蜱唾液腺(葡萄状簇)。如果唾液腺是不可见的,其中包括蜱碎片移动的主要刻度部分,仍然含有唾液腺,新鲜的PBS池,以减少唾液腺的破坏和损失。
注:在喂食早些时候,唾液腺也很难找到,因为它们没有发达相比,后来在喂养。
- 删除与精尖的镊子和新鲜的PBS池发生的蜱唾液腺。
- 无线网络日罚款放倒钳唾液腺转移到另一个干净的25μLPBS池,重复此清洗步骤3-4次,以消除任何外部的微生物和蜱碎片。
注意:洗净,轻轻地减少损失和破坏个人的唾液腺唾液腺集群。
- 放入清洁池的PBS硅烷涂层幻灯片或含PBS在离心管的腺体。
3。唾液收集
(动画4)
- 轻轻地取出成年雌蜱从兔或其他主机采用精尖的镊子,就在他们下车完全充血,附件后约5-7天。
- 坚持到显微镜幻灯片用透明胶带的一端近肿胀蜱。磁带应放在约四分之三向上剔的背部向头部的方式,留下蜱的基础花序(口器)暴露。
- 磁带凡符合蜱背表面吸管5%的毛果芸香碱溶液5μL(甲醇)的前缘。让磁带罗卡没有让罗卡接触蜱的基础花序,灯芯在蜱的背部。
- 挂载到显微镜玻片无毒黏土一块约一英寸从蜱的口器。
- 用细尖镊子折断,一把拉住毛细管28到所需直径的小费。
- 在解剖显微镜下查看蜱的基础花序。
- 轻轻放入上颌触须向驻留在毛细管外拉毛细管管蜱的hypostome的。
- 按入泥毛细管的另一端举行的毛细管到位。
- 将高湿度(例如,一个有盖的发泡胶盒内衬湿PAP内暗室安装垂涎三尺蜱呃毛巾)。倾斜所以hypostome点到容器底部的幻灯片,让重力帮助收集唾液中。
- 在室温下放置容器。
- 密切监察垂涎三尺的第一个小时的蜱,并收集唾液,因为它是与巴斯德吸管灯泡的驱逐毛细管产生。在第一个小时后,检查每隔一小时至少4个小时的积累。继续收集,因为它产生的唾液。
注:一旦足够的唾液可以停止正在执行的研究收集唾液采集。
- 如果蜱是不垂涎三尺,如果需要更多的唾液,唾液可偶尔使用毛细管按摩hypostome诱导。
- 新增0.1唾液和存储在-80°C,直到所需的蛋白酶抑制剂的鸡尾酒卷。
4。代表结果
e_content">电影演示如何把握部分喂养的一肩胛若虫和截肢的腿,收集到显微镜玻片淋巴。一旦腿或腿截肢分泌流畅清晰(图1A和1B)。如果肠破裂淋巴出现浑浊,因为它是截肢(S)(图1C和1D)。电影中的第2和第3若虫后,已为48或72小时喂食唾液腺提取证明。蜱被刺破后,通常是一个有很多杂物(包括气管,马氏管,血液,结缔组织等),以防止丢失或破坏唾液腺移动蜱新鲜的PBS池。图2A和2B显示唾液腺位于若虫已被切开后,图2c显示唾液腺集群中删除的PBS池。
唾液收集从一成立肩胛成年女性,我在电影4和图3 S所示。蜱成毛细管垂涎三尺观察在电影5。这唾液收集方法用毛果芸香碱刺激唾液分泌,可收益率超过20%的成年女性蜱唾液微升。
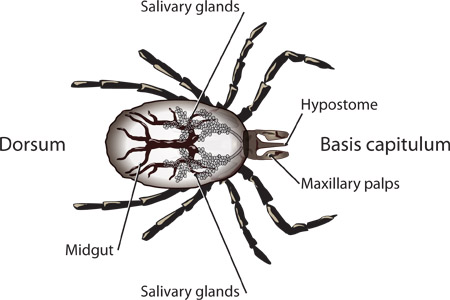
图1。结构的一肩胛若虫的标记。
电影1。 肩突硬蜱血淋巴收集。 点击这里看电影 。

图2。无公害(A和B)和污染(拆建)若虫的腿血淋巴渗出。
电影2。从48小时喂一唾液腺提取肩胛若虫。pload/3894/3894movie2.avi">点击这里看电影。
电影3。从72小时喂一唾液腺提取肩胛若虫。 点击这里看电影 。
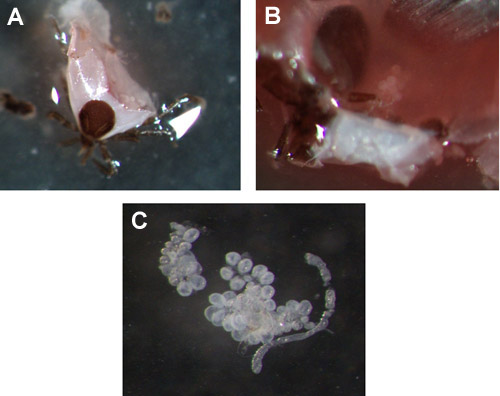
图3。 肩突硬蜱若虫唾液腺。 (A和B)唾液腺的例子,在72小时喂食若虫,前提取。 (c)删除唾液腺集群。
电影4。唾液收集从一个成人一成立肩胛女性蜱。 点击这里看电影 。

从一成人的唾液收集图4。 肩胛女式Ticks。 (A和B)勾选安装其在拉底与unpulled由黏土举行的毛细管毛细管hypostome的幻灯片上。 (拆建)湿盒含有垂涎三尺成人一肩胛雌蜱。
电影5。 肩突硬蜱的女性蜱成毛细管垂涎三尺。 点击这里观看电影 。
讨论
蜱血淋巴,唾液腺和唾液的收集是非常重要的研究蜱传病原体传播,流行,传播,扩散,并在双方的滴答和主机6,11-13,20,23,29的持久性。有几种方法剖析蜱30,31的 。然而,当收集唾液腺关键是正确剖析蜱唾液腺不破裂,或在蜱的遗体丢失。一旦被删除要洗几次,清除肠污染,然后可以固定获得唾液腺提取物(SGE)染色或PBS地面幻灯片上,他们需要从蜱唾液腺。上海黄金交易所是更?...
披露声明
我们什么都没有透露。
致谢
作者要感谢病媒传播疾病的动物资源科司,特别是安德烈彼得森,丽莎马苏迪,贝尔纳奥布莱恩,约翰·利德尔的老鼠和兔子的关心和维护。我们也想感谢艾米·乌尔曼,特里萨·拉塞尔,和Barbara J.约翰逊朝着这个手稿的贡献。最后,我们想承认艾丽萨埃克特通信在疾病预防控制中心副主任办公室指导拍摄这个手稿与所有相关的合法性产生的插图和朱迪·拉维尔。
材料
| Name | Company | Catalog Number | Comments |
| 试剂 | 公司 | 目录编号 | |
| 过氧化氢 | 费舍尔 | H312-500 | |
| 乙醇 | 阿库罗斯福冈 | 61509-5000 | |
| PBS | 波士顿生物制品 | BM-2205 | |
| 杜蒙精细镊子(3C) | 费舍尔 | NC9906085 | |
| 硅烷偶联剂处理的载玻片 | bioworld | 42763007-1 | |
| 子宫颈抹片笔 | bioworld | 21750008-1 | |
| 超级霜加显微镜载玻片 | 费舍尔 | 12-550-18 | |
| 匹罗卡品 | 西格玛 | P6503-5G | |
| 蛋白酶抑制剂 | 西格玛 | P2714 | |
| #11一次性手术刀 | 羽毛 | 2975# | |
| 无毒橡皮泥 | 费舍尔 | S17307 | |
| 毛细管 | 大通科研玻璃,公司 | 40A502 |
参考文献
- Quach, K. A., Boctor, F. N., Elston, D. M. What's eating you? Hyalomma ticks. Cutis. 87, 165-167 (2011).
- Graham, J., Stockley, K., Goldman, R. D. Tick-borne illnesses: a CME update. Pediatr. Emerg. Care. 27, 141-147 (2011).
- Nuttall, P. A., Paesen, G. C., Lawrie, C. H., Wang, H. Vector-host interactions in disease transmission. J. Mol. Microbiol. Biotechnol. 2, 381-386 (2000).
- Estrada-Pena, A., Jongejan, F. Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. Exp. Appl. Acarol. 23, 685-715 (1999).
- Nuttall, P. A. Pathogen-tick-host interactions: Borrelia burgdorferi and TBE virus. Zentralbl Bakteriol. 289, 492-505 (1999).
- Jones, L. D., Hodgson, E., Nuttall, P. A. Enhancement of virus transmission by tick salivary glands. J. Gen. Virol. 70, 1895-1898 (1989).
- Labuda, M., Nuttall, P. A. Tick-borne viruses. Parasitol. 129, 221-245 (2004).
- Socolovschi, C., Mediannikov, O., Raoult, D., Parola, P. Update on tick-borne bacterial diseases in Europe. Parasite. 16, 259-273 (2009).
- Zhang, L., et al. Molecular Interactions that Enable Movement of the Lyme Disease Agent from the Tick Gut into the Hemolymph. PLoS Pathog. 7, e1002079 (2011).
- Piesman, J., Schneider, B. S. Dynamic changes in Lyme disease spirochetes during transmission by nymphal ticks. Exp. Appl. Acarol. 28, 141-145 (2002).
- Brossard, M., Wikel, S. K. Tick immunobiology. Parasitol. , S161-S176 (2004).
- Machackova, M., Obornik, M., Kopecky, J. Effect of salivary gland extract from Ixodes ricinus ticks on the proliferation of Borrelia burgdorferi sensu stricto in vivo. Folia Parasitol. 53, 153-158 (2006).
- Nuttall, P. A., Labuda, M. Tick-host interactions: saliva-activated transmission. Parasitol. 129, 177-189 (2004).
- Anguita, J., Hedrick, M. N., Fikrig, E. Adaptation of Borrelia burgdorferi in the tick and the mammalian host. FEMS Microbiol. Rev. 27, 493-504 (2003).
- Hovius, J. W., van Dam, A. P., Fikrig, E. Tick-host-pathogen interactions in Lyme borreliosis. Trends Parasitol. 23, 434-438 (2007).
- Dunham-Ems, S. M., et al. Live imaging reveals a biphasic mode of dissemination of Borrelia burgdorferi within ticks. Journal Clin. Invest. 119, 3652-3665 (2009).
- Ribeiro, J. M., Mather, T. N., Piesman, J., Spielman, A. Dissemination and salivary delivery of Lyme disease spirochetes in vector ticks (Acari: Ixodidae). J. Med. Entomol. 24, 201-205 (1987).
- Piesman, J. Transmission of Lyme disease spirochetes (Borrelia burgdorferi. Exp. Appl. Acarol. 7, 71-80 (1989).
- De Silva, A. M., Fikrig, E. Growth and migration of Borrelia burgdorferi in Ixodes ticks during blood feeding. Am. J. Trop. Med. Hyg. 53, 397-404 (1995).
- Horka, H., Cerna-Kyckova, K., Skallova, A., Kopecky, J. Tick saliva affects both proliferation and distribution of Borrelia burgdorferi spirochetes in mouse organs and increases transmission of spirochetes to ticks. Int. J. Med. Microbiol. 299, 373-380 (2009).
- Brossard, M., Wikel, S. K. Immunology of interactions between ticks and hosts. Med. Vet. Entomol. 11, 270-276 (1997).
- Wikel, S. K. Tick modulation of host immunity: an important factor in pathogen transmission. Int. J. Parasitol. 29 (99), 851-859 (1999).
- Binnington, K. C., Kemp, D. H. Role of tick salivary glands in feeding and disease transmission. Adv. Parasitol. 18, 315-339 (1980).
- Guo, X., et al. Inhibition of neutrophil function by two tick salivary proteins. Infect. Immun. 77, 2320-2329 (2009).
- Montgomery, R. R., Lusitani, D., De Boisfleury Chevance, A., Malawista, S. E. Tick saliva reduces adherence and area of human neutrophils. Infect. Immun. 72, 2989-2994 (2004).
- Lima, C. M., et al. Differential infectivity of the Lyme disease spirochete Borrelia burgdorferi derived from Ixodes scapularis salivary glands and midgut. J. Med. Entomol. 42, 506-510 (2005).
- Severinova, J., et al. Co-inoculation of Borrelia afzelii with tick salivary gland extract influences distribution of immunocompetent cells in the skin and lymph nodes of mice. Folia Microbiol. 50, 457-463 (2005).
- Labuda, M., Jones, L. D., Williams, T., Nuttall, P. A. Enhancement of tick-borne encephalitis virus transmission by tick salivary gland extracts. Med. Vet. Entomol. 7, 193-196 (1993).
- Kariu, T., Coleman, A. S., Anderson, J. F., Pal, U. Methods for Rapid Transfer and Localization of Lyme Disease Pathogens Within the Tick Gut. J. Vis. Exp. (48), e2544 (2011).
- Edwards, K. T., Goddard, J., Varela-Stokes, A. S. Examination of the internal morphology of the Ixodid tick Amblyomma maculatum koch, (Acari:Ixodidae); a "How-to" pictorial dissection guide. Midsouth Entomologist. 2, 28-39 (2009).
- Ledin, K. E., et al. Borreliacidal activity of saliva of the tick Amblyomma americanum. Med. Vet. Entomol. 19, 90-95 (2005).
- Ribeiro, J. M., Zeidner, N. S., Ledin, K., Dolan, M. C., Mather, T. N. How much pilocarpine contaminates pilocarpine-induced tick saliva?. Med. Vet. Entomol. 18, 20-24 (2004).
- Barker, R. W., Burris, E., Sauer, J. R., Hair, J. A. Composition of tick oral secretions obtained by three different collection methods. J. Med. Entomol. 10, 198-201 (1973).
- Burgdorfer, W. Hemolymph test. A technique for detection of rickettsiae in ticks. Am. J. Trop. Med. Hyg. 19, 1010-1014 (1970).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。