É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A saliva, glândula salivar, e Coleta de hemolinfa de carrapatos Ixodes scapularis
Neste Artigo
Resumo
A coleta de hemolinfa do carrapato infectado, glândulas salivares e saliva é importante estudar como a transmitida por carrapatos patógenos causam doenças. Neste protocolo, demonstramos como coletar glândulas salivares e hemolinfa de alimentação Ixodes scapularis Ninfas. Nós também demonstramos a coleta da saliva da fêmea I. scapularis Adultos.
Resumo
Carrapatos são encontrados em todo o mundo e afligem os seres humanos com muitas doenças transmitidas por carrapatos. Os carrapatos são vetores de patógenos que causam a doença de Lyme e transmitida por carrapatos febre recorrente (Borrelia spp.), Febre maculosa (Rickettsia rickettsii), erliquiose (Ehrlichia chaffeensis e E. equi), anaplasmose (Anaplasma phagocytophilum), encefalite (tick- vírus da encefalite transmitida), babesiose (Babesia spp.), Colorado febre do carrapato (Coltivirus), e tularemia (Francisella tularensis) 1-8. Para ser adequadamente transmitida para o anfitrião destes agentes infecciosos diferencialmente regulam a expressão gênica, interagir com as proteínas de carrapatos, e migram através do carrapato 3,9-13. Por exemplo, o agente da doença de Lyme, Borrelia burgdorferi, adapta-se através da expressão diferencial de genes para as fases de festa e fome de ciclo enzoótico do carrapato 14,15. Além disso, como carrapatos um Ixodes consome umafarinha de sangue Borrelia replicar e migrar do intestino para a hemocele, onde eles viajam para as glândulas salivares e são transmitidos para o host com a saliva expelida 9,16-19.
Como um carrapato se alimenta do hospedeiro geralmente responde com uma resposta hemostática e inata imunológico forte 11,13,20-22. Apesar destas respostas de acolhimento, I. scapularis pode se alimentar por vários dias porque a saliva do carrapato contém proteínas que são imunomoduladores, agentes líticos, anticoagulantes, e fibrinolysins para ajudar o carrapato alimentando 3,11,20,21,23. As atividades imunomoduladoras possuídos pela saliva do carrapato ou extrato de glândula salivar (SGE) facilitar a transmissão, a proliferação e disseminação de inúmeros carrapatos patógenos 3,20,24-27. Para entender melhor como carrapatos agentes infecciosos causam a doença é essencial para dissecar alimentando ativamente carrapatos e coletar a saliva do carrapato. Este protocolo de vídeo demonstra técnicas de dissecação paraa recolha de hemolinfa e à remoção das glândulas salivares de alimentação activamente I. scapularis ninfas após 48 e 72 horas pós posicionamento do mouse. Nós também demonstramos a coleta da saliva de uma fêmea adulta I. carrapato scapularis.
Protocolo
1. Coleta de hemolinfa para a preparação de slides
(Filme 1)
- Remover suavemente activamente carrapatos de alimentação a partir de um animal e em lugar de peróxido de hidrogénio a 3% tópica durante 5 minutos e, em seguida, em etanol a 70% durante 10 minutos à superfície esterilizar.
- Com uma caneta pap desenhar um círculo sobre uma lâmina de microscópio com revestimento de silano e coloque o carrapato dentro do círculo caneta pap.
- Silano lâminas revestidas são utilizados para melhor adesão da hemolinfa para a lâmina de microscópio.
- Ver o carrapato sob um microscópio de dissecação (1X objetivo, ocular de 10X, a ampliação 3.5X).
- Com cuidado, empurre para baixo no dorso do carrapato com uma pinça para afunilar as pernas do carrapato e imobilizar o carrapato.
Nota: Quando imobilizar o carrapato não pressionar muito difícil, porque isso pode prejudicar o intestino ou perfure o carrapato e contaminar a hemolinfa.
- Amputar a perna do carrapato ou pernas em diaconjunto e distal com uma ponta fina descartável bisturi. Para determinar a infectividade via hemolinfa apenas 1 perna precisa ser amputado. Para a coleta de hemolinfa sobre uma lâmina várias pernas pode ser amputado.
Nota: Não corte a perna muito perto do corpo, porque isso pode causar a contaminação do intestino médio da hemolinfa.
- Após a perna ou pernas são cortadas continuar a aplique uma pressão suave dorso do carrapato para a hemolinfa para secretar fora das pernas para o slide. Mova suavemente o carrapato em torno sobre o slide para espalhar a hemolinfa.
2. Remoção completa da glândula salivar
(Filmes 2 e 3)
- Spot de vários pools 25 ul de tampão fosfato salino (PBS) numa lâmina de microscópio e colocar uma carraça em uma das piscinas PBS.
- Ver o carrapato sob um microscópio de dissecação (1X objetivo, ocular de 10X, a ampliação 3.5X).
- Estabilizar o carrapato com pinça ponta finas, segurando o capitulum base (partes da boca) ou a parte traseira da carraça.
- Inserir a pinça de ponta fina na parte traseira do carrapato e fatiar o carrapato é dorso que expõem os órgãos. Se desejado, o intestino médio pode ser removido neste momento e transferido para um pool de fresco de PBS numa lâmina de microscópio ou para um tubo de microcentrífuga contendo PBS.
- Encontre o par de glândulas salivares (uva-como clusters) localizados bilateralmente ao lado das pernas do carrapato. Se as glândulas salivares não são visíveis entre os detritos carrapato mover a porção de carraça principal, ainda contendo as glândulas salivares, a um pool de fresco de PBS para reduzir a ruptura ea perda das glândulas salivares.
Nota: No início de uma alimentação, as glândulas salivares são mais difíceis de localizar, porque não são tão desenvolvido como comparado com mais tarde na alimentação.
- Retire as glândulas salivares do carrapato com uma pinça com pontas finas e coloque em uma piscina nova de PBS.
- Wiª pinça de ponta fina transferir as glândulas salivares para outro limpo piscina PBS 25 ul, repita esta etapa de lavagem 3-4 vezes mais para remover todos os microrganismos externos e os restos do carrapato.
Nota: Lave os aglomerados de glândulas salivares com cuidado para reduzir a perda e ruptura das glândulas salivares individuais.
- Colocar as glândulas em uma piscina limpa de PBS numa lâmina de silano revestido ou em um tubo de microcentrífuga contendo PBS.
3. Coleta de saliva
(Movie 4)
- Retire com cuidado fêmeas adultas do coelho ou outro host usando uma pinça com pontas finas, pouco antes que eles saem totalmente ingurgitadas, cerca de 5-7 dias pós-fixação.
- Respeite o carrapato quase ingurgitadas em uma extremidade de uma lâmina de microscópio com fita adesiva. A fita deve ser colocado cerca de ¾ do caminho para cima do dorso do carrapato em direção à cabeça, deixando capitulum o carrapato base (partes da boca) exposta.
- Sempre que a fita se encontra com o bordo anterior do dorsal superfície carrapatos uL de solução de pipeta 5 pilocarpina 5% (em metanol). Permitir a fita para o pavio pilocarpina sobre o carrapato do dorso, sem permitir que a pilocarpina para entrar em contato com o carrapato capitulum base.
- Montar uma peça de non-toxic massa de modelar para a lâmina de microscópio aproximadamente uma polegada de peças bucais do carrapato.
- Usando finas fórceps com pontas romper a ponta de um tubo capilar 28 puxado para o diâmetro desejado.
- Ver capitulum o carrapato com base em um microscópio de dissecação.
- Suavemente encaixar hypostome do carrapato para dentro do tubo capilar puxado permitindo que os palpos maxilares a residir no exterior do tubo capilar.
- Pressione a extremidade oposta do tubo capilar na argila para segurar o tubo capilar no lugar.
- Coloque o carrapato montado salivando dentro de uma câmara escura, com umidade elevada (por exemplo, uma caixa de isopor com tampa forrada com pap molhado toalhas de ER). Inclinar a lâmina de modo que os pontos hypostome para o fundo do recipiente, permitindo que a gravidade para ajudar na recolha de saliva.
- Colocar o recipiente à temperatura ambiente.
- Acompanhar de perto os carrapatos salivando para a primeira hora, e recolher saliva, como é gerado por expulsando-o para fora dos tubos capilares com uma lâmpada de pipeta de Pasteur. Após a primeira hora, vá acumulação cada hora durante pelo menos 4 horas. Continuar a coleta de saliva como ele é gerado.
Nota: aquisição de saliva pode ser interrompida uma vez bastante saliva são coletadas para o estudo que está sendo executada.
- Se os carrapatos não estão salivando ou se mais saliva é necessária, salivação pode ocasionalmente ser induzida com o uso do tubo capilar para massagear a hypostome.
- Adicionar 0,1 volumes de cocktail inibidor de protease para a saliva e armazenar a -80 ° C até serem necessários.
4. Os resultados representativos
e_content "> Movie 1 demonstra como a realização de uma ninfa parcialmente alimentado I. scapularis e amputar as pernas para coletar hemolinfa sobre uma lâmina de microscópio. Uma vez que a perna ou pernas amputadas um líquido claro é secretada (Figura 1A e 1B). Se o intestino é rompida na hemolinfa parece turvo como é sai da perna amputada (s) (Figura 1C e 1D).A extracção de glândulas salivares após a ninfa tem alimentado durante 48 ou 72 horas é demonstrado nos filmes 2 e 3. Após a marcação é perfurada há geralmente uma grande quantidade de detritos (consistindo de traqueia, malpighiano túbulos, sangue, tecido conjuntivo, etc), para impedir a perda ou a ruptura das glândulas salivares mover o carrapato a um pool de fresco de PBS. As Figuras 2A e 2B mostram onde as glândulas salivares estão localizadas após a ninfa foi cortado e aberto Figura 2C mostra removido aglomerados de glândulas salivares numa piscina de PBS.
Coleta de saliva criada a partir de I. scapularis fêmeas adultas i s mostrado na filme 4 e figura 3. Um carrapato salivando em um tubo capilar é observado em filme 5. Este método de coleta da saliva usada para estimular a salivação de pilocarpina e pode render mais de 20 ul de saliva por carrapato fêmea adulta.
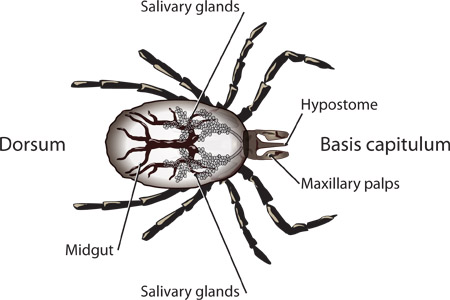
Figura 1. Estruturas rotuladas de uma ninfa scapularis I..
Filme 1. Ixodes scapularis coleção hemolinfa. Clique aqui para assistir filme .

Figura 2. Não contaminadas (A & B) e contaminado (C & D) hemolinfa exalando da perna da ninfa.
Filme 2. Extração da glândula salivar de um 48 horas alimentados I. ninfa scapularis.pload/3894/3894movie2.avi "> Clique aqui para assistir filme.
Filme 3. Extração da glândula salivar de um 72 horas alimentados I. ninfa scapularis. Clique aqui para assistir filme .
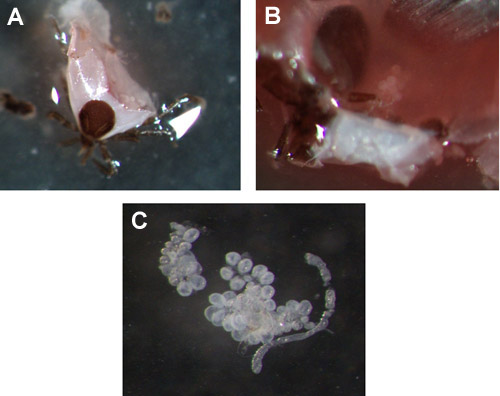
Figura 3. Glândulas salivares Ixodes scapularis ninfa. (A & B) Exemplos de glândulas salivares em um 72 horas alimentados ninfa, antes da extração. (C) removido do cluster da glândula salivar.
Movie 4. Coleta de saliva criado a partir de um adulto I. carrapato fêmea scapularis. Clique aqui para assistir filme .

Figura 4. Coleta de saliva de adultos de I. scapularis t mulheresicks. (A e B) Assinale montado sobre uma lâmina com a sua hypostome no final puxado do tubo capilar, com o fim unpulled do tubo capilar realizada por argila de modelagem. (C & D) câmara úmida contendo salivando adulto I. scapularis carrapatos fêmeas.
Filme 5. Ixodes scapularis carrapato fêmea salivando em um tubo capilar. Clique aqui para assistir filme .
Discussão
A coleta de hemolinfa do carrapato, glândulas salivares e saliva é importante no estudo da transmissão de patógenos transmitida por carrapatos, a divulgação, prevalência, proliferação e persistência, tanto carrapato e do exército 6,11-13,20,23,29. Existem várias maneiras de dissecar um carrapato 30,31. No entanto, ao coletar as glândulas salivares é fundamental para dissecar o carrapato corretamente para as glândulas salivares não são rompidas ou perdido em restos do carrapato. Uma...
Divulgações
Não temos nada a divulgar.
Agradecimentos
Os autores gostariam de agradecer à Divisão de Vector Borne-Doenças Animais Branch Resources, especificamente Andrea Peterson, Lisa Massoudi, Verna O'Brien, e John Liddell para seu cuidado e manutenção dos ratos e coelhos. Gostaríamos também de agradecer a Amy Ullmann, Theresa Russell, e Barbara J. Johnson para suas contribuições para este manuscrito. Finalmente, gostaríamos de reconhecer Alissa Eckert no Gabinete do Diretor Adjunto de Comunicação do CDC para produzir as ilustrações gráficas e Judy Lavelle para dirigir todos os assuntos legais relacionados com a filmagem deste manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente | Companhia | Número de Catálogo | |
| O peróxido de hidrogênio | Pescador | H312-500 | |
| Etanol | Acros | 61509-5000 | |
| PBS | Bioproducts Boston | BM-2205 | |
| Dumont Fino fórceps (3C) | Pescador | NC9906085 | |
| Silano tratados lâminas de microscópio | Bioworld | 42763007-1 | |
| Caneta Pap | Bioworld | 21750008-1 | |
| Super geada mais lâminas de microscópio | Pescador | 12-550-18 | |
| Pilocarpina | Sigma | P6503-5G | |
| Cocktail inibidor de protease | Sigma | P2714 | |
| # 11 bisturi descartável | Pena | 2975 # 11 | |
| Massa de modelar não tóxica | Fisher | S17307 | |
| Os tubos capilares | Perseguição científica Glass, inc | 40A502 |
Referências
- Quach, K. A., Boctor, F. N., Elston, D. M. What's eating you? Hyalomma ticks. Cutis. 87, 165-167 (2011).
- Graham, J., Stockley, K., Goldman, R. D. Tick-borne illnesses: a CME update. Pediatr. Emerg. Care. 27, 141-147 (2011).
- Nuttall, P. A., Paesen, G. C., Lawrie, C. H., Wang, H. Vector-host interactions in disease transmission. J. Mol. Microbiol. Biotechnol. 2, 381-386 (2000).
- Estrada-Pena, A., Jongejan, F. Ticks feeding on humans: a review of records on human-biting Ixodoidea with special reference to pathogen transmission. Exp. Appl. Acarol. 23, 685-715 (1999).
- Nuttall, P. A. Pathogen-tick-host interactions: Borrelia burgdorferi and TBE virus. Zentralbl Bakteriol. 289, 492-505 (1999).
- Jones, L. D., Hodgson, E., Nuttall, P. A. Enhancement of virus transmission by tick salivary glands. J. Gen. Virol. 70, 1895-1898 (1989).
- Labuda, M., Nuttall, P. A. Tick-borne viruses. Parasitol. 129, 221-245 (2004).
- Socolovschi, C., Mediannikov, O., Raoult, D., Parola, P. Update on tick-borne bacterial diseases in Europe. Parasite. 16, 259-273 (2009).
- Zhang, L., et al. Molecular Interactions that Enable Movement of the Lyme Disease Agent from the Tick Gut into the Hemolymph. PLoS Pathog. 7, e1002079 (2011).
- Piesman, J., Schneider, B. S. Dynamic changes in Lyme disease spirochetes during transmission by nymphal ticks. Exp. Appl. Acarol. 28, 141-145 (2002).
- Brossard, M., Wikel, S. K. Tick immunobiology. Parasitol. , S161-S176 (2004).
- Machackova, M., Obornik, M., Kopecky, J. Effect of salivary gland extract from Ixodes ricinus ticks on the proliferation of Borrelia burgdorferi sensu stricto in vivo. Folia Parasitol. 53, 153-158 (2006).
- Nuttall, P. A., Labuda, M. Tick-host interactions: saliva-activated transmission. Parasitol. 129, 177-189 (2004).
- Anguita, J., Hedrick, M. N., Fikrig, E. Adaptation of Borrelia burgdorferi in the tick and the mammalian host. FEMS Microbiol. Rev. 27, 493-504 (2003).
- Hovius, J. W., van Dam, A. P., Fikrig, E. Tick-host-pathogen interactions in Lyme borreliosis. Trends Parasitol. 23, 434-438 (2007).
- Dunham-Ems, S. M., et al. Live imaging reveals a biphasic mode of dissemination of Borrelia burgdorferi within ticks. Journal Clin. Invest. 119, 3652-3665 (2009).
- Ribeiro, J. M., Mather, T. N., Piesman, J., Spielman, A. Dissemination and salivary delivery of Lyme disease spirochetes in vector ticks (Acari: Ixodidae). J. Med. Entomol. 24, 201-205 (1987).
- Piesman, J. Transmission of Lyme disease spirochetes (Borrelia burgdorferi. Exp. Appl. Acarol. 7, 71-80 (1989).
- De Silva, A. M., Fikrig, E. Growth and migration of Borrelia burgdorferi in Ixodes ticks during blood feeding. Am. J. Trop. Med. Hyg. 53, 397-404 (1995).
- Horka, H., Cerna-Kyckova, K., Skallova, A., Kopecky, J. Tick saliva affects both proliferation and distribution of Borrelia burgdorferi spirochetes in mouse organs and increases transmission of spirochetes to ticks. Int. J. Med. Microbiol. 299, 373-380 (2009).
- Brossard, M., Wikel, S. K. Immunology of interactions between ticks and hosts. Med. Vet. Entomol. 11, 270-276 (1997).
- Wikel, S. K. Tick modulation of host immunity: an important factor in pathogen transmission. Int. J. Parasitol. 29 (99), 851-859 (1999).
- Binnington, K. C., Kemp, D. H. Role of tick salivary glands in feeding and disease transmission. Adv. Parasitol. 18, 315-339 (1980).
- Guo, X., et al. Inhibition of neutrophil function by two tick salivary proteins. Infect. Immun. 77, 2320-2329 (2009).
- Montgomery, R. R., Lusitani, D., De Boisfleury Chevance, A., Malawista, S. E. Tick saliva reduces adherence and area of human neutrophils. Infect. Immun. 72, 2989-2994 (2004).
- Lima, C. M., et al. Differential infectivity of the Lyme disease spirochete Borrelia burgdorferi derived from Ixodes scapularis salivary glands and midgut. J. Med. Entomol. 42, 506-510 (2005).
- Severinova, J., et al. Co-inoculation of Borrelia afzelii with tick salivary gland extract influences distribution of immunocompetent cells in the skin and lymph nodes of mice. Folia Microbiol. 50, 457-463 (2005).
- Labuda, M., Jones, L. D., Williams, T., Nuttall, P. A. Enhancement of tick-borne encephalitis virus transmission by tick salivary gland extracts. Med. Vet. Entomol. 7, 193-196 (1993).
- Kariu, T., Coleman, A. S., Anderson, J. F., Pal, U. Methods for Rapid Transfer and Localization of Lyme Disease Pathogens Within the Tick Gut. J. Vis. Exp. (48), e2544 (2011).
- Edwards, K. T., Goddard, J., Varela-Stokes, A. S. Examination of the internal morphology of the Ixodid tick Amblyomma maculatum koch, (Acari:Ixodidae); a "How-to" pictorial dissection guide. Midsouth Entomologist. 2, 28-39 (2009).
- Ledin, K. E., et al. Borreliacidal activity of saliva of the tick Amblyomma americanum. Med. Vet. Entomol. 19, 90-95 (2005).
- Ribeiro, J. M., Zeidner, N. S., Ledin, K., Dolan, M. C., Mather, T. N. How much pilocarpine contaminates pilocarpine-induced tick saliva?. Med. Vet. Entomol. 18, 20-24 (2004).
- Barker, R. W., Burris, E., Sauer, J. R., Hair, J. A. Composition of tick oral secretions obtained by three different collection methods. J. Med. Entomol. 10, 198-201 (1973).
- Burgdorfer, W. Hemolymph test. A technique for detection of rickettsiae in ticks. Am. J. Trop. Med. Hyg. 19, 1010-1014 (1970).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados