A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
طريقتين لتشكيل متغايرة النوى إلى اكتشاف العوامل تقييد HCV
In This Article
Summary
ونحن تصف طريقتين لشرطي العابرة-تكامل من التهاب الكبد الوبائي جمعية (سي) فيروس والانتهاء من دورة الحياة الفيروسية كامل، والتي تعتمد على تشكيل متغايرة النوى. هذه التقنيات هي مناسبة للكشف عن خطوط الخلايا التي تعبر عن عوامل تقييد المهيمنة، والتي تحول دون إنتاج ذرية HCV المعدية.
Abstract
Hepatitis C virus (HCV) is a hepatotropic virus with a host-range restricted to humans and chimpanzees. Although HCV RNA replication has been observed in human non-hepatic and murine cell lines, the efficiency was very low and required long-term selection procedures using HCV replicon constructs expressing dominant antibiotic-selectable markers1-5. HCV in vitro research is therefore limited to human hepatoma cell lines permissive for virus entry and completion of the viral life cycle. Due to HCVs narrow species tropism, there is no immunocompetent small animal model available that sustains the complete HCV replication cycle 6-8. Inefficient replication of HCV in non-human cells e.g. of mouse origin is likely due to lack of genetic incompatibility of essential host dependency factors and/or expression of restriction factors.
We investigated whether HCV propagation is suppressed by dominant restriction factors in either human cell lines derived from non-hepatic tissues or in mouse liver cell lines. To this end, we developed two independent conditional trans-complementation methods relying on somatic cell fusion. In both cases, completion of the viral replication cycle is only possible in the heterokaryons. Consequently, successful trans-complementation, which is determined by measuring de novo production of infectious viral progeny, indicates absence of dominant restrictions.
Specifically, subgenomic HCV replicons carrying a luciferase transgene were transfected into highly permissive human hepatoma cells (Huh-7.5 cells). Subsequently, these cells were co-cultured and fused to various human and murine cells expressing HCV structural proteins core, envelope 1 and 2 (E1, E2) and accessory proteins p7 and NS2. Provided that cell fusion was initiated by treatment with polyethylene-glycol (PEG), the culture released infectious viral particles which infected naïve cells in a receptor-dependent fashion.
To assess the influence of dominant restrictions on the complete viral life cycle including cell entry, RNA translation, replication and virus assembly, we took advantage of a human liver cell line (Huh-7 Lunet N cells 9) which lacks endogenous expression of CD81, an essential entry factor of HCV. In the absence of ectopically expressed CD81, these cells are essentially refractory to HCV infection 10 . Importantly, when co-cultured and fused with cells that express human CD81 but lack at least another crucial cell entry factor (i.e. SR-BI, CLDN1, OCLN), only the resulting heterokaryons display the complete set of HCV entry factors requisite for infection. Therefore, to analyze if dominant restriction factors suppress completion of the HCV replication cycle, we fused Lunet N cells with various cells from human and mouse origin which fulfill the above mentioned criteria. When co-cultured cells were transfected with a highly fusogenic viral envelope protein mutant of the prototype foamy virus (PFV11) and subsequently challenged with infectious HCV particles (HCVcc), de novo production of infectious virus was observed. This indicates that HCV successfully completed its replication cycle in heterokaryons thus ruling out expression of dominant restriction factors in these cell lines. These novel conditional trans-complementation methods will be useful to screen a large panel of cell lines and primary cells for expression of HCV-specific dominant restriction factors.
Protocol
فيوجن الخلية بواسطة PEG
1. خلية ثقافة
- ثقافة هوه-7.5، الحله وHep56.1D خطوط الخلايا ساذجا أو التعبئة والتغليف 12 في 15 سم أطباق ثقافة خلية كاملة في DMEM (DMEM cplt) المتوسطة، على أن تستكمل مع DMEM 2 مم L-الجلوتامين، 1X غير الاساسيين من الأحماض الأمينية، 100 U / مل البنسلين، 100 ميكروغرام / مل الستربتومايسين، و 10٪ مصل العجل الجنين. تطبيق اختيار المناسب لخطوط الخلايا مستقر كما هو مبين في الجدول رقم 1.
2. ترنسفكأيشن من الحمض النووي الريبي سي
- التخزين المؤقت غسل هوه-7.5 الخلايا (واحد متكدسة طبق 15 سم) مرتين مع الفوسفات يعرض للتريبسين المالحة (PBS)، وresuspend بتركيز 1.5x10 7 خلية / مل في Cytomix (120 ملي بوكل، 0.15 CaCl 2 ملم، 10 ملم K 2 هبو 4 [درجة الحموضة 7،6]، 25 HEPES مم، 2 مم EGTA، 5 مم MgCl 2، وتعديلها لدرجة الحموضة 7.6 مع KOH وتعقيم بواسطة الترشيح) التي تحتوي على 2 ملم ATP و 5 ملي الجلوتاثيون.
- Transfect عبر electroporatايون 400 ميكرولتر من تعليق خلية (6x10 6 خلايا) مع 10 ميكروغرام سي الحمض النووي الريبي (_JFH1_dg pFKi389Luc-EI/NS3-3 '13) باستخدام cuvettes مع عرض فجوة قدرها 0.4 سم وبولسير جين إكس سيل للنظام (Biorad) تعيين إلى 975 μF والخامس 270 كما هو موضح سابقا 14.
- نقل على الفور transfected هوه-7.5 الخلايا إلى 10 مل من المتوسط cplt DMEM والبذور وتعليق كامل في طبق ثقافة واحدة ذات قطر 10 سم. خلايا ثقافة لمدة 24 ساعة عند 37 درجة مئوية و 5٪ CO 2.
3. تحريض من قبل الانصهار PEG
- حصاد الخلايا كما هو موضح في 2.1، resuspend في المتوسط cplt DMEM وتمييع ل5x10 5 خلية / مل.
- تولد وحيدة الخلية تعليق من هوه-7.5، هيلا، وخلايا Hep56.1D التعبئة والتغليف، وتمييع ل5x10 5 خلايا / مل، 2x10 الخلايا 5 / مل، و2x10 5 خلايا / مل، على التوالي. لاحظ أن الخلايا التعبئة والتغليف ectopically صريحة HCV البروتينات الأساسية، E1، E2، P7 وNS2 بعد تنبيغ مع اثنين فيlentiviral ناقلات تعتمد transducing من طراز C-E1 و E2-P7-NS2 كاسيت التعبير، على التوالي 13 و 15.
- إعداد لوحات ثقافة 6-جيدا 2-3 مع غطاء زجاجي معقم زلات لكل بئر لمزيد من التحليل من كفاءة الانصهار.
- الجمع بين 1 مل من الخلايا هوه-7.5 transfected إيواء ريبليكون subgenomic مع 1 مل من الخلايا التعبئة والتغليف، والبذور في واحدة جيدا من لوحة 6 جيدا، واحتضان لمدة 24 ساعة عند 37 درجة مئوية و 5٪ CO 2.
- عند هذه النقطة مرة، وينبغي أن كثافة الخلية تتراوح بين 60-80٪ confluency قبل تحريض انصهار الخلية من أجل السماح للخلايا ليكون على مقربة لأغشية الخلايا لدمج.
- نضح المتوسطة من المشاركة في الخلايا مثقف ويغسل مرة واحدة مع PBS 1 مل، ثم يضاف بعناية 500 ميكرولتر من قبل حرارة 40٪ PEG-1500 أو برنامج تلفزيوني، والتحكم والحضانة لمدة 5 دقائق عند 37 درجة مئوية للحث على تشكيل متغايرة النوى.
- نضح PEG وتغسل بعناية 3-5 مرات لمدة 1 دقيقة (دقيقة) في غسل مع PBS 2 مل لإزالة الربط الزائدة وأخيرا اضافة 2مل من المتوسط cplt DMEM إلى كل جيدا واحتضان عند 37 درجة مئوية و 5٪ CO 2.
- ثمان وأربعين ساعة الانصهار آخر، وجمع كل مرشح ومرشح طاف من خلال 0.45 ميكرون.
- إنتاج قدر من جزيئات معدية في heterokaryons تنصهر فيها من قبل تلقيح خلايا هوه-7.5 ساذجة (8X10 4 خلايا / جيد المصنف في لوحة 12-جيدا، لمدة 24 ساعة قبل التلقيح) مع 500 ميكرولتر من السوائل ثقافة خالية من الخلايا، وتقرير لاحق من luciferase المراسل النشاط 14.
4. المناعي لتحديد كفاءة فيوجن
- بعد جمع supernatants ثقافة خلية (القسم 3.8)، وغسل الآبار التي تحتوي على غطاء زجاجي ينزلق مرة واحدة مع 1 مل من برنامج تلفزيوني لمدة 1 دقيقة. يجب أن يتم تنفيذ كافة الخطوات التالية في درجة حرارة الغرفة (RT)، وينبغي أن يتم غسل مع PBS 1 مل لمدة 1 دقيقة لكل غسيل.
- تحديد الخلايا مع 600 ميكرولتر من بارافورمالدهيد 3٪ (منهاج العمل) في برنامج تلفزيوني لمدة 15 دقيقة ثم يغسل 3x مع برنامج تلفزيوني. نقل بعناية غطاء ينزلقفي لوحة 24-جيدا باستخدام ملقط.
- Permeabilize الخلايا مع 500 ميكرولتر من تريتون 0.5٪ X-100 في برنامج تلفزيوني لمدة 5 دقائق ويغسل بعد ذلك 3x مع برنامج تلفزيوني.
- إعداد الأولية حل الأجسام المضادة في مصل الدم PBS تستكمل مع ماعز 5٪. استخدام الألغام المضادة NS5A الضد (9E10) بتركيز 0.5 ميكروغرام / مل وحقوق الإنسان ضد وحيد النسيلة المضادة للE2 (CBH-23) عند تركيز قدره 6.4 نانوغرام / مل. تطبيق 250 ميكروليتر إلى كل جيدا واحتضان في RT لمدة 45 دقيقة.
- تستكمل غسل 3x مع برنامج تلفزيوني، واكتشاف الأجسام المضادة الأولية ملزمة مع 250 ميكرولتر الثانوية الماعز المضادة للفأر أو الماعز الأجسام المضادة IgG محددة لمكافحة مترافق الإنسان إلى ترتيب فلور-546 أو ترتيب، فلور 488، بتركيز 2 ميكروغرام / مل في برنامج تلفزيوني مع 5٪ الماعز المصل. احتضان لمدة 30 دقيقة في RT في الظلام.
- ثم، وغسل 1X مع برنامج تلفزيوني وصمة عار في وقت لاحق نواة الخلية مع 250 دابي ميكرولتر (4 '، 6'-diamidino-2-phenylindole dihydrochloride) المخفف 1:3،000 في برنامج تلفزيوني، من الحضانة لمدة 1 دقيقة في RT في الظلام.
- غسل 4x مع برنامج تلفزيوني و1X مع H 2 O، ثم جبل زلات غطاء رأسا على عقب على قطرة من Fluoromount على شريحة المجهر، واتركها لتجف في العينة مظلم وتقييم من قبل مضان المجهر غير مباشر.
الانصهار بواسطة ترنسفكأيشن عابر من فيروس رغوي النموذج (PFV) بروتين سكري
5. إعداد اللقاح الفيروسي
- إنتاج فيروس عيار ارتفاع الأسهم transfecting في المختبر HCV RNA المحولة إلى خلايا 7.5 هوه والحصاد خلية ثقافة طاف بعد 48 ساعة و 72 ساعة كما هو موضح سابقا 14. تحديد عيار الفيروسية عن طريق الحد من فحص تخفيف (TCID 50) 13.
6. زراعة الخلايا، خلية الانصهار بواسطة ترنسفكأيشن من بروتين سكري PFV Fusogenic
- ثقافة Lunet N، هيلا، وHep56.1D الخلايا hCD81 وفقا للتعليمات الواردة في الجدول 1 في المتوسط cplt DMEM تتضمن التحديدات المناسبة.
- فصل الخلايا كما هو موضح في 2.1، إعداد تعليق خلية واحدة في DMEM cplt مedium، وشارك في زراعة خلايا Lunet N مع هيلا أو خطوط Hep56.1D خلية hCD81 على المعدلات المناسبة (على سبيل المثال ل01:02 Hep56.1D hCD81 أو 01:01 لخلايا هيلا) مما أسفر عن كثافة خلية مجموعه 1.5x10 5 خلايا لكل 12-جيدا واحتضان لمدة 24 ساعة عند 37 درجة مئوية و 5٪ CO 2.
- في اليوم التالي، transfect عابر الخلايا التي تحتوي على البروتين fusogenic جدا مغلف PFV (pczHFVenvEM066 16) باستخدام Lipofectamine 2000 وفقا لتعليمات الشركة المصنعة.
7. عدوى الفحص
- تطعيم heterokaryons 30 ساعة بعد ترنسفكأيشن مع 350 ميكرولتر من مخزون فيروس (وزارة الداخلية من ~ 2.3) لمدة 12 ساعة بين عشية وضحاها، ويغسل مرة واحدة مع برنامج تلفزيوني وإضافة 1 مل من المتوسط cplt DMEM لكل بئر. احتضان لمدة 48 ساعة عند 37 درجة مئوية و 5٪ CO 2.
- طاف حصاد ثقافة متغايرة النوى، مرشح من خلال خلايا هوه-7.5 0.45 ميكرون مرشح وتطعيم المصنفة في لوحات 96-جيدا (1x10 4 خلايا / جيد) في اليوم السابق، في فحص تخفيف الحد 13.
- بعد 72 ساعة، وصمة المصابين هوه-7.5 الخلايا مع أجسام مضادة سي محددة (NS5A؛ 9E10) لقياس انتاج جسيمات ذرية المعدية.
8. تصور من خلية الانصهار
- لتصور أحداث الانصهار، وإعداد الحلول ميكرومتر 5 إلى 10 من الأصباغ CellTracker في المتوسط DMEM من دون إضافات، وأكمل الخطوات أقل من 6 ساعات قبل الثقافة المشتركة (المبينة في القسمين 6.2 و 6.3).
- غسل الخلايا الملتصقة مرة واحدة مع 5 مل من برنامج تلفزيوني واحتضان ثم الخلايا التي تحتوي على 4 مل من تلطيخ حل لكل طبق 10 سم لمدة 45 دقيقة عند 37 درجة مئوية و 5٪ CO 2 (وصمة عار Lunet N الخلايا مع CellTracker البرتقال CMTMR وهيلا أو Hep56.1D hCD81 الخلايا مع CellTracker الأخضر CMFDA، بشكل منفصل).
- غسل خلايا مرة واحدة مع 5 مل من برنامج تلفزيوني لمدة 1 دقيقة وإضافة DMEM cplt المتوسطة واحتضان لمدة 6 ساعات إلى 37 درجة مئوية، وأول أكسيد الكربون بنسبة 5٪ 2.
- تعد البذر وترنسفكأيشن من الخلايا الملون على النحو الموصوف أعلاه في القسمين 6.2 و ومع ذلك، إضافة زلة غطاء للطبق خلية ثقافة قبل البذر.
- 30 ترنسفكأيشن آخر ساعة، وغسل خلايا بعناية مع 1 مل من برنامج تلفزيوني لمدة 1 دقيقة وتحديد الخلايا ثم مع 250 ميكرولتر من PFA 3٪ لمدة 15 دقيقة في RT. غسل خلايا مرة واحدة مع PBS 1 مل لمدة 1 دقيقة، وصمة عار مع دابي ل1 دقيقة كما هو موضح في القسم 4.6، يغسل مرة واحدة مع PBS 1 مل لمدة 1 دقيقة، وتكرار غسل مع H 2 O وزلات غطاء جبل على شرائح زجاجية (راجع القسم 4.7 ). تحليل الخلايا تحت المجهر مضان.
| نوع | خط خلوي | الأصل | متوسط نمو واختيار |
| الإنسان | هاه-7.5 | Subclone من-7 هوه الكبدي خلية خط 17 | DMEM cplt |
| هاه-7.5 [CE1] [E2p7NS2] | معربا عن ستابلي الفيروسية البروتينات الأساسية، transduced E1، E2، P7، وNS2، بواسطة الجينات تي lentiviralransfer اثنين من أشرطة جينة مستقلة | DMEM cplt + Blasticidin 5 ميكروغرام / مل | |
| هاه N-7 Lunet | Subclone من-7 هوه الكبدي خلية خط 9 | DMEM cplt | |
| هيلا | عنق الرحم خط خلية غدية (عدد ATCC: CCL-2) | DMEM cplt | |
| هيلا [CE1] [E2p7NS2] | معربا عن ستابلي الفيروسية البروتينات الأساسية، transduced E1، E2، P7، وNS2، من خلال نقل الجينات lentiviral اثنين من أشرطة جينة مستقلة | DMEM cplt G418 + 750 ميكروغرام / مل؛ Blasticidin 5 ميكروغرام / مل | |
| فأر | Hep56.1D | الابتدائي سرطان الكبد (هدية من نوع Encke J.) الكبار الفئران C57BL/6J | DMEM cplt |
| Hep56.1D [CE1] [E2p7NS2] | ستابلي السابقينالضغط على البروتينات الفيروسية الأساسية، transduced E1، E2، P7، وNS2، بواسطة نقل الجينات lentiviral اثنين من أشرطة جينة مستقلة | DMEM cplt G418 + 750 ميكروغرام / مل؛ Blasticidin 5 ميكروغرام / مل | |
| Hep56.1D hCD81 | transduced CD81 الإنسان التعبير عن ثابت عن طريق نقل الجينات lentiviral | DMEM cplt + Blasticidin 5 ميكروغرام / مل |
. الجدول 1 المواصفات عن شرط المنشأ والثقافة من خطوط الخلايا المستخدمة Cplt: كاملة، G418: geneticin، ح: الإنسان.
9. ممثل النتائج
في هذه الدراسة، قمنا بتطبيق طريقتين مختلفتين من انصهار الخلية الجسدية التي تسمح لنا للتحقيق على وجه التحديد تأثير العوامل القيود المفروضة على الانتهاء من دورة النسخ المتماثل HCV في heterokaryons. من المذكرة، وتصميم مشروط من تكامل العابر على الاندماج من هذين النوعين مختلفة من الخلايا ويؤكد أنفقط في heterokaryons حقيقية بين خلايا الكبد البشرية وخطوط الخلايا غير متساهل، والتجمع فيروس (نهج 1) أو دخول فيروس سي وتكرار دورة كاملة (نهج 2) يتم إنجازه.
في النهج الأول وعابر. هوه-7.5 الخلايا، ومتساهلة للغاية لفيروس (سي)، مع ريبليكون subgenomic تعبر عن التحوير luciferase المراسل وHCV البروتينات غير الهيكلية الداعمة subgenomic تكرار الحمض النووي الريبي سي (خلايا ريبليكون هوه-7.5). وكانت هذه الخلايا شارك في تربيتها وتنصهر لخطوط الخلايا معربا عن HCV البروتينات الهيكلية الأساسية، E1، E2، فضلا عن ملحق P7 البروتينات، وNS2. Figure1A تظهر لمحة عامة عن إجراء التجارب. الأهم من ذلك، بعد اندماج PEG، ينبغي لجميع البروتينات اللازمة لتجميع الجسيمات تكون موجودة في شكل متغايرة النوى التي يمكن التأكد من التألق المناعي ضد بروتينات فيروسية فردية. 1B الرقم يصور حالة انصهار المثالية التي اشارات لكلا NS5A التي أعرب عنها في خلايا هوه-7.5 ريبليكون وE2وأعرب في هوه-7.5 [CE1] [E2p7NS2] تم الكشف عن خلايا التعبئة والتغليف في السيتوبلازم نفسه على تشكيل متغايرة النوى PEG التي يسببها. وعندما تم علاج بدلا من المشاركة في برنامج تلفزيوني مع مثقف الخلايا، التي يسببها عدم الاندماج وبالتالي واحدة فقط إيجابية الخلايا ولم يلاحظ أي شارك في الترجمة من الإشارات. وعلاوة على ذلك، للسيطرة على التعبير التحوير، أجرينا ELISAs محددة لجوهر وE2 (ذكرت سابقا بالتفصيل 15). بالإضافة إلى خلية خط السيطرة التعبئة والتغليف هوه 7.5 [CE1] [E2p7NS2]، ونحن ولدت هيلا والخلايا التعبئة والتغليف Hep56.1D كممثلين للكبد الإنسان وغير خلايا الكبد الفأر، على التوالي. سي كفاءة تكرار الحمض النووي الريبي في هذه الخلايا الأخير هو التجمع منخفضة وفيروس (سي) و لم يظهر الافراج تم. ويوضح الشكل 1C نتائج فحص الانصهار. وقد تم جمع Supernatants من الثقافة المشتركة في آخر 48 ساعة الاستقراء الانصهار والمستخدمة لتطعيم السذاجة هوه-7.5 الخلايا لفحوصات luciferase المراسل اللاحقة. خصوصا، عندما الخلايا ريبليكون هوه-7.5 وتنصهر مع إماخطوط الخلايا ساذجا أو تعامل مع برنامج تلفزيوني والسيطرة، لم يتم اكتشاف أي عدوى في السوائل ثقافة. ومع ذلك، انقذت عبر تكامل بين ريبليكون والبروتينات الهيكلية وأعرب constitutively عندما كان المستحث اندماج الخلية بين ريبليكون-7.5 هوه وخطوط التعبئة والتغليف من قبل خلية PEG، وإنتاج الفيروس في heterokaryons الناتجة عنها، وأفرج عن الجزيئات الفيروسية المعدية في سوائل ثقافة. استنتجنا ذلك أن إنتاج فيروس مطلوب انصهار الخلية والتعبير عن البروتينات الفيروسية في خطوط الخلايا التعبئة والتغليف. لافت للنظر، وليس فقط من heterokaryons-7.5 هوه الخلايا الكبدي الإنسان، ولكن أيضا مع heterokaryons الإنسان الكبد غير (هيلا [CE1] [E2p7NS2])، والماوس الكبد (Hep56.1D [CE1] [E2p7NS2]) الافراج عن فيروس الخلايا المسموح بها، مشيرا إلى أن لا تحول دون الافراج عن التجمع ويغلب عوامل تقييد ممكن في هذه أنواع الخلايا. وظهر تعبير عن البروتينات الهيكلية في خطوط الخلايا التعبئة والتغليف ودخول حقيقي إلى الخلايا المستهدفة في Frentzen وآخرون. 15.
وقد استخدمت طريقة بديلة للاندماج خلية لتحليل القيود المحتملة التي قد تؤثر دخول الخلية، ترجمة الحمض النووي الريبي ومراحل تكرار الحمض النووي الريبي من دورة النسخ المتماثل واستبعاد أن ترزح تحت عبء ثقيل فيروسي في الخلايا transfected هوه ريبليكون 7.5 يحول دون الكشف عن العوامل تقييد من قبل التشبع. تحقيقا لهذه الغاية، وضعنا 1 فحص مستقل على أساس تلقيح heterokaryons مع HCVcc والكشف عن إنتاج فيروس دي نوفو في هذه الخلايا. على النحو المبين في الشكل 2A، وكان المستحث جسدية انصهار الخلية عن طريق التعبير عن بروتين سكري fusogenic بعد زراعة المشارك للخلايا. وقد تم اختيار هذه الطريقة لأنه كان من المرجح زيادة الحساسية نتيجة لزيادة كفاءة الانصهار. وكانت Heterokaryons تصور من قبل تلطيخ خطوط خلايا منفصلة مع الأصباغ CellTracker قبل زراعة المشترك. ومتغايرة النوى مع متجانس الأصباغ وزعت داخل السيتوبلازم يشير إلى الانصهار من أنواع الخلايا يدلان على النحود 2B في الشكل. فقط في heterokaryons من Lunet N الخلايا مع خلايا هيلا أو Hep56.1D الخلايا hCD81 يتم التعبير عن جميع العوامل دخول فيروس (سي) وبالتالي جعلها انتقائية heterokaryons عرضة لدخول الخلية سي. أدى التحدي مع HCVcc في النسخ المتماثل كاملة من هذا الفيروس في heterokaryons الذي هو واضح من إنتاج دي نوفو من سلالة الفيروسية المعدية ما يقرب من 10 أضعاف فوق خلفية من الفحص (الشكل 2C). كعنصر تحكم، وتنصهر Lunet N الخلايا مع الخلايا N Lunet. الأهم لوحظت مستويات منخفضة جدا فقط من وثيقة سي المعدية إلى حد الكشف. وقد تم الحصول على نتائج مماثلة عندما تم تنصهر Lunet الخلايا N مع خلايا Hep56.1D السذاجة. في كلتا الحالتين، كان غائبا CD81 الإنسان بحيث لا يمكن أن يصيب فيروس (سي) منتجة للheterokaryons. هذه العدوى منخفضة للغاية في الكشف عن هذه الحالتين الأخيرتين يعزى على الأرجح إلى انخفاض مستوى العدوى من الخلايا N Lunet و / أو انخفاض مستويات المتبقية مساهمة الفيروسات المعدية من اللقاح. في خلايا هيلا التباين وقالp56.1D hCD81 خلايا CD81 التعبير عن الإنسان وبذلك تكمل دخول الخلية التي تفتقر إلى عامل في heterokaryons والسماح HCV دخول الخلية. مستوى 10 أضعاف من HCV المعدية المكتشفة في المتوسط من heterokaryons تنطوي هذه السطور اثنين من خلية ولذلك يعكس على الأرجح الانتاج من جديد من الجزيئات المعدية في heterokaryons. وبالتالي، خلصت نحن لا يقتصر أن الانتهاء من دورة النسخ المتماثل HCV باستثناء التعبير عن العوامل المسيطرة تقييد هذا الفيروس في هذه السطور الخلية.
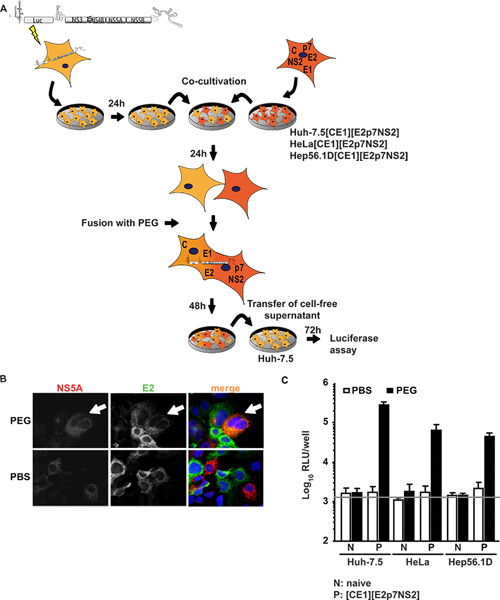
الشكل 1. عبر تكامل التجمع سي والافراج في heterokaryons. (A) الملخص التخطيطي للإجراء التجريبي للاندماج الخلية PEG بوساطة. وكان transfected في JFH1 luciferase المراسل الصحفي ريبليكون لوك-NS3-5B إلى خلايا هوه-7.5 السذاجة التي electroporation. في اليوم التالي، تم فصل الخلايا وشارك مثقف، مع خلايا ساذجة أو التعبئة والتغليف معربا عن الخلايا constitutively HCV الأساسية، E1، E2، P7 وNS2. وكان 24 ساعة آخر شارك في زراعة، التي يسببها متغايرة النوى تشكيل بواسطة العلاج مع PEG 40٪ باستخدام برنامج تلفزيوني ومراقبة سلبية. بعد 48 ساعة، وكان حصادها خالية من الخلايا طاف لتطعيم السذاجة هوه-7.5 الخلايا. تم تحديد العدوى بواسطة luciferase النشاط. (ب) للكشف عن heterokaryons، وimmunostained الخلايا باستخدام الاجسام المضادة ضد E2 وNS5A. التعبير في وقت واحد من كل من البروتينات داخل الخلايا يدل على انصهار الخلية. (ج) وإجراء قياسات لقياس luciferase المراسل العدوى الفيروسية التي تنتج من heterokaryons. وترد يعني القيم من ثلاث تجارب مستقلة، والانحرافات المعيارية من وسائل. شريط أفقي يمثل RLU خلفية مصممة في الخلايا هوه-7.5 غير مصاب. انقر هنا لعرض أكبر شخصية .
9/4029fig2.jpg "/>
الشكل 2. الانتهاء من دورة النسخ المتماثل HCV بعد تلقيح heterokaryons. (A) نظرة عامة تخطيطي لإجراء التجارب. وكان هوه-7 Lunet الخلايا N تفتقر CD81 شارك في تربيتها مع خطوط الخلايا المشار إليها تفتقر أو التعبير عن CD81 الإنسان. الأهم من ذلك، هذه الخلايا هذه الأخيرة تفتقر إلى عامل واحد على الأقل دخول فيروس (سي) وبالتالي لا يمكن أن يصاب مثمر. في اليوم التالي، بدأ انصهار بواسطة ترنسفكأيشن من البروتين الفيروسي المغلف fusogenic من PFV. ثلاثين ساعة في وقت لاحق، كان هناك اعتراض الخلايا التي تحتوي على جزيئات HCV المعدية. لقياس دخول الخلية، وتكرار الحمض النووي الريبي وإنتاج فيروس التي تكبدتها هذه heterokaryons، تم تحديد العدوى صدر في السوائل ثقافة خالية من الخلايا تلقيح 48 آخر ساعة. تحقيقا لهذه الغاية، واستخدمت ساذجة هوه-7.5 الخلايا كما الخلايا المستهدفة في فحص تخفيف الحد (TCID 50). (ب) للكشف عن heterokaryons، تم صبغ الخلايا مع الأخضر CellTracker أو CellTracker البرتقال 6 ساعات قبل أن تشارك في تزرعوأوجه ترنسفكأيشن. ثلاثين ساعة في وقت لاحق، تم إصلاح الخلايا وملطخة دابي. (ج) وتنصهر Lunet N الخلايا إلى خلايا هيلا، ساذجة أو خلايا Hep56.1D Hep56.1D التعبير عن CD81 الإنسان. تم تلقيح هذه الثقافات مع HCVcc (وزارة الداخلية من 2.3). والسوائل ثقافة جمعت 48 ساعة في وقت لاحق، وتقرر الافراج عن دي نوفو جسيم من heterokaryons بواسطة TCID 50 باستخدام السذاجة الخلايا المستهدفة هوه-7.5. وترد يعني القيم من ثلاث تجارب مستقلة. شريط أفقي يمثل الحد الأقصى من كشف الفحص. انقر هنا لعرض أكبر شخصية .
Discussion
نقدم طريقتين للحث على تشكيل متغايرة النوى في الخلايا المزروعة لتحليل القيود السلبية السائدة التي تحول دون تكرار سي. باستخدام هذه الإجراءات استبعدنا وجود عامل مهيمن أعرب constitutively أو فيروس من صنع الإنسان في مختلف الكبد غير والفئران في خطوط خلايا الكبد. الفحص 1 يحلل في ا...
Disclosures
تلقى TP رسوم استشارية من Biotest.
Acknowledgements
ونحن ممتنون لWakita Takaji وينس لBukh JFH1 والعزلات J6CF، على التوالي. وعلاوة على ذلك نشكر تشارلز رايس للخلايا 7.5 هوه والأجسام المضادة 9E10، ستيفن Foung للأجسام المضادة E2 محددة CBH-23، وجميع أعضاء قسم علم الفيروسات التجريبي، Twincore للحصول على اقتراحات مفيدة والمناقشات.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
| DMEM | إينفيتروجن، كارلسروه، ألمانيا | 41965-039 | |
| L-الجلوتامين | إينفيتروجن، كارلسروه، ألمانيا | 25030-024 | |
| غير الاساسيين من الأحماض الأمينية | إينفيتروجن، كارلسروه، ألمانيا | 11140-035 | |
| البنسلين / الستربتومايسين | إينفيتروجن، كارلسروه، ألمانيا | 15140-122 | |
| الجنين المصل في ربلة الساق | PAA، Cölbe، ألمانيا | A15151 | |
| α-E2 (CBH23) | تفضلت التي تقدمها Foung ستيفن 10 | ||
| ATP | سيغما، Steinheim، ألمانيا | A2833-106 | |
| الجلوتاثيون | سيغما، Steinheim، ألمانيا | G4251-1G | |
| Blasticidin | Invivo الجنرال، سان دييغو، الولايات المتحدة الأمريكية | نملة-BL-1 | |
| G418 (geneticin) | إينفيتروجن، كارلسروه، ألمانيا | 11811-064 | |
| البولي ايثيلين جلايكول-1500- | روش، مانهايم، ألمانيا | 10783641001 | |
| بارافورمالدهيد | روث، كارلسروه، ألمانيا | 0335.3 | |
| تريتون X-100 | روث، كارلسروه، ألمانيا | 3051.2 | |
| ماعز المصل | سيغما، Steinheim، ألمانيا | G9023-5mL | |
| α-NS5A (9E10) | تفضلت التي تقدمها رايس تشارلز 7 | ||
| دابي (4 '، 6'-diamidino-2-phenylindole dihydrochloride) | إينفيتروجن | D1306 | |
| اليكسا، فلور 546 - الماعز المضادة للمفتش الإنسان | إينفيتروجن، كارلسروه، ألمانيا | A21089 | |
| اليكسا، فلور 488 - ماعز لمكافحة فأر مفتش | إينفيتروجن، كارلسروه، ألمانيا | A10680 | |
| Lipofectamine 2000 | إينفيتروجن، كارلسروه، ألمانيا | 11668-019 | |
| CellTracker CMTMR | إينفيتروجن، كارلسروه، ألمانيا | C2927 | |
| CellTracker CMFDA | إينفيتروجن، كارلسروه، ألمانيا | C2925 | |
| Fluoromount | سيغما، Steinheim، ألمانيا | F4680-25ML | |
| جميع المواد الكيميائية الأخرى | روث، كارلسروه، ألمانيا | ||
| مواد خلية ثقافة | Sarstedt، Nümbrecht، ألمانيا |
References
- Zhu, Q., Guo, J. T., Seeger, C. Replication of hepatitis C virus subgenomes in nonhepatic epithelial and mouse hepatoma cells. J. Virol. 77, 9204-9210 (2003).
- Kato, T. Nonhepatic cell lines HeLa and 293 support efficient replication of the hepatitis C virus genotype 2a subgenomic replicon. J. Virol. 79, 592-596 (2005).
- Ali, S., Pellerin, C., Lamarre, D., Kukolj, G. Hepatitis C virus subgenomic replicons in the human embryonic kidney 293 cell line. J. Virol. 78, 491-501 (2004).
- Date, T. Genotype 2a hepatitis C virus subgenomic replicon can replicate in HepG2 and IMY-N9 cells. J. Biol. Chem. 279, 22371-22376 (2004).
- Chang, K. S. Replication of hepatitis C virus (HCV) RNA in mouse embryonic fibroblasts: protein kinase R (PKR)-dependent and PKR-independent mechanisms for controlling HCV RNA replication and mediating interferon activities. J. Virol. 80, 7364-7374 (2006).
- Zhong, J. Robust hepatitis C virus infection in vitro. Proc. Natl. Acad. Sci. U.S.A. 102, 9294-9299 (2005).
- Lindenbach, B. D. Complete replication of hepatitis C virus in cell culture. Science. 309, 623-626 (2005).
- Wakita, T. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat. Med. 11, 791-796 (2005).
- Witteveldt, J. CD81 is dispensable for hepatitis C virus cell-to-cell transmission in hepatoma cells. J. Gen. Virol. 90, 48-58 (2009).
- Bitzegeio, J. Adaptation of hepatitis C virus to mouse CD81 permits infection of mouse cells in the absence of human entry factors. PLoS Pathog. 6, e1000978 (2010).
- Lindemann, D., Goepfert, P. A. The foamy virus envelope glycoproteins. Curr Top Microbiol Immunol. 277, 111-129 (2003).
- Brohm, C. Characterization of determinants important for hepatitis C virus p7 function in morphogenesis by using trans-complementation. J. Virol. 83, 11682-11693 (2009).
- Steinmann, E., Brohm, C., Kallis, S., Bartenschlager, R., Pietschmann, T. Efficient trans-encapsidation of hepatitis C virus RNAs into infectious virus-like particles. J. Virol. 82, 7034-7046 (2008).
- Koutsoudakis, G. Characterization of the early steps of hepatitis C virus infection by using luciferase reporter viruses. J. Virol. 80, 5308-5320 (2006).
- Frentzen, A. Completion of hepatitis C virus replication cycle in heterokaryons excludes dominant restrictions in human non-liver and mouse liver cell lines. PLoS Pathog. 7, e1002029 (2011).
- Lindemann, D. A particle-associated glycoprotein signal peptide essential for virus maturation and infectivity. J. Virol. 75, 5762-5771 (2001).
- Blight, K. J., McKeating, J. A., Rice, C. M. Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication. J. Virol. 76, 13001-13014 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved