A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שתי שיטות של גיבוש Heterokaryon לגלות גורמים הגבלת HCV
In This Article
Summary
נתאר שתי שיטות מותנה טראנס-השלמה של הפטיטיס C (HCV) הרכבה השלמת מחזור החיים המלא ויראלי, אשר מסתמכים על היווצרות heterokaryon. טכניקות אלו מתאימות למסך של שורות תאים המבטאים הגבלה גורמים דומיננטיים, אשר המונעים הייצור של הצאצאים HCV זיהומיות.
Abstract
הפטיטיס C (HCV) הוא וירוס hepatotropic עם טווח המארח מוגבל לבני אדם ושימפנזים. למרות שכפול HCV RNA נצפתה האדם שורות תאים בכבד שאינם ואת Murine, יעילות היה נמוך מאוד הדרושים לטווח ארוך הליכי הבחירה באמצעות HCV replicon בונה ביטוי הדומיננטיות לאנטיביוטיקה לבחירה סמנים 1-5. HCV במבחנה מחקר מוגבל ולכן האדם שורות תאים hepatoma מתירנית לכניסה וירוס השלמת מחזור החיים של נגיפי. בשל HCVs זיקה מינים צרה, אין מודל immunocompetent חיים קטן זמין המקיים את מחזור השכפול מלאה HCV 6-8. שכפול יעיל של HCV ב שאינם בני אדם בתאי למשל ממוצא העכבר סביר להניח עקב חוסר התאמה גנטית של חיוניות תלות בגורמים המארחות / או ביטוי של גורמים הגבלה.
אנו בדקו האם ריבוי HCV מדוכאת על ידי fa הגבלת הדומיננטיתctors ב משני שורות תאים אנושיים שמקורם בכבד ללא רקמות או בכבד קווי עכבר סלולריים. לשם כך, פיתחנו שני עצמאיים תנאי השלמה חוצה שיטות בהסתמך על איחוי תאים סומטיים. בשני המקרים, סיום מחזור השכפול הנגיפי אפשרית רק את heterokaryons. כתוצאה מכך, השלמה מוצלחת טרנס, אשר נקבע על ידי מדידת ייצור דה נובו של הצאצאים ויראלית מדבקת, מצביע על העדר הגבלות דומיננטיים.
באופן ספציפי, replicons HCV subgenomic הנושאים transgene בלוציפראז היו transfected אל מתירנית מאוד התאים hepatoma אדם (הא, 7.5 תאים). כתוצאה מכך, התאים הללו לשתף בתרבית התמזגו לתאים אנושיים Murine שונים להביע HCV הליבה חלבונים מבניים, מעטפה 1 ו - 2 (E1, E2) וחלבונים אביזר P7 ו NS2. ובלבד איחוי תאים יזם טיפול גליקול, פוליאתילן (PEG), תרבות פרסמה הרשות ויראלית מדבקתrticles אשר נגועים בתאי נאיביות באופן הקולטן תלוי.
כדי להעריך את השפעת הגבלות הדומיננטיים על מחזור החיים המלא ויראלי כולל כניסת התא, RNA, שכפול תרגום והרכבה וירוס, אנחנו ניצלו את קו התא האנושי הכבד (הא-7 Lunet תאים נ 9), אשר אין ביטוי אנדוגני של CD81, גורם חיוני הכניסה של HCV. בהעדר CD81 הביע ectopically, תאים אלו הם בעצם עקשן לזיהום HCV 10. חשוב לציין, כאשר שיתוף תרבותי התמזגו עם תאים המבטאים CD81 האדם אבל חוסר לפחות תא אחר כניסת גורם מכריע (כלומר SR-BI, CLDN1, OCLN), רק את heterokaryons כתוצאה להציג את מערכת שלמה של גורמים כניסה HCV הנדרשים על זיהום. לכן, כדי לנתח אם הגורמים הדומיננטיים הגבלת לדכא את השלמת מחזור שכפול HCV, אנו התמזגו Lunet תאים N עם תאים שונים ממקור אנושי עכבר למלא מכה קריטית כאמורeria. כאשר שיתוף בתרבית תאים היו transfected עם חלבון fusogenic ביותר מעטפת הנגיף מוטציה של הנגיף מוקצף אב טיפוס (PFV 11) ו תיגר לאחר מכן עם זיהומיות חלקיקים (HCV HCVcc), דה נובו הייצור של הנגיף מדבק נצפתה. זה מצביע על כך HCV בהצלחה מחזור השכפול שלו heterokaryons ובכך פוסלים הגבלת הביטוי של גורמים דומיננטיים אלה שורות תאים. אלה מותנים השלמה הרומן חוצה שיטות יהיה שימושי למסך פאנל גדול של שורות תאים תאים ראשוניים לביטוי של HCV ספציפיים הגורמים הדומיננטיים הגבלה.
Protocol
תא Fusion ידי PEG
1. תא תרבות
- תרבות הא, 7.5, הלה Hep56.1D שורות תאים נאיביים או אריזה 12 על 15 ס"מ תא הכלים תרבות ב DMEM מלאה (DMEM cplt) בינוני, בתוספת DMEM עם 2 מ"מ L-גלוטמין, 1X לא חיוניות חומצות אמינו, 100 U / פניצילין מ"ל, 100 מיקרוגרם / מ"ל סטרפטומיצין, ו 10% נסיוב עגל העובר. החל הבחירה המתאימה שורות תאים יציבות כמפורט בטבלה 1.
2. Transfection של HCV RNA
- לשטוף הא-7.5 תאים (1 מנה confluent 15 ס"מ) פעמיים עם בופר פוספט trypsinize מלוחים (PBS), ו resuspend בריכוז של 1.5x10 7 תאים למ"ל ב Cytomix (120 מ"מ KCl, 0.15 mM CaCl 2, 10 mM K 2 HPO 4 [pH 7.6], 25 HEPES מ"מ, 2 מ"מ, 5 מ"מ EGTA MgCl 2, מותאם pH 7.6 עם KOH ו לעקר על ידי סינון) המכיל 2 מ"מ ATP ו גלוטתיון 5 מ"מ.
- Transfect דרך electroporatיון 400 μL ההשעיה תא (6x10 6 תאים) עם 10 מיקרוגרם HCV RNA (_JFH1_dg pFKi389Luc-EI/NS3-3 '13) באמצעות cuvettes עם רוחב פער של 0.4 ס"מ pulser ג'ין Xcell המערכת (Biorad) מוגדר 975 μF, 270 V כפי שתואר קודם לכן 14.
- מיד להעביר transfected הא-7.5 התאים מ"ל 10 של המדיום cplt DMEM וזרעי ההשעיה כולו לתוך צלחת תרבות אחת בקוטר 10 ס"מ. תאים תרבות שעות 24 ב 37 מעלות צלזיוס, 5% CO 2.
3. אינדוקציה של Fusion של PEG
- תאים קציר כמתואר 2.1, resuspend במדיום cplt DMEM ו לדלל את 5x10 5 תאים למ"ל.
- צור מתא בודד המתלים של הא-7.5, הלה, ותאי אריזה Hep56.1D, וכן לדלל את 5x10 5 תאים למ"ל, 2x10 5 תאים למ"ל ו 2x10 5 תאים למ"ל, בהתאמה. שים לב, אריזה תאים ectopically אקספרס HCV חלבונים הליבה, E1, E2, P7 ו NS2 לאחר התמרה עם שנייםוקטורים lentiviral תלויים transducing C-E1 ו-E2-P7 NS2 קלטת ביטוי, בהתאמה 13, 15.
- הכן 6-גם צלחות תרבות עם 2-3 סטריליים כיסוי זכוכית לכל גולש גם לצורך ניתוח נוסף של יעילות היתוך.
- שלב 1 מ"ל של הא-7.5 תאים transfected מחסה replicon subgenomic עם 1 מ"ל של תאים אריזה, זרעי לתוך אחד גם צלחת 6-היטב, ואת דגירה של 24 שעות ב 37 מעלות צלזיוס, 5% CO 2.
- בנקודה זו בזמן, צפיפות התאים צריך לנוע בין 60-80% confluency לפני הגיוס של איחוי תאים על מנת לאפשר לתאים להיות בסמיכות של קרום התא לחמש.
- Aspirate בינוני של שיתוף בתרבית תאים ולשטוף פעם אחת עם 1 מ"ל PBS, אז בזהירות להוסיף 500 μL מראש מחומם 40% PEG-1500 או כמו PBS מלאה דגירה של 5 דק 'ב 37 ° C כדי לגרום להיווצרות heterokaryon.
- Aspirate PEG ובזהירות לשטוף 3-5 פעמים במשך דקה 1 (דקות) לכל לשטוף עם 2 מ"ל PBS להסיר PEG עודף ולבסוף מוסיפים 2מ"ל של מדיום cplt DMEM זה טוב לדגור על 37 מעלות צלזיוס, 5% CO 2.
- ארבעים ושמונה שעות היתוך לכתוב, לאסוף את כל מסנן supernatant וסינון באמצעות מיקרומטר 0.45.
- מדד הייצור של חלקיקים מזהמים ב heterokaryons התמזגו על ידי חיסון של הא-7.5 התאים הנאיביים (8x10 4 תאים שנזרעו / גם בצלחת 12-טוב, 24 שעות לפני חיסון) עם 500 μL של נוזל התא ללא תרבות ונחישות הבאות של בלוציפראז פעילות 14.
4. Immunofluorescence לקביעת יעילות Fusion
- לאחר איסוף תרבית תאים supernatants (סעיף 3.8), לשטוף את בארות המכיל כיסוי זכוכית מחליק פעם אחת עם 1 מ"ל של PBS דקות 1. כל השלבים הבאים יש לבצע בטמפרטורת החדר (RT) ואת הכביסה צריך לעשות עם 1 מ"ל PBS דקות 1 לכל כביסה.
- לתקן תאים עם μL 600 paraformaldehyde של 3% (PFA) ב PBS במשך 15 דקות ולאחר מכן לשטוף 3x עם PBS. בזהירות להעביר תלושי כיסוילתוך צלחת של 24 גם באמצעות מלקחיים.
- Permeabilize תאים עם μL 500 של טריטון 0.5% X-100 ב PBS 5 דקות ולאחר מכן לשטוף 3x עם PBS.
- הכן פתרון הנוגדן העיקרי PBS השלימו עם סרום עיזים 5%. השתמש נוגדנים נגד NS5A (9E10) בריכוז של 0.5 מיקרוגרם / מ"ל ו - נוגדן חד שבטי אנושי נגד E2 (CBH-23) בריכוז של 6.4 ng / mL. החל 250 μL היטב כל דגירה על RT 45 דקות.
- לשטוף 3x עם PBS לזהות נוגדנים העיקריים הקשורים עם 250 μL משניים עזים נגד עכברים או עז נגד אדם IgG נוגדנים ספציפיים מצומדות ל-Alexa Alexa פלואוריד 546 או 488, פלואוריד, בריכוז של 2 מיקרוגרם / מ"ל PBS השלימו עם עיזים 5% בסרום. דגירה למשך 30 דקות ב RT בחושך.
- לאחר מכן, לשטוף 1x עם PBS ולאחר מכן כתם גרעיני תאים עם 250 DAPI μL (4 ", 6'-diamidino-2-phenylindole dihydrochloride) בדילול 1:3,000 ב PBS, דגירה דקות 1 ב RT בחושך.
- לשטוף 4x עם PBS ו 1x עם H 2 O, ואז לעלות תלושי כיסוי הפוך על ירידה של Fluoromount בשקופית מיקרוסקופ, תן לו להתייבש במדגם כהה להעריך ידי מיקרוסקופ פלואורסצנטי עקיף.
Fusion ידי transfection חולף של וירוס מוקצף אב טיפוס (PFV) גליקופרוטאין
5. הכנת הבידוד ויראלי
- לייצר מלאי גבוהה וירוס titer ידי transfecting במבחנה עיבד HCV RNA אל הא-7.5 תאים והקציר תרבות supernatant התא לאחר 48 שעות ו 72 שעות כפי שתואר קודם לכן 14. קביעת כייל הנגיף על ידי הגבלת assay דילול (TCID 50) 13.
6. תרבית תאים, היתוך התא על ידי transfection של גליקופרוטאין PFV Fusogenic
- תרבות Lunet N, הלה Hep56.1D hCD81 תאים לפי ההוראות בטבלה 1 ב בינונית cplt DMEM המכיל את הבחירות המתאימות.
- ניתוק תאים כמתואר 2.1, להכין את המתלים תא ותא DMEM cplt מ 'edium, ושיתוף לטפח Lunet N תאים עם הלה או Hep56.1D hCD81 שורות תאים על יחס מתאים (למשל 01:02 על Hep56.1D hCD81 או 01:01 עבור תאים הלה) מניב צפיפות התאים הכולל של 1.5x10 5 תאים לכל 12-היטב דגירה של 24 שעות ב 37 מעלות צלזיוס, 5% CO 2.
- למחרת, זמני transfect תאים עם חלבון PFV fusogenic ביותר המעטפה (pczHFVenvEM066 16) באמצעות 2000 Lipofectamine על פי הוראות היצרן.
7. זיהום Assay
- לחסן heterokaryons 30 שעות לאחר transfection עם μL 350 מניות וירוס (משרד הפנים של ~ 2.3) עבור H 12 לילה, לשטוף פעם אחת עם PBS ולהוסיף 1 מ"ל של מדיום cplt DMEM בכל טוב. דגירה של 48 שעות ב 37 מעלות צלזיוס, 5% CO 2.
- קציר supernatant התרבות heterokaryon, מסנן דרך כמה הא, 7.5 תאים 0.45 מיקרומטר סינון ולחסן, שנזרעו על פלטות 96-היטב (1x10 4 תאים / גם) יום קודם לכן, ב assay דילול הגבלת 13.
- לאחר 72 שעות, כתם נגועים הא-7.5 תאים עם נוגדנים HCV ספציפי (NS5A; 9E10) לכמת הייצור של חלקיקים צאצאי זיהומיות.
8. ויזואליזציה של Fusion Cell
- כדי להמחיש אירועים היתוך, להכין 5 עד 10 מיקרומטר פתרונות של צבעים CellTracker במדיום DMEM ללא תוספים ולהשלים את השלבים הבאים 6 שעות לפני תרבות משותפת (כמתואר בסעיפים 6.2 ו -6.3).
- לשטוף את התאים חסיד פעם אחת עם 5 מ"ל של PBS ולאחר מכן דגירה תאים עם 4 מ"ל של מכתים פתרון לכל צלחת 10 ס"מ על 45 דק 'ב 37 מעלות צלזיוס, 5% CO 2 (כתם Lunet N תאים עם CellTracker אורנג' CMTMR והלה או Hep56.1D hCD81 תאים עם CellTracker גרין CMFDA, בנפרד).
- לשטוף את התאים פעם אחת עם 5 מ"ל של PBS דקות 1 והוסיפו DMEM בינוני cplt, דגירה של 6 שעות ב 37 ° C ו-CO 5% 2.
- הכן זריעת ו transfection של תאים מוכתמים כמתואר לעיל בסעיפים 6.2 ו עם זאת, להוסיף פתק כיסויתרבית תאים המנה לפני זריעה.
- 30 שעות transfection הודעה, לשטוף היטב עם תאים מ"ל 1 של PBS דקות 1 ולאחר מכן לתקן תאים עם μL 250 PFA של 3% במשך 15 דקות ב RT. לשטוף את התאים פעם עם 1 מ"ל PBS דקות 1, כתם עם DAPI דקות 1, כמתואר בסעיף 4.6, לשטוף פעם אחת עם 1 מ"ל PBS דקות 1, חזור על לשטוף עם H 2 O ו תלושי הר כיסוי על שקופיות הזכוכית (ראה סעיף 4.7 ). ניתוח התאים באמצעות מיקרוסקופ פלואורסצנטי.
| מין | התא קו | מקור | הצמיחה ובינוניים הבחירה |
| אנושי | הא-7.5 | Subclone השורה הא-7 hepatoma תא 17 | DMEM cplt |
| הא, 7.5 [CE1] [E2p7NS2] | ביציבות להביע ויראלי הליבה חלבונים, transduced E1, E2, P7 ו ns2, על ידי הגן לא lentiviralransfer של שתי קלטות גנים עצמאיים | DMEM cplt + Blasticidin 5 מיקרוגרם / מ"ל | |
| מה-7 Lunet N | Subclone השורה הא-7 hepatoma תא 9 | DMEM cplt | |
| הלה | אדנוקרצינומה של צוואר הרחם קו תאים (מספר ATCC: CCL-2) | DMEM cplt | |
| הלה [CE1] [E2p7NS2] | ביציבות להביע ויראלי הליבה חלבונים, transduced E1, E2, P7 ו ns2, על ידי העברת גנים lentiviral של שתי קלטות גנים עצמאיים | DMEM cplt G418 + 750 מיקרוגרם / מ"ל; Blasticidin 5 מיקרוגרם / מ"ל | |
| עכבר | Hep56.1D | Hepatocellular קרצינומה ראשונית (מתנה מסוג ג'Encke) למבוגרים C57BL/6J עכברים | DMEM cplt |
| Hep56.1D [CE1] [E2p7NS2] | ביציבות לשעברלחיצה ויראלי הליבה חלבונים, E1, E2, P7 ו ns2, transduced על ידי העברת גנים lentiviral של שתי קלטות גנים עצמאיים | DMEM cplt G418 + 750 מיקרוגרם / מ"ל; Blasticidin 5 מיקרוגרם / מ"ל | |
| Hep56.1D hCD81 | CD81 אדם ביציבות המבטאים transduced על ידי העברת גנים lentiviral | DMEM cplt + Blasticidin 5 מיקרוגרם / מ"ל |
. לוח 1 מפרט על מצב המוצא והתרבות של שורות תאים המשמשים Cplt: מלאה, G418: geneticin, ש: אדם.
9. נציג תוצאות
במחקר זה, אנחנו מוחלים שתי שיטות שונות של איחוי תאים סומטיים שמאפשרים לנו לבדוק באופן ספציפי את ההשפעה של גורמים מגבלה על השלמת מחזור שכפול HCV ב heterokaryons. ראוי לציין, עיצוב מותנה של השלמה, טרנס על שילוב של שני סוגי תאים שונים מבטיח כירק heterokaryons האמיתיים בין תאים בכבד האדם הלא מתירנית שורות תאים, הרכבה וירוס (גישה 1) או כניסת וירוסים מחזור שכפול מלא HCV (גישה 2) הם השיגו.
לפי הגישה הראשונה, הא 7.5 תאים, מתירנית ביותר עבור HCV, היו transfected זמני עם replicon subgenomic להביע transgene בלוציפראז ו HCV ללא חלבונים מבניים תמיכה שכפול subgenomic HCV RNA (הא, 7.5 תאים replicon). תאים אלה היו שיתוף תרבותי קיבע את שורות תאים המבטאים הליבה חלבונים מבניים HCV, E1, E2, כמו גם חלבונים P7 אביזר, ו NS2. Figure1A מציג סקירה של הליך ניסיוני. חשוב לציין, לאחר היתוך PEG, כל החלבונים הדרושים להרכבה החלקיקים צריך להיות נוכח heterokaryon יצרו אשר יכול להיות מאושרת על ידי immunofluorescence נגד חלבונים נגיפיים בודדים. איור 1 ב 'מתאר אירוע למופת היתוך שבו אותות עבור NS5A הן ביטוי הא-7.5 תאים replicon ו E2ביטוי הא-7.5 [CE1] [E2p7NS2] תאים אריזה התגלו בציטופלסמה אותו על היווצרות heterokaryon PEG-Induced. כאשר שיתוף בתרבית תאים טופלו במקום עם PBS, היתוך לא היה מושרה ובכך רק חד תאים חיוביים ולא שותף לוקליזציה של אותות נצפתה. יתר על כן, כדי לשלוט ביטוי transgene, ביצענו ELISAs ספציפיים הליבה E2 (שדווח קודם לכן בפירוט 15). בנוסף קו אריזה השליטה תא הא 7.5 [CE1] [E2p7NS2], אנחנו שנוצר הלה תאים אריזה Hep56.1D כמו נציגים של הכבד הלא אנושי כבד תאים העכבר, בהתאמה. יעילות HCV RNA שכפול תאים אלה האחרונים הוא הרכבה נמוכה HCV ושחרור לא הוכח. איור 1 ג ממחיש את תוצאות assay היתוך. Supernatants נאספו תרבות משותפת ב 48 אינדוקציה היתוך h הדואר המשמש מחסן נאיביות הא-7.5 תאים מבחני לוציפראז הבאים. יש לציין, כאשר הא-7.5 תאים replicon היו התמזגו עם אושורות תאים נאיביים או שטופלו PBS כמו שליטה, infectivity לא זוהה הנוזלים תרבות. עם זאת, כאשר איחוי בין תאים replicon-7.5 הא תא קווי אריזה היה המושרה על ידי PEG, חוצה השלמה בין replicon וחלבונים מבניים לידי ביטוי constitutively הציל את ייצור הנגיף heterokaryons שהתקבל חלקיקים נגיפיים זיהומיות שוחררו לתוך הנוזלים תרבות. לכן הגענו למסקנה כי הייצור וירוס נדרש איחוי תאים ביטוי של חלבונים נגיפיים של שורות תאים אריזה. באופן מפתיע, לא רק את heterokaryons של הא-7.5 hepatoma תאים אנושיים, אלא גם heterokaryons עם כבד שאינו אנושי (הלה [CE1] [E2p7NS2]) ועכבר הכבד (Hep56.1D [CE1] [E2p7NS2]) תאים מותר לשחרר וירוס, המציין כי הרכבה שחרור לא דומיננטית מעוכבים על ידי גורמים הגבלת אפשריים אלו סוגי תאים. ביטוי של חלבונים מבניים בתא קווי אריזה כניסה אותנטי לתאי היעד הוצגה Frentzen Et al. 15.
שיטה חלופית של איחוי תאים נוצל לנתח מגבלות אפשריות המשפיעות על ערך תא, תרגום RNA בשלבי רנ"א שכפול של מחזור שכפול להוציא את נטל ויראלי גבוה transfected הא 7.5 תאים replicon היה למנוע זיהוי של גורמים הגבלת ידי הרוויה. לשם כך, פיתחנו assay עצמאית המבוססת על חיסון של heterokaryons עם HCVcc וזיהוי של ייצור דה נובו הווירוס בתאים אלה. כמתואר באיור 2 א, היתוך סומטי התא היה המושרה על ידי ביטוי של גליקופרוטאין fusogenic לאחר עיבוד משותף של התאים. שיטה זו נבחרה בגלל רגישות הוגדל כנראה עקב יעילות היתוך גדל. Heterokaryons היו דמיינו ידי מכתים שורות תאים נפרדים עם צבעים CellTracker קודמים לטיפוח שיתוף. Heterokaryon עם צבעים מבוזרים homogenously בתוך הציטופלסמה מציין שילוב של שני סוגי התאים כמו עולהד באיור 2 ב. רק heterokaryons של Lunet N תאים עם תאים הלה או Hep56.1D hCD81 התאים הם גורמים כניסה HCV לידי ביטוי ובכך סלקטיבי עיבוד heterokaryons רגישים ערך תא HCV. האתגר עם HCVcc הביא שכפול מלא של HCV ב heterokaryons אשר ניכר מייצור דה נובו של הצאצאים ויראלית מדבקת כ 10 פי מעל רקע assay (איור 2 ג). כמו פקד, Lunet תאים נ היו התמזגו עם תאים Lunet n. חשוב לציין כי רק רמות נמוכות מאוד של קרוב HCV זיהומיות לגבול איתור נצפו. תוצאות דומות התקבלו כאשר Lunet תאים נ היו התמזגו עם תאים Hep56.1D נאיביות. בשני המקרים, היה CD81 אדם נעדרים, כך HCV לא פרודוקטיבית להדביק את heterokaryons. זה infectivity נמוך מאוד זיהה את שני המקרים האחרונים נובע עשוי רמה נמוכה של זיהום של תאים Lunet N ו / או רמות נמוכות של קלט שיורית וירוס מדבק מן הבידוד. ב הלה תאים בניגוד והואp56.1D hCD81 תאים להביע האדם CD81, ובכך משלים ערך תא חסר גורם heterokaryons ועל המתיר כניסה לתא HCV. רמה 10 עלייה של פי HCV זיהומיות זוהה במדיום של heterokaryons מעורבים שתי שורות תאים ולכן סביר משקף ייצור דה נובו של חלקיקים מזהמים ב heterokaryons. לכן, הגענו למסקנה כי השלמת מחזור שכפול HCV אינו מוגבל למעט הביטוי של גורמים דומיננטיים הגבלת HCV ב שורות תאים אלה.
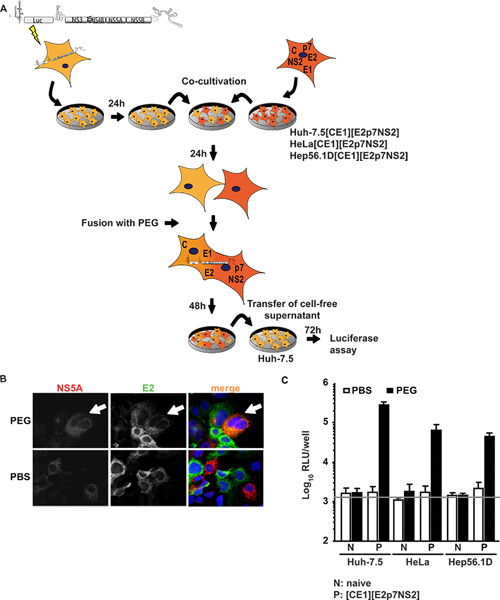
באיור 1. חוצה השלמה של הרכבה HCV ולשחרר heterokaryons. (א ') מתאר סכמטי של הליך ניסיוני של היתוך PEG בתיווך התא. JFH1 בלוציפראז כתב replicon לוק, ns3-5b היה transfected אל הא-7.5 התאים הנאיביים ידי electroporation. למחרת, תאים נותקו ושיתוף בתרבית עם תאים נאיביים או אריזה תאים המבטאים constitutively HCV הליבה, E1, E2, P7 ו NS2. 24 שעות הודעה משותפת לגידול, היווצרות heterokaryon היה המושרה על ידי טיפול עם PEG 40% באמצעות PBS כביקורת שלילית. לאחר 48 שעות, תא ללא supernatant היה לקצור לחסן נאיביות הא-7.5 תאים. Infectivity נקבע על ידי הפעילות בלוציפראז. (ב) זיהוי של heterokaryons, התאים היו immunostained באמצעות נוגדנים חד שבטיים כנגד E2 ו NS5A. ביטוי בו זמנית של שני חלבונים בתוך תאים מעיד על איחוי תאים. (ג) בלוציפראז המדידות בוצעו לכמת infectivity ויראלי המופק heterokaryons. משמעות הערכים של שלושה ניסויים בלתי תלויים ואת סטיות תקן של האמצעים מקבלים. הפס האופקי מייצג את RLU הרקע שנקבע הא-7.5 תאים נגוע. לחץ כאן כדי להציג דמות גדולה .
9/4029fig2.jpg "/>
איור 2. השלמת מחזור שכפול HCV לאחר חיסון של heterokaryons. (א ') סקירה סכמטי של הליך ניסיוני. מה-7 Lunet תאים נ חסרי CD81 היו שיתוף תרבותי עם שורות תאים הצביע חסר או להביע CD81 האדם. חשוב לציין, תאים אלה האחרונים חסרים לפחות גורם אחד כניסה HCV ולכן לא ניתן להידבק באופן פרודוקטיבי. למחרת היתוך יזם transfection של חלבון המעטפת הנגיפי fusogenic מ PFV. שלושים שעות לאחר מכן, התאים היו תיגר עם חלקיקים HCV זיהומיות. כדי למדוד את ערך תא, שכפול רנ"א וייצור וירוס שנגרמו heterokaryons אלה, infectivity שוחרר התא נוזלים נטולי תרבות נקבע על 48 שעות שלאחר חיסון. לשם כך, תמימה הא-7.5 התאים שימשו תאים היעד assay דילול מגביל (TCID 50). (ב) זיהוי של heterokaryons, תאים הוכתמו CellTracker ירוק או כתום CellTracker 6 שעות לפני שיתוף cultivation ו transfection. שלושים שעות לאחר מכן, התאים קובעו ונצבעו עם DAPI. (ג) Lunet תאים נ היו התמזגו לתאים הלה, תאים Hep56.1D או Hep56.1D נאיביות המבטאים CD81 אדם. תרבויות אלה מחוסן עם HCVcc (משרד הפנים של 2.3). נוזלים תרבות נאספו 48 שעות מאוחר יותר, דה נובו שחרור חלקיק מן heterokaryons נקבע על ידי TCID 50 משתמש נאיביות הא-7.5 התאים היעד. משמעות הערכים של שלושה ניסויים בלתי תלויים מקבלים. הפס האופקי מייצג את גבול הגילוי של assay. לחץ כאן כדי להציג דמות גדולה .
Discussion
אנו מציגים שתי שיטות להשרות היווצרות heterokaryon בתאים בתרבית ניתוח של מגבלות שליליים דומיננטיים המונעים שכפול HCV. באמצעות נהלים אלה הוצאנו את נוכחותו של גורם הביע constitutively או וירוס הנגרמת הדומיננטי שונים הכבד אי האנושי ב שורות תאים Murine כבד. Assay 1 מנתח בעיקר אם גורמים הגבלת...
Disclosures
TP קיבל דמי ייעוץ מ Biotest.
Acknowledgements
אנו מודים Takaji Wakita ו Jens בוך עבור JFH1 ומבודד J6CF, בהתאמה. כמו כן אנו מודים צ'ארלס רייס על הא-7.5 התאים נוגדנים 9E10, סטיבן Foung עבור E2 נוגדנים ספציפיים CBH-23, וכל חברי המחלקה לוירולוגיה ניסיוני, Twincore לקבלת הצעות ודיונים מועילות.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
| DMEM | Invitrogen, קרלסרוהה, גרמניה | 41965-039 | |
| L-גלוטמין | Invitrogen, קרלסרוהה, גרמניה | 25030-024 | |
| לא חיוניות חומצות אמינו | Invitrogen, קרלסרוהה, גרמניה | 11140-035 | |
| פניצילין / סטרפטומיצין | Invitrogen, קרלסרוהה, גרמניה | 15140-122 | |
| העגל העובר סרום | PAA, Cölbe, גרמניה | A15151 | |
| α-E2 (CBH23) | מספקים בנדיבותם של סטיבן Foung 10 | ||
| ה-ATP | סיגמא, שטיינהיים, גרמניה | A2833-106 | |
| הגלוטתיון | סיגמא, שטיינהיים, גרמניה | G4251-1G | |
| Blasticidin | InVivo אלוף, סן דייגו, ארה"ב | Ant-BL-1 | |
| G418 (geneticin) | Invitrogen, קרלסרוהה, גרמניה | 11811-064 | |
| פוליאתילן גליקול--1500 | רוש, מנהיים, גרמניה | 10783641001 | |
| Paraformaldehyde | רוט, קרלסרוהה, גרמניה | 0,335.3 | |
| טריטון X-100 | רוט, קרלסרוהה, גרמניה | 3051.2 | |
| עיזים סרום | סיגמא, שטיינהיים, גרמניה | G9023-5 מ"ל | |
| α-NS5A (9E10) | בתנאי חביב ידי צ'ארלס רייס 7 | ||
| DAPI (4 ", 6'-diamidino-2-phenylindole dihydrochloride) | Invitrogen | D1306 | |
| אלקסה, פלואוריד 546 - אנטי אנושי עז IgG | Invitrogen, קרלסרוהה, גרמניה | A21089 | |
| אלקסה, פלואוריד 488 - עז נגד העכבר IgG | Invitrogen, קרלסרוהה, גרמניה | A10680 | |
| Lipofectamine 2000 | Invitrogen, קרלסרוהה, גרמניה | 11668-019 | |
| CellTracker CMTMR | Invitrogen, קרלסרוהה, גרמניה | C2927 | |
| CellTracker CMFDA | Invitrogen, קרלסרוהה, גרמניה | C2925 | |
| Fluoromount | סיגמא, שטיינהיים, גרמניה | F4680-25ML | |
| כל כימיקלים אחרים | רוט, קרלסרוהה, גרמניה | ||
| תרבית תאים חומרים | Sarstedt, Nümbrecht, גרמניה |
References
- Zhu, Q., Guo, J. T., Seeger, C. Replication of hepatitis C virus subgenomes in nonhepatic epithelial and mouse hepatoma cells. J. Virol. 77, 9204-9210 (2003).
- Kato, T. Nonhepatic cell lines HeLa and 293 support efficient replication of the hepatitis C virus genotype 2a subgenomic replicon. J. Virol. 79, 592-596 (2005).
- Ali, S., Pellerin, C., Lamarre, D., Kukolj, G. Hepatitis C virus subgenomic replicons in the human embryonic kidney 293 cell line. J. Virol. 78, 491-501 (2004).
- Date, T. Genotype 2a hepatitis C virus subgenomic replicon can replicate in HepG2 and IMY-N9 cells. J. Biol. Chem. 279, 22371-22376 (2004).
- Chang, K. S. Replication of hepatitis C virus (HCV) RNA in mouse embryonic fibroblasts: protein kinase R (PKR)-dependent and PKR-independent mechanisms for controlling HCV RNA replication and mediating interferon activities. J. Virol. 80, 7364-7374 (2006).
- Zhong, J. Robust hepatitis C virus infection in vitro. Proc. Natl. Acad. Sci. U.S.A. 102, 9294-9299 (2005).
- Lindenbach, B. D. Complete replication of hepatitis C virus in cell culture. Science. 309, 623-626 (2005).
- Wakita, T. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat. Med. 11, 791-796 (2005).
- Witteveldt, J. CD81 is dispensable for hepatitis C virus cell-to-cell transmission in hepatoma cells. J. Gen. Virol. 90, 48-58 (2009).
- Bitzegeio, J. Adaptation of hepatitis C virus to mouse CD81 permits infection of mouse cells in the absence of human entry factors. PLoS Pathog. 6, e1000978 (2010).
- Lindemann, D., Goepfert, P. A. The foamy virus envelope glycoproteins. Curr Top Microbiol Immunol. 277, 111-129 (2003).
- Brohm, C. Characterization of determinants important for hepatitis C virus p7 function in morphogenesis by using trans-complementation. J. Virol. 83, 11682-11693 (2009).
- Steinmann, E., Brohm, C., Kallis, S., Bartenschlager, R., Pietschmann, T. Efficient trans-encapsidation of hepatitis C virus RNAs into infectious virus-like particles. J. Virol. 82, 7034-7046 (2008).
- Koutsoudakis, G. Characterization of the early steps of hepatitis C virus infection by using luciferase reporter viruses. J. Virol. 80, 5308-5320 (2006).
- Frentzen, A. Completion of hepatitis C virus replication cycle in heterokaryons excludes dominant restrictions in human non-liver and mouse liver cell lines. PLoS Pathog. 7, e1002029 (2011).
- Lindemann, D. A particle-associated glycoprotein signal peptide essential for virus maturation and infectivity. J. Virol. 75, 5762-5771 (2001).
- Blight, K. J., McKeating, J. A., Rice, C. M. Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication. J. Virol. 76, 13001-13014 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved