Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Deux méthodes de formation hétérocaryons à découvrir les facteurs de restriction du VHC
Dans cet article
Résumé
Nous décrivons deux méthodes pour conditionnelle Trans-Complémentation de l'hépatite C (VHC) de montage et la réalisation du cycle de vie virale complète, qui reposent sur la formation des hétérocaryons. Ces techniques sont adaptées à l'écran pour les lignées cellulaires qui expriment des facteurs de restriction dominantes, qui empêchent la production de la descendance du VHC infectieux.
Résumé
L'hépatite C (VHC) est un virus hépatotrope avec une gamme d'hôtes limitée pour les humains et les chimpanzés. Bien que l'ARN du VHC de réplication a été observée dans les lignées cellulaires humaines non-hépatiques et murin, l'efficacité était très faible et les procédures de sélection requis à long terme en utilisant le VHC réplicon construit exprimant dominantes antibiotiques sélectionnables marqueurs 1-5. VHC in vitro de la recherche se limite donc à des lignées cellulaires d'hépatome permissives pour l'entrée du virus et l'achèvement du cycle de vie virale. En raison de HVC tropisme espèces étroit, il n'ya pas de modèle animal immunocompétent petite disponibles qui soutient le cycle de réplication du VHC complète 6-8. La réplication du VHC dans inefficace des cellules non humaines, par exemple d'origine de la souris est probablement dû à un manque d'incompatibilité génétique des facteurs essentiels de dépendance d'accueil et / ou l'expression de facteurs de restriction.
Nous avons étudié si la propagation du VHC est supprimée par fa restriction dominantectors en soit des lignées cellulaires humaines dérivées de non-hépatiques tissus ou dans des lignées de souris cellules hépatiques. À cette fin, nous avons développé deux indépendants conditionnelles trans-complémentation des méthodes reposant sur la fusion de cellules somatiques. Dans les deux cas, l'achèvement du cycle de réplication virale n'est possible que dans les hétérocaryons. Par conséquent, le succès trans-complémentation, qui est déterminée en mesurant la production de novo de la descendance virale infectieuse, indique l'absence de restrictions dominantes.
Plus précisément, subgénomiques réplicons du VHC portant un transgène luciférase ont été transfectés dans des cellules permissives hautement hépatome humain (Huh-7.5 des cellules). Par la suite, ces cellules ont été co-cultivées et fusionné à diverses cellules humaines et murines exprimant VHC noyau structurel protéines, de l'enveloppe 1 et 2 (E1, E2) et accessoire protéines p7 et NS2. À condition que la fusion cellulaire a été initiée par un traitement avec du polyéthylène-glycol (PEG), la culture virale infectieuse libérée particles qui a infecté des cellules naïves d'une manière dépendante du récepteur.
Pour évaluer l'influence des restrictions dominantes sur le cycle de vie complet, y compris virale entrée dans la cellule, la traduction d'ARN, la réplication et l'assemblage du virus, nous avons profité d'une lignée cellulaire de foie humain (Huh-7 Lunet N cellules 9) qui manque de l'expression endogène de CD81, un facteur essentiel de l'entrée du VHC. En l'absence de CD81 exprimés de manière ectopique, ces cellules sont essentiellement réfractaire à l'infection par le VHC 10. Il est important, en cas de co-culture et fusionnées avec des cellules qui expriment CD81 humain, mais le manque au moins un autre facteur crucial entrée dans la cellule (c.-à-SR-BI, CLDN1, OCLN), seuls les hétérocaryons résultant d'afficher l'ensemble des facteurs d'entrée du VHC nécessaires pour l'infection. Par conséquent, pour analyser si les facteurs de restriction dominantes supprimer l'achèvement du cycle de réplication du VHC, on condensé Lunet N cellules avec des cellules d'origine humaine différents et une souris qui remplissent la critique mentionnée ci-dessuseria. Lorsque des cellules co-cultivées ont été transfectées avec une protéine d'enveloppe virale hautement fusogène mutante de type foamy virus du prototype (PFV 11) et par la suite avec des particules de VHC défi infectieuses HCVcc), de novo de production de virus infectieux a été observée. Cela indique que le VHC complété avec succès son cycle de réplication dans les hétérocaryons écartant ainsi l'expression de facteurs de restriction dominantes dans ces lignées cellulaires. Ces nouveaux conditionnelles trans-complémentation méthodes sera utile pour dépister un large panel de lignées cellulaires et cellules primaires pour l'expression du VHC-spécifiques facteurs de restriction dominantes.
Protocole
Fusion cellulaire par PEG
1. Culture cellulaire
- Culture Huh-7.5, HeLa et les lignées de cellules naïves Hep56.1D ou l'emballage 12 sur 15 cm plats de culture de cellules dans du DMEM complet (DMEM CPLT) moyennes, DMEM supplémenté avec 2 mM de L-glutamine, 1x non-acides aminés essentiels, 100 U / mL de pénicilline, 100 pg / ml streptomycine, et 10% de sérum de veau foetal. Appliquer la sélection appropriée des lignées cellulaires stables, comme indiqué dans le tableau 1.
2. La transfection de l'ARN du VHC
- Lavez-Huh 7,5 cellules confluentes (un plat de 15 cm) à deux reprises avec tampon phosphate salin (PBS), trypsiniser, et remettre en suspension à une concentration de 1,5.10 7 cellules / ml dans CYTOMIX (120 mM de KCl, 0,15 mM CaCl 2, 10 mM K 2 HPO 4 [pH 7,6], 25 mM d'HEPES, 2 mM d'EGTA, 5 mM MgCl 2, ajustée à pH 7,6 avec KOH et stérilisé par filtration) contenant 2 mM d'ATP et 5 mM de glutathion.
- Transfecter via electroporation 400 ul de la suspension cellulaire (6x10 6 cellules) avec 10 pg d'ARN du VHC (_JFH1_dg pFKi389Luc-EI/NS3-3 '13) en utilisant des cuves avec une largeur de fente de 0,4 cm et un Gene Pulser Xcell système (Biorad) réglé à 975 uF et 270 V comme décrit précédemment 14.
- Transférer immédiatement transfectées Huh-7.5 des cellules à 10 ml de DMEM CPLT moyen et la semence de la totalité de la suspension dans une boîte de culture unique de 10 cm de diamètre. Des cellules en culture pendant 24 h à 37 ° C et 5% de CO 2.
3. Induction de la Fusion par PEG
- Cellules de récolte tel que décrit à la section 2.1, remettre en suspension dans du DMEM CPLT à moyen et à diluer à 5x10 5 cellules / ml.
- Générer une seule cellule suspensions de Huh-7.5, HeLa et les cellules de conditionnement Hep56.1D et diluées à 5x10 5 cellules / ml, 2x10 5 cellules / ml, et 2x10 5 cellules / ml, respectivement. Notez que les cellules de conditionnement ectopique exprimer des protéines du VHC de base, E1, E2, p7 et NS2 après transduction avec deuxdépendants des vecteurs lentiviraux de transduction d'un C-E1 et E2-cassette d'expression p7-NS2, respectivement 13, 15.
- Préparer les plaques de culture à 6 puits avec 2-3 lamelles de verre stériles par puits pour une analyse plus approfondie de l'efficacité de fusion.
- Mélanger 1 ml de transfectées Huh-7.5 cellules hébergeant le réplicon sous-génomique avec 1 ml de cellules d'emballage, de semences dans un puits d'une plaque à 6 puits, et incuber pendant 24 h à 37 ° C et 5% de CO 2.
- À ce point temporel, la densité de cellules doit être comprise entre 60-80% de confluence avant l'induction de la fusion cellulaire, pour permettre aux cellules de se trouver à proximité de membranes cellulaires à fusionner.
- Aspirer à moyen de co-cultures de cellules et laver une fois avec 1 ml de PBS, puis soigneusement ajouter 500 ul de pré-chauffé à 40% de PEG-1500 ou du PBS que le contrôle et incuber pendant 5 min à 37 ° C pour induire la formation hétérocaryon.
- Aspirer PEG et se laver soigneusement les 3-5 fois pendant 1 minute (min) par lavage avec 2 ml de PBS pour éliminer l'excès de PEG et enfin ajouter 2mL de DMEM CPLT à moyen et à chaque puits et incuber à 37 ° C et 5% de CO 2.
- Quarante-huit heures après la fusion, de recueillir chaque filtre surnageant et filtrer à travers un um 0,45.
- Mesure de la production de particules infectieuses dans hétérocaryons fusionnés par inoculation de naïfs Huh-7.5 (8x10 cellules 4 cellules / puits ensemencées dans une plaque à 12 puits, 24 h avant l'inoculation) avec 500 ul de milieu de culture cellulaire et sans la détermination ultérieure de la luciférase l'activité 14.
4. Immunofluorescence pour déterminer l'efficacité de fusion
- Après avoir recueilli les surnageants de culture de cellules (section 3.8), laver les puits contenant couvercle en verre se glisse une fois avec 1 mL de PBS pendant 1 min. Toutes les étapes suivantes doivent être effectuées à température ambiante (RT) et le lavage doit être fait avec 1 ml de PBS pendant 1 min par lavage.
- Fixer les cellules avec 600 uL de paraformaldéhyde 3% (PFA) dans du PBS pendant 15 min puis laver 3x avec du PBS. Transférer délicatement les lamellesdans une plaque de 24 puits en utilisant une pince.
- Perméabiliser les cellules avec 500 ul de Triton 0,5% X-100 dans du PBS pendant 5 min, puis lavez-3x avec du PBS.
- Préparer une solution d'anticorps primaire dans du PBS additionné de sérum de chèvre 5%. Utilisation d'anticorps anti-NS5A (9E10) à une concentration de 0,5 ug / ml et monoclonal humain anti-E2 anticorps (CBH-23) à une concentration de 6,4 ng / ml. Appliquer de 250 ul à chaque puits et incuber à température ambiante pendant 45 min.
- Laver 3x avec du PBS et de détecter les anticorps primaires liés avec 250 pi secondaires de chèvre anti-souris ou de chèvre anti-IgG humaines-anticorps spécifiques conjugués à Alexa Fluor-546 ou Alexa Fluor 488-, à une concentration de 2 ug / ml dans du PBS additionné du sérum de chèvre 5%. Incuber pendant 30 min à température ambiante dans l'obscurité.
- Puis, lavez avec du PBS 1x puis tache noyaux des cellules avec 250 ul DAPI (4 ', 6'-diamidino-2-phénylindole dichlorhydrate) dilué dans du PBS 1:3,000, incuber pendant 1 min à température ambiante dans l'obscurité.
- Laver avec du PBS 4x et 1x avec H 2 O, puis montez les lamelles à l'envers sur une baisse de Fluoromount sur une lame de microscope, laissez-le sécher dans l'échantillon sombre et d'évaluer par microscopie à fluorescence indirecte.
Fusion par transfection transitoire de virus spumeux prototype (PFV) glycoprotéine
5. Préparation de l'inoculum viral
- Produire un stock à titre élevé de virus par transfection d'ARN transcrit in vitro du VHC dans les cellules Huh-7.5 et la récolte surnageant de culture cellulaire après 48 h et 72 h 14 comme décrit précédemment. Déterminer titre viral en limitant test de dilution (DICT 50) 13.
6. Culture cellulaire, la fusion cellulaire par transfection d'une glycoprotéine fusogène PFV
- Culture Lunet N, HeLa, et Hep56.1D hCD81 cellules selon les instructions dans le tableau 1 dans du DMEM CPLT milieu contenant sélections appropriées.
- Détacher les cellules comme décrit en 2.1, préparer des suspensions de cellules uniques dans un milieu DMEM CPLT moyen, et co-cultiver Lunet N cellules HeLa ou avec des lignes de cellules Hep56.1D hCD81 à des taux appropriés (par exemple 1:2 pour Hep56.1D hCD81 ou 1:1 pour les cellules HeLa) et ont donné une densité cellulaire total de 1,5.10 5 cellules par 12 puits et incuber pendant 24 h à 37 ° C et 5% de CO 2.
- Le lendemain, transitoirement transfecter des cellules avec la protéine d'enveloppe hautement PFV fusogène (pczHFVenvEM066 16) en utilisant 2000 Lipofectamine conformément aux instructions du fabricant.
7. Dosage des infections
- Inoculer hétérocaryons 30 h après la transfection avec 350 uL de stock de virus (MOI de ~ 2,3) pendant 12 h durant la nuit, se laver une fois avec du PBS et ajouter 1 ml de DMEM CPLT milieu par puits. Incuber pendant 48 h à 37 ° C et 5% de CO 2.
- Surnageant de récolte de la culture hétérocaryon, filtrer à travers un filtre de 0,45 um et ensemencer Huh-7.5 cellules, ensemencées dans des plaques à 96 puits (1x10 4 cellules / puits), la veille, dans un essai de dilution limite 13.
- Après 72 h, d'un colorant infectées Huh-7.5 cellules avec un anticorps spécifique du VHC (NS5A; 9E10) pour quantifier la production de particules de descendance infectieuse.
8. Visualisation de la fusion cellulaire
- Pour visualiser les événements de fusion, de préparer 5 à 10 uM solutions de colorants CellTracker dans du milieu DMEM sans additifs et de compléter les étapes ci-dessous 6 h avant de co-culture (décrits dans les sections 6.2 et 6.3).
- Laver les cellules adhérentes fois avec 5 ml de PBS et puis incuber les cellules avec 4 ml de solution de coloration par 10 cm plat pendant 45 min à 37 ° C et 5% de CO 2 (tache Lunet N cellules avec CellTracker orange CMTMR et HeLa ou Hep56.1D hCD81 cellules avec CellTracker vert CMFDA, séparément).
- Laver les cellules une fois avec 5 ml de PBS pendant 1 min et ajoutez DMEM CPLT moyenne, incuber pendant 6 h à 37 ° C et 5% de CO 2.
- Préparer l'ensemencement et la transfection de cellules colorées comme décrit ci-dessus dans les sections 6.2 et cependant, ajouter une lamelle à l'boîte de culture cellulaire avant l'ensemencement.
- 30 h après la transfection, laver les cellules avec soin avec 1 mL de PBS pendant 1 min, puis fixer les cellules avec 250 ul de 3% PFA pendant 15 min à température ambiante. Laver les cellules une fois avec 1 ml de PBS pendant 1 min, coloration au DAPI pendant 1 min comme décrit dans la section 4.6, se laver une fois avec 1 ml de PBS pendant 1 min, répéter laver avec H 2 O et des lamelles de montage sur lames de verre (voir la section 4.7 ). Analyser les cellules avec un microscope à fluorescence.
| Espèce | La lignée cellulaire | Origine | Le milieu de croissance et de la sélection |
| Humain | Huh-7.5 | Sous-clone de Huh-7 lignée cellulaire d'hépatome 17 | DMEM CPLT |
| Huh-7.5 [CE1] [E2p7NS2] | Exprimant de façon stable virale de base des protéines, E1, E2, p7 et NS2, transduites par le gène lentiviral transfert de deux cassettes de gènes indépendants | DMEM + CPLT blasticidine 5 ug / ml | |
| Huh-7 Lunet N | Sous-clone de Huh-7 lignée cellulaire d'hépatome 9 | DMEM CPLT | |
| HeLa | Col de l'utérus ligne de cellules d'adénocarcinome (numéro ATCC: CCL-2) | DMEM CPLT | |
| HeLa [CE1] [E2p7NS2] | Exprimant de manière stable virale de base protéines, E1, E2, p7, et NS2, transduites par transfert de gène lentiviral de deux cassettes de gènes indépendants | DMEM CPLT + G418 750 pg / mL; blasticidine 5 ug / ml | |
| Souris | Hep56.1D | Carcinome hépatocellulaire primaire (gentil cadeau de J. Encke) Souris adultes C57BL/6J | DMEM CPLT |
| Hep56.1D [CE1] [E2p7NS2] | Ex stableappuyant virale de base protéines, E1, E2, p7, et NS2, par transfert de gène de transduction de lentivirale deux cassettes de gènes indépendants | DMEM CPLT + G418 750 pg / mL; blasticidine 5 ug / ml | |
| Hep56.1D hCD81 | Exprimant de façon stable CD81 humaines transduites par transfert de gène lentiviral | DMEM + CPLT blasticidine 5 ug / ml |
Tableau 1 Caractéristiques sujet de l'état d'origine et la culture de lignées cellulaires utilisées CPLT:. Complète, G418: généticine, h: de l'homme.
9. Les résultats représentatifs
Dans cette étude, nous avons appliqué deux méthodes différentes de la fusion de cellules somatiques qui nous permettent de spécifiquement pour étudier l'impact des facteurs de restriction à la fin du cycle de réplication du VHC dans des hétérocaryons. Fait à noter, la conception conditionnelle de trans-complémentation lors de la fusion des deux types de cellules différentes assure queseulement dans hétérocaryons véritables entre les cellules de foie humain et des lignées cellulaires non-permissives, l'assemblage du virus (approche 1) ou à l'entrée du virus et le cycle de réplication complète du VHC (approche 2) sont réalisées.
Dans la première approche Huh-7.5, très permissives cellules pour le VHC, ont été transfectées de façon transitoire avec un réplicon sous-génomique exprimant un transgène luciférase et VHC des protéines non structurales soutenir subgénomique l'ARN du VHC de réplication (cellules Huh-réplicons 7.5). Ces cellules sont en co-culture et est fusionnée à des lignées cellulaires exprimant des protéines du VHC noyau structurel, E1, E2, ainsi que l'accessoire protéines p7, et NS2. Figure1a montre un aperçu de la procédure expérimentale. Il est important, à la suite de fusion PEG, toutes les protéines nécessaires à l'assemblage des particules doit être présent dans le hétérocaryon formé qui peut être confirmé par immunofluorescence contre individuels protéines virales. Figure 1B représente un événement de fusion exemplaire dans lequel les signaux à la fois pour NS5A exprimé dans les cellules Huh-7.5 réplicon et E2exprimée en Huh-7.5 [CE1] [E2p7NS2] des cellules d'encapsidation ont été détectés dans le cytoplasme même sur PEG-formation induite par hétérocaryon. Lors de la co-cultures de cellules ont été traitées avec du PBS au lieu, pas de fusion a été induite ainsi que seule cellules positives et pas de co-localisation de signaux a été observée. En outre, pour contrôler l'expression du transgène, nous avons effectué des tests ELISA spécifiques pour le coeur et E2 (précédemment rapporté en détail 15). En plus de la lignée cellulaire contrôle de l'emballage Huh 7,5 [CE1] [E2p7NS2], nous avons généré des cellules HeLa et des cellules d'encapsidation Hep56.1D en tant que représentants de l'homme non-foie et les cellules du foie de souris, respectivement. L'efficacité du VHC réplication de l'ARN dans ces dernières cellules est un assemblage à faible et le VHC et de la libération n'a pas été démontré. Figure 1C illustre les résultats de l'essai de fusion. Les surnageants ont été recueillis à partir de la co-culture à 48 h d'induction de fusion après et utilisées pour inoculer naïfs Huh-7.5 des cellules pour la suite des essais luciférase. Notamment, lorsque les cellules Huh-réplicons 7.5 ont été fusionnées avec soitlignées de cellules naïves ou traités avec du PBS comme témoin, aucune infectiosité a été détectée dans les liquides de culture. Toutefois, lorsque la fusion cellulaire entre Huh-7.5 réplicon et les lignées cellulaires d'emballage a été induite par le PEG, le trans-complémentation entre réplicon et exprimées de manière constitutive les protéines structurelles sauvé la production de virus dans les hétérocaryons résultant et des particules virales infectieuses ont été libérés dans les liquides de culture. Nous avons donc conclu que la production de virus nécessaire la fusion cellulaire et l'expression de protéines virales dans les lignées cellulaires d'encapsidation. Il est frappant, non seulement les hétérocaryons de Huh-7.5 cellules d'hépatome humain, mais aussi avec hétérocaryons humaine non du foie (cellules HeLa [CE1] [E2p7NS2]) et de la souris du foie (Hep56.1D [CE1] [E2p7NS2]) libération du virus des cellules a permis, indiquant que l'assemblage et la libération ne sont pas dominante inhibée par des facteurs de restriction possibles dans ces types cellulaires. L'expression de protéines structurales dans les lignées cellulaires d'emballage et de l'entrée authentique dans les cellules cibles a été montré dans Frentzen Et al. 15.
Une méthode alternative de la fusion cellulaire a été utilisé pour analyser les éventuelles restrictions affectant entrée dans la cellule, la traduction de l'ARN et les étapes de réplication d'ARN du cycle de réplication et d'exclure qu'une charge virale élevée dans les cellules transfectées Huh réplicons 7.5 empêcherait la détection des facteurs de restriction par la saturation. À cette fin, nous avons développé un test indépendant basée sur l'inoculation des hétérocaryons avec HCVcc et la détection de la production de virus de novo dans ces cellules. Comme il est indiqué dans la figure 2A, la fusion cellulaire somatique a été induite par l'expression d'une glycoprotéine fusogène après co-culture des cellules. Cette méthode a été choisie parce que la sensibilité a été augmentée probablement due à l'efficacité de fusion a augmenté. Hétérocaryons ont été visualisées par coloration des lignées cellulaires distinctes avec des colorants CellTracker avant la co-culture. Un hétérocaryon avec des colorants distribués façon homogène dans le cytoplasme indique la fusion de deux types de cellules que indiquentd dans la figure 2B. Ce n'est que dans hétérocaryons de Lunet N cellules avec des cellules HeLa ou Hep56.1D hCD81 cellules sont autant de facteurs d'entrée du VHC exprimé ainsi rendre sélectivement hétérocaryons sensibles à la pénétration des cellules par le VHC. Challenge avec HCVcc entraîné dans la réplication complète du VHC dans hétérocaryons ce qui est évident à partir de novo de production de la descendance virale infectieuse environ 10 fois supérieure à l'arrière-plan de l'essai (figure 2C). Comme un contrôle, Lunet N cellules ont été fusionnées avec des cellules N Lunet. Il est important que de très faibles niveaux de près par le VHC infectieuses à la limite de détection ont été observés. Des résultats similaires ont été obtenus lorsque Lunet N cellules ont été fusionnées avec des cellules naïves Hep56.1D. Dans les deux cas, la CD81 humaine était absent alors que le VHC ne pouvait pas infecter les hétérocaryons productive. Cette très faible infectiosité détectée dans ces deux derniers cas est probablement attribuable au faible niveau d'infection des cellules N Lunet et / ou de faibles niveaux d'entrée du virus infectieux résiduel de l'inoculum. Dans les cellules HeLa et de contraste Ilp56.1D hCD81 cellules expriment CD81 humaine, complétant ainsi le facteur de cellule dépourvue d'entrée dans les hétérocaryons et d'autoriser l'entrée cellulaire du VHC. Le niveau de 10 fois plus élevé de maladies infectieuses par le VHC détectés dans le milieu des hétérocaryons impliquant ces deux lignées de cellules reflète donc probablement la production de novo de particules infectieuses dans hétérocaryons. Ainsi, nous avons conclu que l'achèvement du cycle de réplication du VHC ne se limite pas à l'exclusion de l'expression des facteurs de restriction dominantes VHC dans ces lignées cellulaires.
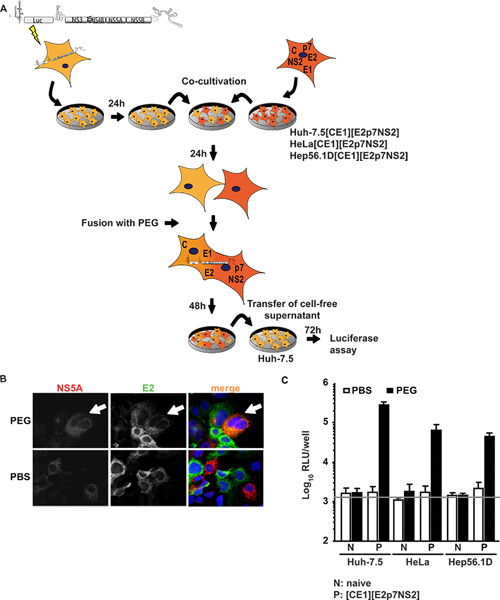
Figure 1. Trans-complémentation de l'assemblage du VHC et la libération dans les hétérocaryons. (A) les grandes lignes Schéma de la procédure expérimentale de la fusion cellulaire médiée par PEG-. Le rapporteur de la luciférase JFH1 réplicon Luc-NS3-5B a été transfecté dans naïfs Huh-7.5 cellules par électroporation. Le lendemain, les cellules ont été détachées et co-cultivées avec des cellules naïves ou d'emballage cellules exprimant de manière constitutive VHC noyau, E1, E2, p7 et NS2. 24 h après la co-culture, la formation a été hétérocaryon induite par le traitement avec PEG 40% en utilisant PBS comme contrôle négatif. Après 48 h, sans cellule surnageant a été récolté pour inoculer naïfs Huh-7.5 cellules. L'infectiosité a été déterminée par l'activité luciférase. (B) pour la détection de hétérocaryons, les cellules ont été immunocolorées en utilisant des anticorps monoclonaux contre E2 et NS5A. L'expression simultanée des deux protéines dans les cellules est indicative de la fusion cellulaire. (C) des mesures ont été effectuées luciférase pour quantifier l'infectivité virale produite à partir de hétérocaryons. Les valeurs moyennes de trois expériences indépendantes et les écarts-types des moyens sont donnés. La barre horizontale représente la RLU fond déterminée non infectés Huh-7.5 cellules. Cliquez ici pour agrandir la figure .
9/4029fig2.jpg "/>
Figure 2. Achèvement du cycle de réplication du VHC après l'inoculation des hétérocaryons. Aperçu schématique (A) de la procédure expérimentale. Huh-7 Lunet N cellules CD81 dépourvus étaient co-cultivées avec des lignées cellulaires indiqués défaut ou exprimant CD81 humain. Fait important, ces dernières cellules manquent d'au moins un facteur de l'entrée du VHC et donc ne peut pas être productive infectés. Le lendemain, la fusion a été initié par la transfection d'une protéine d'enveloppe virale fusogène de PFV. Trente heures plus tard, les cellules ont été contestés par des agents infectieux des particules VHC. Pour mesurer la pénétration des cellules, la réplication de l'ARN et la production de virus soutenue par ces hétérocaryons, l'infectiosité publié dans les liquides de culture cellulaire a été déterminée, 48 libres après l'inoculation h. À cette fin, naïfs Huh-7.5 cellules ont été utilisées comme cellules cibles dans un essai de dilution limite (DICT 50). (B) Pour la détection de hétérocaryons, les cellules ont été colorées avec Green CellTracker ou CellTracker Orange 6 h avant de co-cultivÃation et la transfection. Trente heures plus tard, les cellules ont été fixées et colorées avec du DAPI. (C) Lunet N cellules ont été fusionnées à des cellules HeLa, les cellules naïves ou Hep56.1D Hep56.1D exprimant CD81 humains. Ces cultures ont été inoculées avec HCVcc (MOI de 2,3). Les fluides de culture ont été recueillies 48 heures plus tard et la libération de particules de novo hétérocaryons a été déterminée par DICT 50 en utilisant des cellules cibles naïves Huh-7.5. Les valeurs moyennes de trois expériences indépendantes sont donnés. La barre horizontale représente la limite de détection du test. Cliquez ici pour agrandir la figure .
Discussion
Nous présentons deux méthodes pour induire la formation hétérocaryon dans des cellules cultivées pour l'analyse des dominantes restrictions négatives qui empêchent la réplication du VHC. Utilisation ces procédures on exclut la présence d'un élément dominant exprimé de manière constitutive ou induit par un virus dans différentes humaine non foie et dans des lignées cellulaires hépatiques de souris. Le premier essai analyse principalement si les facteurs de restriction de prévenir assemblage du V...
Déclarations de divulgation
TP a reçu des honoraires de consultation de Biotest.
Remerciements
Nous sommes reconnaissants à Takaji Wakita et Jens Bukh pour JFH1 et les isolats de J6CF, respectivement. En outre, nous remercions Charles Rice pour Huh-7.5 des cellules et l'anticorps 9E10, Steven Foung pour l'anticorps spécifique à E2 CBH-23, et tous les membres du ministère de la virologie expérimentale, Twincore des suggestions utiles et des discussions.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| DMEM | Invitrogen, Karlsruhe, Allemagne | 41965-039 | |
| L-glutamine | Invitrogen, Karlsruhe, Allemagne | 25030-024 | |
| Non-acides aminés essentiels | Invitrogen, Karlsruhe, Allemagne | 11140-035 | |
| Pénicilline / streptomycine | Invitrogen, Karlsruhe, Allemagne | 15140-122 | |
| Sérum de veau foetal | AAP, Cölbe, Allemagne | A15151 | |
| α-E2 (CBH23) | aimablement fournies par Steven Foung 10 | ||
| ATP | Sigma, Steinheim, Allemagne | A2833-106 | |
| Le glutathion | Sigma, Steinheim, Allemagne | G4251-1G | |
| Blasticidine | Invivo Gen, San Diego, Etats-Unis | Ant-bl-1 | |
| G418 (généticine) | Invitrogen, Karlsruhe, Allemagne | 11811-064 | |
| Polyéthylène-glycol-1500 | Roche, Mannheim, Allemagne | 10783641001 | |
| Paraformaldéhyde | Roth, Karlsruhe, Allemagne | 0335,3 | |
| Triton X-100 | Roth, Karlsruhe, Allemagne | 3051,2 | |
| Du sérum de chèvre | Sigma, Steinheim, Allemagne | G9023-5mL | |
| α-NS5A (9E10) | Aimablement communiqué par Charles Rice 7 | ||
| DAPI (4 ', 6'-diamidino-2-phénylindole dichlorhydrate) | Invitrogen | D1306 | |
| Alexa Fluor-546 - chèvre anti-IgG humaine | Invitrogen, Karlsruhe, Allemagne | A21089 | |
| Alexa Fluor-488 - chèvre anti-IgG de souris | Invitrogen, Karlsruhe, Allemagne | A10680 | |
| Lipofectamine 2000 | Invitrogen, Karlsruhe, Allemagne | 11668-019 | |
| CellTracker CMTMR | Invitrogen, Karlsruhe, Allemagne | C2927 | |
| CellTracker CMFDA | Invitrogen, Karlsruhe, Allemagne | C2925 | |
| Fluoromount | Sigma, Steinheim, Allemagne | F4680-25ML | |
| Tous les autres produits chimiques | Roth, Karlsruhe, Allemagne | ||
| Matériaux de culture cellulaire | Sarstedt, Nümbrecht, Allemagne |
Références
- Zhu, Q., Guo, J. T., Seeger, C. Replication of hepatitis C virus subgenomes in nonhepatic epithelial and mouse hepatoma cells. J. Virol. 77, 9204-9210 (2003).
- Kato, T. Nonhepatic cell lines HeLa and 293 support efficient replication of the hepatitis C virus genotype 2a subgenomic replicon. J. Virol. 79, 592-596 (2005).
- Ali, S., Pellerin, C., Lamarre, D., Kukolj, G. Hepatitis C virus subgenomic replicons in the human embryonic kidney 293 cell line. J. Virol. 78, 491-501 (2004).
- Date, T. Genotype 2a hepatitis C virus subgenomic replicon can replicate in HepG2 and IMY-N9 cells. J. Biol. Chem. 279, 22371-22376 (2004).
- Chang, K. S. Replication of hepatitis C virus (HCV) RNA in mouse embryonic fibroblasts: protein kinase R (PKR)-dependent and PKR-independent mechanisms for controlling HCV RNA replication and mediating interferon activities. J. Virol. 80, 7364-7374 (2006).
- Zhong, J. Robust hepatitis C virus infection in vitro. Proc. Natl. Acad. Sci. U.S.A. 102, 9294-9299 (2005).
- Lindenbach, B. D. Complete replication of hepatitis C virus in cell culture. Science. 309, 623-626 (2005).
- Wakita, T. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat. Med. 11, 791-796 (2005).
- Witteveldt, J. CD81 is dispensable for hepatitis C virus cell-to-cell transmission in hepatoma cells. J. Gen. Virol. 90, 48-58 (2009).
- Bitzegeio, J. Adaptation of hepatitis C virus to mouse CD81 permits infection of mouse cells in the absence of human entry factors. PLoS Pathog. 6, e1000978 (2010).
- Lindemann, D., Goepfert, P. A. The foamy virus envelope glycoproteins. Curr Top Microbiol Immunol. 277, 111-129 (2003).
- Brohm, C. Characterization of determinants important for hepatitis C virus p7 function in morphogenesis by using trans-complementation. J. Virol. 83, 11682-11693 (2009).
- Steinmann, E., Brohm, C., Kallis, S., Bartenschlager, R., Pietschmann, T. Efficient trans-encapsidation of hepatitis C virus RNAs into infectious virus-like particles. J. Virol. 82, 7034-7046 (2008).
- Koutsoudakis, G. Characterization of the early steps of hepatitis C virus infection by using luciferase reporter viruses. J. Virol. 80, 5308-5320 (2006).
- Frentzen, A. Completion of hepatitis C virus replication cycle in heterokaryons excludes dominant restrictions in human non-liver and mouse liver cell lines. PLoS Pathog. 7, e1002029 (2011).
- Lindemann, D. A particle-associated glycoprotein signal peptide essential for virus maturation and infectivity. J. Virol. 75, 5762-5771 (2001).
- Blight, K. J., McKeating, J. A., Rice, C. M. Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication. J. Virol. 76, 13001-13014 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon