JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Heterokaryon 형성의 두 가지 방법 HCV 제한 요소를 발견하기
요약
우리는 조건부를위한 두 가지 방법을 설명 트랜스-complementation. 이 기술은 감염 HCV 자손의 생산을 배제 지배적인 제한 요소를 표현하는 세포 라인을위한 화면으로 적합합니다.
초록
C 형 간염 바이러스 (HCV)는 인간과 침팬지에 제한된 호스트 범위 hepatotropic 바이러스입니다. HCV RNA의 복제 인간이 아닌 간장과 murine 세포 라인에서 관찰되었지만, 효율이 매우 낮은이었고, HCV replicon을 사용하여 필요한 장기적인 선정 절차가 지배적인 항생제가 선택할 수있는 마커 1-5 구성하고 표현. 시험 관내 연구에서 HCV 따라서 바이러스 생활주기의 바이러스 항목과 완성을위한 허용 인간 간암 세포 라인으로 제한됩니다. 좁은 종의 tropism을 HCVs으로 인해 전체 HCV 복제주기에게 6-8 격려하고 사용할 수있는 면역 적격 작은 동물 모델이 없습니다. 마우스 원산지 예 비 인간의 세포에서 HCV의 비효율적인 복제 가능성 필수 호스트 종속 요소 및 / 또는 제한 요인의 표현의 유전자 호환성 부족으로 인한 것입니다.
우리는 HCV 전파가 지배적인 제한 FA에 의해 억압 받고 있는지 여부를 조사비 간장 조직이나 마우스 간 세포 라인에서 파생된 인간의 세포 라인 중의 ctors. 이를 위해, 우리는 체세포 융합에 의존하는 두 개의 독립적인 조건부 횡단 complementation 방법을 개발했습니다. 두 경우 모두, 바이러스 복제 사이클의 완성은 heterokaryons에서만 가능합니다. 따라서 전염성 바이러스 자손의 드 노보 생산을 측정하여 결정됩니다 성공 횡단 complementation은, 지배적인 규제의 부재를 나타냅니다.
특히, 루시페라제 transgene를 들고 subgenomic HCV replicons가 적극 허용 인간 간암 세포 (어 - 7.5 세포)로 transfected되었다. 그 후,이 세포들은 공동 배양해와 HCV 구조 단백질 코어, 봉투 1과 2 (E1, E2) 및 액세서리 단백질 P7과 NS2를 표현하는 다양한 인간과 murine 세포에 융합되었다. 세포 융합은 폴리에틸렌 글리콜 - (PEG)와 치료에 의해 시작되었다고 제공, 문화가 전염성 바이러스 PA를 출시수용체에 의존 방식으로 순진 세포를 감염 rticles.
셀 입력, RNA 번역, 복제 및 바이러스 조립을 포함한 완전한 바이러스 생활주기에 지배적인 제한의 영향을 평가하기 위해, CD81의 내생적인 표현이 부족 인간 간 세포주 (허-7 Lunet N 전지 9)을 이용했다 HCV의 필수 항목 계수. ectopically 표현 CD81의 부재에서 이러한 세포는 HCV 감염 10 ~ 근본적 내화물입니다. 중요한 것은 공동 배양해과 인간 CD81하지만 부족 적어도 또 다른 중요한 세포 엔트리 계수 (예 : SR-BI, CLDN1, OCLN)를 표현하는 세포와 융합 경우에만 결과 heterokaryons 감염에 대한 필요한 HCV 항목 요소의 전체 집합을 표시합니다. 따라서 지배적인 제한 요인 HCV 복제주기의 완성을 억제하는 경우에는 분석, 우리는 위에서 언급한 crit를 충족 인간 및 마우스 유래의 다양한 세포로 Lunet N 개의 세포를 융합eria. 공동 교양 세포 프로토 타입 거품 바이러스의 돌연변이 높은 fusogenic 바이러스성 봉투 단백질 (PFV 11)로 transfected하고 이후 감염 HCV 입자 (HCVcc)와 도전을 때, 전염성 바이러스의 드 노보 제작이 관찰되었다. 이것은 HCV가 성공적 따라서 이들 세포 라인에있는 지배적인 제한 요인의 표현을 배제 heterokaryons 년에 복제주기를 완료했음을 나타냅니다. 이 소설 조건부 횡단 complementation 방법 HCV 특정 지배적인 제한 요인의 표현을위한 셀 라인 및 기본 세포의 대형 패널을 구분할 도움이 될 것입니다.
프로토콜
PEG에 의한 세포 융합
1. 세포 배양
- 문화 허-7.5, HELA과 DMEM 전체 (DMEM cplt) 매체에서 15cm 세포 배양 접시에 순진하거나 포장 셀 라인에게 12 Hep56.1D, DMEM 2 MM L-글루타민, 1X 비 필수 아미노산, 100와 함께 보충 U / ML 페니실린, 100 μg / ML의 스트렙토 마이신,와 10 % 태아 송아지 혈청. 같은 표 1에 표시된 안정적인 세포 라인에 맞는 선택을 적용합니다.
2. HCV RNA의 Transfection
- 인산과 두 어 - 7.5 세포 (한 지류 15cm 접시) 워시는 식염수 (PBS), trypsinize를 버퍼, 그리고 Cytomix에서 1.5x10 7 셀 / ML의 농도 (120 MM KCl, 0.15 MM CaCl 2, 10 MM K에서 resuspend 2 HPO 4 [산도 7.6], 2 개의 MM ATP와 5 밀리미터 글루타티온를 포함하는 25 밀리미터 HEPES, 2 개의 MM EGTA, 코이와 산도 7.6로 조정하고 여과하여 멸균 5 밀리미터 MgCl 2).
- Transfect 통해 electroporat0.4 cm의 간격 너비와 975로 설정되어 진 pulser Xcell 시스템 (Biorad)로 cuvettes를 사용하여 10 μg HCV RNA (pFKi389Luc-EI/NS3-3 '_JFH1_dg 13)와 세포 현탁액 (6x10 6 셀)의 이온 400 μL μF 270 V는 이전 14 설명했다.
- 즉시 DMEM cplt 매체와 10cm 직경의 단일 문화 접시에 씨앗이 전체 현탁액을 10 ML로 transfected 어 - 7.5 세포를 전송합니다. 37에서 24 H를위한 문화 세포 ° C에서 5 % CO 2.
3. PEG에 의한 퓨전의 유도
- 하베스트 세포는, 2.1에 설명된 DMEM cplt 매체에 resuspend 및 5x10 5 셀 / ML로 희석.
- 각각 단일 셀 허-7.5의 현탁액, HELA 및 Hep56.1D 포장 세포, 그리고 희석 5x10 5 셀 / ML, 2x10 5 셀 / ML 및 2x10 5 세포 / ML를 생성합니다. 참고 두와 형질 도입 후 ectopically 포장 세포 특급 HCV 단백질 코어, E1, E2, P7과 NS2각각의 C-E1과 E2-P7-NS2 발현 카세트, 13, 15 transducing 종속 lentiviral 벡터.
- 융합 효율의 추가 분석을 위해 잘 당 2-3 멸균 유리 커버 전표와 함께 6 - 잘 배양 접시를 준비합니다.
- 6 - 잘 접시의 잘 하나에 패키징 세포, 종자 1 ML과 subgenomic replicon을 품고 transfected 어 - 7.5 세포의 1 ML을 결합하고, 37 ° C 5 % CO 2에서 24 H 위해 품어.
- 이 시점에서, 세포 밀도는 세포 융합 세포 점막에 대한 근접 거리에있을 수 있도록하기 위해서는 세포 융합을 유도하기 전에 confluency % 60-80 사이에 이르기까지 다양합니다.
- 공동 교양 세포에서 매체를 대기음 1 ML PBS로 한번 씻어 다음, 조심스럽게 heterokaryon 형성을 유도하기 위해 37 ° C에서 5 분 동안 제어 및 부화 등 사전 워밍업 40% PEG-1500 또는 PBS 500 μL를 추가합니다.
- PEG를 대기음 조심스럽게 초과 PEG를 제거하고 마지막 2 추가하려면이 ML PBS로 세척 당 일분 (분)을 3-5 번 씻어DMEM cplt 각도 중간이나 37에서 품어의 ML ° C에서 5 % CO 2.
- 마흔 여덟 시간 게시물 융합 각각 0.45 μm의를 통해 뜨는 및 필터 필터를 수집합니다.
- 500 셀 - 무료 문화 유체의 μL와 루시페라제의 후속 결정과 순진 허-7.5 세포 (8x10과 /도 전에 접종으로 12도 판, 24 H에 놓는 4 세포)의 접종에 의해 융합된 heterokaryons의 전염성 입자의 측정 제작 활동 14.
4. 퓨전의 효율성을 결정하는 Immunofluorescence
- 세포 배양 supernatants (섹션 3.8)를 수집 후, 우물은 유리 커버를 포함하면 1 분 대한 PBS의 1 ML로 한번 실수할 씻는다. 모두 다음 단계는 실온 (RT)에서 수행되어야하며 세척은 세척 당 1 분에 대해 1 ML PBS 다해야합니다.
- 15 분 대한 PBS의 3 % paraformaldehyde 600 μL (PFA)로 세포를 고정 후 PBS로 3 배 씻는다. 조심스럽게 표지 전표를 전송집게를 사용하여 24도 판에.
- 0.5 % Triton은 5 분 대한 PBS의 X-100 500 μL로 세포를 Permeabilize하고 이후 PBS로 3 배 씻는다.
- 5 % 염소 혈청으로 보충 PBS의 일차 항체 용액을 준비한다. 6.4 NG / ML의 농도에서 0.5 μg / ML과 인간 단클론 항 E2 항체 (CBH-23)의 농도에 안티 NS5A 항체 (9E10)를 사용합니다. 각도 250 μL를 적용하고 45 분 동안 RT에서 품어.
- PBS로 3 배 씻어과 2 μg / PBS에서 ML의 농도에서, 알렉사-형석 546이나 알렉사-형석 488에 복합 250 μL 보조 염소 항 마우스 또는 염소 안티 - 인간 IgG에 특정한 항체로 묶인 일차 항체를 감지 같이 보충 5 % 염소 혈청. 어둠 RT에서 30 분 동안 품어.
- 그런 다음, PBS와 함께 1X 씻고 이후 PBS로 1:3,000 희석 (6'-diamidino-2-phenylindole dihydrochloride 4 ') 250 μL DAPI, 어둠 RT에서 1 분 동안 품어로 세포 핵 얼룩.
- H 2 PBS와 1X와 4X 씻으 O는 다음 현미경 슬라이드에 Fluoromount 한 방울에 거꾸로 커버 전표를 탑재, 간접 형광 현미경에 의해 어둡고 평가 샘플에 말리도록.
프로토 타입 거품 바이러스의 과도 transfection (PFV) 당단백질 의해 퓨전
5. 바이러스성 Inoculum의 작성
- 어 - 7.5 세포로 체외 베꼈는데 HCV RNA에 transfecting하고 이전 14 설명된대로 48 H 72 H 후 세포 배양 뜨는 수확하여 높은 titer의 바이러스 주식을 생산하고 있습니다. 희석 분석 (TCID 50) 13 제한함으로써 바이러스 titer를 결정합니다.
6. Fusogenic PFV의 당단백질의 Transfection에 의한 세포 배양, 세포 융합
- 적절한 선택을 포함하는 DMEM cplt 매체에 표 1의 지시에 따라 문화 Lunet N, HELA 및 Hep56.1D hCD81 세포.
- 2.1에서 설명한대로 세포를 분리, DMEM cplt 손에 단세포 현탁액을 준비edium 및 공동 육성 Lunet N 당 1.5x10 5 세포의 전체 세포 밀도를하였으며 적절한 비율 (Hep56.1D hCD81 또는 HELA 전지 1시 1분 예 : 1시 2분)에서 HELA 또는 Hep56.1D hCD81 셀 라인 세포 12도 37에서 24 H 동안 품어 ° C에서 5 % CO 2.
- 다음날, transiently 제조 업체의 지침에 따라 Lipofectamine 2000을 사용하여 높은 fusogenic PFV 봉투 단백질 (pczHFVenvEM066 16)과 함께 세포를 transfect.
7. 감염 분석
- 하룻밤 12 H에 대한 바이러스 주식 350 μL (전부다 ~ 2.3의)과 transfection 후 heterokaryons 30 H의 예방, PBS로 한번 씻어 잘 당 DMEM cplt 매체의 1 ML을 추가합니다. 37시 48 H에 대해 품어 ° C에서 5 % CO 2.
- 제한 희석 분석에서, 전날 (1x10 4 셀 / 음) 96 - 웰 플레이트에 놓는 0.45 μm의 필터와 접종 어 - 7.5 세포를 통해 필터 heterokaryon 문화의 수확 뜨는, 13.
- 전염성 자손 입자의 생산을 계량하기 위해, 72 H 후, HCV 특정 항체 (9E10 NS5A)에 감염된 어 - 7.5 세포를 얼룩.
8. 세포 융합의 시각화
- 퓨전 이벤트를 시각화하기 위해 첨가제없이 DMEM 매체에 CellTracker 염료 중 5-10 μm의 솔루션을 준비하고 (섹션 6.2 및 6.3에서 설명) 공동 문화 전에 6 H 다음 단계를 완료합니다.
- PBS의 5 ML로 한번 자기편 세포를 씻어 다음 37 45 분 동안 10cm 접시 당 솔루션을 더럽히는 것 4 ML과 세포를 품어 ° C에서 5 % CO 2 (Lunet N CellTracker 오렌지 CMTMR 및 HELA 또는 Hep56.1D있는 세포를 얼룩 CellTracker 그린 CMFDA 별도)와 hCD81 세포.
- 1 분 대한 PBS의 5 ML로 한 세포를 씻어 37에서 6 H에 대한 ° C에서 5 % CO 2를 품어 DMEM cplt 매체를 추가하십시오.
- 섹션 6.2에서는 위에서 설명한하고 그러나에 커버 슬립을 추가로 스테인드 세포의 시딩과 transfection을 준비시딩 전에 세포 배양 접시.
- 30 H 포스트 transfection은 1 분 동안 PBS 1 ML로 신중하게 셀을 씻는 후 RT에서 15 분 동안 3퍼센트 PFA 250 μL로 세포를 고정시킨다. 섹션 4.6에서 설명한대로 1 분에 대해 1 ML PBS로 한 번 세포를 씻어, 1 분 동안 DAPI로 얼룩, (섹션 4.7 참조 유리 슬라이드에 H 2 O 및 마운트 커버 전표로 씻어 반복, 1 분 1 ML PBS로 한 번 씻어 ). 형광 현미경으로 세포를 분석합니다.
| 종 | 세포주 | 유래 | 성장 매체 및 선택 |
| 사람의 | 허-7.5 | 허-7 간암 세포주 17 Subclone | DMEM cplt |
| 허-7.5 [CE1] [E2p7NS2] | 안정적으로 바이러스성 단백질 코어를 표현, E1, E2, P7, 그리고 NS2는 lentiviral 유전자 t으로 transduced두 개의 독립적인 유전자 카세트의 ransfer | DMEM cplt + Blasticidin 5 μg / ML | |
| 허-7 Lunet N | 허-7 간암 세포주 9 Subclone | DMEM cplt | |
| HELA | 경부 선암 세포주 (ATCC 번호 : CCL-2) | DMEM cplt | |
| HELA [CE1] [E2p7NS2] | 안정적으로 바이러스성 단백질 코어를 표현, E1, E2, P7과 NS2가 두 개의 독립적인 유전자 카세트의 lentiviral 유전자 송금으로 transduced | DMEM cplt + G418 750 μg / ML, Blasticidin 5 μg / ML | |
| 마우스 | Hep56.1D | 기본 간세포암 (J. Encke 일종의 선물) 성인 C57BL/6J 마우스 | DMEM cplt |
| Hep56.1D [CE1] [E2p7NS2] | 안정적으로 전E1, E2, P7과 NS2가 두 개의 독립적인 유전자 카세트의 lentiviral 유전자 전달함으로써 바이러스성 단백질 코어를 transduced 누르면 | DMEM cplt + G418 750 μg / ML, Blasticidin 5 μg / ML | |
| Hep56.1D hCD81 | 안정적으로 표현하는 인간 CD81는 lentiviral 유전자 송금으로 transduced | DMEM cplt + Blasticidin 5 μg / ML |
완료 G418 : geneticin, H : 인간. 사용되는 세포 라인 Cplt의 기원과 문화 조건에 대한 표 1 사양.
9. 대표 결과
본 연구에서 우리는 우리가 특별히 heterokaryons에서 HCV 복제주기의 완성에 대한 제한 요인의 영향을 조사할 수 있도록 체세포 융합의 두 가지 방법을 적용했습니다. 쪽지 중에서 두 가지 세포 유형의 융합시 횡단 complementation의 조건부 디자인은 그것을 보장인간 간세포와 비 허용 세포 라인, 바이러스 조립 (접근 방법 1) 또는 바이러스 항목과 전체 HCV 복제주기 간의 진정한 heterokaryons에 (접근법 2) 달성된다.
첫 번째 접근 방식에서는 HCV에 대한 높은 허용 허-7.5 세포는, transiently subgenomic HCV RNA 복제를 (어 - 7.5 replicon 전지) 지원 루시페라제 transgene와 HCV 비 구조 단백질을 표현 subgenomic replicon으로 transfected되었다. 이러한 세포는 공동 교양과, E1, E2뿐만 아니라 액세서리 단백질의 P7과 NS2를 HCV 구조 단백질 코어를 표현하는 세포 라인에 융합했다. Figure1A이 실험 절차의 개요를 보여줍니다. 중요한 것은, PEG 융합에 따라, 입자 조립에 필요한 모든 단백질은 개별 바이러스성 단백질에 대한 immunofluorescence으로 확인하실 수 있습니다 형성 heterokaryon에 존재해야합니다. 그림 1B 모두 NS5A에 대한 신호가 어 - 7.5 replicon 전지와 E2로 표현하는 모범적인 퓨전 행사 모습허-7.5로 표현 [CE1] [E2p7NS2] 포장 세포 PEG 유발 heterokaryon 형성시 같은 세포질에서 발견되었다. 공동 교양 세포 대신 PBS로 치료가되었을 때, 아무 융합은 단일 양수 세포 따라서 유도된 않았다과 신호에 대한 공동 지방화는 관찰되지 않았습니다. 또한, transgene 표현을 통제하기 위해, 우리는 코어 및 E2 (이전 15 상세히 보도)에 대한 구체적인 ELISAs을 수행. 제어 패키징 세포주 이외에 허 7.5 [CE1] [E2p7NS2] 우리 HELA과 인간 이외의 간 및 마우스 간 세포에 대표를 각각 같은 Hep56.1D 포장 세포를 생성. 이러한 후자의 세포에서 HCV RNA의 복제 효율이 낮은 HCV 조립이며 릴리스가 표시되지 않았습니다. 그림 1C는 융합 분석의 결과를 보여줍니다. Supernatants은 48 H 포스트 융합 유도에 공동의 문화로부터 수집하여 후속 루시페라제 assays에 대한 순진 허-7.5 세포를 예방하기 위해 사용되었다. 특히, 언제 어 - 7.5 replicon 전지 것은 하나와 융합되어컨트롤로 PBS로 치료 순진 셀 라인은 어떤 감염은 문화 체액에서 발견되지 않았습니다. 그러나 허-7.5 replicon 및 포장 전지 라인 사이의 세포 융합은 PEG에 의해 유도된 때, replicon 및 constitutively 표현 구조 단백질 사이의 횡단 complementation이 결과 heterokaryons에 바이러스 생산 구조 및 전염성 바이러스 입자는 문화 체액으로 릴리스되었습니다. 따라서 우리는 그 바이러스 생산 포장 셀 라인의 바이러스 단백질의 세포 융합과 표현이 필요 결론을 내렸다. Strikingly, 흥-7.5 인간 간암 세포의 heterokaryons뿐 아니라 인간 이외의 간 (HELA [CE1] [E2p7NS2])와 마우스 간 (Hep56.1D [CE1] [E2p7NS2]) 세포가 허용되는 바이러스 발표와 함께 heterokaryons뿐만 아니라, 조립 및 릴리스는 dominantly 이러한 세포 유형에서 가능한 제한 요소에 의해 저해되지 않는 것을 나타냅니다. 포장 셀 라인과 타겟 세포에 본격적인 항목의 구조 단백질의 표현은 Frentzen에 표시되었다 외. 15.
세포 융합의 다른 방법은 셀 항목, RNA의 번역 및 복제주기의 RNA 복제 단계에 영향을 가능한 제한 사항을 분석하고 transfected 허 7.5 replicon 세포에서 높은 바이러스성 부담이 포화 상태에 의해 제한 요인의 탐지를 배제 것을 제외 활용되었다. 이를 위해, 우리는 HCVcc 이러한 세포의 드 노보 바이러스 생산의 검출과 heterokaryons의 접종을 바탕으로 독립적인 분석을 개발. 그림 2A에서 설명한 바와 같이, 체세포 융합은 세포의 공동 배양 후 fusogenic 당단백질의 표현에 의해 유도되었다. 감도로 인해 증가 융합 효율을 가능성이 증가했기 때문에이 방법은 선정되었습니다. Heterokaryons은 공동 경작 이전 CellTracker 염료와 함께 별도의 세포 라인을 더럽히는 것함으로써 시각 있었다. 세포질 내에서 homogenously 분산 염료와 heterokaryon 두 세포 유형의 융합과 같은 의미 나타냅니다그림 2B의 디. 단 Lunet N HELA 세포 또는 Hep56.1D hCD81 세포와 세포의 heterokaryons 모든 HCV 항목 요인 따라서 선택적으로 HCV 셀 항목에 감염될 heterokaryons 렌더링 표현됩니다. HCVcc과 도전 약 10 배 검정 (그림 2C)의 배경 위에 전염성 바이러스 자손의 드 노보 생산에서 분명 heterokaryons에서 HCV의 완전한 복제 결과. 컨트롤로서 Lunet N 전지 Lunet N 세포와 융합되었다. 중요한 검출 한계에 가까운 HCV 감염의 단지 매우 낮은 수준이 관찰되었다. Lunet N 개의 세포가 순진 Hep56.1D 세포와 융합했을 때 비슷한 결과를 획득했다. HCV는 생산 heterokaryons를 감염시킬 수 없습니다 있도록 두 경우 모두, 인간 CD81는 결석했습니다. 두 번째 경우에 검출이 매우 낮은 감염은 Lunet N 세포 및 / 또는 inoculum에서 잔류 전염성 바이러스 입력 낮은 수준의 감염의 낮은 단계로 가능성 기인 것입니다. 대비 HELA 세포와 그 관련p56.1D hCD81 세포 따라서 heterokaryons의 부족한 세포 엔트리 계수를 보완하고 HCV 셀 항목을 허용, CD81 인간의 표현. 이 두 세포 라인 관련된 heterokaryons의 매체에 감지된 악성 HCV의 10 배 이상 증가 수준은 따라서 가능성이 heterokaryons의 전염성 입자의 드 노보 생산을 반영합니다. 따라서, 우리는 HCV 복제주기의 완성은 이들 세포 라인의 지배 HCV 제한 요인의 표현을 제외한 제한되지 않습니다 결론 지었다.
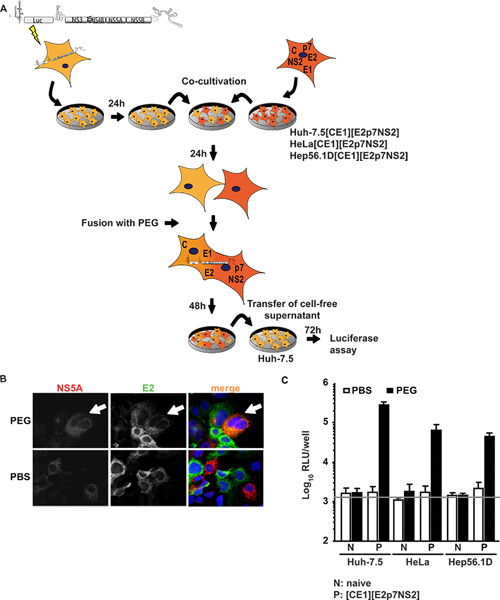
그림 1. 횡단 complementation HCV 어셈블리 및 heterokaryons에서 릴리스. PEG-매개 세포 융합의 실험 절차의 () 도식 개요. JFH1 루시페라제 기자 replicon 룩 - NS3-5B는 electroporation에 의해 순진 허-7.5 세포로 transfected되었다. 그 다음날은 순진 세포 또는 포장으로 세포 분리되었으며 공동 배양해 constitutively HCV 코어, E1, E2, P7과 NS2를 표현 세포. 24 H 포스트 공동 경작, heterokaryon 형성은 대조군으로 PBS를 사용하여 40 % PEG와 치료에 의해 유발되었다. 48 이후 H는 휴대폰이없는 뜨는는 순진 허-7.5 세포를 예방하기 위해 수확했다. 감염은 루시페라제 활동에 의해 결정되었다. (B) heterokaryons의 검출 들어, 세포는 E2와 NS5A에 대한 단클론 항체를 사용하여 immunostained되었다. 세포 내에서 두 단백질의 동시 표현이 세포 융합을 나타내는 것입니다. (C) 루시페라제 성능은 heterokaryons에서 생산되는 바이러스 감염을 계량하기 위해 수행되었다. 세 독립적인 실험과 수단의 표준 편차의 평균 값이 주어집니다. 가로 막대는 감염되지 않은 허-7.5 세포에서 결정된 배경 RLU를 나타냅니다. 큰 그림을 보려면 여기를 누르십시오 .
9/4029fig2.jpg "/>
그림 2. heterokaryons의 접종 후 HCV의 복제 사이클의 완성. 실험 절차의 () 도식 개요. CD81이 부족 하긴 허-7 Lunet N 전지는 지정된 셀 라인이 부족하거나 인간의 CD81을 표현들과 공동 배양해 있었다. 중요한 것은, 이러한 후자의 세포는 적어도 하나의 HCV 항목 요소를 결여하고 있으므로 생산 감염될 수 없습니다. 그 다음날, 융합은 PFV의 fusogenic 바이러스성 봉투 단백질의 transfection에 의해 시작되었다. 서른 시간 후에 세포 전염성 HCV 입자를 맡고 있었다. 이러한 heterokaryons 의해 유지 셀 항목, RNA 복제 및 바이러스 생산을 측정하기 위해 세포없는 문화 체액에 출시된 감염은 48 H 포스트 접종 결정되었다. 이를 위해 순진 허-7.5 세포 제한 희석 분석 (TCID 50)의 표적 세포로 사용되었다. (B) heterokaryons의 검출 들어, 세포는 사전 공동 cultiv에 CellTracker 녹색 또는 CellTracker 오렌지 6 H 물들일되었습니다ation과 transfection. 서른 시간 후에 세포가 수정 및 DAPI 물들일되었다. (C) Lunet N 전지는 HELA 세포, 인간 CD81을 표현 순진 Hep56.1D 또는 Hep56.1D 세포에 융합되었다. 이러한 문화는 HCVcc (방어 2.3의)를 주사했다. 문화 체액은 48 H 나중에 수집되었고 heterokaryons에서 드 노보 입자 릴리스는 순진 허-7.5 대상 세포를 사용 TCID 50에 의해 결정되었다. 세 독립적인 실험의 평균 값이 주어집니다. 가로 막대는 분석의 검출 한계를 나타냅니다. 큰 그림을 보려면 여기를 누르십시오 .
토론
우리는 HCV 복제를 배제 지배적인 부정적인 제한 사항 분석을 위해 교양 세포 heterokaryon 형성을 유발하는 두 가지 방법을 제시. 이 절차를 사용하여 우리는 다양한 인간 이외의 간장 및 murine 간 세포 라인의 지배 constitutively 표현이나 바이러스 유발 요인의 존재를 제외. 제한 요인 전염성 자손의 HCV 조립 및 릴리스를 방지하는 경우 첫 번째 분석은 주로 분석합니다. 이 경우에는 포장 세포가 HCV replico...
공개
TP는 Biotest에서 컨설팅 수수료를 받았다.
감사의 말
우리는 Takaji Wakita 각각 JFH1 및 J6CF의 분리를위한 젠스 Bukh에 감사를드립니다. 아울러 우리는 찰스 허-7.5 세포에 대한 쌀과 9E10 항체, E2 특정 항체 CBH-23에 대한 스티븐 였어, 그리고 실험 바이러스학, 유용한 제안 및 토론을위한 Twincore학과의 모든 구성원 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| DMEM | Invitrogen, 카를 스루에, 독일 | 41965-039 | |
| L-글루타민 | Invitrogen, 카를 스루에, 독일 | 25030-024 | |
| 비 필수 아미노산 | Invitrogen, 카를 스루에, 독일 | 11140-035 | |
| 페니실린 / 스트렙토 마이신 | Invitrogen, 카를 스루에, 독일 | 15140-122 | |
| 태아 송아지 혈청 | PAA, Cölbe, 독일 | A15151 | |
| α-E2 (CBH23) | 친절 스티븐 였어 10 제공 | ||
| ATP | 시그마, Steinheim, 독일 | A2833-106 | |
| 글루타티온 | 시그마, Steinheim, 독일 | G4251-1G | |
| Blasticidin | Invivo 세대, 샌디에고, 미국 | 개미-BL-1 | |
| G418 (geneticin) | Invitrogen, 카를 스루에, 독일 | 11811-064 | |
| 폴리에틸렌 - 글리콜-1500 | 로슈, 만하임, 독일 | 10783641001 | |
| Paraformaldehyde | 로스, 카를 스루에, 독일 | 0335.3 | |
| 트리톤 X-100 | 로스, 카를 스루에, 독일 | 3051.2 | |
| 염소 혈청 | 시그마, Steinheim, 독일 | G9023-5mL | |
| α-NS5A (9E10) | 친절 찰스 쌀 7에 의해 제공 | ||
| DAPI (4 ', 6'-diamidino-2-phenylindole dihydrochloride) | Invitrogen | D1306 | |
| 알렉사 - 형석 546 - 염소 안티 - 인간 IgG | Invitrogen, 카를 스루에, 독일 | A21089 | |
| 알렉사 - 형석 488 - 염소 안티 - 마우스 IgG | Invitrogen, 카를 스루에, 독일 | A10680 | |
| Lipofectamine 2000 | Invitrogen, 카를 스루에, 독일 | 11668-019 | |
| CellTracker CMTMR | Invitrogen, 카를 스루에, 독일 | C2927 | |
| CellTracker CMFDA | Invitrogen, 카를 스루에, 독일 | C2925 | |
| Fluoromount | 시그마, Steinheim, 독일 | F4680-25ML | |
| 기타 모든 화학 물질 | 로스, 카를 스루에, 독일 | ||
| 세포 배양 자료 | Sarstedt, Nümbrecht, 독일 |
참고문헌
- Zhu, Q., Guo, J. T., Seeger, C. Replication of hepatitis C virus subgenomes in nonhepatic epithelial and mouse hepatoma cells. J. Virol. 77, 9204-9210 (2003).
- Kato, T. Nonhepatic cell lines HeLa and 293 support efficient replication of the hepatitis C virus genotype 2a subgenomic replicon. J. Virol. 79, 592-596 (2005).
- Ali, S., Pellerin, C., Lamarre, D., Kukolj, G. Hepatitis C virus subgenomic replicons in the human embryonic kidney 293 cell line. J. Virol. 78, 491-501 (2004).
- Date, T. Genotype 2a hepatitis C virus subgenomic replicon can replicate in HepG2 and IMY-N9 cells. J. Biol. Chem. 279, 22371-22376 (2004).
- Chang, K. S. Replication of hepatitis C virus (HCV) RNA in mouse embryonic fibroblasts: protein kinase R (PKR)-dependent and PKR-independent mechanisms for controlling HCV RNA replication and mediating interferon activities. J. Virol. 80, 7364-7374 (2006).
- Zhong, J. Robust hepatitis C virus infection in vitro. Proc. Natl. Acad. Sci. U.S.A. 102, 9294-9299 (2005).
- Lindenbach, B. D. Complete replication of hepatitis C virus in cell culture. Science. 309, 623-626 (2005).
- Wakita, T. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat. Med. 11, 791-796 (2005).
- Witteveldt, J. CD81 is dispensable for hepatitis C virus cell-to-cell transmission in hepatoma cells. J. Gen. Virol. 90, 48-58 (2009).
- Bitzegeio, J. Adaptation of hepatitis C virus to mouse CD81 permits infection of mouse cells in the absence of human entry factors. PLoS Pathog. 6, e1000978 (2010).
- Lindemann, D., Goepfert, P. A. The foamy virus envelope glycoproteins. Curr Top Microbiol Immunol. 277, 111-129 (2003).
- Brohm, C. Characterization of determinants important for hepatitis C virus p7 function in morphogenesis by using trans-complementation. J. Virol. 83, 11682-11693 (2009).
- Steinmann, E., Brohm, C., Kallis, S., Bartenschlager, R., Pietschmann, T. Efficient trans-encapsidation of hepatitis C virus RNAs into infectious virus-like particles. J. Virol. 82, 7034-7046 (2008).
- Koutsoudakis, G. Characterization of the early steps of hepatitis C virus infection by using luciferase reporter viruses. J. Virol. 80, 5308-5320 (2006).
- Frentzen, A. Completion of hepatitis C virus replication cycle in heterokaryons excludes dominant restrictions in human non-liver and mouse liver cell lines. PLoS Pathog. 7, e1002029 (2011).
- Lindemann, D. A particle-associated glycoprotein signal peptide essential for virus maturation and infectivity. J. Virol. 75, 5762-5771 (2001).
- Blight, K. J., McKeating, J. A., Rice, C. M. Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication. J. Virol. 76, 13001-13014 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유