É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Dois métodos de formação de heterocários Descobrir Fatores de restrição HCV
Neste Artigo
Resumo
Descrevemos dois métodos para condicional Trans Complementação de vírus da hepatite C (HCV) de montagem e da realização do ciclo de vida completo viral, que se baseiam na formação de heterocarionte. Estas técnicas são adequados para triagem de linhagens de células que expressam fatores de restrição dominantes, que impedem a produção de progênie HCV infeccioso.
Resumo
Vírus da hepatite C (HCV) é um vírus hepatotrópico com uma gama de hospedeiros restrita aos seres humanos e chimpanzés. Embora HCV replicação de RNA tem sido observada em linhas de células humanas não-hepáticas e de murídeo, a eficiência foi muito baixa e necessários procedimentos de longo prazo de selecção utilizando HCV replicão constrói expressando dominantes antibiótico-seleccionáveis marcadores 1-5. HCV in vitro de pesquisa é, portanto, limitados a linhas celulares de hepatoma humano permissivas para a entrada do vírus e conclusão do ciclo de vida do vírus. Devido a HCVs tropismo espécies estreito, não existe nenhum modelo animal imunocompetente pequena disponível que sustenta o ciclo de replicação do HCV completa 6-8. Replicação ineficiente do HCV em células não-humanos, por exemplo de origem do rato é provavelmente devido à falta de incompatibilidade genética de factores do hospedeiro essenciais de dependência e / ou expressão de factores de restrição.
Investigamos se a propagação HCV é suprimida por fa restrição dominantectors em qualquer linhas de células humanas derivadas de tecidos não-hepáticas, ou em linhas de células do fígado de rato. Para este fim, desenvolvemos dois independentes condicionais de complementação trans métodos que dependem somática fusão celular. Em ambos os casos, a conclusão do ciclo de replicação viral só é possível em os heterocariontes. Por conseguinte, a complementação trans-sucesso, o que é determinado por medição da produção de novo de descendência virai infecciosa, indica ausência de restrições dominantes.
Especificamente, subgenómico replicões de HCV que transportam um transgene de luciferase foram transfectados para altamente permissivas células de hepatoma humano (Huh-7.5 células). Subsequentemente, estas células foram co-cultivados e fundidos a várias células humanas e de murino expressando HCV núcleo proteínas estruturais, envelope 1 e 2 (E1, E2) e acessório proteínas p7 e NS2. Desde que a fusão celular foi iniciada por meio de tratamento com polietileno-glicol (PEG), a cultura libertado infecciosa virai aaARTIGOS que as células infectadas sem tratamento prévio de uma forma do receptor-dependente.
Para avaliar a influência das restrições dominantes sobre o ciclo de vida viral, incluindo entrada de célula, tradução do RNA, replicação e montagem do vírus, que se aproveitou de uma linha celular humana do fígado (Huh-7 células Lunet N 9) que não tem expressão endógena de CD81, um factor de entrada essencial do HCV. Na ausência de CD81 ectopicamente expressa, estas células são essencialmente refractário para infecção por VHC 10. Importante, quando co-cultivadas e fundidos com células que expressam CD81 humano, mas falta pelo menos um outro fator fundamental a entrada de células (ou seja, SR-BI, CLDN1, OCLN), apenas os resultantes heterocários exibir o conjunto completo de fatores de entrada HCV necessárias para a infecção. Portanto, para analisar se factores de restrição dominantes suprimir a conclusão do ciclo de replicação do HCV, que fundiram células Lunet N com várias células de origem humana e do rato que preenchem a crit acima mencionadoeria. Quando a co-cultura de células foram transfectadas com uma proteína do envelope viral altamente fusogénicos mutante do vírus sincicial protótipo (PFV 11) e subsequentemente desafiados com partículas infecciosas HCV (HCVcc), de novo de produção de vírus infeccioso foi observada. Isso indica que o HCV concluído com êxito o seu ciclo de replicação em heterocárions descartando assim a expressão de fatores de restrição dominantes nessas linhas celulares. Estas novas condicionais de complementação-trans métodos serão úteis para pesquisar uma grande painel de linhas celulares e células primárias para a expressão de factores específicos de HCV de restrição dominantes.
Protocolo
A fusão celular por PEG
1. Cultura de Células
- Cultura Huh-7.5, HeLa e linhas celulares Hep56.1D naive ou embalagem 12 em 15 cm pratos de cultura de células em DMEM completo (DMEM CPLT) médio, DMEM suplementado com 2 mM de L-glutamina, 1x não-aminoácidos essenciais, 100 U / ml de penicilina, 100 ug / ml de estreptomicina, e soro de vitela fetal a 10%. Aplicar a selecção apropriada para linhas celulares estáveis, como indicado na Tabela 1.
2. A transfecção do RNA do HCV
- Lavar Huh-7.5 células (um prato centímetros confluente 15) por duas vezes com Tampão fosfato trypsinize salino (PBS), e ressuspender a uma concentração de 1.5x10 7 células / ml em Cytomix (120 mM de KCl, 0,15 mM de CaCl2, 10 mM de K 2 HPO 4 [pH 7,6], 25 mM de HEPES, 2 mM de EGTA, 5 mM de MgCl2, pH ajustado a 7,6 com KOH e esterilizado por filtração) contendo 2 mM de ATP e 5 glutationa mM.
- Transfectar via electroporatião uL 400 da suspensão de células (6x10 células 6) com 10 ug de RNA de HCV (_JFH1_dg pFKi389Luc-EI/NS3-3 '13) utilizando cuvetes com uma largura da abertura de 0,4 cm e um Gene Pulser Xcell sistema (Biorad) definida como 975 uF e 270 V, como descrito anteriormente 14.
- Imediatamente transferir transfectadas Huh-7.5 células para 10 ml de meio DMEM CPLT e semente a suspensão inteira em um prato de cultura única de 10 cm de diâmetro. Células de cultura para 24 horas a 37 ° C e 5% de CO 2.
3. Indução de fusão por PEG
- Células de colheita como descrito em 2.1, ressuspender em meio DMEM CPLT e diluir a 5x10 5 células / mL.
- Gerar unicelulares suspensões de Huh-7.5, HeLa, e células de empacotamento Hep56.1D, e diluídas para 5x10 5 células / ml, 2x10 5 células / ml, e 2x10 5 células / ml, respectivamente. Note-se que células de empacotamento ectopicamente expressa HCV proteínas do núcleo, E1, E2, p7 e NS2 após a transdução com dois emdependentes lentivirais transdução um C-E1 e E2-p7-NS2 cassete de expressão, respectivamente 13, 15.
- Prepare pratos bem 6-cultura com 2-3 folhas de vidro estéreis cobertura por poço, para posterior análise da eficiência de fusão.
- Combinar 1 mL de transf Huh-7.5 células portadoras do replicão subgenómico com 1 mL de células de empacotamento, sementes em um poço de uma placa de 6 poços, e incubar durante 24 horas a 37 ° C e 5% de CO 2.
- Neste ponto do tempo, a densidade celular deve variar entre 60-80% de confluência antes da indução da fusão celular, a fim de permitir que as células estar na proximidade para as membranas celulares a fundir.
- Aspirar meio de co-cultura de células e lavar uma vez com 1 mL de PBS, então, cuidadosamente, adicionar 500 uL de pré-aquecida a 40% de PEG-1500 ou PBS como controlo e incubar durante 5 min a 37 ° C para induzir a formação de heterocários.
- Aspirar PEG e lava-se cuidadosamente 3-5 vezes durante 1 minuto (min) por lavagem com 2 mL de PBS para remover o excesso de PEG e, finalmente, adicionar 2mL de meio DMEM CPLT a cada poço e incubar a 37 ° C e 5% de CO 2.
- Quarenta e oito horas de fusão pós, recolher cada filtro sobrenadante e filtrar através de um iM 0,45.
- Produção de partículas infecciosas medida em heterocariontes fundidos por inoculação de naive Huh-7.5 células (8x10 4 células / poço semeadas numa placa de 12 poços, 24 h antes da inoculação) com 500 uL de células livres de fluido de cultura e subsequente determinação da luciferase atividade 14.
4. Imunofluorescência para determinar a eficiência de fusão
- Após recolha de sobrenadantes de culturas celulares (secção 3.8), lavar os poços contendo tampa de vidro desliza uma vez com 1 mL de PBS durante 1 min. Todos os passos que se seguem devem ser realizada à temperatura ambiente (TA) e de lavagem deve ser feito com 1 ml de PBS durante 1 min por lavagem.
- Fixar as células com 600 uL de paraformaldeído a 3% (PFA) em PBS durante 15 min e depois lavar 3x com PBS. Transferir com cuidado lamínulasem uma placa de 24 poços utilizando fórceps.
- Permeabilizar as células com 500 uL de Triton 0,5% X-100 em PBS durante 5 min e, subsequentemente, lavar 3x com PBS.
- Preparar solução de anticorpo primário em PBS suplementado com soro de cabra 5%. Use anti-NS5A anticorpo (9E10) a uma concentração de 0,5 ug / mL e anticorpo humano anti-E2 monoclonal (CBH-23) a uma concentração de 6,4 ng / mL. Aplicar 250 uL a cada poço e incubar à temperatura ambiente durante 45 min.
- Lavar 3x com PBS e detectar anticorpos primários ligados com 250 uL secundárias de cabra anti-ratinho ou de cabra anti-IgG humana conjugados com anticorpos monoclonais específicos para Alexa-Fluor 546 ou Alexa-Fluor 488, a uma concentração de 2 ug / mL em PBS suplementado com soro de cabra 5%. Incubar durante 30 min à temperatura ambiente no escuro.
- Em seguida, lavar com PBS 1x e, subsequentemente, mancha núcleos de células com 250 uL DAPI (4 ', 6'-diamidino-2-fenilindol dicloridrato) diluída 1:3.000 em PBS, incubar durante 1 min à temperatura ambiente no escuro.
- Lavar 4x com PBS e 1x com H 2 O, em seguida, montar lamínulas de cabeça para baixo em uma gota de Fluoromount numa lâmina de microscópio, deixe secar na amostra escuro e avaliar por microscopia de fluorescência indireta.
Fusão por transfecção transitória do vírus espumoso protótipo (PFV) glicoproteína
5. Preparação do inóculo viral
- Produção de um estoque de vírus de alto título por transfecção in vitro transcrita em RNA do HCV Hein-7.5 células e colheita sobrenadante da cultura celular após 48 he 72 h como descrito anteriormente 14. Determinar título virai por ensaio de diluição limitante (TCID 50) 13.
6. Cultura celular, fusão celular por transfecção de uma glicoproteína PFV fusogénicos
- Cultura Lunet N, HeLa, e Hep56.1D hCD81 células de acordo com as instruções da Tabela 1 em meio DMEM contendo CPLT selecções apropriadas.
- Separar as células como descrito em 2.1, preparar suspensões de células únicas em DMEM CPLT medium, e co-cultivar Lunet N células com células HeLa ou hCD81 Hep56.1D linhas de células em proporções adequadas (por exemplo, 1:2 para Hep56.1D hCD81 ou 1:01 para as células HeLa), tendo produzido uma densidade celular total de 1.5x10 5 células por 12-poço e incubar durante 24 horas a 37 ° C e 5% de CO 2.
- No dia seguinte, transitoriamente transfectar células com a proteína altamente fusogénicos envelope PFV (pczHFVenvEM066 16) usando 2000 Lipofectamine acordo com as instruções do fabricante.
7. Ensaio de Infecção
- Inocule heterocariontes 30 h após a transfecção com 350 ul de estoque de vírus (MOI de ~ 2,3) durante 12 h durante a noite, lavar uma vez com PBS e adicionar 1 mL de meio DMEM CPLT por poço. Incubar durante 48 horas a 37 ° C e 5% de CO 2.
- Sobrenadante colheita da cultura heterocário, filtrar através de um filtro de 0,45 uM e inocular Huh-7.5 células, semeadas em placas de 96 poços (1x10 4 células / poço) no dia anterior, num ensaio de diluição limitante 13.
- Após 72 h, mancha infectadas Huh-7.5 células com um anticorpo específico de HCV-(NS5A; 9E10) para quantificar a produção de partículas infecciosas progenitura.
8. Visualização de fusão celular
- Para visualizar eventos de fusão, preparar soluções de 5 a 10 mM de corantes CellTracker em meio DMEM sem aditivos e completar os passos abaixo 6 h antes de co-cultura (descrito nas secções 6.2 e 6.3).
- Lave as células aderentes uma vez com 5 mL de PBS e em seguida incubar as células com 4 mL de solução por coloração 10 centímetros prato durante 45 min a 37 ° C e 5% de CO 2 (mancha Lunet N células com CellTracker Laranja CMTMR e HeLa ou Hep56.1D hCD81 células com CellTracker Verde CMFDA, separadamente).
- Lave as células uma vez com 5 mL de PBS durante 1 min e adicionar meio DMEM CPLT, incubar durante 6 horas a 37 CO ° C e 5% 2.
- Preparar a semeadura e transfecção de células coradas como descrito acima no Secções 6.2 e No entanto, adicionar uma lamela para oprato de cultura de células antes da semeadura.
- 30 h após a transfecção, lavar as células cuidadosamente com 1 mL de PBS durante 1 min e, em seguida, fixar as células com 250 uL de PFA 3% durante 15 min à TA. Lave as células uma vez com 1 mL de PBS durante 1 min, a mancha com DAPI durante 1 min, tal como descrito na secção 4.6, lavar uma vez com 1 mL de PBS durante 1 min, repetir lava-se com H2O e lamelas de montagem em lâminas de vidro (ver a secção 4.7 ). Analise as células com um microscópio de fluorescência.
| Espécies | A linha de células | Origem | Meio de crescimento e seleção |
| Humano | Huh-7.5 | Subclone de Huh-7 linha celular de hepatoma 17 | DMEM CPLT |
| Huh-7.5 [CE1] [E2p7NS2] | Expressando estavelmente núcleo proteínas virais, E1, E2, P7, e NS2, transduzidas por lentivirus gene do tRANSFERÊNCIA de duas cassetes de genes independentes | DMEM CPLT + blasticidina 5 mg / mL | |
| Huh-7 Lunet N | Subclone de Huh-7 linha celular de hepatoma 9 | DMEM CPLT | |
| HeLa | Linha celular de adenocarcinoma do colo do útero (número ATCC: CCL-2) | DMEM CPLT | |
| HeLa [CE1] [E2p7NS2] | Expressando estavelmente núcleo proteínas virais, E1, E2, P7, e NS2, transduzidas por transferência de genes lentiviral de duas cassetes de genes independentes | DMEM + CPLT G418 750 ug / mL; ug blasticidina 5 / mL | |
| Mouse | Hep56.1D | Carcinoma hepatocelular primário (dom tipo de J. Encke) Adultos camundongos C57BL/6J | DMEM CPLT |
| Hep56.1D [CE1] [E2p7NS2] | Ex estávelpressionando núcleo proteínas virais, E1, E2, P7, e NS2, transduzidas por transferência de genes lentiviral de duas cassetes de genes independentes | DMEM + CPLT G418 750 ug / mL; ug blasticidina 5 / mL | |
| Hep56.1D hCD81 | Expressando estavelmente CD81 humanas transduzidas por transferência de genes lentiviral | DMEM CPLT + blasticidina 5 mg / mL |
. Tabela 1 Especificações sobre a origem e cultura condição de linhas celulares utilizadas CPLT: completo, G418: geneticina, h: humanos.
9. Os resultados representativos
Neste estudo, foram aplicados dois métodos diferentes de fusão celular somática que nos permitem investigar especificamente o impacto dos fatores de restrição após a conclusão do ciclo de replicação do HCV em heterocárions. De nota, o desenho condicional de complementação-trans mediante a fusão dos dois tipos de células diferentes que asseguraapenas em heterocárions verdadeiros entre as células de fígado humano e linhas não-permissivas celulares, montagem de vírus (abordagem 1) ou de entrada de vírus e do ciclo de replicação completa HCV (abordagem 2) são realizadas.
Na primeira abordagem Huh-7.5 células, altamente permissivas para o HCV, foram transitoriamente transfectadas com um replicão subgenómico expressando um transgene de luciferase e de HCV proteínas não-estruturais de suporte subgenómico HCV replicação de RNA (células Huh-7.5 replicão). Estas células foram co-cultivados e fundido com linhas de células que expressam o HCV núcleo proteínas estruturais, E1, E2, bem como proteínas p7 acessório, e NS2. Figura 1A mostra uma visão geral do procedimento experimental. Importante, seguindo fusão de PEG, todas as proteínas necessárias para a montagem da partícula deve estar presente no heterocário formado, que pode ser confirmada por imunofluorescência contra individuais proteínas virais. A Figura 1B representa um evento de fusão exemplar no qual os sinais tanto para NS5A expressa em Hein-7.5 células replicão e E2expressa em Huh-7.5 [CE1] [E2p7NS2] células de empacotamento foram detectados no citoplasma mesmo sobre o PEG-induzida de células híbridas. Quando a co-cultura de células foram tratadas em vez com PBS, sem fusão foi induzida, assim, apenas um único células positivas e sem co-localização dos sinais foi observada. Além disso, para controlar a expressão do transgene, foi realizada ELISAs específicos para o núcleo e E2 (relatado anteriormente em detalhe 15). Para além da linha de células de controlo de embalagem Huh 7,5 [CE1] [E2p7NS2], foram geradas HeLa e células de empacotamento Hep56.1D como representantes de figado humano não-e células do fígado de rato, respectivamente. HCV eficiência da replicação de RNA nestas últimas células é montagem de baixo e de HCV e de libertação não foi demonstrado. A Figura 1C ilustra os resultados do ensaio de fusão. Os sobrenadantes foram coletados a partir da co-cultura de 48 h após a indução de fusão e usada para inocular ingênuos Huh-7.5 células para posterior ensaios de luciferase. Notadamente, quando as células Huh-7.5 replicão foram fundidas com tantolinhas de células naive ou tratados com PBS como controlo, não infectividade foi detectada nos fluidos de cultura. No entanto, quando a fusão celular entre Huh-7.5 replicão e linhas celulares de empacotamento foi induzida por PEG, trans-complementação entre replicão e expressas constitutivamente proteínas estruturais resgatado a produção de vírus nas heterocariontes resultantes e partículas virais infecciosas foram libertados para os fluidos de cultura. Assim, concluímos que a produção de vírus necessária fusão de células e expressão de proteínas virais nas linhas celulares de empacotamento. Surpreendentemente, não só os heterocários de Hein-7.5 células de hepatoma humano, mas também heterocários com fígado humano não (HeLa [CE1] [E2p7NS2]) do mouse e do fígado (Hep56.1D [CE1] [E2p7NS2]) a liberação de vírus células permitiu, indicando que a montagem ea libertação não são predominantemente inibida por factores de restrição possíveis nestes tipos de células. Expressão de proteínas estruturais em linhas de embalagem de células e de entrada autêntica em células alvo foi mostrado na Frentzen Et al. 15.
Um método alternativo de fusão celular foi utilizada para analisar as possíveis restrições que afectam entrada de célula, a tradução de RNA e fases de replicação de RNA do ciclo de replicação e para excluir que uma elevada carga virai em células transfectadas Hein 7,5 replicão impediria a detecção de factores de restrição por meio de saturação. Para este fim, foi desenvolvido um ensaio independente baseado no inoculação de heterocariontes com HCVcc e detecção de novo de produção de vírus nestas células. Como ilustrado na Figura 2A, somática fusão celular foi induzida pela expressão de uma glicoproteína fusogénicos após co-cultura das células. Este método foi escolhido porque a sensibilidade foi aumentada provavelmente devido a eficiência de fusão aumentou. Heterocariontes foram visualizadas por coloração linhas celulares separadas com corantes CellTracker Antes de co-cultivo. Um heterocário com forma homogénea corantes distribuídas dentro do citoplasma indica fusão de dois tipos de células como indicamd na Figura 2B. Apenas em heterocárions de Lunet N com células HeLa ou Hep56.1D hCD81 células são todos os fatores de entrada HCV expressa, assim, tornando seletivamente heterocários suscetíveis à entrada de célula HCV. Desafio com HCVcc resultou em replicação completa de HCV em heterocariontes que é evidente a partir de novo de produção de descendência virai infecciosa aproximadamente 10 vezes acima da de fundo do ensaio (Figura 2C). Como um controlo, as células Lunet N foram fundidos com células de Lunet N. É importante notar apenas níveis muito baixos de perto HCV infeccioso para o limite de detecção foram observados. Resultados semelhantes foram obtidos quando as células Lunet N foram fundidas com células naive Hep56.1D. Em ambos os casos, CD81 humano estava ausente de modo que o VHC não podia produtivamente infectar os heterocariontes. Este infecciosidade muito baixa detectada nestes dois últimos casos é provavelmente atribuíveis a baixo nível de infecção de células Lunet N e / ou baixos níveis de entrada do vírus infeccioso residual a partir do inoculo. Em células HeLa e de contraste Elep56.1D hCD81 células expressam CD81 humano, complementando assim o fator de entrada sem celular nos heterocários e permitindo a entrada de células HCV. O nível 10 vezes maior de HCV infeccioso detectada no meio de heterocariontes envolvendo estas duas linhas celulares, por conseguinte, provavelmente reflecte a produção de novo de partículas infecciosas em heterocariontes. Assim, concluiu-se que a conclusão do ciclo de replicação do HCV não se restringe excluindo a expressão de factores de restrição do HCV dominantes nestas linhas celulares.
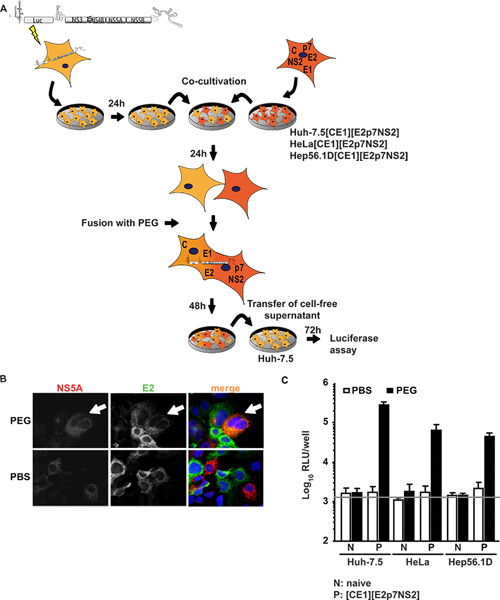
Figura 1. Trans-complementação de HCV de montagem e de libertação em heterocariontes. (A) esboço esquemático do procedimento experimental de PEG-mediada fusão celular. O JFH1 luciferase repórter replicão Luc-NS3-5B foi transfectado em naive Huh-7.5 células por electroporação. No dia seguinte, as células foram destacadas e co-cultivados com células naive ou embalagens As células que expressam constitutivamente HCV núcleo, E1, E2, p7 e NS2. 24 h após a co-cultura, a formação de heterocarionte foi induzida por tratamento com PEG de 40% usando PBS como controlo negativo. Após 48 h, livre de células sobrenadante foi colhido para inocular naive Huh-7.5 células. Infectividade foi determinada pela atividade da luciferase. (B) Para a detecção de heterocariontes, as células foram imunocoradas utilizando anticorpos monoclonais contra E2 e NS5A. A expressão simultânea de ambas as proteínas no interior das células é indicativo de fusão celular. (C) foram realizadas medições luciferase para quantificar a infectividade virai produzido a partir de heterocariontes. Valores médios de três experimentos independentes e os desvios-padrão das médias são dadas. A barra horizontal representa a RLU fundo determinado em não infectados Huh-7.5 células. Clique aqui para ver maior figura .
9/4029fig2.jpg "/>
Figura 2. Conclusão do ciclo de replicação do HCV após a inoculação de heterocariontes. (A) Resumo esquemática do procedimento experimental. Huh-7 células Lunet N faltam CD81 foram co-cultivados com as linhas celulares indicadas em falta ou expressando CD81 humano. Importante, estas últimas células não possuem, pelo menos, um factor de entrada de HCV e, por conseguinte, não pode ser produtivamente infectadas. No dia seguinte, a fusão foi iniciada por transfecção de uma proteína do envelope viral fusogénicos da PFV. Trinta horas mais tarde, as células foram desafiadas com partículas infecciosas de HCV. Para medir a entrada de célula, a replicação de RNA e produção de vírus sustentada por estes heterocariontes, infecciosidade libertado nos fluidos de cultura isentos de células foi determinada após a inoculação 48 h. Para este fim, sem tratamento prévio Huh-7.5 células foram utilizadas como células alvo, num ensaio de diluição limitante (TCID 50). (B) Para a detecção de heterocariontes, as células foram coradas com Green CellTracker ou CellTracker Laranja 6 h antes do co-cultivção e transfecção. Trinta horas mais tarde, as células foram fixadas e coradas com DAPI. (C) células Lunet N foram fundidas a células HeLa, células naive Hep56.1D ou Hep56.1D que expressam CD81 humanas. Estas culturas foram inoculadas com HCVcc (MOI de 2,3). Os fluidos da cultura foram coletados 48 h mais tarde e de liberação de partículas de novo heterocários foi determinada por TCID 50 usando ingênuos células Huh-7.5-alvo. Valores médios de três experimentos independentes são dadas. A barra horizontal representa o limite de detecção do ensaio. para ver figura maior .
Discussão
Apresentamos dois métodos para induzir a formação heterocário em células em cultura para a análise de dominantes negativos restrições que impedem a replicação do HCV. Utilizando estes procedimentos que excluída a presença de um factor dominante expressa constitutivamente ou induzida por vírus em vários figado humano não-e em linhas celulares de murídeo do fígado. O primeiro ensaio analisa principalmente se os fatores de restrição de impedir a montagem HCV e liberação de progênie infecciosa. Uma vez...
Divulgações
TP recebeu honorários de consultoria da Biotest.
Agradecimentos
Somos gratos a Takaji Wakita e Bukh Jens para JFH1 e isolados J6CF, respectivamente. Além disso, agradecemos Charles Rice para Hein-7.5 células e do anticorpo 9E10, Steven Foung para o anticorpo específico CBH-E2-23, e todos os membros do Departamento de Virologia Experimental, Twincore para sugestões e discussões.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| DMEM | Invitrogen, Karlsruhe, Alemanha | 41965-039 | |
| L-glutamina | Invitrogen, Karlsruhe, Alemanha | 25030-024 | |
| Non-aminoácidos essenciais | Invitrogen, Karlsruhe, Alemanha | 11140-035 | |
| A penicilina / estreptomicina | Invitrogen, Karlsruhe, Alemanha | 15140-122 | |
| Soro fetal de vitelo | PAA, Cölbe, Alemanha | A15151 | |
| α-E2 (CBH23) | gentilmente cedido por Steven Foung 10 | ||
| ATP | Sigma, Steinheim, Alemanha | A2833-106 | |
| Glutationa | Sigma, Steinheim, Alemanha | G4251-1G | |
| Blasticidina | Invivo Gen, San Diego, EUA | Ant-bl-1 | |
| G418 (geneticina) | Invitrogen, Karlsruhe, Alemanha | 11811-064 | |
| Polietileno-glicol-1500 | Roche, Mannheim, Alemanha | 10783641001 | |
| Paraformaldeído | Roth, Karlsruhe, Alemanha | 0.335,3 | |
| Triton X-100 | Roth, Karlsruhe, Alemanha | 3051,2 | |
| Soro de cabra | Sigma, Steinheim, Alemanha | G9023-5mL | |
| α-NS5A (9E10) | Gentilmente cedido por Charles Rice 7 | ||
| DAPI (4 ', 6'-diamidino-2-fenilindol dicloridrato) | Invitrogen | D1306 | |
| Alexa-Fluor 546 - cabra anti-IgG humana | Invitrogen, Karlsruhe, Alemanha | A21089 | |
| Alexa-Fluor 488 - cabra anti-IgG de rato | Invitrogen, Karlsruhe, Alemanha | A10680 | |
| Lipofectamine 2000 | Invitrogen, Karlsruhe, Alemanha | 11668-019 | |
| CellTracker CMTMR | Invitrogen, Karlsruhe, Alemanha | C2927 | |
| CellTracker CMFDA | Invitrogen, Karlsruhe, Alemanha | C2925 | |
| Fluoromount | Sigma, Steinheim, Alemanha | F4680-25ML | |
| Todos os outros produtos químicos | Roth, Karlsruhe, Alemanha | ||
| De cultura de células materiais | Sarstedt, Nümbrecht, Alemanha |
Referências
- Zhu, Q., Guo, J. T., Seeger, C. Replication of hepatitis C virus subgenomes in nonhepatic epithelial and mouse hepatoma cells. J. Virol. 77, 9204-9210 (2003).
- Kato, T. Nonhepatic cell lines HeLa and 293 support efficient replication of the hepatitis C virus genotype 2a subgenomic replicon. J. Virol. 79, 592-596 (2005).
- Ali, S., Pellerin, C., Lamarre, D., Kukolj, G. Hepatitis C virus subgenomic replicons in the human embryonic kidney 293 cell line. J. Virol. 78, 491-501 (2004).
- Date, T. Genotype 2a hepatitis C virus subgenomic replicon can replicate in HepG2 and IMY-N9 cells. J. Biol. Chem. 279, 22371-22376 (2004).
- Chang, K. S. Replication of hepatitis C virus (HCV) RNA in mouse embryonic fibroblasts: protein kinase R (PKR)-dependent and PKR-independent mechanisms for controlling HCV RNA replication and mediating interferon activities. J. Virol. 80, 7364-7374 (2006).
- Zhong, J. Robust hepatitis C virus infection in vitro. Proc. Natl. Acad. Sci. U.S.A. 102, 9294-9299 (2005).
- Lindenbach, B. D. Complete replication of hepatitis C virus in cell culture. Science. 309, 623-626 (2005).
- Wakita, T. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat. Med. 11, 791-796 (2005).
- Witteveldt, J. CD81 is dispensable for hepatitis C virus cell-to-cell transmission in hepatoma cells. J. Gen. Virol. 90, 48-58 (2009).
- Bitzegeio, J. Adaptation of hepatitis C virus to mouse CD81 permits infection of mouse cells in the absence of human entry factors. PLoS Pathog. 6, e1000978 (2010).
- Lindemann, D., Goepfert, P. A. The foamy virus envelope glycoproteins. Curr Top Microbiol Immunol. 277, 111-129 (2003).
- Brohm, C. Characterization of determinants important for hepatitis C virus p7 function in morphogenesis by using trans-complementation. J. Virol. 83, 11682-11693 (2009).
- Steinmann, E., Brohm, C., Kallis, S., Bartenschlager, R., Pietschmann, T. Efficient trans-encapsidation of hepatitis C virus RNAs into infectious virus-like particles. J. Virol. 82, 7034-7046 (2008).
- Koutsoudakis, G. Characterization of the early steps of hepatitis C virus infection by using luciferase reporter viruses. J. Virol. 80, 5308-5320 (2006).
- Frentzen, A. Completion of hepatitis C virus replication cycle in heterokaryons excludes dominant restrictions in human non-liver and mouse liver cell lines. PLoS Pathog. 7, e1002029 (2011).
- Lindemann, D. A particle-associated glycoprotein signal peptide essential for virus maturation and infectivity. J. Virol. 75, 5762-5771 (2001).
- Blight, K. J., McKeating, J. A., Rice, C. M. Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication. J. Virol. 76, 13001-13014 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados