A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ثابت الطريقة النتوء الضغط التي تسيطر عليها لإعداد الحويصلات الدهن نانو الحجم
In This Article
Summary
يصف هذا بروتوكول طريقة قذف لإعداد الحويصلات الدهون من دون ميكرون الأحجام مع وجود درجة عالية من التجانس. هذا الأسلوب يستخدم نظام الضغط التي تسيطر عليها مع تسيطر عليها معدلات تدفق النيتروجين لإعداد الحويصلية. ودهن إعداد 1،2، سيتم تقديم قذف الحويصلية، وتوصيف حجم هنا.
Abstract
Liposomes are artificially prepared vesicles consisting of natural and synthetic phospholipids that are widely used as a cell membrane mimicking platform to study protein-protein and protein-lipid interactions3, monitor drug delivery4,5, and encapsulation4. Phospholipids naturally create curved lipid bilayers, distinguishing itself from a micelle.6 Liposomes are traditionally classified by size and number of bilayers, i.e. large unilamellar vesicles (LUVs), small unilamellar vesicles (SUVs) and multilamellar vesicles (MLVs)7. In particular, the preparation of homogeneous liposomes of various sizes is important for studying membrane curvature that plays a vital role in cell signaling, endo- and exocytosis, membrane fusion, and protein trafficking8. Several groups analyze how proteins are used to modulate processes that involve membrane curvature and thus prepare liposomes of diameters <100 - 400 nm to study their behavior on cell functions3. Others focus on liposome-drug encapsulation, studying liposomes as vehicles to carry and deliver a drug of interest9. Drug encapsulation can be achieved as reported during liposome formation9. Our extrusion step should not affect the encapsulated drug for two reasons, i.e. (1) drug encapsulation should be achieved prior to this step and (2) liposomes should retain their natural biophysical stability, securely carrying the drug in the aqueous core. These research goals further suggest the need for an optimized method to design stable sub-micron lipid vesicles.
Nonetheless, the current liposome preparation technologies (sonication10, freeze-and-thaw10, sedimentation) do not allow preparation of liposomes with highly curved surface (i.e. diameter <100 nm) with high consistency and efficiency10,5, which limits the biophysical studies of an emerging field of membrane curvature sensing. Herein, we present a robust preparation method for a variety of biologically relevant liposomes.
Manual extrusion using gas-tight syringes and polycarbonate membranes10,5 is a common practice but heterogeneity is often observed when using pore sizes <100 nm due to due to variability of manual pressure applied. We employed a constant pressure-controlled extrusion apparatus to prepare synthetic liposomes whose diameters range between 30 and 400 nm. Dynamic light scattering (DLS)10, electron microscopy11 and nanoparticle tracking analysis (NTA)12 were used to quantify the liposome sizes as described in our protocol, with commercial polystyrene (PS) beads used as a calibration standard. A near linear correlation was observed between the employed pore sizes and the experimentally determined liposomes, indicating high fidelity of our pressure-controlled liposome preparation method. Further, we have shown that this lipid vesicle preparation method is generally applicable, independent of various liposome sizes. Lastly, we have also demonstrated in a time course study that these prepared liposomes were stable for up to 16 hours. A representative nano-sized liposome preparation protocol is demonstrated below.
Protocol
1. الحويصلية التحضير
- استرداد زجاج مل 20 قارورة مع غطاء تفلون مبطنة.
- تنظيف الأواني الزجاجية وجميع المحاقن مع الكلوروفورم قبل استخدامها لمنع التلوث.
- نقل 100 ميكرولتر من كلوروفورم الصف كاشف للقارورة من الزجاج باستخدام 250 ميكرولتر حقنة زجاجية محكمة الغلق.
- إضافة 30 ميكرولتر من الميثانول الصف كاشف للقارورة من الزجاج نفسه باستخدام 100 ميكرولتر حقنة زجاجية محكمة الغلق.
- لإعداد 2 مم 7:1.5:1.5 فسفاتيديل كولين (POPC): فسفاتيديل إيثانولامين (البابا): حل الكولسترول الدهون، نقل 216 ميكرولتر من 10 ملغ / مل POPC، 42 ميكرولتر من ميكرولتر ملغ / مل البابا و20 10 من 11 ملغ / مل الكولسترول الحلول في CHCL 3 إلى 20 قارورة من الزجاج مل.
- تتبخر المذيبات العضوية باستخدام بطء تدفق الأرجون أو غاز النيتروجين حتى يتم ملاحظة وجود طبقة رقيقة من الدهون في الجزء السفلي من القارورة.
- وضع قنينة زجاج لم يسبق لهم اللعب في مجفف فراغ لا يقل عن 30 دقيقة لإزالة المذيبات المتبقية.
- TRansfer 2 مل من العازلة، ومرت في السابق من خلال مرشح ميكرون 0.2، إلى قارورة من الزجاج على ترطيب الدهون.
- احتضان هذا الخليط في 4 درجات مئوية خلال الليل واستخدم في غضون 48 ساعة.
2. التجميد والذوبان-: لأحجام الحويصلية من 30 - 100 نانومتر فقط
- تجميد تعليق الحويصلية في النيتروجين السائل لمدة 15 ثانية.
- ذوبان الجليد تعليق الحويصلية باستخدام كتلة التدفئة في درجة الحرارة 42 درجة مئوية لمدة 3 ~.
- كرر الخطوات من 2.1 و 2.2 ليصبح المجموع 5 دورات.
3. قذف
اتبع الإرشادات Avestin لتجميع بشكل صحيح Liposofast LF-50 الطارد، وذلك باستخدام أداة الخطوط العريضة في كتاب مرشدهم.
- ثم وضع الدعم ثقب كبير الشاشة (مع فتحات دائرية) في قاعدة دعم مرشح، وذلك طبق في متكلس دائري (بدون ثقوب)، قرص واحد هجرة (25 مليمتر في القطر)، واحد غشاء البولي (25 مليمتر في القطر).
- وضع صغير، أسوديا الدائري على الجزء العلوي من الغشاء لضمان الحصول عليها على قاعدة دعم مرشح.
- نعلق الطارد أعلى مرشح من خلال تشديد 4 براغي في ثقوب 4 المقابلة.
- تجميع وحدة الطارد مرشح للبرميل تحت الطارد كبير. إضافة إلى حل الحويصلية برميل الاسطوانة. ضع ما يلي على رأس برميل قذف بالترتيب: دائري كبير يا الدائري، قبعة ضيقة، دائرية كبيرة يا الدائري، قبعة دائرية.
- نعلق منظم الغاز إلى الأعلى برميل الطارد وإغلاق كافة الصمامات لمنع تسرب الهواء، بما في ذلك ضغط صمام. وضع قنينة زجاج 20 مل أو 50 مل دورق مخروطي في إطار وحدة تصفية الطارد. تم توصيل صمام أمان للمنظم وستفرج إذا ضغط يتجاوز 600 رطل. بدوره على غاز النيتروجين وفتح صمام الغاز مرتبطة الطارد.
- زيادة ضغط النيتروجين إلى 25 PSI لالليبوزومات 400 نانومتر، 125 رطل عن الليبوزومات 100 نانومتر، والمبادرة لالليبوزومات 400-500 نانومتر 30.
- مشاهدة SUSP الحويصليةension كما يقذف في وعاء في حين يتم دفعها من قبل النيتروجين. الحفاظ على تدفق النيتروجين حتى لم تعد مراقبة أي يمر السائل خلال فلتر الطارد في قنينة زجاجية.
4. ديناميكية تشتت الضوء (DLS) تحليل
- تجهيز 50 ميكرولتر من حل الحويصلية 20 ميكرون.
- بدوره على مصدر القوة ومصدر مصباح.
- فتح البرنامج DynaPro.
- وضع برنامج لنموذج الخوارزمية MS / X للكشف عن الليبوزومات من 30 نانومتر و 100 و MS800 نموذج خوارزمية للكشف عن> الليبوزومات 100 نانومتر.
- وصل إلى الأجهزة.
- الماصة 14 ميكرولتر من عينة الحويصلية في كوفيت الكوارتز وتضاف إلى صاحب الخلية.
- اضغط على بدء.
- اضغط توقف بعد ~ 20-30 الاستحواذ.
- تحليل متوسط قمم بقطر الحويصلية المسجلة على الرسم البياني.
5. جسيمات متناهية الصغر تحليل تتبع (NTA)
- إعداد ميكرولتر 500، 0.1 ميكرومتر الحويصليةحل.
- شطف حجرة العينة مع الماء والايثانول.
- تجفيف مقصورة عينة مع منشفة ورقية خالية من الوبر.
- بدوره على الليزر مصدر قوة والكمبيوتر.
- تسليم 300 ميكروليتر من محلول 0.1 ميكرومتر الحويصلية إلى حجرة العينة.
- فتح السيطرة على درجة الحرارة وتحليل تتبع البرامج جسيمات متناهية الصغر.
- اضغط على زر التقاط لتشغيل الليزر.
- استخدام التعديلات الأفقية والعمودية لنقل مرحلة وضبط التركيز المجهر.
- ضبط درجة الحرارة المطلوبة (20 درجة مئوية)، وتسجيل الوقت (على الأقل 30 ثانية).
- اضغط على زر سجل لاتخاذ إطارات صور متعددة من الجسيمات الحويصلية لفترة محددة من الزمن. تحليل قمم المقابلة لالاحجام الحويصلية قطرها على الرسم البياني لأنها تتبع حركة كل جسيم.
6. ممثل النتائج
وهناك مخطط يحدد طريقة البثق هو عاستياء في الشكل 1. للحصول على أفضل النتائج، وإعداد الليبوزومات بأقطار من 30 نانومتر يتطلب الضغط العالي من المبادرة 500 ~ وبأقطار من 100 نانومتر يتطلب الضغط من 125 رطل لتحقيق معدل سريع مرشح. لبأقطار من 400 نانومتر، ويوصى الضغط المنخفض من المبادرة 25 ~ لتحقيق أبطأ معدل التصفية، والذي يسمح الحويصلات إلى استطال وتشكل أكبر، الليبوزومات متجانس. أجرينا سلسلة من التجارب لتحديد ضغط الأمثل لإنتاج أحجام متناسقة حويصلة الفرعية ميكرون. تباينت نحن الضغط فضلا عن عدد من قذف يمر عبر مرشحات البولي مع أحجام المسام من 30، 100، و 400 نانومتر، واكتشفت الضغط المناسب لكل الحجم المطلوب. لمسام نانومتر 30، وضغط أقل من 500 رطل خفض معدل تدفق، مما تسبب في استطالة وأحجام أكبر وبالتالي حويصلة. لمسام 100 نانومتر، تم التوصل إلى تدفق مستمر في 125 رطل. لمسام 400 نانومتر، وضغط منخفض (25 رطل) يسمح للحويصلات إلى استطال إلى S أكبر حويصلةizes. وبطء تدفق الترشيح الانقطاع عن الحكمة هو الأمثل لخلق أكبر الفرعية ميكرون الحويصلات 13.
أجرينا DLS لتحديد أحجام الحويصلية مقذوف من خلال ثلاثة أحجام مختلفة القطر، أي 30 و 100 و 400 نانومتر. DLS هو أسلوب المنشأة التي تقوم بتجميع الضوء المتناثرة لتحديد قطرها جسيم. نحن الليبوزومات رطب مقذوف من 2 ملم من خلال غشاء البولي نانومتر 30 في 500 رطل مع 5 تمريرات من خلال مسام فلتر؛ من 100 نانومتر غشاء البولي عند 125 رطل مع 5 تمريرات من خلال مسام فلتر و400 نانومتر غشاء البولي عند 25 PSI مع 2 يمر عبر فلتر المسام. كانت بأقطار من الليبوزومات وتقاس DLS لمدة 30 أحجام 100 و 400 نانومتر، والمسام 66 ± 28، 138 ± 18 و 360 ± 25 نانومتر (الشكل 2). تم استخدام نظام التعليق من 50 حبات البوليستيرين نانومتر كمعيار المعايرة كما هو موضح في الشكل رقم 2، حيث سجلت قطر من 47 ± 16 نانومتر. في المئة polydispersity يبين أنه لا يوجد تداخل في أحجام الحويصلية. انه يعتبر نموذجا لمراقبة بأقطار أعلى من 30 نانومتر عند استخدام DLS تحليل نظرا لانحياز يعرف هذا الصك لديها نحو الجسيمات الأكبر حجما 12. يتم جمع شدة تبعثر الضوء من الجزيئات الكبيرة والصغيرة في وقت واحد من اكتشاف طريقة واحدة وبالتالي من الصعب حل الليبوزومات في تعليق 12. على الرغم من هذا القيد مفيدة، منحنى المعايرة توضح وجود علاقة خطية القريب.
NTA هي التكنولوجيا الجديدة التي يقيس حجم كل جسيم من الرصد المباشر لنشرها في وسيلة السائل، ومستقلة عن معامل الانكسار جسيم أو كثافة. ويمكن استخدام هذه التقنية عالية الدقة لاستكمال قياس الليبوزومات مع دائرة الأراضي والمساحة. سجل NTA بأقطار من 95 ± 48 و 356 ± 51 نانومتر، واثنين من 100 نانومتر و 400 نانومتر حلول البوليسترين كانت تستخدم لمعايرة. وقد لوحظت حلول الدهون من 30 نانومتر و 100 نانومتر لديها أكثر شركات قطر الصالحة للزراعة بالنسبة لدائرة الأراضي والمساحة كما هو مبين في الشكل (3)، وإنتاج أحجام متوسط من 29 ± 14 و 95 ± 17 و 359 ± 73 نانومتر. قد يكون هناك بوادر تقنية توصيف أكثر عمومية لتحديد الجزيئات المجهرية منذ حساسيتها يتيح لها قياس الجسيمات 50 - 1000 نانومتر. منحنى المعايرة ويبين وجود علاقة خطية بين مسام غشاء البولي مقابل القطر NTA المسجلة.
| الحويصلية مقاسات | الكشف عن عتبة | يتوقع حجم الجسيمات الحد الأدنى (نانومتر) |
| 30 نانومتر | 11 | 30 |
| 100 نانومتر | 11 | 100 |
| 400 نانومتر | 21 | 400 |
الجدول رقم 1. معلمات Nanosight.
ad/4151/4151fig1.jpg "/>
الشكل 1. الرسم البياني لطريقة البثق، واصفا كيف الضغط وتدفق النيتروجين تسيطر على تجانس بأقطار مختلفة الحويصلية. بعد ترطيب الحويصلية، حويصلات unilamellar من أحجام مختلفة تنبثق من خلال مختلف البولي غشاء المسام مرشح على الضغوط المختلفة.
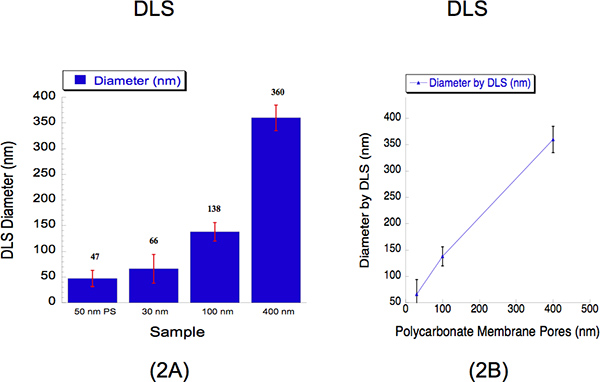
الشكل 2. الديناميكي ضوء التشتت (DLS) بيانات تصف الأحجام الكمية الحويصلية بعد قذف. (أ) وتظهر الرسوم البيانية لوصف بأقطار من العينات 3 الحويصلية. تم استخدام معيار المعايرة من الخرز نانومتر 50 (PS) البوليسترين كمرجع. يشار إلى أن متوسط أقطار الحويصلية فوق العارضة عن كل عينة. المحور س يصف أحجام المسام من الحلول التي كانت تنبثق من خلال. في محور y يصف قطر التي سجلتها دائرة الأراضي والمساحة. على الرغم من أن 30 و 100 نانومتر سجل أحجام نانومترإد قيم أعلى من أحجامها المسام في حين زاد حجم 400 نانومتر سجلت حجم أقل قليلا، ومنحنى المعايرة (ب) تبين وجود علاقة خطية القريب، حيث المحور س يعبر عن مسام غشاء البولي الأحجام، ومحور y يصف سجلت قطر الحويصلية من قبل دائرة الأراضي والمساحة.

شخصية تتبع جسيمات متناهية الصغر 3. تحليل (NTA) بيانات تصف أحجام الحويصلية بعد قذف. (أ) الرسوم البيانية تمثيل قطر كل عينة الحويصلية. المحور س يصف أحجام المسام من الحلول التي كانت تنبثق من خلال. في محور y يصف حجم قطرها التي سجلتها الهيئة الوطنية للمواصلات. وصفت وبأقطار متوسط الحويصلية فوق كل عينة. (ب) منحنى معايرة NTA يبين وجود علاقة خطية أكثر من منحنى المعايرة DLS بين أحجام مسام غشاء مرشح مقابل القطر مسجل. المحور س يصف مسام غشاء أحجام البولي. في محور y يصف قطره مسجل الحويصلية من قبل الإدارة الوطنية للسياحة.
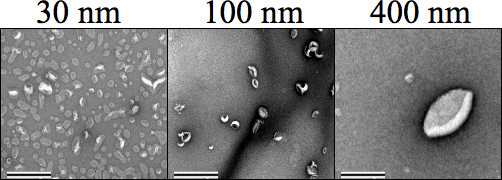
الشكل 4. السلبية الإلكترون انتقال صمة عار المجهري (تيم) وصور تظهر حجم كل الحويصلية (500 ميكرومتر)، يليه قذف. وقد خرج سلبا الكربون Formvar شبكات سلكية قبل تلطيخ عينة، حيث تم استخدام 1٪ خلات اليورانيل في الماء إلى وصمة عار على العينات قبل عملية التجفيف والتصوير في التكبير × 34000. أحجام 30 و 100، و 400 نانومتر بشكل واضح متميزة عن بعضها البعض. تم تعيين التكبير إلى 25000 ×. شريط مقياس يمثل 0.5 ميكرون.
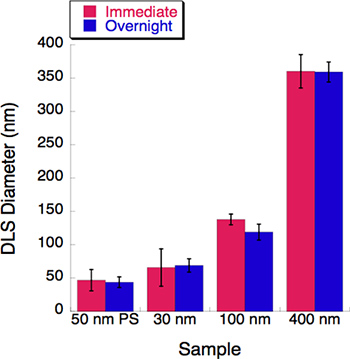
الشكل 5. أجريت تجربة للوقت بطبيعة الحال مع ثلاثة أحجام الحويصلية. وقد تم قياس ديناميكية تشتت الضوء (DLS) لكل حل الحويصلية قذف التالية مباشرة. تم تخزين جميع الحلول الحويصلية في 4 درجاتC بين عشية وضحاها. وسجلت قطر من قبل دائرة الأراضي والمساحة بعد حضانة بين عشية وضحاها. وقد لوحظ قليل من دون تغيير بعد فترة حضانة استمرت 16 ساعة.
Access restricted. Please log in or start a trial to view this content.
Discussion
باستخدام Liposofast Avestin LF-50 الطارد، أثبتنا كيف صغيرة الحجم، يتم إعداد الليبوزومات الاصطناعية من خلال نظام الضغط التي تسيطر عليها. من المهم أن نلاحظ أن الحويصلات الصفاحات تشكل عفويا بعد ترطيب الحويصلية، مما قد يؤدي إلى إنتاج أصغر النانوية. وهذه الحويصلات الصغيرة الصفاحا?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل معهد هوارد هيوز الطبي (HHMI) التعاونية جائزة الابتكار. وأيد LAM بواسطة الإشارات الخلوية وتنظيم المعهد الوطني للصحة تدريب منحة (T32 GM008759) وروث المعاهد الوطنية للصحة L. كيرشتاين ما قبل الدكتوراه زميل (CA165349-01). نود أن نشكر الأستاذ الدكتور مايكل Stowell (CU بولدر)، والبروفيسور ريس دوغلاس وروب البروفيسور فيليبس (كالتك) للتعليق عليها لا تقدر بثمن.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
| الكلوروفورم | سيغما الدريخ | 02432-25ML | 95٪ مثبتات |
| الدرجة العالية للميثانول | سيغما الدريخ | 179337-4L | |
| Liposofast LF-50 الطارد | Avestin، المؤتمر الوطني العراقي. | ||
| الفوسفورية | الدهون أفانتي القطبية | ||
| المسامات البولي | Avestin، المؤتمر الوطني العراقي. | قطره 25 ملم | |
| استنزاف أقراص PE | Avestin، المؤتمر الوطني العراقي. | 230600 | قطره 25 ملم |
References
- Connor, J., Bucana, C., Fidler, I. J., Schroit, A. J. Differentiation-dependent expression of phosphatidylserine in mammalian plasma membranes: quantitative assessment of outer-leaflet lipid by prothrombinase complex formation. Proc. Natl. Acad. Sci. U.S.A. 86, 3184-3188 (1989).
- Smith, S. A., Morrissey, J. H. Rapid and efficient incorporation of tissue factor into liposomes. J. Thromb. Haemost. 2, 1155-1162 (2004).
- Hui, E., Johnson, C. P., Yao, J., Dunning, F. M., Chapman, E. R. Synaptotagmin-mediated bending of the target membrane is a critical step in Ca(2+)-regulated fusion. Cell. 138, 709-721 (2009).
- Loughrey, H. C., Choi, L. S., Cullis, P. R., Bally, M. B. Optimized procedures for the coupling of proteins to liposomes. J. Immunol. Methods. 132, 25-35 (1990).
- Mui, B., Chow, L., Hope, M. J. Extrusion technique to generate liposomes of defined size. Methods Enzymol. 367, 3-14 (2003).
- Gruner, S. M., Cullis, P. R., Hope, M. J., Tilcock, C. P. Lipid polymorphism: the molecular basis of nonbilayer phases. Annu. Rev. Biophys. Biophys. Chem. 14, 211-238 (1985).
- Guven, A., Ortiz, M., Constanti, M., O'Sullivan, C. K. Rapid and efficient method for the size separation of homogeneous fluorescein-encapsulating liposomes. J. Liposome. Res. 19, 148-154 (2009).
- Zimmerberg, J., Kozlov, M. How proteins produce cellular membrane curvature. Nature Reviews Molecular Cell Biology. 7, 9-19 (2006).
- Chonn, A., Cullis, P. R. Recent advances in liposomal drug-delivery systems. Curr. Opin. Biotechnol. 6, 698-708 (1995).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochim. Biophys. Acta. 858, 161-168 (1986).
- Matsuoka, K., Schekman, R. The use of liposomes to study COPII- and COPI-coated vesicle formation and membrane protein sorting. Methods. 20, 417-428 (2001).
- Dragovic, R. A., Gardiner, C., Brooks, A. S., Tannetta, D. S., Ferguson, D., Hole, P., Carr, B., Redman, C., Harris, A. L., Dobson, P. J., Harrison, P., Sargent, I. L. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine. , (2011).
- Hunter, D. G., Frisken, B. J. Effect of extrusion pressure and lipid properties on the size and polydispersity of lipid vesicles. Biophys J. 74, 2996-3002 (1998).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved