Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Nano ölçekli Lipid Vesiküller Hazırlanması için Sabit Basınç kontrollü Ekstrüzyon Yöntemi
Bu Makalede
Özet
Bu protokol, homojen bir yüksek derecede mikronaltı boyutlarda lipid kesecikler hazırlanması için bir çekme yöntemi açıklar. Bu yöntem, lipozom preparatı için kontrollü bir nitrojen akışı hızları ile bir basınç kontrol sistemi kullanır. Lipid hazırlanışını 1,2, Lipozom ekstrüzyon ve boyutu karakterizasyonu burada sunulacaktır.
Özet
Lipozomlar, yaygın olarak protein-protein, protein-lipid etkileşimler 3, monitör ilaç teslim 4,5, ve kapsülleme 4 platformun çalışmak için taklit eden bir hücre membranı olarak kullanılan doğal ve sentetik fosfolipidler oluşan yapay olarak hazırlanmış kesecikler vardır. Fosfolipidler doğal bir misel kendisini ayıran, kavisli lipid bilayers oluşturun. 6 Lipozomlar geleneksel bilayers, yani büyük tek lamelli kesecikler (luvs), küçük tek lamelli kesecikler (SUV) ve multilamellar veziküller (MLVs) 7 büyüklüğü ve sayısına göre sınıflandırılır. Özellikle, çeşitli boyutlarda homojen lipozomlar hazırlanması endo-ve ekzositoz olayları, membran füzyon ve protein trafiğini 8, hücre sinyal hayati bir rol oynar membran eğrilik eğitim için önemlidir. 400 - Birçok grup proteinleri membran eğrilik içerir ve bu nedenle çapları lipozomlar hazırlamak süreçleri <100 modüle kullanılır nasıl analizhücre fonksiyonlarını 3 davranışlarını incelemek için Nm. Diğer araçların ilgi 9 uyuşturucu taşımak ve teslim gibi lipozomlar okuyan, lipozom-ilaç kapsülleme odaklanın. Lipozom oluşumu sırasında 9 bildirildiği gibi, Drug kapsülleme elde edilebilir. Bizim ekstrüzyon adım iki nedenden dolayı kapsüllü ilaç etkilememesi gerektiğini, yani (1) ilaç kapsülleme bu adımı önce elde edilmelidir ve (2) lipozomlar güvenli sulu çekirdek ilaç taşıyan, doğal biyofiziksel istikrarı muhafaza etmelidir. Bu araştırma hedeflerini daha istikrarlı mikronaltı lipid veziküller tasarlamak için optimize edilmiş bir yöntem olan ihtiyacı göstermektedir.
Bununla birlikte, mevcut lipozom hazırlama teknolojileri (sonication 10, donma ve çözülme-10, sedimantasyon) biyofiziksel sınırlar yüksek tutarlılık ve verimlilik 10,5 ile oldukça eğimli (yani çapı <100 nm) lipozomlar hazırlanmasına izin vermez Bir emergi çalışmalarımembran eğrilik algılama ng alanı. Bu yazıda, biyolojik ilgili lipozomlar çeşitli için sağlam bir hazırlama yöntemi sunuyoruz.
Gaz sızdırmaz şırıngalar ve polikarbonat membran 10,5 kullanarak Manuel ekstrüzyon yaygın bir uygulamadır ama gözenek boyutları uygulanan manuel basınç değişkenliği nedeniyle nedeniyle <100 nm kullanırken heterojenite sık görülmektedir. Biz, çapları 30 ile 400 nm arasında değişmektedir sentetik lipozomlar hazırlamak için sabit bir basınç kontrollü ekstrüzyon cihazları istihdam. Dinamik ışık saçılması (DLS) 10, 11 ve elektron mikroskopi nanoparçacık izleme analizi (NTA) 12 bizim protokolde tarif edildiği gibi, ticari polistiren (PS), bir kalibrasyon, standart olarak kullanıldı boncuklar ile, lipozom boyutları ölçmek için kullanılmıştır. Bir yakın doğrusal korelasyon bizim basınç kontrollü lipozom hazırlık yüksek sadakat gösteren, meslek gözenek boyutları ve deneysel olarak belirlenmiştir lipozomlar arasında anlamlı karşılandıdeme usulü. Ayrıca, bu yağ vesikül hazırlama yöntemi, çeşitli boyutlarda lipozom bağımsız olarak, genel olarak uygulanabilir olduğunu göstermiştir. Son olarak, biz de en fazla 16 saate kadar Hazırlanan bu lipozomlar stabil olduğu bir zaman ders çalışmada gösterilmiştir. A temsilcisi nano boyutlu lipozom hazırlık protokolü aşağıda gösterilmiştir.
Protokol
1. Lipozom preparatı
- Bir Teflon astarlı kapakla bir 20 ml bir cam şişe al.
- Bulaşmasını önlemek için kullanmadan önce kloroform ile tüm cam ve şırıngalar temizleyin.
- Bir 250 uL hava geçirmez bir cam şırınga kullanılarak bir cam şişeye saflıkta kloroform 100 uL transfer edin.
- Bir 100 uL hava geçirmez bir cam şırınga kullanılarak aynı cam şişeye tepkin madde gradlı metanol 30 uL ekleyin.
- Fosfatidiletanolamin (POPE): a 2 mM 7:1.5:1.5 fosfatidilkolin (POPC) hazırlamak için kolesterol lipid çözeltisi, 11 mg / mL 'lik 10 mg / mL Pope ve 20 ul uL 10 mg / mL POPC, 42 ve 216 uL transferi 20 ml bir cam şişeye CHCl3 kolesterol çözümler.
- Lipit ince bir film şişeye altındaki gözlenene kadar yavaş akış argon veya nitrojen gazı ile organik çözücüler buharlaşır.
- Artık çözücü kaldırmak için, en azından 30 dakika boyunca bir vakumlu kurutucuda kapağını açıp cam şişeye yerleştirin.
- Trtamponu ansfer 2 mL, daha önce hidrat lipidler için bir cam şişeye, bir 0.2 mikron filtreden geçirilir.
- 4 ° C de bir gece azından karışımı inkübe ve 48 saat içinde kullanımı.
2. Freeze-ve-çözülme: 30 Lipozom Ölçüler de - 100 nm Sadece
- 15 saniye boyunca sıvı nitrojen içinde lipozom süspansiyon dondurun.
- 42 bir ısıtma bloğu kullanarak lipozom süspansiyon çözülme ° ~ 3 dakika C sıcaklık.
- 5 döngü toplam adımları 2.1 ve 2.2 tekrarlayın.
3. Ekstrüzyon
Doğru kendilerine rehber kitapta enstrüman anahat kullanarak, Liposofast LF-50 ekstruder monte Avestin yönergeleri izleyin.
- Destek filtre tabanında büyük bir delik destek ekranı (dairesel delik ile) yerleştirin, dairesel sinterlenmiş çanağı (deliksiz), bir dren disk (çapı 25 mm), bir polikarbonat membran (çapı 25 mm) izledi.
- Küçük, siyah koyunDestek filtre tabanına sabitlemek için membran üstündeki O-ring.
- 4 deliklere 4 vidayı sıkarak üst filtre ekstruder takın.
- Büyük ekstruder varil altındaki üzere filtre ekstruder birimi birleştirin. Silindir namluya lipozom çözüm ekleyin. Için ekstrüzyon varil üzerinde aşağıdaki yerleştirin: büyük dairesel O-ring, dar kap, büyük dairesel O-ring, dairesel kap.
- Ekstruder varil başına gaz regülatörü takın ve basınç tahliye vanası dahil olmak üzere hava kaçağı önlemek için tüm vanaları kapatın. Bir 20 ml bir cam şişe ya ekstruder filtre ünitesi altında 50 ml Erlenmeyer şişesinde yerleştirin. Bir emniyet valfi regülatör bağlı ve 600 psi basınç aşarsa yayınlayacak. Azot gazı açın ve ekstruder bağlı gaz vanasını açın.
- Azot basıncı 400 nm lipozomlar, 100 nm lipozomlar için 125 psi ve 30 nm lipozomlar için 400-500 psi 25 psi artırın.
- Lipozom süspansiyon izlemeknitrojen ile itilerek edilirken ension bu kap içine çıkarır gibi. Artık cam şişe içinde ekstruder filtresi aracılığıyla herhangi bir sıvı geçen gözlemlemek kadar azot akan tutun.
4. Dinamik ışık saçılımı (DLS) Analizi
- Bir 20 uM lipozom solüsyonu 50 uL hazırlayın.
- Güç kaynağı ve lamba kaynağı açın.
- DynaPro yazılımını açın.
- 30 nm ve 100 nm ve> 100 nm lipozomlar tespit MS800 algoritma modeli lipozomlar algılamak için MS / X algoritma modeli için yazılım ayarlayın.
- Donanım bağlanın.
- Hücre tutucusu içine kuvars küvet ve yerleştirmeye lipozom numunesi pipetleyin 14 uL.
- Başlatmak basın.
- 30 satın alma - ~ 20 sonra durması basın.
- Histogram kaydedilen ortalama lipozom çapı zirveleri analiz edin.
5.. Takip nanoparçacık Analizi (NTA)
- Bir 500 uL, 0.1 uM lipozom hazırlamakçözüm.
- Su ve etanol ile örnek bölmesi çalkalayın.
- Bir tüy bırakmayan kağıt havlu ile örnek bölmesi kurulayın.
- Lazer güç kaynağı ve bilgisayarı açın.
- Örnek bölmesine 0.1 uM lipozom çözüm 300 uL sunun.
- Sıcaklık kontrolü ve Nanopartikül Takip Analiz yazılımı açın.
- Lazer açmak için düğmeye Yakalama basın.
- Sahne taşımak ve mikroskop odağı ayarlamak için yatay ve dikey ayarlamaları kullanın.
- Istenilen sıcaklığa (20 ° C) ve kayıt süresi (en az 30 saniye) ayarlayın.
- Zaman belirli bir miktar için lipozom parçacıkların birden fazla resim çerçeveleri çekmek için Kaydet düğmesine basın. Her parçacığın hareket izler olarak histogram üzerine çapı lipozom boyutları karşılık gelen tepe analiz.
6. Temsilcisi Sonuçlar
Ekstrüzyon yöntemi özetleyen bir şema, pŞekil 1 'de temsil edilir. , En iyi sonuçlar elde 30 nm çaplı lipozomlar hazırlanması ~ 500 psi ve 100 nm çaplı bir yüksek basınç gerektirir hızlı bir filtre hızı elde etmek için 125 psi'lik bir basınçta gerektirir. 400 nm çaplar için, ~ 25 psi arasında bir alçak basınç kesecikler daha büyük, daha homojen bir lipozom uzamasına ve oluşturmasına izin veren yavaş filtre oranının elde edilmesi tavsiye edilir. Biz tutarlı mikronaltı vezikül boyutları üretmek için optimal basınç belirlemek için bir dizi deney gerçekleştirdi. Biz basıncı gibi ekstrüzyon gözenek 30 ebatlarında, 100 ve 400 nm ile polikarbonat filtrelerden geçer sayısı çeşitlidir ve her istenilen boyutu için uygun basınç keşfetti. 30 nm gözenekler için 500 psi basınç altında uzama ve böylece daha büyük vezikül boyutları neden akış hızı azaltacaktır. 100 nm gözenekler için, sürekli bir akış 125 psi sağlandı. 400 nm gözenekler için, düşük basınçlı (25 psi) veziküller daha büyük vezikül s içine uzamasına izin verirsimgelediği kabul edilir. Yavaş açılan bilge filtrasyon akışı büyük mikronaltı veziküller 13 oluşturmak için en uygunudur.
Biz üç farklı çapta, yani 30, 100 ve 400 nm ile ekstrüde lipozom boyutlarını belirlemek için DLS yapıldı. DLS partikül çapı belirlemek için saçılan ışık toplayan oluşturulmuş bir yöntemdir. Filtre gözenek ile 5 pas ve 2 ile 25 psi az 400 nm polikarbonat membran ile 125 psi 100 nm polikarbonat membran, filtre gözenek 5 ile geçer ile 500 psi bir polikarbonat 30 nm zarından 2 mM Biz ekstrüde hidrate lipozomlar Filtre gözenek geçer. 30, 100 ve 400 nm gözenek boyutları için lipozomlar ve DLS ile ölçülen çapları 66 ± 28, 138 ± 18 ve 360 ± 25 nm (Şekil 2). Bu 47 çapı 16 nm ± kaydedildi Şekil 2, gösterildiği gibi, 50 nm polistiren boncuklar bir süspansiyon, bir kalibrasyon, standart olarak kullanıldı. Yüzde polydispersity lipozom boyutları içinde herhangi bir örtüşme olmadığını göstermektedir. Bu cihaz daha büyük parçacıklar 12 doğru var bilinen önyargı nedeniyle DLS analizi kullanırken 30 nm daha yüksek çapları gözlemlemek için tipiktir. Büyük ve küçük parçacıklar ışık saçılımı şiddetlerde süspansiyon 12 lipozomlar çözmek için bir algılama yöntemi aynı anda toplanan ve böylece daha sert edilir. Bu enstrümantal sınırlamaya rağmen, kalibrasyon eğrisi yakın bir doğrusal ilişki açıklanır.
NTA parçacık kırılma indisi veya yoğunluk bağımsız bir sıvı ortam, difüzyon doğrudan gözlemler her parçacığın boyutu ölçen yeni bir teknolojidir. Bu, yüksek çözünürlükte tekniği ile DLS lipozomlar ölçümü takviye etmek için kullanılabilir. NTA kalibrasyon için kullanılan 95 çapları ± 48 ve 356 ± 51 nm, iki adet 100 nm ve 400 nm polistiren çözümler kaydetti. 30 nm ve 100 nm Lipid çözümleri daha comp kaldığı görüldü olarak ortalama 29 boyutları ± 14, 95 ± 17 ve 359 ± 73 nm üreten, Şekil 3'te gösterildiği gibi DLS göre işlenebilir çapı. 1000 nm - NTA duyarlılığını o 50 parçacıkları ölçmek için sağlar yana mikroskobik partikülleri ölçmek için daha genel bir karakterizasyon tekniği olabilir. Kalibrasyon eğrisi kaydedilen NTA çapı karşı polikarbonat membran gözenekleri arasında doğrusal bir ilişki gösterir.
| Lipozom Boyutları | Algılama Eşiği | Beklenen Minimum Partikül Boyutu (nm) |
| 30 nm | 11 | 30 |
| 100 nm | 11 | 100 |
| 400 nm | 21 | 400 |
Tablo 1. Nanosight Parametreler.
ad/4151/4151fig1.jpg "/>
Şekil 1. Açıklayan ekstrüzyon yöntemi akış şeması, baskının nasıl ve azot akış farklı lipozom çaplarda homojenliği kontrol eder. Lipozom hidrasyonu takiben, farklı boyutlarda tek lamelli kesecikler farklı basınçlarda farklı polikarbonat membran filtreden gözenekler aracılığıyla uzatılır.
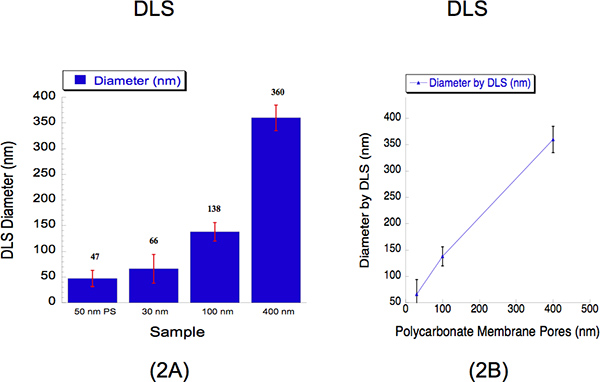
Şekil 2. Ekstrüzyon sonrası kantitatif lipozom boyutlarını açıklayan Dinamik ışık saçılımı (DLS) verileri. (A) Bar grafikler üç lipozom örnekleri arasında çapı tarif etmek için gösterilmiştir. 50 nm polistiren (PS) boncuk bir kalibrasyon standart bir referans olarak kullanılmıştır. Ortalama çapı lipozom her bir örnek için çubuğu yukarıda belirtilmiştir. X-ekseni çözümlerle haddelenmiş olduğu üzere gözenek boyutları açıklanmaktadır. Y-ekseni DLS tarafından kaydedilen çapı açıklanmaktadır. Rağmen 30 nm ve 100 nm boyutları rekorbüyük 400 nm boyutu biraz daha düşük bir boyutu kaydedildi ederken ed kendi gözenek boyutları daha yüksek değerleri, kalibrasyon eğrisi (b) x-ekseni polikarbonat membran gözenek boyutları ifade yakın bir lineer korelasyon gösterir ve y-ekseni tarif DLS tarafından lipozom çapı kaydedildi.

Ekstrüzyon takiben lipozom boyutları tarif Şekil 3. Nanopartikül Takip Analizi (NTA) veri. (A), her çubuk grafik lipozom örneğin çapı temsil eder. X-ekseni çözümlerle haddelenmiş olduğu üzere gözenek boyutları açıklanmaktadır. Y-ekseni NTA tarafından kaydedilen çapı açıklanmaktadır. Ortalama çapı lipozom her numune yukarıda etiketlenmiştir. (B) NTA kalibrasyon eğrisi kaydedildi çapına karşılık filtre zarı gözenek boyutları arasındaki DLS kalibrasyon eğrisi daha doğrusal bir ilişki gösterir. X-ekseni polikarbonat membran gözenek boyutları açıklar. Y-ekseni NTA tarafından kaydedilen lipozom çapı açıklanmaktadır.
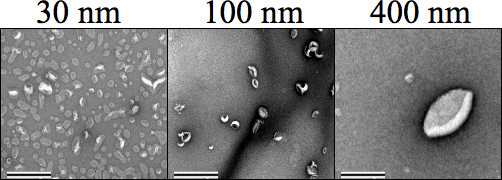
Şekil 4. Ekstrüzyon ardından her lipozom boyutu (500 uM) gösteren Negatif leke transmisyon elektron mikroskobu (TEM) görüntüler. Su içinde% 1 uranil asetat öncesinde 34.000 × büyütmede kurutma ve görüntüleme için örnekler leke kullanılan nerede Karbon Formvar örgü ızgaralar olumsuz örnek boyamadan önce taburcu edildi. Boyutları 30, 100 ve 400 nm açık bir şekilde birbirinden farklıdır. Büyütme 25.000 × ayarlandı. Ölçek çubuğu 0,5 mikron temsil eder.
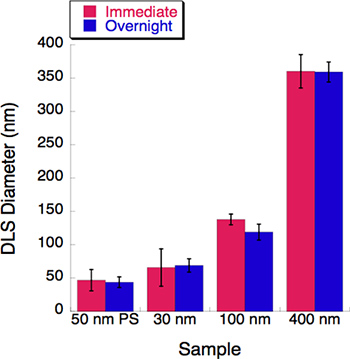
Şekil 5. Bir zaman elbette deneyi üç lipozom boyutları ile yapılmıştır. Dinamik ışık saçılımı (DLS) her lipozom çözelti hemen aşağıdaki ekstrüzyon için ölçüldü. Bütün lipozom çözümler 4 bekletildi °C de bir gece. Bunların çapları bir gece inkübasyondan sonra DLS tarafından kaydedildi. Hiç değişiklik 16 saat inkübasyon döneminden sonra gözlenmiştir.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Avestin Liposofast LF-50 Extruder kullanarak, ne kadar küçük ölçekli, sentetik lipozomlar bir basınç kontrol sistemi ile hazırlanmıştır gösterdi. Bu multilamellar veziküller küçük nanopartiküllerin üretimine yol açabilir lipozom hidrasyon, sonrasında kendiliğinden oluşması dikkat etmek önemlidir. Bu küçük multilamellar veziküller kaçınılmaz olarak büyük bir filtre gözenek tarafından üretilen ünilamellar veziküllerin çözümleri heterojenite neden büyük polikarbonat membran gözen...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma Howard Hughes Tıp Enstitüsü (HHMI) Ortak İnovasyon Ödülü ile desteklenmiştir. LAM Sinyali ve Sağlık eğitim bursu Hücresel Yönetmeliği Ulusal Enstitüsü (T32 GM008759) ve NIH Ruth L. Kirschstein Ön Doktora Sonrası (CA165349-01) tarafından desteklenmiştir. Biz onların değerli yorumları için Prof Michael Stowell (CU Boulder), Prof Douglas Rees ve Prof Rob Phillips (Caltech) teşekkür etmek istiyorum.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| Kloroform | Sigma-Aldrich | 02.432-25ml | % 95 stabilizatörler |
| Yüksek Dereceli Metanol | Sigma-Aldrich | 179.337-4L | |
| Liposofast LF-50 Extruder | Avestin, Inc | ||
| Fosfolipidler | Avanti Polar Lipidler | ||
| Polikarbonat Gözenekler | Avestin, Inc | 25 mm çapında | |
| Diskler PE boşaltın | Avestin, Inc | 230600 | 25 mm çapında |
Referanslar
- Connor, J., Bucana, C., Fidler, I. J., Schroit, A. J. Differentiation-dependent expression of phosphatidylserine in mammalian plasma membranes: quantitative assessment of outer-leaflet lipid by prothrombinase complex formation. Proc. Natl. Acad. Sci. U.S.A. 86, 3184-3188 (1989).
- Smith, S. A., Morrissey, J. H. Rapid and efficient incorporation of tissue factor into liposomes. J. Thromb. Haemost. 2, 1155-1162 (2004).
- Hui, E., Johnson, C. P., Yao, J., Dunning, F. M., Chapman, E. R. Synaptotagmin-mediated bending of the target membrane is a critical step in Ca(2+)-regulated fusion. Cell. 138, 709-721 (2009).
- Loughrey, H. C., Choi, L. S., Cullis, P. R., Bally, M. B. Optimized procedures for the coupling of proteins to liposomes. J. Immunol. Methods. 132, 25-35 (1990).
- Mui, B., Chow, L., Hope, M. J. Extrusion technique to generate liposomes of defined size. Methods Enzymol. 367, 3-14 (2003).
- Gruner, S. M., Cullis, P. R., Hope, M. J., Tilcock, C. P. Lipid polymorphism: the molecular basis of nonbilayer phases. Annu. Rev. Biophys. Biophys. Chem. 14, 211-238 (1985).
- Guven, A., Ortiz, M., Constanti, M., O'Sullivan, C. K. Rapid and efficient method for the size separation of homogeneous fluorescein-encapsulating liposomes. J. Liposome. Res. 19, 148-154 (2009).
- Zimmerberg, J., Kozlov, M. How proteins produce cellular membrane curvature. Nature Reviews Molecular Cell Biology. 7, 9-19 (2006).
- Chonn, A., Cullis, P. R. Recent advances in liposomal drug-delivery systems. Curr. Opin. Biotechnol. 6, 698-708 (1995).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochim. Biophys. Acta. 858, 161-168 (1986).
- Matsuoka, K., Schekman, R. The use of liposomes to study COPII- and COPI-coated vesicle formation and membrane protein sorting. Methods. 20, 417-428 (2001).
- Dragovic, R. A., Gardiner, C., Brooks, A. S., Tannetta, D. S., Ferguson, D., Hole, P., Carr, B., Redman, C., Harris, A. L., Dobson, P. J., Harrison, P., Sargent, I. L. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine. , (2011).
- Hunter, D. G., Frisken, B. J. Effect of extrusion pressure and lipid properties on the size and polydispersity of lipid vesicles. Biophys J. 74, 2996-3002 (1998).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır