A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שחול קבוע לחץ שבשליטת שיטה להכנת בגודל ננו שלפוחית שומנים
In This Article
Summary
פרוטוקול זה מתאר שיטה שחול להכנת שלפוחית השומנים של מיקרון משנה גדלים עם רמה גבוהה של הומוגניות. שיטה זו משתמשת במערכת לחץ מבוקר עם מבוקרים זרימת שיעורי חנקן להכנת liposome. הכנה שומנים בדם 1,2, שיחול liposome, ואפיון גודל יוצגו להלן.
Abstract
ליפוזומים הם בועיות שהוכנו באופן מלאכותי המורכב פוספוליפידים טבעיים וסינתטיים הנמצאים בשימוש נרחב כמו קרום התא מחקה פלטפורמת ללמוד חלבונים חלבונים חלבונים שומנים בדם אינטראקציות 3, משלוח צג התרופה 4,5, ו 4 אנקפסולציה. פוספוליפידים באופן טבעי ליצור bilayers השומנים מעוקלים, להבדיל את עצמו מן micelle. 6 ליפוזומים מסווגים באופן מסורתי על ידי גודל ומספר bilayers, כלומר שלפוחית unilamellar גדולות ('לאב'), שלפוחית unilamellar קטנים (רכבי השטח) ואת שלפוחית multilamellar (MLVs) 7. בפרט, הכנת ליפוזומים הומוגניות בגדלים שונים, חשוב ללמוד עקמומיות קרום זה ממלא תפקיד חיוני איתות התא, אנדו ו-exocytosis, איחוי קרום, וסחר חלבון 8. מספר קבוצות לנתח כיצד חלבונים משמשים לווסת את התהליכים הכרוכים עקמומיות הממברנה ובכך להכין ליפוזומים בקטרים של פחות מ -100 - 400ננומטר ללמוד את ההתנהגות שלהם על פונקציות התא 3. אחרים מתמקדים אנקפסולציה liposome תרופות, לומד ליפוזומים כלי רכב לבצע ולספק סמים עניין 9. אנקפסולציה התרופה ניתן להשיג כפי שדווח במהלך היווצרות liposome 9. צעד שחול שלנו לא אמור להשפיע על התרופה Encapsulated משתי סיבות, כלומר (1) אנקפסולציה התרופה צריכה להיות מושגת לפני השלב הזה (2) ליפוזומים צריך לשמור על יציבות biophysical הטבעי שלהם, באופן מאובטח נושאת את התרופה הליבה מימית. מטרות אלה מחקר נוסף מצביעים על הצורך שיטת אופטימיזציה לעצב יציבים מיקרון משנה שלפוחית השומנים.
עם זאת, הטכנולוגיות הנוכחיות הכנה liposome (sonication 10, הקפאת-and-ההפשרה 10, שקיעה) לא מאפשרים הכנה של ליפוזומים עם משטח עקום מאוד (כלומר <בקוטר 100 ננומטר) עם עקביות יעילות גבוהה 10,5, אשר מגביל את biophysical מחקרים של emergiבתחום ng של חישה עקמומיות קרום. כאן, אנו מציגים שיטת הכנה חזק עבור מגוון רחב של ליפוזומים רלוונטיות מבחינה ביולוגית.
שחול ידני באמצעות גז חזק מזרקים וממברנות פוליקרבונט 10,5 היא מנהג נפוץ אך ההטרוגניות הוא נצפה לעיתים קרובות בעת השימוש גדלים הנקבוביות פחות מ -100 ננומטר בשל בשל השתנות של לחץ ידני מיושם. העסקנו מנגנון קבוע לחץ שבשליטת שחול להכין ליפוזומים סינתטיים אשר בקטרים לנוע בין 30 ל 400 ננומטר. פיזור אור דינאמי (DLS) 10, 11 ו במיקרוסקופ אלקטרונים Nanoparticle מעקב וניתוח (נ.ת. ע) 12 שימשו כדי לכמת את גודל liposome כמפורט בפרוטוקול שלנו, עם קלקר מסחרי (PS) חרוזים ששימשו כסטנדרט כיול. קשר ליניארי ליד נצפתה בין גודל הנקבוביות מועסק על ליפוזומים נקבע באופן ניסיוני, המעיד על איכות גבוהה של הכנה שלנו לחץ שבשליטת liposome נפגשוהוד. יתר על כן, הראינו כי שלפוחית שומנים שיטת הכנת חלה באופן כללי, ללא תלות בגודל liposome שונים. לבסוף, אנו הוכיחו גם במחקר כמובן אז אלה ליפוזומים מוכנים היו יציבים עד 16 שעות. פרוטוקול נציג בגודל ננו הכנה liposome באה לידי ביטוי בהמשך.
Protocol
1. Liposome הכנה
- אחזור בקבוקון 20 מ"ל עם מכסה זכוכית מצופה טפלון.
- יש לנקות את כל כלי זכוכית מזרקים עם כלורופורם לפני השימוש כדי למנוע זיהום.
- העברת 100 μL של כלורופורם כיתה מגיב על בקבוקון זכוכית באמצעות מזרק 250 μL אוויר חזק זכוכית.
- הוסף 30 μL של מתנול כיתה מגיב על בקבוקון זכוכית אותו באמצעות מזרק 100 μL אוויר חזק זכוכית.
- להכין 2 7:1.5:1.5 mM phosphatidylcholine (POPC): phosphatidylethanolamine (האפיפיור): פתרון שומנים וכולסטרול, להעביר 216 μL של 10 מ"ג / מ"ל POPC, 42 μL של μL מ"ג / מ"ל האפיפיור 20 10 של 11 מ"ג / מ"ל פתרונות הכולסטרול CHCl 3 עד 20 מ"ל בקבוקון זכוכית.
- לאדות את ממיסים אורגניים באמצעות איטי זרימת ארגון או גז חנקן עד שכבה דקה של שומנים הוא ציין בתחתית בקבוקון.
- מניחים את בקבוקון זכוכית כיפה בתוך תא ייבוש ואקום לפחות 30 דקות להסיר ממס שיורי.
- TRansfer 2 מ"ל של המאגר, עברה בעבר דרך 0.2 מיקרון המסנן, כדי בקבוקון זכוכית מימה את השומנים.
- דגירה את התערובת על 4 מעלות צלזיוס במשך הלילה ולהשתמש תוך 48 שעות.
2. Freeze-and-הפשרה: עבור גדלים liposome של 30 - 100 ננומטר בלבד
- להקפיא את ההשעיה liposome בחנקן נוזלי למשך 15 שניות.
- להפשיר ההשעיה liposome באמצעות אבן חימום על 42 מעלות צלזיוס בטמפרטורה של ~ 3 דקות.
- חזור על שלבים 2.1 ו -2.2 עבור סכום כולל של 5 מחזורים.
3. שחול
בצע את ההוראות Avestin כראוי להרכיב extruder Liposofast LF-50, באמצעות מכשיר מתאר בספר המדריך שלהם.
- מניחים את חור גדול תמיכה המסך (עם חורים עגולים) בבסיס התמיכה מסנן, ואחריה המנה sintered עגול (בלי חורים), 1 דיסק הניקוז (25 מ"מ קוטר), ואחד פוליקרבונט קרום (25 מ"מ קוטר).
- מניחים את קטן, שחורO-טבעת על גבי הממברנה על מנת לאבטח אותו לבסיס תמיכה הסינון.
- צרף extruder מסנן למעלה הידוק 4 ברגים ב 4 חורים המתאימים.
- להרכיב את יחידת extruder מסנן מתחת לחבית מכבש גדול. מוסיפים את הפתרון liposome כדי לחבית גליל. מניחים את הפעולות הבאות על גבי חבית שיחול על מנת: עגול גדול O-טבעת, כובע צר, גדול עגול O-טבעת, כובע עגול.
- צרף הרגולטור גז לראש לחבית extruder וסגור את כל השסתומים כדי למנוע דליפת אוויר, כולל שסתום הקלה בלחץ. מניחים צנצנת זכוכית 20 מ"ל או 50 מ"ל בבקבוק Erlenmeyer תחת יחידת extruder הסינון. שסתום הבטיחות מחובר הרגולטור ואת תשחרר אם הלחץ עולה על 600 psi. הפעלת גז חנקן לפתוח את שסתום הגז מחובר extruder.
- להגביר את הלחץ חנקן ל -25 PSI ל 400 ננומטר, ליפוזומים 125 תע"ח של 100 ננומטר, ליפוזומים ו תע"ח 400-500 עבור 30 ננומטר ליפוזומים.
- לצפות לכל חש liposomeension כפי שהוא פולט לתוך המיכל תוך נדחף על ידי חנקן. שמור חנקן זורם עד שאתה כבר לא צופים כל עובר הנוזל דרך פילטר extruder לתוך בקבוקון זכוכית.
4. פיזור אור דינאמי (DLS) ניתוח
- הכן 50 μL של פתרון liposome 20 מיקרומטר.
- הפעל את מקור הכוח מקור המנורה.
- פתח את תוכנת DynaPro.
- להגדיר את התוכנה למודל MS / X האלגוריתם לזהות ליפוזומים של 30 ננומטר ו -100 ננומטר MS800 מודל אלגוריתם לזיהוי> 100 ליפוזומים ננומטר.
- חיבור החומרה.
- 14 Pipet μL המדגם liposome אל קובט הוספה קוורץ לתוך המחזק את התא.
- לחץ על התחל.
- לחץ להפסיק אחרי ~ 20 - 30 רכישות.
- ניתוח הפסגות הממוצע בקוטר liposome שנרשמו על ההיסטוגרמה.
5. Nanoparticle מעקב וניתוח (נ.ת. ע)
- הכן μL 500, 0.1 מיקרומטר liposomeפתרון.
- יש לשטוף את תא המדגם עם מים ואתנול.
- לייבש את תא מדגם במגבת נטולת מוך נייר.
- הפעל את מקור לייזר כוח המחשב.
- לספק 300 μL של פתרון 0.1 מיקרומטר liposome לתא המדגם.
- פתח את בקרת טמפרטורה Nanoparticle מעקב תוכנת ניתוח.
- לחץ לכידת כדי להפעיל את הלייזר.
- השתמש התאמות אופקיים ואנכיים לעבור לשלב ולהתאים את המיקוד מיקרוסקופ.
- קבע את הטמפרטורה הרצויה (20 מעלות) וזמן ההקלטה (לפחות 30 שניות).
- לחצו על כפתור ההקלטה לקחת מסגרות של תמונות רבות של חלקיקים liposome עבור כמות מוגדרת של זמן. לנתח את פסגות המתאימים גדלים liposome בקוטר על ההיסטוגרמה כפי שהוא עוקב אחר התנועה של כל חלקיק.
6. נציג תוצאות
תכנית מתאר שיטה שחול הוא pהתרעם באיור 1. כדי להשיג תוצאות אופטימליות, הכנת ליפוזומים עם קוטר של 30 ננומטר דורש לחץ גבוה של ~ 500 psi ו בקטרים של 100 ננומטר דורש הלחץ של 125 psi להשיג קצב הסינון מהירה. עבור קוטר של 400 ננומטר, לחץ נמוך של 25 PSI ~ מומלץ להשיג שיעור הסינון איטי יותר, המאפשר להאריך את שלפוחית ויוצרים גדולים יותר, ליפוזומים הומוגניות. ערכנו סדרת ניסויים כדי לקבוע את הלחץ האופטימלי להפקת עקביות מיקרון משנה גודל שלפוחית. אנחנו מגוונים את הלחץ, כמו גם את מספר שחול עובר דרך מסננים פוליקרבונט עם הגדלים הנקבוביות של 30, 100, ו -400 ננומטר וגילה הלחץ המתאים לכל גודל רצוי. במשך 30 ננומטר הנקבוביות, לחץ להלן 500 psi יקטין את קצב הזרימה, גרימת התארכות וגדלים שלפוחית ובכך גדולים יותר. עבור 100 ננומטר הנקבוביות, זרם קבוע הושגה ב 125 psi. עבור 400 ננומטר הנקבוביות, בלחץ נמוך (25 psi) מאפשר שלפוחית כדי להאריך לתוך שלפוחית גדולה יותר שלizes. זרימה איטית ירידה מבחינת סינון רצוי ליצור יותר משנה מיקרון שלפוחית 13.
ביצענו DLS כדי לקבוע את גודל liposome משוחלים דרך בשלוש מידות קוטר שונות, כלומר 30, 100 ו -400 ננומטר. DLS היא שיטה הוקמה שאוסף אור מפוזרות כדי לקבוע את קוטר החלקיקים. אנחנו ליפוזומים hydrated משוחלים של 2 מ"מ דרך הממברנה פוליקרבונט 30 ננומטר ב 500 psi עם 5 עובר דרך נקבוביות המסנן: 100 ננומטר פוליקרבונט קרום על 125 psi עם 5 עובר דרך נקבוביות המסנן 400 ננומטר קרום פוליקרבונט ב 25 psi עם 2 עובר דרך הנקבוביות את המסנן. את קוטר של ליפוזומים ומדד ידי DLS עבור 30, 100 ו 400 ננומטר גודל הנקבוביות היו 66 ± 28, 138 ± 18 360 ± 25 ננומטר (איור 2). ההשעיה של 50 ננומטר חרוזי פוליסטירן שימש תקן כיול כפי שמוצג באיור 2, שם נרשם קוטר של 47 ± 16 nm. Polydispe אחוזיםrsity מראה כי אין חפיפה בתוך בגדלים liposome. זה אופייני לצפות בקטרים גבוהים יותר מ -30 ננומטר, כאשר באמצעות ניתוח DLS בשל הטיה ידועה המכשיר הזה יש חלקיקים גדולים יותר לכיוון 12. עוצמות ופיזור אור מכדור חלקיקים גדולים וקטנים נאספים בו זמנית משיטה אחת זיהוי ולכן קשה יותר לפתור ליפוזומים בתרחיף 12. למרות מגבלה זו סייעה, עקומת כיול מתאר קשר לינארי הקרוב.
נ.ת. ע היא טכנולוגיה חדשה אשר מודד את הגודל של כל חלקיק מן התצפיות הישירות של דיפוזיה בתווך נוזלי, עצמאית של מדד החלקיקים השבירה או צפיפות. טכניקה זו ברזולוציה גבוהה יכול לשמש כדי להשלים את המדידה של ליפוזומים עם DLS. נ.ת. ע רשם קוטר של 95 ± 48 ו - 356 ± 51 ננומטר, שני 100 ננומטר ו -400 ננומטר פוליסטירן פתרונות שימשו לצורך כיול. בתמיסות של 30 ננומטר ו -100 ננומטר נצפו להיות comp יותר קוטר לעיבוד יחסית DLS כפי שמוצג באיור 3, ייצור בגדלים ממוצעים של 29 ± 14, 95 ו - 17 ± 359 ± 73 ננומטר. נ.ת. ע עשוי להיות טכניקה אפיון כללי יותר לכמת חלקיקים מיקרוסקופיים מאז הרגישות שלה מאפשרת לה למדוד חלקיקים של 50 - 1000 ננומטר. עקומת הכיול מראה קשר לינארי בין נקבוביות הממברנה פוליקרבונט לעומת בקוטר נ.ת. ע מוקלט.
| Liposome גדלים | זיהוי סף | צפוי החלקיקים מינימום גודל (ננומטר) |
| 30 ננומטר | 11 | 30 |
| 100 ננומטר | 11 | 100 |
| 400 nm | 21 | 400 |
טבלה 1. פרמטרים NanoSight.
ad/4151/4151fig1.jpg "/>
באיור 1. תרשים זרימה של השיטה שחול, המתאר כיצד הלחץ ואת זרימת החנקן שולט ההומוגניות של קטרים liposome שונים. לאחר הידרציה liposome, שלפוחית unilamellar בגדלים שונים נמתחים דרך שונים פוליקרבונט נקבוביות הממברנה הסינון בלחצים שונים.
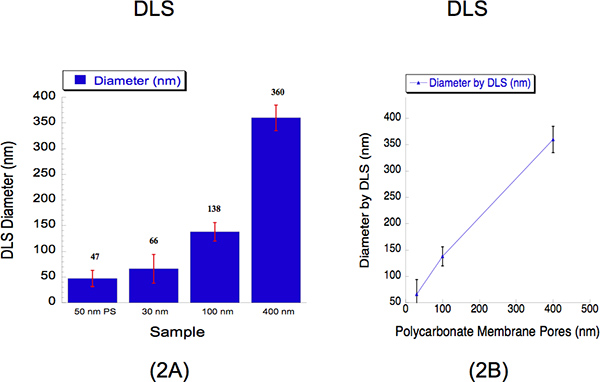
איור 2. דינמי פיזור אור (DLS) נתונים המתארים את גודל liposome כמותיים לאחר שחול. (א) גרפים בר מוצגים לתאר את קוטר של שלוש דגימות liposome. סטנדרט כיול של 50 ננומטר פוליסטירן (PS) חרוזים שימש כנקודת התייחסות. בקטרים את liposome הממוצע מסומנים מעל שורת עבור מדגם זה. ציר X מתאר את גודל הנקבוביות אשר הפתרונות היו extruded דרך. ציר y מתאר את קוטר נרשם על ידי DLS. למרות 30 ננומטר ו 100 בגדלים שיא ננומטראד ערכים גבוהים יותר מאשר גודל הנקבוביות שלהם בזמן גדול יותר בגודל 400 ננומטר רשמה בגודל מעט נמוך יותר, עקומת כיול (ב) מציג קשר לינארי הקרוב, שבו ציר x מבטא את נקבוביות הממברנה גדלים פוליקרבונט, ואת ציר y מתאר רשמה בקוטר liposome על ידי DLS.

3. איור Nanoparticle מעקב ניתוח (נ.ת. ע) נתונים המתארים את גודל liposome לאחר שחול. (א) גרפים בר לייצג את הקוטר של מדגם זה liposome. ציר X מתאר את גודל הנקבוביות אשר הפתרונות היו extruded דרך. ציר y מתאר את קוטר גודל נרשם על ידי נ.ת. ע. בקטרים את liposome הממוצע מסומנים מעל מדגם זה. (ב) עקומת כיול נ.ת. ע מראה קורלציה ליניארית יותר עקומת כיול DLS בין הנקבובית גדלים סינון הממברנה לעומת בקוטר מוקלט. ציר X מתאר את נקבוביות הממברנה גדלים פוליקרבונט. ציר y מתאר את קוטר liposome נרשם על ידי נ.ת. ע.
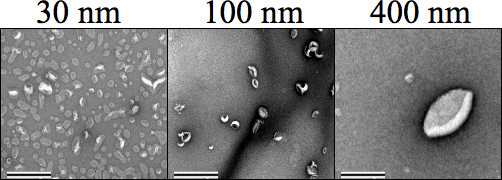
איור 4. שליליות כתם במיקרוסקופ אלקטרונים הילוכים (TEM) תמונות המציגות כל אחת בגודל liposome (500 מיקרומטר) ואחריו שחול. פחמן Formvar רשתות רשת שוחררו לרעה לפני מכתים המדגם, שם אצטט Uranyl 1% במים נעשה שימוש כדי להכתים את דגימות לפני ייבוש הדמיה בהגדלה 34000 ×. מידות 30, 100, ו -400 ננומטר הם בבירור ברורה זה מזה. ההגדלה נקבע × 25000. בר מייצגת בהיקף 0.5 מיקרומטר.
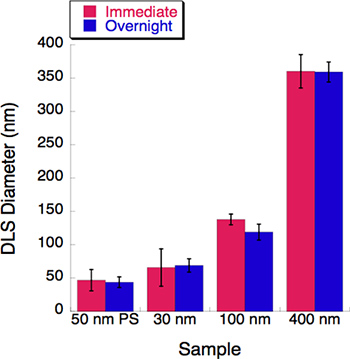
איור 5. הניסוי בזמן הקורס נערך עם שלושה גדלים liposome. פיזור אור דינאמי (DLS) נמדד עבור כל פתרון liposome שחול הבאה מיד. כל פתרונות liposome אוחסנו 4 °ג לילה. בקטרים שלהם נרשמו על ידי DLS לאחר הדגירה לילה. קצת שינוי לא נצפתה לאחר תקופה 16 שעות דגירה.
Access restricted. Please log in or start a trial to view this content.
Discussion
שימוש Liposofast Avestin LF-50 extruder, הראינו עד כמה קטן בגודל, ליפוזומים מלאכותיים מוכנים באמצעות מערכת לחץ מבוקר. חשוב לציין כי שלפוחית multilamellar ליצור באופן ספונטני לאחר הידרציה liposome, מה שעשוי להוביל לייצור של חלקיקים קטנים יותר. אלו שלפוחיות קטנות multilamellar בהכרח לזרום גודל גד?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
עבודה זו נתמכה על ידי הווארד יוז רפואי במכון (HHMI) בפרס חדשנות שיתופית. לאם נתמך על ידי איתות נייד תקנה המכון הלאומי לבריאות אימון מענק (T32 GM008759) ואת רות NIH ל Kirschstein קדם דוקטורט (CA165349-01). אנו רוצים להודות פרופ 'מיכאל Stowell (CU Boulder), פרופ' דאגלס ריס ופרופ 'רוב פיליפס (קלטק) להערות יסולא בפז שלהם.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| כלורופורם | Sigma-Aldrich | 02432-25ML | 95% מייצבים |
| מתנול ציון גבוה | Sigma-Aldrich | 179337-4L | |
| Extruder Liposofast LF-50 | Avestin, Inc | ||
| פוספוליפידים | AVANTI ליפידים פולאר | ||
| פוליקרבונט הנקבוביות | Avestin, Inc | 25 מ"מ קוטר | |
| מסננים דיסקים PE | Avestin, Inc | 230600 | 25 מ"מ קוטר |
References
- Connor, J., Bucana, C., Fidler, I. J., Schroit, A. J. Differentiation-dependent expression of phosphatidylserine in mammalian plasma membranes: quantitative assessment of outer-leaflet lipid by prothrombinase complex formation. Proc. Natl. Acad. Sci. U.S.A. 86, 3184-3188 (1989).
- Smith, S. A., Morrissey, J. H. Rapid and efficient incorporation of tissue factor into liposomes. J. Thromb. Haemost. 2, 1155-1162 (2004).
- Hui, E., Johnson, C. P., Yao, J., Dunning, F. M., Chapman, E. R. Synaptotagmin-mediated bending of the target membrane is a critical step in Ca(2+)-regulated fusion. Cell. 138, 709-721 (2009).
- Loughrey, H. C., Choi, L. S., Cullis, P. R., Bally, M. B. Optimized procedures for the coupling of proteins to liposomes. J. Immunol. Methods. 132, 25-35 (1990).
- Mui, B., Chow, L., Hope, M. J. Extrusion technique to generate liposomes of defined size. Methods Enzymol. 367, 3-14 (2003).
- Gruner, S. M., Cullis, P. R., Hope, M. J., Tilcock, C. P. Lipid polymorphism: the molecular basis of nonbilayer phases. Annu. Rev. Biophys. Biophys. Chem. 14, 211-238 (1985).
- Guven, A., Ortiz, M., Constanti, M., O'Sullivan, C. K. Rapid and efficient method for the size separation of homogeneous fluorescein-encapsulating liposomes. J. Liposome. Res. 19, 148-154 (2009).
- Zimmerberg, J., Kozlov, M. How proteins produce cellular membrane curvature. Nature Reviews Molecular Cell Biology. 7, 9-19 (2006).
- Chonn, A., Cullis, P. R. Recent advances in liposomal drug-delivery systems. Curr. Opin. Biotechnol. 6, 698-708 (1995).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochim. Biophys. Acta. 858, 161-168 (1986).
- Matsuoka, K., Schekman, R. The use of liposomes to study COPII- and COPI-coated vesicle formation and membrane protein sorting. Methods. 20, 417-428 (2001).
- Dragovic, R. A., Gardiner, C., Brooks, A. S., Tannetta, D. S., Ferguson, D., Hole, P., Carr, B., Redman, C., Harris, A. L., Dobson, P. J., Harrison, P., Sargent, I. L. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine. , (2011).
- Hunter, D. G., Frisken, B. J. Effect of extrusion pressure and lipid properties on the size and polydispersity of lipid vesicles. Biophys J. 74, 2996-3002 (1998).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved