Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Constant procédé d'extrusion-pression contrôlée pour la préparation de vésicules lipidiques de taille nanométrique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit un procédé d'extrusion pour la préparation des vésicules lipidiques de tailles submicroniques avec un haut degré d'homogénéité. Cette méthode utilise un système de pression contrôlée avec contrôle des débits d'azote pour la préparation des liposomes. La préparation lipidique 1,2, L'extrusion des liposomes, et caractérisation de la taille sera présenté ici.
Résumé
Les liposomes sont des vésicules préparées artificiellement constitués de phospholipides naturels et synthétiques qui sont largement utilisés comme une plate-forme de la membrane cellulaire mimant d'étudier protéine-protéine et protéine-lipide interactions 3, l'administration de médicaments moniteur 4,5, et l'encapsulation 4. Les phospholipides naturellement créer bicouches lipidiques courbes, en se distinguant d'une micelle. 6 liposomes sont traditionnellement classés par taille et le nombre de bicouches, c'est à dire de grandes vésicules unilamellaires (LUV), de petites vésicules unilamellaires (SUV) et des vésicules multilamellaires (MLV) 7. En particulier, la préparation des liposomes homogènes de différentes tailles est important pour l'étude de la courbure membranaire qui joue un rôle essentiel dans la signalisation cellulaire, endocytose et exocytose, la fusion membranaire, et 8 le trafic de protéines. Plusieurs groupes d'analyser comment les protéines sont utilisés pour moduler les processus qui impliquent courbure de la membrane et donc préparer des liposomes de diamètres <100 - 400nm à étudier leur comportement sur les 3 fonctions cellulaires. D'autres se concentrent sur les liposomes de drogue encapsulation, l'étude des liposomes comme véhicules pour transporter et de livrer une drogue d'intérêts 9. Encapsulation des drogues peut être réalisé comme indiqué lors de la formation des liposomes 9. Notre étape d'extrusion ne devrait pas affecter le médicament encapsulé pour deux raisons, à savoir l'encapsulation des médicaments (1) devrait être atteint avant cette étape et (2) des liposomes devraient conserver leur stabilité naturelle biophysique, en toute sécurité de transport de la drogue dans le cœur aqueux. Ces objectifs de recherche suggèrent en outre la nécessité d'une méthode optimisée pour concevoir stables vésicules lipidiques sub-micronique.
Néanmoins, les technologies actuelles de préparation des liposomes (sonication 10, gel-dégel et 10, sédimentation) ne permettent pas de préparation de liposomes avec une surface très incurvée (c.-à-diamètre <100 nm) avec une cohérence et une efficacité élevées 10,5, ce qui limite la biophysique études d'un Emergichamp ng de détection de courbure de membrane. Ici, nous présentons une méthode de préparation robuste pour une variété de liposomes biologiquement pertinentes.
Extrusion manuelle à l'aide de gaz étanches seringues et des membranes en polycarbonate 10,5 est une pratique courante, mais l'hétérogénéité est souvent observée lors de l'utilisation des tailles de pores inférieur à 100 nm en raison de raison de la variabilité de la pression manuelle appliquée. On a utilisé une installation d'extrusion de pression constante contrôlée de synthèse pour préparer des liposomes dont les diamètres compris entre 30 et 400 nm. Diffusion de la lumière dynamique (DLS) 10, 11 et microscopie électronique à l'analyse de suivi de nanoparticules (NTA) 12 ont été utilisés pour quantifier les tailles des liposomes comme décrit dans notre protocole, avec du polystyrène du commerce (PS) billes utilisées comme étalon. Une corrélation quasi linéaire a été observée entre les tailles des pores travailleurs et les liposomes déterminées expérimentalement, ce qui indique une grande fidélité de notre pression contrôlée préparation de liposomes a rencontréhod. En outre, nous avons montré que cette méthode de préparation lipidique des vésicules est généralement applicable, indépendamment de diverses tailles des liposomes. Enfin, nous avons aussi démontré dans une étude bien sûr du temps que ces liposomes préparés ont été stables pendant jusqu'à 16 heures. Un représentant de taille nanométrique protocole de préparation des liposomes est démontré ci-dessous.
Protocole
1. Préparation de liposomes
- Récupérer un flacon de 20 ml en verre avec un bouchon de téflon.
- Nettoyez toute la verrerie et des seringues avec du chloroforme avant de l'utiliser pour prévenir la contamination.
- Transférer 100 ul de chloroforme de qualité réactif dans le flacon de verre en utilisant une seringue 250 ul de verre étanche à l'air.
- Ajouter 30 uL de méthanol de qualité réactif dans le flacon de verre en utilisant une même seringue de 100 ul de verre étanche à l'air.
- Pour préparer un 2 mM 7:1.5:1.5 phosphatidylcholine (POPC): phosphatidyléthanolamine (PAPE): solution de lipide de cholestérol, de transférer 216 ul de 10 mg / ml POPC, 42 ul de 10 uL mg / ml et 20 PAPE de 11 mg / ml des solutions de cholestérol dans CHCl 3 à la fiole de 20 ml en verre.
- Évaporer les solvants organiques en utilisant lente débit d'argon ou d'azote jusqu'à ce qu'une fine pellicule de lipides est observée sur le fond du flacon.
- Placez le flacon en verre non plafonnés dans un dessiccateur à vide pendant au moins 30 minutes pour éliminer le solvant résiduel.
- Transfer 2 mL de tampon, préalablement passés à travers un filtre de 0,2 micron, de l'ampoule de verre pour hydrater les lipides.
- Incuber le mélange à 4 ° C pendant la nuit et utiliser dans les 48 heures.
2. Gel-et-dégel: Pour les tailles de liposomes de 30 - 100 nm seulement
- Congeler suspension de liposomes dans l'azote liquide pendant 15 secondes.
- Décongeler suspension de liposomes à l'aide d'un bloc de chauffage à 42 ° C de la température pour environ 3 minutes.
- Répétez les étapes 2.1 et 2.2 pour un total de 5 cycles.
3. Extrusion
Suivez les instructions AVESTIN à assembler correctement le LiposoFast LF-50 extrudeuse, en utilisant le contour instrument dans leur guide.
- Placer l'écran large trou de support (avec des trous circulaires) dans la base de support de filtre, suivie par l'antenne circulaire fritté (sans trous), un disque de drain (25 mm de diamètre), et une membrane de polycarbonate (25 mm de diamètre).
- Placez le petit, noirTorique sur le dessus de la membrane pour le fixer à la base de support de filtre.
- Fixez l'extrudeuse dessus du filtre en serrant les 4 vis dans les 4 trous correspondants.
- Assembler l'unité de filtre à l'extrudeuse sous le cylindre d'extrudeuse grande. Ajouter la solution de liposomes à l'barillet. Placez le suivant sur le dessus du cylindre d'extrusion dans l'ordre: grand cercle O-ring, casquette étroite, grand cercle O-ring, chapeau circulaire.
- Attacher le régulateur de gaz au début cylindre d'extrudeuse et fermer toutes les vannes pour empêcher les fuites d'air, y compris la soupape de surpression. Placer un flacon en verre de 20 ml ou 50 ml Erlenmeyer en vertu de l'unité d'extrusion de filtre. Une soupape de sûreté est reliée au régulateur et se libérer en cas de pression supérieure à 600 psi. Allumer le gaz azote et ouvrir la vanne de gaz relié à l'extrudeuse.
- Augmenter la pression d'azote à 25 psi pour 400 nm, liposomes 125 psi pour 100 nm, et des liposomes psi 400-500 pour 30 liposomes nm.
- Regarder la susp liposomeension qu'il éjecte dans le récipient en étant poussé par l'atome d'azote. Gardez le courant d'azote jusqu'à ce que vous ne respecterait plus aucun liquide passant à travers le filtre extrudeuse dans le flacon en verre.
4. Dynamic Light Scattering (DLS) Analyse
- Préparer 50 ul d'une solution à 20 uM liposome.
- Allumez la source d'alimentation et la source de la lampe.
- Ouvrez le logiciel DynaPro.
- Réglez le logiciel pour le modèle algorithme MS / X pour détecter des liposomes de 30 nm et 100 nm et MS800 modèle algorithme pour détecter plus de 100 nm liposomes.
- Connectez-vous à du matériel.
- Pipeter 14 uL d'échantillon liposome dans la cuvette de quartz et de l'insérer dans le support de cellule.
- Appuyez sur start.
- Appuyez sur stop après environ 20 - 30 acquisitions.
- Analyser les pics diamètre moyen des liposomes enregistrées sur l'histogramme.
5. Analyse de suivi des nanoparticules (NTA)
- Préparer un pl 500, 0,1 uM liposomeSolution.
- Rincez le compartiment à échantillons avec de l'eau et l'éthanol.
- Séchez le compartiment échantillon avec une serviette en papier non pelucheux.
- Allumez la source laser de puissance et de l'ordinateur.
- Livrer 300 ul de 0,1 solution de liposomes uM à le compartiment à échantillons.
- Ouvrez le contrôle de la température et le logiciel d'analyse des nanoparticules de suivi.
- Appuyez sur le bouton Capture pour allumer le laser.
- Utilisation des réglages horizontaux et verticaux pour déplacer la scène et ajuster la mise au point du microscope.
- Régler la température désirée (20 ° C) et temps d'enregistrement (au moins 30 secondes).
- Appuyez sur le bouton Enregistrer pour prendre cadres multiples des particules de liposome pour un montant de temps spécifiée. Analyser les pics correspondant aux diamètres de liposomes sur l'histogramme comme il suit le mouvement de chaque particule.
6. Les résultats représentatifs
Un schéma décrivant le procédé d'extrusion est psont représentés dans la figure 1. Pour obtenir un résultat optimal, la préparation de liposomes avec des diamètres de 30 nm nécessite une haute pression d'environ 500 psi et un diamètre de 100 nm nécessite une pression de 125 psi à atteindre un taux rapide de filtre. Pour des diamètres de 400 nm, une basse pression de ~ 25 psi est recommandée pour obtenir un taux plus lent filtre, ce qui permet à des vésicules allongé et former des liposomes, des plus grandes homogènes. Nous avons effectué une série d'expériences pour déterminer la pression optimale pour la production d'uniformes tailles des vésicules sub-micronique. On fait varier la pression ainsi que le nombre de filtres passe à travers l'extrusion de polycarbonate avec des tailles de pores de 30, 100 et 400 nm et découvert pression appropriée pour chaque taille souhaitée. Pendant 30 pores nm, une pression inférieure à 500 psi à réduire le taux d'écoulement, provoquant un allongement et tailles plus grandes vésicules ainsi. Pour 100 nm pores, un flux constant a été réalisé à 125 psi. Pour 400 nm pores, à basse pression (25 psi) permet les vésicules à allongé en plus des vésicules sIzes. Un débit de filtration lente goutte à goutte est optimale pour créer plus sub-micronique vésicules 13.
Nous avons effectué DLS pour déterminer les tailles des liposomes extrudées à travers trois diamètres différents, à savoir 30, 100 et 400 nm. DLS est une méthode établie qui recueille la lumière diffusée afin de déterminer le diamètre de particule. Nous extrudés liposomes hydratés de 2 mM à travers une membrane en polycarbonate nm 30 à 500 psi avec 5 passes à travers le filtre avec des pores, une membrane de polycarbonate de 100 nm à 125 psi avec 5 passes à travers le filtre avec des pores et une membrane en polycarbonate de 400 nm à 25 psi avec 2 passe à travers le filtre avec des pores. Les diamètres des liposomes et mesurées par DLS pour 30, 100 et 400 nm tailles de pores étaient de 66 ± 28, 138 ± 18 et 360 ± 25 nm (Figure 2). Une suspension de 50 billes de polystyrène nm a été utilisé comme étalon comme le montre la figure 2, où il a enregistré un diamètre de 47 ± 16 nm. Le polydispe pour centrsité montre qu'il n'y a pas de chevauchement dans les tailles des liposomes. Il est typique d'observer diamètres supérieurs à 30 nm en utilisant l'analyse DLS en raison de la partialité connue de cet instrument a les plus grosses particules vers 12. Intensités diffusion de la lumière à partir de particules grandes et petites sont collectées simultanément à partir d'une méthode de détection et donc plus difficiles à résoudre des liposomes en suspension 12. Malgré cette limitation instrumentale, la courbe d'étalonnage décrit une corrélation presque linéaire.
NTA est une technologie qui mesure la taille de chaque particule de l'observation directe de la diffusion dans un milieu liquide, indépendante de l'indice de réfraction des particules ou de la densité. Cette technique de haute résolution peut être utilisée pour compléter la mesure de liposomes avec DLS. La NTA a enregistré des diamètres de 95 ± 48 et 356 ± 51 nm, 100 nm et deux solutions de polystyrène 400 nm ont été utilisées pour l'étalonnage. Les émulsions lipidiques de 30 nm et 100 nm ont été observés pour avoir un échantillon plus diamètre arables par rapport aux DLS comme le montre la figure 3, la production de taille moyenne de 29 ± 14, 95 ± 17 et 359 ± 73 nm. La NTA peut être une technique de caractérisation plus générale de quantifier les particules microscopiques depuis sa sensibilité lui permet de mesurer les particules de 50 à 1000 nm. La courbe d'étalonnage montre une corrélation linéaire entre les pores de la membrane en polycarbonate par rapport au diamètre nominal NTA.
| Tailles liposomes | Seuil de détection | Prévue taille minimale de particules (nm) |
| 30 nm | 11 | 30 |
| 100 nm | 11 | 100 |
| 400 nm | 21 | 400 |
Tableau 1. Paramètres NanoSight.
ad/4151/4151fig1.jpg "/>
Figure 1. Diagramme du procédé d'extrusion, décrivant la façon dont la pression et le débit d'azote contrôle de l'homogénéité des différents diamètres de liposomes. À la suite d'hydratation liposome, des vésicules unilamellaires de taille différente sont extrudés à travers les pores différentes polycarbonate filtre à membrane à des pressions différentes.
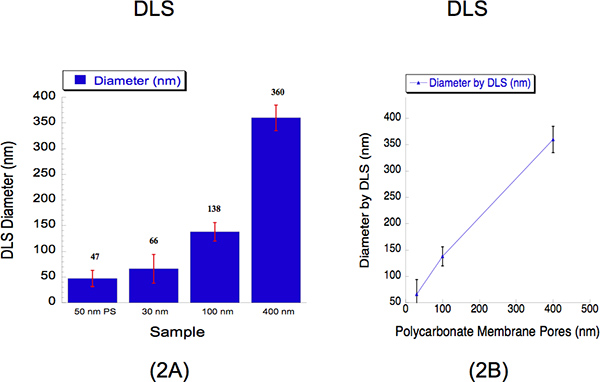
Figure 2. Dynamiques de diffusion de lumière (DLS) des données décrivant les tailles quantitatives liposomes après extrusion. (A) Les diagrammes à barres sont représentés à décrire les diamètres des trois échantillons de liposomes. Un étalon de 50 nm de polystyrène (PS) a été utilisé perles comme une référence. Les diamètres moyens des liposomes sont indiqués ci-dessus la barre pour chaque échantillon. L'axe des abscisses décrit les tailles de pores dont les solutions ont été extrudée à travers. L'axe des y décrit le diamètre enregistrée par DLS. Bien que les 30 nm et 100 nm des tailles recorded des valeurs supérieures à leurs tailles de pores tandis que les plus de 400 nm de taille ont enregistré une taille légèrement inférieure, la courbe d'étalonnage (b) montre une corrélation presque linéaire, où l'axe des x exprime les tailles en polycarbonate pores de la membrane, et l'axe des y décrit le enregistrée diamètre des liposomes par DLS.

Figure 3. Nanoparticules analyse de suivi (NTA) des données décrivant les tailles des liposomes après extrusion. (A) Les diagrammes à barres représentent le diamètre de chaque échantillon de liposomes. L'axe des abscisses décrit les tailles de pores dont les solutions ont été extrudée à travers. L'axe des y décrit le diamètre de enregistrée par le NTA. Les diamètres moyens des liposomes sont étiquetés au dessus de chaque échantillon. (B) la courbe d'étalonnage NTA présente une corrélation plus linéaire de la courbe d'étalonnage DLS entre les tailles des pores du filtre à membrane par rapport au diamètre enregistrée. L'axe des abscisses décrit les tailles en polycarbonate pores de la membrane. L'axe des y décrit le diamètre nominal de liposome par NTA.
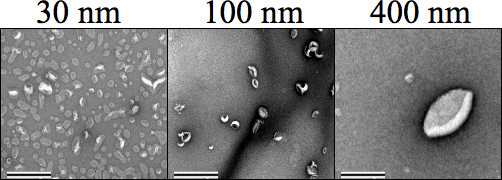
Figure 4. Coloration négative microscopie électronique en transmission (TEM) des images illustrant chaque taille des liposomes (500 uM), suivie par extrusion. Carbone Formvar grilles mailles ont été négativement déchargée avant la coloration de l'échantillon, où l'acétate d'uranyle 1% dans de l'eau a été utilisée pour colorer les échantillons avant le séchage et l'imagerie à 34.000 grossissement. Tailles 30, 100 et 400 nm sont clairement distinctes les unes des autres. Le grossissement a été fixé à 25 000 ×. La barre d'échelle représente 0,5 um.
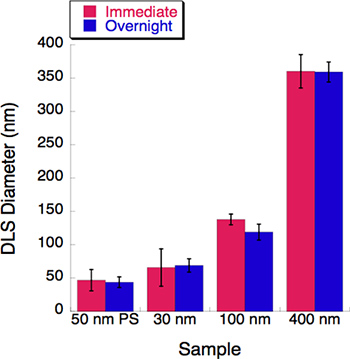
Figure 5. Une expérience du temps bien sûr a été menée avec trois tailles de liposomes. Diffusion de la lumière dynamique (DLS) a été mesurée pour chaque solution de liposomes d'extrusion qui suit immédiatement. Toutes les solutions ont été stockées dans des liposomes 4 °C pendant la nuit. Leurs diamètres ont été enregistrées par les DLS après une nuit d'incubation. Peu ou pas de changement n'a été observé après une période d'incubation de 16 heures.
Access restricted. Please log in or start a trial to view this content.
Discussion
Utilisation de la Avestin LiposoFast LF-50 Extrudeuse, nous avons démontré comment les petites entreprises, les liposomes synthétiques sont préparés grâce à un système commandé par la pression. Il est important de noter que les vésicules multilamellaires se forment spontanément à la suite d'hydratation des liposomes, ce qui peut conduire à la production de petites nanoparticules. Ces petites vésicules multilamellaires inévitablement couler à travers la plus grande taille en polycarbonate pores de la ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par le Howard Hughes Medical Institute (HHMI) Prix de l'innovation collaborative. LAM a été soutenue par la signalisation cellulaire et le règlement par l'Institut national de la santé une formation de subvention (T32 GM008759) et le NIH Ruth L. Kirschstein pré-doctoral (CA165349-01). Nous tenons à remercier le Professeur Michael Stowell (CU Boulder), Prof Rees Douglas et professeur Rob Phillips (Caltech) pour leurs précieux commentaires.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Chloroforme | Sigma-Aldrich | 02432-25ML | Stabilisants 95% |
| Haut de méthanol de qualité | Sigma-Aldrich | 179337-4L | |
| LiposoFast LF-50 Extrudeuse | Avestin, Inc | ||
| Les phospholipides | Avanti Polar Lipids | ||
| Pores en polycarbonate | Avestin, Inc | 25 mm de diamètre | |
| Égoutter disques PE | Avestin, Inc | 230600 | 25 mm de diamètre |
Références
- Connor, J., Bucana, C., Fidler, I. J., Schroit, A. J. Differentiation-dependent expression of phosphatidylserine in mammalian plasma membranes: quantitative assessment of outer-leaflet lipid by prothrombinase complex formation. Proc. Natl. Acad. Sci. U.S.A. 86, 3184-3188 (1989).
- Smith, S. A., Morrissey, J. H. Rapid and efficient incorporation of tissue factor into liposomes. J. Thromb. Haemost. 2, 1155-1162 (2004).
- Hui, E., Johnson, C. P., Yao, J., Dunning, F. M., Chapman, E. R. Synaptotagmin-mediated bending of the target membrane is a critical step in Ca(2+)-regulated fusion. Cell. 138, 709-721 (2009).
- Loughrey, H. C., Choi, L. S., Cullis, P. R., Bally, M. B. Optimized procedures for the coupling of proteins to liposomes. J. Immunol. Methods. 132, 25-35 (1990).
- Mui, B., Chow, L., Hope, M. J. Extrusion technique to generate liposomes of defined size. Methods Enzymol. 367, 3-14 (2003).
- Gruner, S. M., Cullis, P. R., Hope, M. J., Tilcock, C. P. Lipid polymorphism: the molecular basis of nonbilayer phases. Annu. Rev. Biophys. Biophys. Chem. 14, 211-238 (1985).
- Guven, A., Ortiz, M., Constanti, M., O'Sullivan, C. K. Rapid and efficient method for the size separation of homogeneous fluorescein-encapsulating liposomes. J. Liposome. Res. 19, 148-154 (2009).
- Zimmerberg, J., Kozlov, M. How proteins produce cellular membrane curvature. Nature Reviews Molecular Cell Biology. 7, 9-19 (2006).
- Chonn, A., Cullis, P. R. Recent advances in liposomal drug-delivery systems. Curr. Opin. Biotechnol. 6, 698-708 (1995).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochim. Biophys. Acta. 858, 161-168 (1986).
- Matsuoka, K., Schekman, R. The use of liposomes to study COPII- and COPI-coated vesicle formation and membrane protein sorting. Methods. 20, 417-428 (2001).
- Dragovic, R. A., Gardiner, C., Brooks, A. S., Tannetta, D. S., Ferguson, D., Hole, P., Carr, B., Redman, C., Harris, A. L., Dobson, P. J., Harrison, P., Sargent, I. L. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine. , (2011).
- Hunter, D. G., Frisken, B. J. Effect of extrusion pressure and lipid properties on the size and polydispersity of lipid vesicles. Biophys J. 74, 2996-3002 (1998).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon