Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Constant Pressure-gesteuerte Extrusionsverfahren zur Herstellung von Nano-Größe Lipidvesikeln
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein Extrusionsverfahren zur Herstellung Lipidvesikel von Submikrometer-Abmessungen mit einem hohen Grad an Homogenität. Dieses Verfahren verwendet eine Druck-Steuerung mit gesteuerten Stickstoff Flussraten für Liposomenpräparation. Die Lipid-Vorbereitung 1,2, Wird Liposomen Extrusion, Größe und Charakterisierung Beispiele vorgestellt werden.
Zusammenfassung
Liposomen sind künstlich hergestellte Vesikel aus natürlichen und synthetischen Phospholipiden, die weithin als eine Zellmembran imitiert Plattform, um Protein-Protein und Protein-Lipid-Wechselwirkungen 3, Drug-Delivery-Monitor 4,5 und 4 studierst Einkapselung verwendet werden. Phospholipide natürlich erstellen gebogene Lipid-Doppelschichten und zeichnet sich aus einer Micelle. 6 Liposomen werden traditionell von Größe und Anzahl der Doppelschichten, dh große unilamellare Vesikel (LUV), kleine einschichtige Vesikel (SUVs) und multilamellare Vesikel (MLV) 7 eingestuft. Insbesondere ist die Herstellung von homogenen Liposomen in verschiedenen Größen für das Studium Membrankrümmung, die eine wichtige Rolle bei der zellulären Signalübertragung, Endo-und Exozytose, Membranfusion und Proteintransport 8 wichtig. Mehrere Gruppen analysieren, wie sich Proteine verwendet werden, zu modulieren Prozesse, die Membrankrümmung einzubeziehen und somit vorbereiten Liposomen mit Durchmessern <100 bis 400nm bis ihr Verhalten auf Zellfunktionen 3 studierst. Andere konzentrieren sich auf Liposom-Arzneistoff-Verkapselung, Studium Liposomen als Vehikel zu transportieren und liefern ein Medikament von Interesse 9. Drug-Kapselung erreicht wie während Liposomenbildung 9 gemeldet werden. Unsere Extrusionsschritt sollte nicht die verkapselten Wirkstoffs aus zwei Gründen, dh sie sollten (1) Wirkstoffverkapselung vor diesem Schritt erreicht werden und (2) Liposomen sollten ihrer natürlichen biophysikalischen und formstabil bleibt, sicher trägt das Arzneimittel im wässrigen Kern. Diese Forschungsergebnisse legen nahe, weitere Ziele die Notwendigkeit für eine optimierte Methode, um eine stabile Sub-Mikrometer-Lipidvesikel zu entwerfen.
Dennoch weisen die aktuellen Liposomenzubereitung Technologien (Beschallung 10, Frost-und Tauwetter-10, Sedimentation) nicht zulassen, Herstellung von Liposomen mit stark gekrümmten Oberfläche (dh Durchmesser <100 nm) mit hoher Konsistenz und Effizienz 10,5, die der physischen Begrenztheit Studien eines Emerging Bereich der Membrankrümmung Fernerkundung. Hier präsentieren wir eine robuste Herstellungsmethode für eine Vielzahl von biologisch relevanten Liposomen.
Manuelle Extrusion unter Verwendung gasdichte Spritzen und Polycarbonatmembranen 10,5 ist eine gängige Praxis, aber Heterogenität wird oft beobachtet, wenn mit Porengrößen <100 nm aufgrund aufgrund der Variabilität der manuellen Druck aufgebracht. Wir verwendeten einen konstanten Druck-gesteuerten Extrusionsvorrichtung, um synthetischen Liposomen, deren Durchmesser im Bereich zwischen 30 und 400 nm herzustellen. Die dynamische Lichtstreuung (DLS) 10, 11 und Elektronenmikroskopie Nanopartikel Tracking-Analyse (NTA) 12 wurden verwendet, um die Liposomen-Größen zu quantifizieren, wie in unserem Protokoll beschrieben, mit kommerziellen Polystyrol (PS) Perlen als Kalibrier-Standard verwendet. Eine nahezu lineare Korrelation zwischen der verwendeten Porengrößen und der experimentell bestimmten Liposomen beobachtet, was eine hohe Wiedergabetreue der druckgesteuerten Liposomenpräparation erfüllthod. Ferner haben wir gezeigt, dass diese Lipidvesikel Herstellungsverfahren allgemein anwendbar, unabhängig von verschiedenen Größen Liposom ist. Schließlich haben wir auch in einem zeitlichen Verlauf Studie zeigte, dass diese vorbereiteten Liposomen stabil waren für bis zu 16 Stunden. Ein Vertreter in Nano-Größe Liposomenzubereitung Protokoll wird unter Beweis gestellt.
Protokoll
1. Liposomenpräparat
- Abrufen einer 20 ml-Glas mit einem mit Teflon ausgekleideten Deckel.
- Reinigen Sie alle Glaswaren und Spritzen mit Chloroform vor dem Gebrauch, um eine Kontamination zu verhindern.
- Übertragen Sie 100 ul Chloroform von Reagenzgüteklasse dem Glasfläschchen mit einer 250 ul luftdichten Glas Spritze.
- In 30 l Reagens reines Methanol zu dem gleichen Glasfläschchen mit einer 100 ul luftdichten Glas Spritze.
- Phosphatidylethanolamin (PAPST):: zu einer 2 mm 7:1.5:1.5 Phosphatidylcholin (POPC) vorbereiten Cholesterin-Lipid-Lösung, zu übertragen 216 ul 10 mg / mL POPC, 42 ul 10 mg / mL Papst und 20 ul von 11 mg / mL Cholesterin-Lösungen in CHCl 3 der 20 ml Glasflasche.
- Verdampft die organischen Lösungsmittel unter Verwendung langsam-Flow-Argon oder Stickstoff, bis ein dünner Film von Lipiden an der Unterseite des Glasfläschchens.
- Legen Sie den nicht begrenzten Glasfläschchen in einem Vakuumexsikkator für mindestens 30 Minuten, um das restliche Lösungsmittel zu entfernen.
- Transfer 2 ml Puffer, die vorher durch einen 0,2 Mikron-Filter geleitet, um dem Glasfläschchen zu hydratisieren die Lipide.
- Inkubieren Sie die Mischung bei 4 ° C über Nacht und innerhalb von 48 Stunden.
2. Frost-und Tauwetter-: Für Liposomengrößen von 30 bis 100 nm nur
- Liposomensuspension Einfrieren in flüssigem Stickstoff für 15 Sekunden.
- Auftauen Liposomensuspension mit einem Heizblock bei 42 ° C Temperatur für ~ 3 Minuten.
- Wiederholen Sie die Schritte 2.1 und 2.2 für insgesamt 5 Zyklen.
3. Extrusion
Folgen Sie den Anweisungen, um Avestin korrekt zusammenbauen LiposoFast LF-50 Extruder, mit dem Instrument stellen in ihren Reiseführer.
- Platzieren Sie die große Öffnung Stützsieb (mit runden Löchern) in dem Träger Filtergrundplatte, gefolgt von der kreisförmigen gesinterten Schale (ohne Löcher), eine Drain-Scheibe (25 mm Durchmesser), und eine Polycarbonat-Membran (25 mm im Durchmesser).
- Setzen Sie den kleinen, schwarzenO-Ring an der Oberseite der Membran, um sie auf den Träger Filter zu befestigen.
- Bringen Sie die obere Filter Extruder durch Anziehen 4 Schrauben in den vier entsprechenden Löcher.
- Montieren Sie den Filter auf die Extruder-Einheit unter dem großen Extruderzylinder. Fügen Sie die Liposomen-Lösung für das Zylinderrohr. Platzieren Sie den folgenden auf der Oberseite des Extrusionstrommel um: große, runde O-Ring, schmale Mütze, großen runden O-Ring-, Kreis-Kappe.
- Befestigen Sie den Gasregler auf dem Extruderzylinder oben und schließen Sie alle Ventile zu Luftverlust, darunter das Überdruckventil zu verhindern. Legen Sie eine 20 ml Glasflasche oder 50-ml-Erlenmeyer-Kolben unter dem Extruder Filtereinheit. Ein Sicherheitsventil ist an den Regler angeschlossen werden und loslassen, wenn der Druck über 600 psi. Schalten Sie das Stickstoffgas und öffnen Sie das Gasventil mit dem Extruder.
- Steigern Stickstoffdruck auf 25 psi für 400 nm Liposomen, 125 psi für 100 nm Liposomen und 400-500 psi für 30 nm Liposomen.
- Sehen Sie sich das Liposom suspSpannen Sie wie es in den Behälter ausstößt, während der Stickstoff geschoben wird. Halten Sie den Stickstoff fließt, bis Sie beobachten nicht mehr jede Flüssigkeit, die durch den Extruder Filter in das Glasgefäß.
4. Die dynamische Lichtstreuung (DLS) Analyse
- Bereiten 50 ul einer 20 uM Liposomenlösung.
- Schalten Sie die Stromversorgung der Lampe und Quelle.
- Öffnen Sie die DynaPro Software.
- Stellen Sie die Software an die MS / X-Algorithmus Modell Liposomen von 30 nm und 100 nm und MS800-Algorithmus Modell> 100 nm Liposomen erkennen zu erfassen.
- Schließen Sie an die Hardware.
- Jeweils 14 ul von Liposomen-Probe in die Quarzküvette und Einsatz in den Küvettenhalter.
- Drücken Sie starten.
- Drücken Sie nach ~ 20 stoppen - 30 Akquisitionen.
- Analysieren Sie die durchschnittliche Liposomendurchmesser Gipfel im Histogramm aufgezeichnet.
5. Nanopartikel Tracking-Analyse (NTA)
- Bereiten Sie einen 500 mL, 0,1 uM LiposomenLösung.
- Spülen Sie den Probenraum mit Wasser und Ethanol.
- Trocknen Sie den Probenraum mit einem fusselfreien Papiertuch.
- Schalten von der Laserleistung und an den Computer.
- Liefern Sie 300 ul 0,1 uM Liposomenlösung zu den Probenraum.
- Öffnen Sie die Temperaturregelung und die Nanopartikel-Tracking-Analyse-Software.
- Drücken Sie auf die Schaltfläche Capture, um den Laser einzuschalten.
- Verwenden Sie die horizontalen und vertikalen Ausrichtung auf die Bühne zu bewegen und justieren Sie die Mikroskop-Fokus.
- Stellen Sie die gewünschte Temperatur (20 ° C) und Aufnahmedauer (mindestens 30 Sekunden).
- Drücken Sie die Record-Taste, um mehrere Bilderrahmen der Liposomen-Partikel für eine bestimmte Menge an Zeit in Anspruch nehmen. Analysieren der Peaks, die den Durchmesser Liposomengrößen auf dem Histogramm, wie es die Bewegung der einzelnen Partikel verfolgt.
6. Repräsentative Ergebnisse
Ein Schema skizziert die Extrusion Methode ist pübel in 1. Um optimale Ergebnisse zu erhalten, Herstellung von Liposomen mit einem Durchmesser von 30 nm erfordert einen hohen Druck von ~ 500 psi und einem Durchmesser von 100 nm erfordert einen Druck von 125 psi, um eine rasche Filter zu erzielen. Für Durchmesser von 400 nm, ein Unterdruck von etwa 25 psi empfohlen eine etwas langsamere Abscheiderate, die die Vesikel zu verlängern und zu größeren, homogenen Liposomen können zu erreichen. Wir führten eine Reihe von Experimenten, um den optimalen Druck für die Erstellung von konsistenten Sub-Mikrometer-Vesikel Größen zu bestimmen. Wir variiert der Druck als auch die Anzahl der Extrusion durchläuft Polycarbonat-Filter mit einer Porengröße von 30, 100 und 400 nm und entdeckte geeigneten Druck für jede gewünschte Größe. Für 30 nm Poren, wird der Druck unter 500 psi reduziert die Fließgeschwindigkeit, was zu Dehnung und damit größere Vesikelgrößen. Für 100 nm Poren, wurde ein stetiger Strom bei 125 psi erreicht. Bei 400 nm-Poren, ermöglicht niedrigem Druck (25 psi) die Vesikel in größeren Vesikel s länglichenzialisiert. Eine langsame tropfenweise Flow Filtration ist optimal, um größere Sub-Mikrometer-Vesikel 13 zu schaffen.
Wir führten DLS die Liposomengrößen extrudiert durch drei verschiedenen Durchmessern, dh 30, 100 und 400 nm zu bestimmen. DLS ist ein etabliertes Verfahren, das gestreute Licht sammelt, um die Partikeldurchmesser zu bestimmen. Wir extrudiert hydratisierten Liposomen von 2 mM durch eine Polycarbonat-Membran 30 nm bei 500 psi mit 5 Durchgängen durch den Filter Poren, eine 100 nm Polycarbonat-Membran bei 125 psi mit 5 Durchgängen durch den Filter Poren und einer 400 nm Polycarbonat-Membran bei 25 psi mit 2 durch den Filter Poren. Die Durchmesser der Liposomen gemessen und durch DLS für 30, 100 und 400 nm Porengröße waren 66 ± 28, 138 ± 18 und 360 ± 25 nm (Abbildung 2). Eine Suspension von 50 nm Polystyrolkügelchen wurde als Kalibrierstandard verwendet wie in 2, wo sie erfasst einen Durchmesser von 47 ± 16 nm dargestellt. Die prozentuale polydispersity zeigt, dass es keine Überschneidungen innerhalb Liposomen-Größen. Es ist typisch, Durchmesser größer als 30 nm zu beobachten bei der Verwendung von DLS-Analyse aufgrund der bekannten Bias dieses Instrument zu größeren Partikel 12. Lichtstreuung Intensitäten von großen und kleinen Partikeln gleichzeitig von einem Nachweisverfahren gesammelt und damit schwerer zu Liposomen in Suspension 12 zu lösen. Trotz dieser Einschränkung instrumental, beschreibt die Eichkurve eine nahezu lineare Korrelation.
NTA ist eine neue Technologie, die die Größe der einzelnen Partikel aus direkten Beobachtungen der Diffusion in einem flüssigen Medium, unabhängig von Teilchen Brechungsindex oder Dichte mißt. Das hochauflösende Technik kann verwendet werden, um die Messung von Liposomen mit DLS ergänzen. Die NTA aufgezeichnet Durchmesser von 95 ± 48 und 356 ± 51 nm, zwei 100 nm und 400 nm Polystyrol-Lösungen wurden für die Kalibrierung verwendet. Lipid-Lösungen von 30 nm und 100 nm beobachtet, um eine Layout-Datei haben landwirtschaftlicher Durchmesser zu den DLS wie in 3 gezeigt ist, wodurch durchschnittlichen Größen von 29 ± 14, 95 ± 17 und 359 ± 73 nm aufweist. 1000 nm - Die NTA kann eine allgemeinere Charakterisierung Technik, um mikroskopisch kleine Partikel zu quantifizieren, da seine Empfindlichkeit erlaubt es, Partikel von 50 zu messen sein. Die Eichkurve zeigt eine lineare Korrelation zwischen den Polycarbonat-Membran Poren im Vergleich zu dem aufgezeichneten NTA Durchmesser.
| Liposomengrößen | Nachweisgrenze | Erwartete minimale Partikelgröße (nm) |
| 30 nm | 11 | 30 |
| 100 nm | 11 | 100 |
| 400 nm | 21 | 400 |
Tabelle 1. NanoSight Parameter.
ad/4151/4151fig1.jpg "/>
1. Flussdiagramm der Extrusionsverfahren, die beschreiben, wie der Druck und Stickstoffstrom steuert die Homogenität der verschiedenen Liposom Durchmesser. Im Anschluss an Liposomen Flüssigkeitszufuhr, sind unilamellare Vesikel verschiedener Größe durch verschiedene Polycarbonat-Membranfilter Poren mit unterschiedlichem Druck extrudiert.
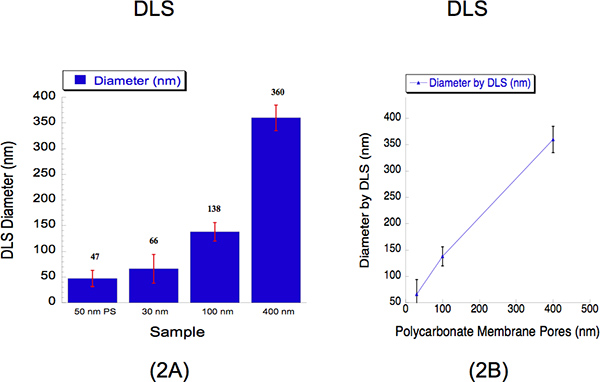
Abbildung 2. Dynamische Lichtstreuung (DLS) Daten zur Beschreibung der quantitativen Größen Liposomen nach der Extrusion. (A) Balkendiagramme gezeigt, um die Durchmesser der drei Liposom Beispiele beschreiben. Ein Kalibrierstandard von 50 nm Polystyrol (PS)-Kügelchen wurde als Referenz verwendet. Die durchschnittlichen Liposomen Durchmesser werden über der Bar für jede Probe angegeben. Die x-Achse beschreibt die Porengrößen von denen die Lösungen wurden extrudiert durch. Die y-Achse beschreibt den Durchmesser von DLS aufgezeichnet. Obwohl die 30 nm und 100 nm Größen EintragED-Werte höher als die Porengröße, während die größere Größe 400 nm aufgezeichnet eine etwas geringere Größe, zeigt die Eichkurve (b) eine nahezu lineare Korrelation, wobei die x-Achse drückt die Polycarbonatmembran Porengrößen und die y-Achse beschreibt die aufgezeichnet Liposomendurchmesser durch DLS.

Abbildung 3. Nanopartikel Tracking-Analyse (NTA) Daten zur Beschreibung der Liposomen-Größen nach der Extrusion. (A) Die Balkendiagramme stellen den Durchmesser jedes Liposom Probe. Die x-Achse beschreibt die Porengrößen von denen die Lösungen wurden extrudiert durch. Die y-Achse beschreibt die Größe Durchmesser durch die NTA aufgezeichnet. Die mittlere Liposomen Durchmessern übereinander Probe markiert. (B) Die NTA Eichkurve zeigt eine lineare Korrelation als der DLS Eichkurve zwischen den Filtermembran Porengrößen gegenüber dem Durchmesser aufgenommen. Die x-Achse beschreibt die Polycarbonatmembran Porengrößen. Die y-Achse beschreibt die aufgezeichneten Liposomendurchmesser NTA.
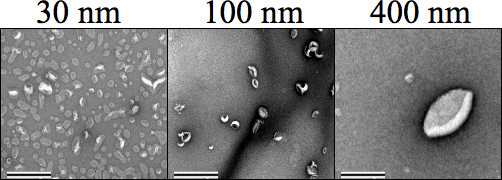
Abbildung 4. Negativ Fleck Transmissionselektronenmikroskopie (TEM)-Aufnahmen zeigen jeweils Liposomengröße (500 um) extrudiert. Carbon-Mesh-Gitter wurden Formvar negativ vor der Färbung Probe entlassen, wo 1% Uranylacetat in Wasser verwendet wurde, um die Proben vor dem Trocknen und Bildgebung bei 34.000-facher Vergrößerung zu färben. Größe 30, 100 und 400 nm deutlich voneinander unterscheiden. Die Vergrößerung wurde zu 25.000 × gesetzt. Der Maßstab entspricht 0,5 um.
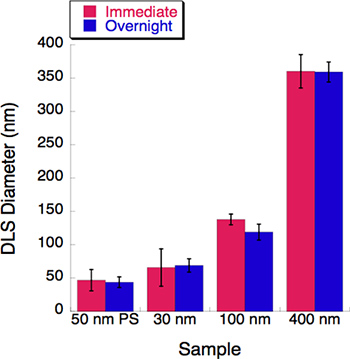
Abbildung 5. Ein Zeit-Gänge-Versuch wurde mit drei Größen Liposomen durchgeführt. Die dynamische Lichtstreuung (DLS) wurde für jede Liposomen-Lösung unmittelbar nach der Extrusion gemessen. Alle Lösungen wurden in Liposomen 4 °C über Nacht. Die Durchmesser wurden von den DLS nach Inkubation über Nacht aufgezeichnet. Wenig bis gar keine Veränderung wurde nach einer 16-stündigen Inkubationszeit beobachtet.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Verwenden des Avestin LiposoFast LF-50 Extruder, haben wir gezeigt, wie kleine, synthetischen Liposomen durch ein druckgesteuertes System hergestellt. Es ist wichtig zu beachten, dass multilamellare Vesikel spontan nach Liposom Hydratisierung, die Herstellung von kleineren Nanopartikel führen kann. Diese kleinen multilamellare Vesikel wird unweigerlich durch die größere Polycarbonat-Membran Porengröße fließen, wodurch Heterogenität in Lösungen von einschichtigen Vesikeln durch eine große Filterporengröße prod...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von dem Howard Hughes Medical Institute (HHMI) Collaborative Innovation Award unterstützt. LAM wurde von der Signaling and Cellular Verordnung National Institute of Health Ausbildungsförderung (T32 GM008759) und der NIH Ruth L. Kirschstein Pre-Doctoral Fellow (CA165349-01) unterstützt. Wir möchten Prof. Michael Stowell (CU Boulder), Prof. Douglas Rees und Prof. Rob Phillips (Caltech) für ihre wertvollen Kommentare danken.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Chloroform | Sigma-Aldrich | 02432-25ML | 95% Stabilisatoren |
| High Grade Methanol | Sigma-Aldrich | 179.337-4L | |
| LiposoFast LF-50 Extruder | Avestin, Inc. | ||
| Phospholipide | Avanti Polar Lipids | ||
| Polycarbonat Poren | Avestin, Inc. | 25 mm Durchmesser | |
| Lassen Sie Discs PE | Avestin, Inc. | 230600 | 25 mm Durchmesser |
Referenzen
- Connor, J., Bucana, C., Fidler, I. J., Schroit, A. J. Differentiation-dependent expression of phosphatidylserine in mammalian plasma membranes: quantitative assessment of outer-leaflet lipid by prothrombinase complex formation. Proc. Natl. Acad. Sci. U.S.A. 86, 3184-3188 (1989).
- Smith, S. A., Morrissey, J. H. Rapid and efficient incorporation of tissue factor into liposomes. J. Thromb. Haemost. 2, 1155-1162 (2004).
- Hui, E., Johnson, C. P., Yao, J., Dunning, F. M., Chapman, E. R. Synaptotagmin-mediated bending of the target membrane is a critical step in Ca(2+)-regulated fusion. Cell. 138, 709-721 (2009).
- Loughrey, H. C., Choi, L. S., Cullis, P. R., Bally, M. B. Optimized procedures for the coupling of proteins to liposomes. J. Immunol. Methods. 132, 25-35 (1990).
- Mui, B., Chow, L., Hope, M. J. Extrusion technique to generate liposomes of defined size. Methods Enzymol. 367, 3-14 (2003).
- Gruner, S. M., Cullis, P. R., Hope, M. J., Tilcock, C. P. Lipid polymorphism: the molecular basis of nonbilayer phases. Annu. Rev. Biophys. Biophys. Chem. 14, 211-238 (1985).
- Guven, A., Ortiz, M., Constanti, M., O'Sullivan, C. K. Rapid and efficient method for the size separation of homogeneous fluorescein-encapsulating liposomes. J. Liposome. Res. 19, 148-154 (2009).
- Zimmerberg, J., Kozlov, M. How proteins produce cellular membrane curvature. Nature Reviews Molecular Cell Biology. 7, 9-19 (2006).
- Chonn, A., Cullis, P. R. Recent advances in liposomal drug-delivery systems. Curr. Opin. Biotechnol. 6, 698-708 (1995).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochim. Biophys. Acta. 858, 161-168 (1986).
- Matsuoka, K., Schekman, R. The use of liposomes to study COPII- and COPI-coated vesicle formation and membrane protein sorting. Methods. 20, 417-428 (2001).
- Dragovic, R. A., Gardiner, C., Brooks, A. S., Tannetta, D. S., Ferguson, D., Hole, P., Carr, B., Redman, C., Harris, A. L., Dobson, P. J., Harrison, P., Sargent, I. L. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine. , (2011).
- Hunter, D. G., Frisken, B. J. Effect of extrusion pressure and lipid properties on the size and polydispersity of lipid vesicles. Biophys J. 74, 2996-3002 (1998).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten