A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام LysoTracker لكشف موت الخلية المبرمج في الأجنة والخلايا الجذعية الجنينية التفريق
In This Article
Summary
نقدم بروتوكول بسيط لتصور مناطق موت الخلايا المبرمج (PCD) في أجنة الفئران الجنينية والتمييز الثقافات الخلايا الجذعية (ES) باستخدام صبغة قابلة للذوبان للغاية ودعا LysoTracker.
Abstract
موت الخلية المبرمج (PCD) ويحدث في الكبار للحفاظ على التوازن الطبيعي الأنسجة الجنينية والتنمية خلال لتشكيل الأنسجة والأعضاء 1،2،6،7. خلال التنمية، يمكن أن المواد الكيميائية السامة أو تغيرات جينية تسبب زيادة في PCD PCD أو تغيير الأنماط مما أدى إلى تشوهات النمو والعيوب الخلقية 3-5. لفهم مسببات هذه العيوب، يمكن أن تستكمل دراسة الأجنة في المقايسات مع المختبر التي تستخدم التفريق الجذعية الجنينية (ES) الخلايا.
موت الخلايا المبرمج هو شكل مدروسة من PCD التي تنطوي على حد سواء الذاتية وخارجي مما يشير إلى تفعيل تتالي كاسباس الانزيم. التغييرات الخلية مميزة تشمل blebbing الغشاء، وتقلص النووية، وتجزئة الحمض النووي. أشكال أخرى من PCD لا تنطوي على تفعيل كاسباس وربما تكون النتيجة النهائية من الالتهام الذاتي لفترات طويلة. بغض النظر عن المسار PCD، الخلايا الميتة تحتاج إلى إزالة. في البالغين، والخلايا المناعية PERFORM هذه الوظيفة، بينما في الأجنة، حيث لم الجهاز المناعي تطور بعد، وإزالة يحدث من قبل آلية بديلة. هذه الآلية تنطوي على الخلايا المجاورة (وتسمى "غير المهنية البالعات") أخذ على أكلة الدور يعترفون 'أكل لي' إشارة على سطح الخلية الموت وتبتلع من 8-10. بعد الإحاطة، يتم جلب الحطام إلى يحلول للتدهور. بغض النظر بالتالي آلية PCD، يمكن يرتبط زيادة في النشاط الليزوزومية مع زيادة موت الخلايا.
يمكن لدراسة PCD، وهو فحص بسيط لتصور الجسيمات الحالة في الأنسجة سميكة ومتعدد الطبقات الثقافات يكون من المفيد التمييز. صبغ LysoTracker هو جزيء صغير جدا للذوبان التي يتم الاحتفاظ بها في حجرات التحت خلوية الحمضية مثل يحلول 11-13. يتم أخذ صبغة بنسبة نشرها من خلال والدورة الدموية. منذ اختراق ليست عائقا، والتصور من PCD في الأنسجة سميكة والثقافات متعددة الطبقات من الممكن 12،13 14، إلى عينات صغيرة، المقاطع النسيجية، والثقافات أحادي الطبقة لأن الإجراء يتطلب إدخال / نفاذية محطة ترانسفيراز.
وعلى النقيض من الزرقاء الأنيلين، الذي ينشر ويذوب من المذيبات، LysoTracker الأحمر DND-99 هو قابل للتثبيت، ومشرق، ومستقرة. يمكن تلطيخ يمكن تصور المجهر الفلورسنت القياسية مع مبائر أو في جبل لكليا أو القسم أو باستخدام المذيبات المائية القائمة على وسائل الإعلام تصاعد 12،13. نحن هنا وصف البروتوكولات باستخدام هذه الصبغة للنظر في PCD في الحالات العادية والماوس سونيك القنفذ الأجنة فارغة. وبالإضافة إلى ذلك، علينا أن نبرهن تحليل PCD في التفريق مزارع الخلايا ES وتقديم طريقة بسيطة الكمي. وباختصار، يمكن تلطيخ LysoTracker يكون تكملة كبيرة إلى أساليب أخرى للكشف عن PCD.
Protocol
1. تلوين LysoTracker من أجنة الفئران
- توليد أجنة الفئران عن طريق وضع الشباب (5-6 الاسبوع القديمة) الإناث في أقفاص مسمار الذكور. حدث صباح رصد التالية لظهور المكونات المهبلية تشير إلى أن التزاوج. إذا الأنثى وهي حامل، ويسمى الظهر في ذلك اليوم 0،5 DPC (أيام الجماع آخر). الإجراء المقدمة هنا هي مثالية للأجنة 7-13 DPC.
- في اليوم الجنينية المصالح، الموت ببطء الأنثى وفقا لبروتوكولات المعتمدة وإزالة الرحم. إزالة الأجنة من الساقط في طبق بتري الطول 10 مع BSS هانكس (بدون أحمر الفينول). إزالة الأغشية الجنينية وخارج واحد على الأقل لا شطف مع BSS لإزالة الأنسجة هانكس غريبة والدم.
- إعداد الحل LysoTracker تلوين الأجنة (5 ملم في LysoTracker BSS هانكس). A حجم مريحة لمدة 1-2 الفضلات هو 5 مل. المزيج بلطف لصرف الصبغة بالتساوي.
- إضافة إلى تلوين الأجنة Solut LysoTracker الأجنةايون في أنبوب أو قنينة microfuge واحتضان في C ° 37 لمدة 45 دقيقة.
- شطف بلطف شديد في BSS هانكس أربع مرات، كل 5 دقائق يغسل.
- إصلاح في امتصاص العرق 4٪ بين عشية وضحاها.
- شطف مرة واحدة في BSS هانكس، 10 دقيقة، لإزالة الإصلاح.
- يذوى من خلال سلسلة الميثانول (50٪، 75٪، 80٪، 100٪، 5 دقائق كل خطوة) للقضاء على تلطيخ الخلفية. هذا مهم لتحقيق إشارة جيدة إلى الضوضاء أثناء التصوير.
- في هذه المرحلة يمكنك تخزين العينات الجنين إلى ما لا نهاية في الميثانول في -20 ° C، محمية من الضوء.
ملاحظة: يمكن أخذ عينة الأنسجة في أي خطوة للالتنميط الجيني DNA، ومع ذلك، يمكن أن يكون الأكثر ملاءمة لأخذ عينة فقط قبل تخزينها بحيث تصل إلى هذه الخطوة جميع العينات يمكن أن تكون دفعة مصنعة. جمع عينة من الأنسجة من الذيل، الطرف، أو رئيس من كل جنين ووضع كل في أنابيب منفصلة. ترطيب العينة الأنسجة والاستعداد لgenotyبينغ.
2. تلوين LysoTracker التفرقة الثقافات ES
- إعداد الهيئات مضغي الشكل عبر ال 15 قطرة أسلوب الشنق ذات الكثافة ابتداء من 500 الخلايا بنسبة 20 ميكرولتر قطرة.
- بعد 3 أيام، ونقل الجثث إلى مضغي الشكل الثقافة التعليق على أطباق بتري 10 سم غير ملتصقة (أي تلك المستخدمة للعمل البكتريولوجية). الثقافة لمدة 5 أيام، وتغيير وسائل الإعلام كل يوم 2.
- في يوم 7، نقل الجثث إلى مضغي الشكل مهيلم الشرائح غرفة 8-جيدا (0.1٪ إضافة إلى غرف الجيلاتين، انتظر 5 دقائق، وإزالة، وإضافة وسائل الإعلام). نقل مضغي الشكل 1-2 الهيئات في الغرفة.
- الثقافة لمدة 10 أيام، وتغيير وسائل الإعلام كل يوم. أن تحرص على وضع ماصة في ركن من أركان غرفة الشريحة حتى لا التشويش الجسم مضغي الشكل المترتبة على سطح الزجاج. أيضا عند إضافة جديدة وسائل الإعلام أيضا وضع ماصة في ركن من أركان الغرفة والافراج عن وسائل الإعلام ببطء.
- بعد 10 يوما من عبادةلدى عودتهم، للحث على موت الخلايا المبرمج كعنصر تحكم إيجابية، وعلاج بعض الآبار بنسبة 0.1 ملم و1.0 ملم H 2 O 2 (إضافة O 2 H 2 إلى مزيج الطازجة، ووسائل الإعلام، ثم تضاف إلى الخلايا) لمدة 60 دقيقة. شطف مرتين مع D-PBS والثقافة بين عشية وضحاها في وسائل الإعلام العادية.
- نضح بلطف وسائل الإعلام القائمة وإضافة حل LysoTracker تلطيخ الخليوي (500 LysoTracker نيوتن متر (تركيز النهائي) في وسائل الإعلام، و 300 ميكرولتر لكل غرفة).
- احتضان في C ° 37 لمدة 15 دقيقة.
- شطف مرتين مع أوقات 2 D-PBS، 5 دقائق لكل منهما.
- إصلاح في بارافورمالدهيد 4٪ لمدة 15 دقيقة في RT.
- شطف مرتين مع D-PBS، 5 دقائق.
3. عرض ملون LysoTracker الأجنة أو الثقافات ES
- إعداد عينات للفحص المجهري من قبل خلية الشفط وD-PBS، إزالة غرفة خارج الشريحة؛ التجفيف بالهواء لمدة 5 دقائق، وبعد ذلك مضيفا وسط مائي تركيب (Vectashield مع دابي أو ما شابه ذلك). وضع حاجز احباط حين dryinز لخفض تبيض من fluorophore. تحميل الأجنة في طبق زجاجي عميق للاكتئاب أو صغيرة في طبق بتري Vectashield أو ما شابه.
- تصور مع مجهر تشريح أو مركب تجهيزه مع رودامين أو تكساس الأحمر فلتر (DND LysoTracker RED-99، الإثارة / الانبعاث: 577/590 نانومتر). وعادة تلوين مشرق جدا حتى التعرض الطويل وعادة ما تكون غير ضرورية.
4. الكمي للنتائج باستخدام تقنيات التصوير
- التقاط الصور الرقمية الخاصة بك من العينات تحت ظروف التعرض نفسه في الوضع اليدوي.
- فتح الصور في أدوبي فوتوشوب أو برنامج التصوير مماثلة. لتحديد مقدار تلطيخ LysoTracker، حدد القناة الحمراء وعتبة الصورة (تحويل الصورة إلى اللون الأسود والأبيض و) بحيث يتم تمثيل تلطيخ الحمراء الآن من قبل بكسل الأبيض. حدد بكسل أبيض واستخدام وظيفة الرسم البياني للحصول على العدد الكلي.
- استخدام القناة الزرقاء لحسابعدد النوى في الميدان. يمكن أن يكون مفيدا للاحتفاظ بسجل للفرز من قبل التأشير الصورة.
- تسجيل حساب القيم وثم مستوى متوسط تلطيخ لكل خلية. تكرار هذا التحليل مع إعداد عتبة نفسه بالنسبة لجميع الصور التي ترغب في العينة.
5. ممثل النتائج
هناك نمط العادي للPCD أثناء التطور الجنيني يمكن أن يتغير عندما تتم إزالة جينة عامل النمو، مثل القنفذ الصوتي (SHH)، 16،17. منذ LysoTracker هو صبغ جزيء صغير للغاية وهذا هو إنتشاري، يمكن للجنين يمكن تصور كامل لتقييم مجالات PCD العميق حتى داخل اللحمة المتوسطة 12،13 يبين الشكل 1 نمط تلطيخ LysoTracker لطبيعية وSHH - / - أجنة الفئران الطافرة في 10.5dpc. في هذه المرحلة، وزيادة كبيرة في PCD SHH - / - الأجنة متحولة، لا سيما في الأطراف والناحية الجسيدةNS. ولا يمكن تصوير أجزاء من الجنين في جبل لأعلى كله في التكبير (1B) لتقييم النمط العام. يمكن أيضا أن تكون أجزاء تشريح مقطوع مع مشراح تهتز (1C) أو ناظم البرد (DF) للكشف عن مناطق PCD بمزيد من التفصيل.
ويتم تحليل أفضل TUNEL على أقسام رقيقة حيث تغلغل محطة ترانسفيراز هو أقل إثارة للمشاكل. ويمكن أن يتم تلطيخ LysoTracker ومقايسة TUNEL في النسيج نفسه (الشكل 1D-G). هذه النتائج تظهر أنه على الرغم من عدم وجود علاقة بين صارمة 01:01 LysoTracker وتلطيخ TUNEL، والمناطق العامة من التداخل PCD إلى حد كبير. في أعلى التكبير، فمن الممكن أن نرى أن نقاط وصمة عار الإيجابي مع مقايسة TUNEL ولكن ليس مع الصبغة LysoTracker، نقاط وصمة عار فقط مع أن الصبغة LysoTracker، ونقاط والتي تداخل تلطيخ.
وعندما يتم مطلي EB على سطح الجيلاتين المغلفة، والخلايا التمييز migratه إلى الخارج. بعد 10 يوما من الثقافة وسيكون قد تختلف الخلايا في مجموعة متنوعة من أنواع الخلايا بما في ذلك الخلايا العصبية، خلايا العضلات، وcardiomyocytes. الثقافات هو مبين في الشكل 2 تحتوي على عشائر مختلطة من هذه أنواع الخلايا، ولكن يمكن للمرء أن تتكيف لدينا بروتوكول لدراسة PCD من نوع معين من خلايا الفائدة. على سبيل المثال، يمكن أن تعامل مع حمض الريتينويك EB لتعزيز تمايز الخلايا العصبية 19، ومن ثم يمكن استخدامها في فحص LysoTracker لتقييم موت الخلايا العصبية في ظل ظروف مختلفة. في الثقافة الطبيعي للخلايا ES متباينة، وهناك عدد قليل الخلايا التي تخضع PCD، ويمكن أن يتم الكشف عن هذه مع LysoTracker و / أو فحوصات TUNEL (2A الشكل). يمكن أن يتسبب PCD من قبل عدد من وكلاء السامة للخلايا مختلفة مثل بيروكسيد الهيدروجين (H 2 O 2) الذي يدفع الضرر التأكسدي ويبدأ مسار أفكارك 20،21. جرعة منخفضة من H 2 O 2 يزيد على حد سواءLysoTracker وتلطيخ TUNEL مقارنة أي علاج، في حين أن نتائج الجرعة العالية في انكماش الخلايا وLysoTracker على نطاق واسع والإيجابية TUNEL. مماثلة لنتائج في الجنين، فمن الممكن أن نرى أن نقاط وصمة عار الإيجابي مع مقايسة TUNEL ولكن ليس مع الصبغة LysoTracker، نقاط وصمة عار فقط مع أن الصبغة LysoTracker، ونقاط والتي تداخل تلطيخ. تتم مقارنة نتيجة للتطبيق وكيل السامة للخلايا أن يدفع لظروف المجاعة apopotosis المصل مما يحفز على الالتهام الذاتي (الشكل 2D). الخلايا التي خضعت لفترة من المجاعة المصل (1 ساعة) يحمل نمطا مختلفا حيث LysoTracker وتلطيخ TUNEL لا تتطابق إلى حد كبير. يتم زيادة تلطيخ LysoTracker بكثير بالمقارنة مع الثقافات غير المعالجة، ولكن TUNEL الإيجابية هي عند مستوياتها الطبيعية.
توظيف الأدوات القياسية المتاحة في أدوبي فوتوشوب، يمكن كميا تلطيخ LysoTracker مع طريقة بسيطة العتبةأن يسمح احد لحساب متوسط مستوى تلطيخ للسكان من الخلايا. الشكل 3A-B يظهر كيف تبدو صورة عينة أثناء عملية القياس الكمي. وبدءا من خط الأساس مع صورة تلطيخ LysoTracker في القناة الحمراء ونواة دابي الملطخة في القناة الزرقاء (لوحة 3A)، thresholded القناة الحمراء من هذه الصورة لتحويل الصورة إلى الأسود والأبيض وكانت وبيضاء بكسل ثم اختيار وفرز (الشكل 3A). وقد تم اختيار مستوى العتبة التي تمثل نمط تلطيخ LysoTracker. كما هو الحال مع أي وسيلة القياس الكمي الذي يستخدم الصور، من المهم تجنب تعريض لصورك لأن ذلك قد يتسبب في خلافات بين أكثر مؤكدا. ويمكن بعد ذلك عدد من النوى في مجال تحسب من خلال النظر في قناة الأزرق فقط (الشكل 3B) وبمناسبة النوى باستخدام أداة رسم مثل الرسام في حين عد (الشكل 3B). يمكن للمرء التعبير عن ال ثممستوى (ه) من تلطيخ عن طريق حساب متوسط مستوى تلطيخ لكل خلية (عدد بكسل / عدد النوى). إذا كان أحد يرغب في استخدام هذه الخوارزمية لفحص من خلال وضع عالية، يمكن أن معظم حزم فحص قياس السطوع في قناة معينة ولها أيضا وظيفة معرف الكائن الذي سيعتمد نوى في أحد الحقول، ولكن لمعظم تطبيقات نموذجية الطريقة اليدوية سريعة و بسيطة. وعلى سبيل المثال، تم كميا منطقة عينة من أرقام 2A-C وتأكيد النتائج أن زيادة تركيزات من أصل 2 نتيجة H 2 O في مستوى أعلى من تلطيخ LysoTracker (الشكل 3C).
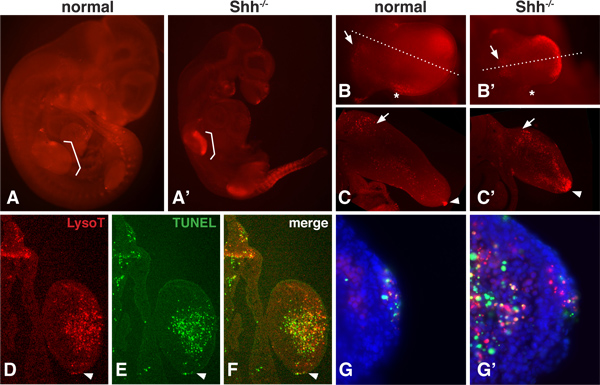
الشكل 1. تلطيخ LysoTracker في الحالات العادية وSHH - الأجنة - /. A، A 'عادي وسويت هومز القابضة - / - أجنة الفئران في DPC 10.5، ملطخة الأحمر LysoTracker، التي تقام في Vectashield وتصويرها تحتوepiflourescence تشريح المجهر. بين قوسين تشير إلى مكان وجود الأمامية B، B 'Forelimb العادية وSHH - / - تصوير الأجنة في أعلى التكبير. لاحظ المجالات الطبيعي للموت الخلايا بما في ذلك 'منطقة نخرية الخلفي' (التي تحمل علامة النجمة) ومنطقة في اللحمة المتوسطة القريبة من برعم الطرف (التي تحمل علامة السهم). أطرافه فارغة SHH يحمل أقوى تلطيخ في الجزء الإنسي القاصي و . C، C '. أقسام طبية من خلال برعم من براعم الأطراف forelimb العادية والخالية. ملاحظة وجود تلطيخ في اللحمة المتوسطة القريبة (السهم) وAER (رأس السهم) من برعم الطرف الطبيعي وتلطيخ قوية داخل اللحمة المتوسطة الظهرية والبطنية والبعيدة داخل برعم الطرف فارغة. DF. نفس القسم (12 ميكرون، مجمدة تم تصوير المقطع) لLysoTracker وTUNEL تلطيخ (روش 1684795). قسم يمر عبر الجزء الأعلى من mesenc فارغة SHHhyme. النقاط رأس السهم إلى AER. نلاحظ كيف أن النمط العام هي مشابهة جدا باستخدام كل الأساليب، ولكن لا تتداخل تلطيخ تماما. G، G '. بسعر أعلى من التكبير AER واللحمة المتوسطة، يمكن للمرء أن يرى كل وجود نقاط والتي هي LysoTracker أو TUNEL إيجابية فقط وكذلك نقاط والتي تداخل تلطيخ.

الشكل 2. كانت مطلية تلطيخ LysoTracker في خلايا ES متباينة. التفريق الخلايا في 8 الدائرة الشرائح في غياب LIF. لاظهار كيف LysoTracker وتلطيخ TUNEL مقارنة، وكان المستحث مسار موت الخلايا المبرمج مع 2 جرعات مختلفة من H 2 O 2، في حين كان المستحث المسار الالتهام الذاتي باستخدام 1 ساعة من الجوع المصل. أخذت هذه الصور مع المجهر متحد البؤر LSM5 زايس A-A'':. الثقافات غير المعالجة تظهر بعض الخلايا العادية كما أشارت إلى ذلك LysoTracker وتلطيخ TUNEL. نمط باستخدام كل التقنيات معظمهم التداخل (الأسهم البيضاء)، ومع ذلك، يمكن للمرء أن يرى نقاط والتي هي قليلة LysoTracker (الأسهم الحمراء) إيجابي فقط B-B''، CC ": المعاملة مع كميات متزايدة من H 2 O 2 يحفز موت الخلايا المبرمج . أقل جرعة يظهر أكثر إيجابية LysoTracker ونقاط وTUNEL بالمقارنة مع الخلايا غير المعالجة، فكلما ارتفعت الجرعة يدفع في LysoTracker أكثر وTUNEL نقاط وإيجابية. الأبيض السهام أشر إلى تلطيخ المتداخلة، في حين السهام الحمراء أشر إلى نقاط والتي هي إيجابية للLysoTracker فقط. ومن الممكن أيضا أن نرى نقاط والتي هي الإيجابية الوحيدة لتلطيخ TUNEL (الأسهم الخضراء) DD ": يمكن أن تحدث مجاعة المصل الالتهام الذاتي، والتي يمكن أن تحفز تراكم المواد في الجسيمات الحالة وautophagolysosomes. نلاحظ كيف العديد من نقاط وأكثر LysoTracker مرئية مقارنة الثقافات غير المعالجة. TUNEL نقاط وإيجابية موجودة (معظمها تداخل LysoTracker وصمة عارجي، السهام البيضاء)، ومع ذلك، فإن العدد ليس زيادة كبيرة مقارنة مع الظروف غير المعالجة. وبالإضافة إلى ذلك، في ظل ظروف المجاعة المصل، LysoTracker فقط نقاط وإيجابية تنتشر بشدة (الأسهم الحمراء).
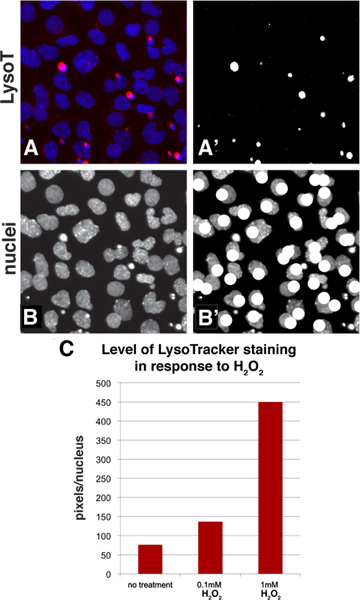
الشكل 3. طريقة القياس الكمي لتقييم مستوى تلطيخ من السكان البالغ عددهم الخلايا باستخدام أدوبي فوتوشوب. A: تم اختيار جزء من الشكل 2A ويظهر LysoTracker (أحمر قناة) وتلوين دابي (نوى والأزرق قناة) في هذه اللوحة 'A: تم thresholded القناة الحمراء من الشكل 3A إلى تحويله إلى والأسود صورة بيضاء. يمكن للبكسل الأبيض ثم يتم اختيار وتحسب باستخدام وظيفة الرسم البياني B-B ': القناة الأزرق يدل على نواة وبينما عد لهم، والصورة يمكن أن تكون مشروحة مع دالة رسم مثل الرسام C: هذا هو سابقوافرة الكمي لعينة من لوحات 2A-C. يتم تمثيل البيانات في بكسل لكل نواة. اضغط هنا لمشاهدتها بشكل اكبر شخصية .
Discussion
بصمات هامة من موت الخلايا المبرمج وتشمل الكشف عن الحمض النووي من التلف مع مقايسة TUNEL، جنبا إلى جنب مع الكشف عن النشاط كاسباس (الكشف عن MABS أو مع جزيء ملزمة مثل ZVAD-ماركا)، ومراقبة التغيرات الخلوية، وطريقة عرض فسفاتيديل (PS ) على سطح الغشاء (الكشف عنها بواسطة Annexin V ملزمة). هن...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نشكر أعضاء المختبر للحصول على مساعدة مارياني تحرير البروتوكول. وقد تم تمويل هذا العمل من قبل على منحة ما بعد الدكتوراه التدريب CIRM (JLF)، والتدريب الجسور CIRM (TZTT)، وروبرت E. ومايو R. رايت في مؤسسة (FVM)، وجامعة جنوب كاليفورنيا (FVM).
Materials
| Name | Company | Catalog Number | Comments | ||||||||||||||
| اسم كاشف | شركة | كتالوج رقم | |||||||||||||||
| LysoTracker الأحمر DND-99 | إينفيتروجن | # L-7528 | |||||||||||||||
| هانكس BSS | إينفيتروجن | 14025-076 | |||||||||||||||
| بارافورمالدهيد | EMD | EM-PX0055-3 | |||||||||||||||
| Vectashield | VECTOR | H-1200 | |||||||||||||||
| DMEM | Cellgro | 10-013-CV | |||||||||||||||
| غير الأحماض الأمينية الأساسية | Cellgro | 25-025-CI | |||||||||||||||
| البيروفات الصوديوم | Cellgro | 25-000-CI | |||||||||||||||
| FBS | Hyclone | SH30071.02 | |||||||||||||||
| القلم بكتيريا | إينفيتروجن | 15140-122 | |||||||||||||||
| B-المركابتويثانول، 50 مم | إينفيتروجن | 21985-023 | |||||||||||||||
| LabTek-II الشرائح غرفة (8-أيضا) | Nalge نونك الدولية | 154534 | |||||||||||||||
| 0.1٪ الجيلاتين | ميليبور | ES-006-B | |||||||||||||||
| Dulbecco في PBS (D-PBS) | Cellgro | 21-031-CV | |||||||||||||||
حل وصفات 4٪ لامتصاص العرق ل100 مل:
تحذير: لامتصاص العرق في شكل "هدب" (مضغوط الكريات الصغيرة) أقل مساحيق وبالتالي يمكن قياس خارج غطاء. ومع ذلك لا يزال يجب عليك ارتداء قناع الغبار واقية (N95على الأقل) أثناء التداول. EB الثقافة وسائل الإعلام وسائل الإعلام لمدة 500 مل EB:
|
References
- Baehrecke, E. H. How death shapes life during development. Nat. Rev. Mol. Cell Biol. 3, 779-787 (2002).
- Meier, P., Finch, A., Evan, G. Apoptosis in development. Nature. 407, 796-801 (2000).
- Ikonomidou, C. Ethanol-induced apoptotic neurodegeneration and fetal alcohol syndrome. Science. 287, 1056-1060 (2000).
- Dunty, W. C., Chen, S. Y., Zucker, R. M., Dehart, D. B., Sulik, K. K. Selective vulnerability of embryonic cell populations to ethanol-induced apoptosis: implications for alcohol-related birth defects and neurodevelopmental disorder. Alcohol Clin. Exp. Res. 25, 1523-1535 (2001).
- Price, O. T., Lau, C., Zucker, R. M. Quantitative fluorescence of 5-FU-treated fetal rat limbs using confocal laser scanning microscopy and Lysotracker. Cytometry A. 53, 9-21 (2003).
- Jacobson, M. D., Weil, M., Raff, M. C. Programmed cell death in animal development. Cell. 88, 347-354 (1997).
- Fuchs, Y., Steller, H. Programmed cell death in animal development and disease. Cell. 147, 742-758 (2011).
- Qu, X. Autophagy gene-dependent clearance of apoptotic cells during embryonic development. Cell. 128, 931-946 (2007).
- Grimsley, C., Ravichandran, K. S. Cues for apoptotic cell engulfment: eat-me, don't eat-me and come-get-me signals. Trends Cell Biol. 13, 648-656 (2003).
- Lauber, K., Blumenthal, S. G., Waibel, M., Wesselborg, S. Clearance of apoptotic cells: getting rid of the corpses. Mol. Cell. 14, 277-287 (2004).
- Haller, T., Dietl, P., Deetjen, P., Volkl, H. The lysosomal compartment as intracellular calcium store in MDCK cells: a possible involvement in InsP3-mediated Ca2+ release. Cell Calcium. 19, 157-165 (1996).
- Zucker, R. M., Hunter, S., Rogers, J. M. Confocal laser scanning microscopy of apoptosis in organogenesis-stage mouse embryos. Cytometry. 33, 348-354 (1998).
- Zucker, R. M., Hunter, E. S., Rogers, J. M. Apoptosis and morphology in mouse embryos by confocal laser scanning microscopy. Methods. 18, 473-480 (1999).
- Gavrieli, Y., Sherman, Y., Ben-Sasson, S. A. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J. Cell Biol. 119, 493-501 (1992).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J. Vis. Exp. (51), e2720 (2011).
- Chiang, C. Manifestation of the limb prepattern: limb development in the absence of sonic hedgehog function. Dev. Biol. 236, 421-435 (2001).
- Ishibashi, M., McMahon, A. P. A sonic hedgehog-dependent signaling relay regulates growth of diencephalic and mesencephalic primordia in the early mouse embryo. Development. 129, 4807-4819 (2002).
- Schuldiner, M. Induced neuronal differentiation of human embryonic stem cells. Brain Res. 913, 201-205 (2001).
- Bain, G., Kitchens, D., Yao, M., Huettner, J. E., Gottlieb, D. I. Embryonic stem cells express neuronal properties in vitro. Dev. Biol. 168, 342-357 (1995).
- Dumont, A. Hydrogen peroxide-induced apoptosis is CD95-independent, requires the release of mitochondria-derived reactive oxygen species and the activation of NF-kappaB. Oncogene. 18, 747-757 (1999).
- Hampton, M. B., Orrenius, S. Dual regulation of caspase activity by hydrogen peroxide: implications for apoptosis. FEBS Lett. 414, 552-556 (1997).
- Wood, W. Mesenchymal cells engulf and clear apoptotic footplate cells in macrophageless PU.1 null mouse embryos. Development. 127, 5245-5252 (2000).
- Scott, R. C., Juhasz, G., Neufeld, T. P. Direct induction of autophagy by Atg1 inhibits cell growth and induces apoptotic cell death. Curr. Biol. 17, 1-11 (2007).
- Rodriguez-Enriquez, S., Kim, I., Currin, R. T., Lemasters, J. J. Tracker dyes to probe mitochondrial autophagy (mitophagy) in rat hepatocytes. Autophagy. 2, 39-46 (2006).
- Bampton, E. T., Goemans, C. G., Niranjan, D., Mizushima, N., Tolkovsky, A. M. The dynamics of autophagy visualized in live cells: from autophagosome formation to fusion with endo/lysosomes. Autophagy. 1, 23-36 (2005).
- Boya, P., Mellen, M. A., de la Rosa, E. J. How autophagy is related to programmed cell death during the development of the nervous system. Biochem. Soc. Trans. 36, 813-817 (2008).
- Galluzzi, L. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death Differ. 16, 1093-1107 (2009).
- Klionsky, D. J. Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes. Autophagy. 4, 151-175 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved