このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
胚におけるプログラム細胞死を検出するためのLysoTrackerの使用は、胚性幹細胞を分化
要約
我々は、マウス胚とLysoTrackerと呼ばれる非常に水溶性染料を使用して差別化胚性幹(ES)細胞培養でプログラムされた細胞死(PCD)の領域を可視化するための単純なプロトコルを提示。
要約
プログラム細胞死(PCD)は、通常の組織の恒常性を維持し、胎生発育中の組織や臓器1,2,6,7を形作るために成人に発生します。開発時には、有毒化学物質や遺伝子の変化は、PCDの増加の原因になったり、発育異常、先天性異常、結果3-5で、PCDのパターンを変更することができます。これらの欠陥の原因を理解するために、胚の研究は、胚性幹(ES)細胞を分化使用in vitroアッセイで補完することができます。
アポトーシスは、カスパーゼ酵素カスケードを活性化するシグナル伝達内因性及び外因性の両方が関与し、PCDのよく研究形態である。特徴的な細胞の変化は、膜ブレブ形成、核の縮小、およびDNA断片化が含まれています。 PCDの他の形態は、カスパーゼの活性化を伴わないと長引くオートファジーの最終結果かもしれません。かかわらず、PCD経路の、死細胞を除去することが必要。成人では、免疫細胞PERF胚では、免疫系がまだ発達していない場合には、除去、代替メカニズムによって発生している間は、この機能をORM。このメカニズムは、貪食役割彼らは瀕死細胞と巻き込むこと8月10日の表面に"私を食べて"信号を認識する上で取る隣接するセル(以下、 "非専門食細胞"と呼ばれる)が含まれます。貪食した後、破片が分解のためのリソソームに運ばれます。したがってかかわらずPCD機構は、リソソーム活性の上昇は、細胞死の増加と相関させることができる。
PCDは、厚い組織と多層差別の文化ではリソソームを可視化するための単純な検定を勉強しておくと便利です。 LysoTracker染料は、リソソーム11月13日のような酸性の細胞内区画内に保持される溶解性の高い小分子である。色素が拡散によって、循環を通じて取り上げられています。浸透は支障はないので、厚い組織と多層培養におけるPCDの可視化が可能である12,13 14は 、小さなサンプル、組織切片、及び単層培養に制限されています。
拡散し、溶剤によって溶解されるアニリンブルー、とは対照的に、LysoTrackerレッドDND-99は、修正可能な明るく、かつ安定しています。染色はホールマウントまたは水性または溶剤ベースマウントメディア12,13を使用して、セクション内の標準的な蛍光または共焦点顕微鏡を用いて可視化することができます。ここではノーマルとソニックヘッジホッグヌルのマウス胚でPCDを見て、この染料を使用してプロトコルを記述。加えて、我々はES細胞培養物の区別にPCDの分析を示し、単純な定量化法を提案する。要約すると、LysoTracker染色は、PCDを検出する他の方法に大きな補完することができます。
プロトコル
1。マウス胚のLysoTracker染色
- 男性のスタッドケージに若い(5-6週齢)の雌を配置することによって、マウスの胚を生成します。その交配を示す膣栓の外観については、次の朝にはモニタが発生しました。女性が妊娠している場合は、その日の正午は0.5 DPC(日後に性交)と呼ばれています。ここで紹介する手順は、胚7月13日DPCに最適です。
- 興味のある胚当日は、承認されたプロトコルに従って女性を安楽死させると子宮を取り除く。ハンクスBSS(フェノールレッドなし)10cmペトリ皿の中の脱落膜から胚を取り出します。胚外膜を取り出して、少なくとも一つは無関係な組織や血液を除去するためにハンクスBSSとすすぎん。
- LysoTracker胚の染色液(ハンクスBSS内の5mM LysoTracker)を準備します。 1から2リットルのための便利な音量は5ミリリットルです。優しく均等に染料を支払うために混ぜる。
- LysoTracker胚の染色solutをに胚を追加45分間微量遠心チューブまたは37℃でインキュベートしたバイアル内のイオン。
- ハンクスBSSに非常に穏やかに4回、各5分間洗浄をすすぐ。
- 一晩4%パラホルムアルデヒドで固定してください。
- 修正プログラムを削除するには、ハンクスBSS、10分に一回すすいでください。
- バックグラウンド染色を排除するためにメタノールシリーズ(50%、75%、80%、100%、5分間の各ステップ)を介して脱水する。これは、撮像時に良好な信号対雑音比を達成するために重要です。
- この時点で、光から保護し、-20℃でメタノールで無期限胚サンプルを格納することができます。
注:組織サンプルをDNAタイピングのための任意のステップで撮影することができます、しかし、それはここまでのステップに全てのサンプルをバッチ処理できるように単に保存する前に、サンプルを取るために最も便利なことができます。各胚から尾、四肢、あるいは頭部から組織のサンプルを採取し、別のチューブにすべて置く。組織サンプルを再水和するとgenotyための準備pingを実行します。
2。 ESの文化を差別化LysoTracker染色
- 20μlのドロップあたり500細胞の密度で始まるハンギングドロップ法15を介して胚様体を準備します。
- 3日後、非接着ペトリ皿(細菌学的仕事のために使用されているもの、 すなわち )10 CMに懸濁培養に胚様体を転送します。 2日ごとにメディアを変え5日間培養し、。
- 7日目に、糊化8ウェルチャンバースライドに胚様体を転送(チャンバーに0.1%ゼラチンを加え、5分待ってから削除して、メディアを追加します)。室あたり1-2胚様体を転送します。
- 一日おきにメディアを変える10日間培養。ガラス表面に付着した胚様体を乱さないようにするようにチャンバースライドの隅にピペットを置くように注意してください。また、新鮮な培地を追加するときにはまた、室内の隅にピペットを置き、徐々にメディアを解放します。
- カルトの10日後UREは、ポジティブコントロールとしてアポトーシスを誘導するために、0.1 mMおよび1.0mMのH 2 O 2を用いた井戸のいくつかを扱う60分間(新鮮なメディア、ミックスにH 2 O 2を追加して、セルに追加します)。 D-PBSと通常のメディアで一晩培養した培養液で二回すすぎ。
- 優しく、既存のメディアを吸引し、LysoTracker細胞染色液(メディアで500nMのLysoTracker(最終濃度)、チャンバーあたり300μl)を追加します。
- 15分間37℃でインキュベートする。
- D-PBSで2回、各5分間で二回すすぎ。
- 室温で15分間、4%パラホルムアルデヒドで固定してください。
- D-PBS、5分で二回すすぎ。
3。 LysoTrackerのステンド胚またはES文化の表示
- 空気は、約5分間乾燥させ;;スライドオフ室を除去する工程; D-PBSを吸引することにより顕微鏡用細胞サンプルを準備してから、水性封入剤(DAPIでVectashieldまたは類似の)を加える。 dryinながら箔障壁を置き蛍光色素の漂白減少するグラム。 Vectashieldまたは類似の深いうつ病のガラス皿や小さなシャーレに胚をマウントします。
- ローダミンまたはテキサスレッドフィルター(:590分の577 nmのLysoTrackerレッドDND-99、励起/発光)を装備解剖または化合物を顕微鏡で可視化する。染色は、一般的にかなり明るいですので、長時間露光は通常必要ありません。
4。イメージング技術を使用した結果の定量化
- マニュアルモードで同じ露光条件の下であなたのサンプルのデジタル写真を撮る。
- Adobe Photoshopまたは類似のイメージングプログラムで画像を開きます。 LysoTracker染色の量を調べるには、赤チャンネルおよびしきい値を選択し、赤い染色が今、白いピクセルで表されるようなイメージ(白黒に画像を変換します)。白のピクセルを選択し、合計カウントを取得するためにヒストグラム関数を使用します。
- カウントする青色チャネルを使用フィールド内の核の数。これは、画像に注釈を付けることにより、カウントの記録を保管しておくことができます。
- 値を記録した後、セル当たりの平均染色レベルを計算します。サンプルを取りたいすべての画像に同じしきい値設定でこの分析を繰り返します。
5。代表的な結果
そのようなソニックヘッジホッグ(Shh)などの増殖因子遺伝子は、16,17を削除されたときに変更することができます胚の発生過程で、PCDの正常なパターンがあります。 LysoTrackerは非常に拡散性のある小分子色素であるため、全胚は、間葉12,13の奥深くにあってもPCDエリアを評価することが可視化することができる図1は正常と ShhのためLysoTracker染色パターンを示している- / -変異マウス胚で10.5dpc。特に四肢及び体節レジオで、変異胚- / -この段階では、PCDは大幅に増加さシーッNS。胚の部分が全体のパターンを評価するために、高倍率(1B)でホールマウントで撮像することができる。切開部分も振動ミクロトーム(1C)以上詳細にPCDの領域を明らかにするクライオスタット(DF)との区分けすることができます。
TUNEL分析は最高のターミナルトランスフェラーゼの浸透が少ない問題がある薄いセクションで行われます。 LysoTracker染色とTUNELアッセイは、同じ組織( 図1D-G)で行うことができます。これらの結果は、LysoTrackerとTUNEL染色、かなりPCDの重なりの一般的な領域の間の厳密な1時01分の相関関係がありませんが。高倍率で、それはLysoTracker染料のみで染色することpuncta、TUNELアッセイとなくLysoTracker染料で陽性に染色することpunctaを参照することが可能となり、puncta染色が重複していること。
EBは、ゼラチンでコーティングされた表面上にメッキされると、分化細胞がmigratますeが外側。培養10日後に、細胞を神経細胞、筋肉細胞、心筋細胞を含む種々の細胞型に分化しているでしょう。 図2に示されている文化はこれらの細胞型の混合集団を含んで、しかし1は、関心のある特定の細胞型のPCD研究する我々のプロトコルを適応させることができます。例えば、EBは19ニューロンの分化を促進するためにレチノイン酸で処理することができ、その後LysoTrackerアッセイは異なる条件下で神経細胞死を評価するために使用することができる。分化したES細胞の正常な文化では、PCDを受け、これらがLysoTracker及び/又はTUNELアッセイ( 図2A)を用いて検出することができる少数の細胞があります。 PCDは、そのような酸化的損傷を誘導し、アポトーシス経路20,21を開始過酸化水素(H 2 O 2)などの異なる細胞毒性薬の数によって誘導することができる。 H 2 O 2の低用量の両方を増加させるLysoTrackerとTUNEL染色では、無治療と比較して、細胞収縮と広範LysoTrackerおよびTUNEL陽性で高用量の結果ながら。胚における結果と同様に、それはLysoTracker染料のみで染色することpuncta、TUNELアッセイとなくLysoTracker染料で陽性に染色することpunctaを参照することが可能となり、puncta染色が重複していること。 apopotosisを誘導する細胞毒性剤の適用の結果は、オートファジー( 図2D)を誘発血清飢餓状態と比較されます。血清飢餓の期間(1時間)を受けた細胞がLysoTrackerとTUNEL染色は非常に相関していない別のパターンを示す。 LysoTracker染色は非常にしかし、TUNEL陽性が正常なレベルであり、未治療の文化と比較して増加しています。
Adobe Photoshopで利用できる標準的なツール採用、LysoTracker染色は、単純なしきい値法で定量化することができるそれは、1つの細胞集団の平均染色レベルを計算することができます。 図3A-Bは 、サンプル画像が定量化プロセスの間にどのように見えるかを示しています。 LysoTrackerの赤チャンネルの染色および青チャネル(パネル3A)において、DAPI染色された核を持つベースラインイメージを皮切りに、この画像の赤チャンネルが白黒に画像を変換するためにしきい値処理と白のピクセルがあった次に、選択した( 図3A ')カウント。しきい値レベルはLysoTrackerの染色パターンを表していることを選ばれました。画像を使用する任意の定量法と同様に、これは潜在的に過剰強調差が生じる可能性があるので、あなたの写真をoverexposing避けるために重要です。フィールド内の核の数は、ちょうど青チャンネル( 図3B)を見ていると( 図3B ')数えながらそのような絵筆などの描画ツールを使って核をマークすることでカウントすることができます。一つは、次に目を表現することができますセルごとに染色の平均レベルを算出することで染色の電子レベル(画素/核のカウント数)。ハイスループット·スクリーニングのためにこのアルゴリズムを使用する1つの願いをした場合、ほとんどのスクリーニングパッケージは、特定のチャネルで明るさを測り、またフィールドで核をカウントするオブジェクト識別子の機能を持たせることができる、しかし、最も一般的なアプリケーション用に手動の方法は迅速であり、シンプル。例を挙げれば、 図2A-Cからサ ンプル領域を定量化し、その結果がLysoTracker染色( 図3C)のより高いレベルでのH 2 O 2の結果の濃度を増加させていることを確認した。
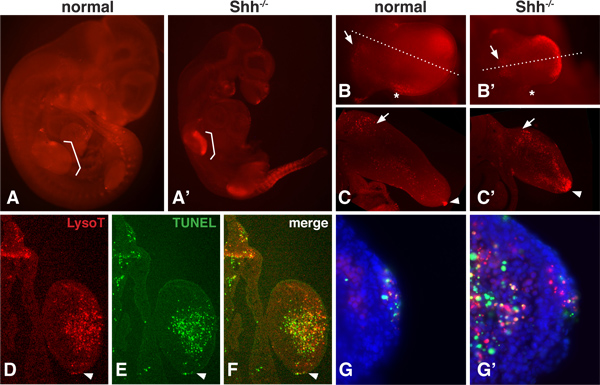
図1。 - / -胚ノーマルとShhでLysoTracker染色。 、 'ノーマルと Shh - / - LysoTrackerレッドで染色10.5 DPC、、でマウス胚はVectashieldに取り付けられ、下で撮影epiflourescence解剖顕微鏡。ブラケットは、前肢の位置を示すA、B、B 'は正常とShhの前肢- / -胚は高い倍率で結像する。 '事後壊死ゾーン'(アスタリスク付き)および肢芽間充織の近位(矢印でマークされている)で領域を含む細胞死の正常なドメインに注意してください。Shhのヌル手足が内側と遠位部で強い染色を示すC、C '。ノーマルとヌルの両方肢芽の前肢芽を通じて前頭セクション。ヌル肢芽内の正常な肢芽と背側と腹側および遠位の間充織内で強い染色の近充織(矢印)とAER(矢じり)で染色の存在に注意してください。DF。同じセクション(12ミクロン、凍結セクション)LysoTrackerとTUNEL染色(ロッシュ1684795)のために画像化した。セクションは 、Shhヌルmesencの遠位部を通過するhyme。 AERに矢印を指しています。全体的なパターンは、両方の方法を使用して非常に類似している方法は、しかし染色は完全に重ならないように注意してください。G、G '。AERと間葉の高倍率で、一つはLysoTrackerまたはTUNEL陽性アールpunctaの存在の両方を見ることができます染色が重複しているpunctaのみだけでなく、。

図2。分化したES細胞の染色LysoTracker。分化細胞は、LIFの不在下で8チャンバースライドに播種した。オートファジー経路は血清飢餓の1時間を使って誘導されながらLysoTrackerとTUNEL染色を比較する方法を示すために、アポトーシス経路は、H 2 O 2の2つの異なる用量で誘発された。これらの画像はツァイスLSM5共焦点顕微鏡で撮影した- '':。未処理培養物LysoTによって示されるように、いくつかの正常なアポトーシスを示すラッカーとTUNEL染色。ほとんど両方の技術の重複を(白矢印)を使用してパターンは、しかし、1つは正のLysoTrackerあるいくつかpunctaを見ることができます(赤矢印) のB-B '、C-C ":H 2の量を増加による治療O 2がアポトーシスを刺激。低用量は、未処理細胞と比較して、よりLysoTrackerとTUNEL陽性punctaを示しています。のみLysoTrackerが陽性であることpunctaに赤い矢印がポイントしながら、より高い線量は、染色が重なって、さらにLysoTrackerとTUNEL陽性puncta。白い矢印ポイントに誘導する。それはTUNEL染色(緑の矢印)のみ陽性であるpunctaを参照することも可能ですDD ":血清飢餓は、リソソームとautophagolysosomesで材料の蓄積を刺激することができるオートファジーを誘導することができます。未処理培養に比べて表示されているどのように多くのLysoTrackerのpunctaに注意してください。 TUNEL陽性punctaが存在しています(このうちのほとんどがLysoTracker染色重複しているり、白矢印)が、しかし、数は、未処理の条件に比べて大幅に増加していません。また、血清飢餓条件下で、LysoTracker専用ポジティブpunctaは非常に普及している(赤矢印)。
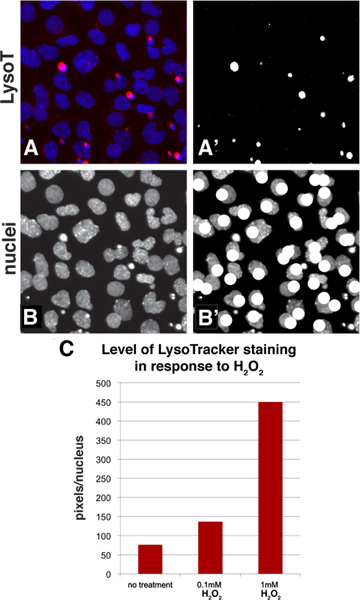
図3。 Adobe Photoshopを使用して細胞集団における染色のレベルを評価するための定量法。 :図2Aの部分が選ばれたとLysoTracker(赤チャンネル)とDAPI染色(核、青のチャンネル)がこのパネルに表示されます':図3Aの赤チャンネルはに変換するために閾値処理された黒と白のイメージ。白のピクセルが選択され、次にヒストグラム機能を使用してカウントすることができ、B-B ':。青チャンネルは核を示しており、その数をカウントしながら、画像は、絵筆などの描画機能を付けることができますC:これは、EXですパネル2A〜Cからのサンプルの十分な定量化。データは、核あたりのピクセル数として表されます。 拡大図を表示するには、ここをクリックしてください 。
ディスカッション
アポトーシスの重要な特徴は、カスパーゼ活性の検出と共にTUNELアッセイによるDNA損傷、(例えばZVAD-FMKとしてmAbまたは結合分子で検出)の検出、細胞の変化を観察し、ホスファチジルセリン(PSのプレゼンテーションを含める膜表面上)(アネキシンV結合によって検出された)。これらのアッセイのそれぞれのいくつかの欠点があります。例えば、TUNELアッセイで使用されるターミナルトラ?...
開示事項
特別な利害関係は宣言されません。
謝辞
私たちは、プロトコルを編集助けマリアーニ研究室のメンバーに感謝。この作品はCIRMポスドクトレーニンググラント(JLF)、CIRM BRIDGESのインターンシップ(TZTT)、ロバート·Eと5月R.ライト財団(FVM)と、南カリフォルニア大学(FVM)によって賄われていた。
資料
| Name | Company | Catalog Number | Comments | ||||||||||||||
| 試薬の名称 | 会社 | カタログ番号 | |||||||||||||||
| LysoTrackerレッドDND-99 | インビトロジェン | #L-7528 | |||||||||||||||
| ハンクスBSS | インビトロジェン | 14025-076 | |||||||||||||||
| パラホルムアルデヒド | EMD | EM-PX0055-3 | |||||||||||||||
| Vectashield | VECTOR | H-1200 | |||||||||||||||
| DMEM | Cellgro | 10から013-CV | |||||||||||||||
| 非必須アミノ酸 | Cellgro | 25から025-CI | |||||||||||||||
| ピルビン酸ナトリウム | Cellgro | 25から000-CI | |||||||||||||||
| FBS | Hyclone社 | SH30071.02 | |||||||||||||||
| ペンのStrep | インビトロジェン | 15140-122 | |||||||||||||||
| b-メルカプトエタノール、50mMの | インビトロジェン | 21985-023 | |||||||||||||||
| LabTek-Ⅱチャンバースライド (8ウェル) | Nalgeヌンクインターナショナル | 154534 | |||||||||||||||
| 0.1%ゼラチン | ミリポア | ES-006-B | |||||||||||||||
| ダルベッコPBS(D-PBS) | Cellgro | 21から031-CV | |||||||||||||||
ソリューションレシピ 4%パラホルムアルデヒド 100ミリリットルの場合:
警告: 'フリル'の形式でパラホルムアルデヒド(圧縮された小さなペレット)小さい粉状であるため、フードの外で測定することができます。しかし、あなたはまだ防塵マスク(N95を着用する必要があります取扱い中)少なくとも。 EB文化メディア 500ミリリットルEBメディアの場合:
|
参考文献
- Baehrecke, E. H. How death shapes life during development. Nat. Rev. Mol. Cell Biol. 3, 779-787 (2002).
- Meier, P., Finch, A., Evan, G. Apoptosis in development. Nature. 407, 796-801 (2000).
- Ikonomidou, C. Ethanol-induced apoptotic neurodegeneration and fetal alcohol syndrome. Science. 287, 1056-1060 (2000).
- Dunty, W. C., Chen, S. Y., Zucker, R. M., Dehart, D. B., Sulik, K. K. Selective vulnerability of embryonic cell populations to ethanol-induced apoptosis: implications for alcohol-related birth defects and neurodevelopmental disorder. Alcohol Clin. Exp. Res. 25, 1523-1535 (2001).
- Price, O. T., Lau, C., Zucker, R. M. Quantitative fluorescence of 5-FU-treated fetal rat limbs using confocal laser scanning microscopy and Lysotracker. Cytometry A. 53, 9-21 (2003).
- Jacobson, M. D., Weil, M., Raff, M. C. Programmed cell death in animal development. Cell. 88, 347-354 (1997).
- Fuchs, Y., Steller, H. Programmed cell death in animal development and disease. Cell. 147, 742-758 (2011).
- Qu, X. Autophagy gene-dependent clearance of apoptotic cells during embryonic development. Cell. 128, 931-946 (2007).
- Grimsley, C., Ravichandran, K. S. Cues for apoptotic cell engulfment: eat-me, don't eat-me and come-get-me signals. Trends Cell Biol. 13, 648-656 (2003).
- Lauber, K., Blumenthal, S. G., Waibel, M., Wesselborg, S. Clearance of apoptotic cells: getting rid of the corpses. Mol. Cell. 14, 277-287 (2004).
- Haller, T., Dietl, P., Deetjen, P., Volkl, H. The lysosomal compartment as intracellular calcium store in MDCK cells: a possible involvement in InsP3-mediated Ca2+ release. Cell Calcium. 19, 157-165 (1996).
- Zucker, R. M., Hunter, S., Rogers, J. M. Confocal laser scanning microscopy of apoptosis in organogenesis-stage mouse embryos. Cytometry. 33, 348-354 (1998).
- Zucker, R. M., Hunter, E. S., Rogers, J. M. Apoptosis and morphology in mouse embryos by confocal laser scanning microscopy. Methods. 18, 473-480 (1999).
- Gavrieli, Y., Sherman, Y., Ben-Sasson, S. A. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J. Cell Biol. 119, 493-501 (1992).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J. Vis. Exp. (51), e2720 (2011).
- Chiang, C. Manifestation of the limb prepattern: limb development in the absence of sonic hedgehog function. Dev. Biol. 236, 421-435 (2001).
- Ishibashi, M., McMahon, A. P. A sonic hedgehog-dependent signaling relay regulates growth of diencephalic and mesencephalic primordia in the early mouse embryo. Development. 129, 4807-4819 (2002).
- Schuldiner, M. Induced neuronal differentiation of human embryonic stem cells. Brain Res. 913, 201-205 (2001).
- Bain, G., Kitchens, D., Yao, M., Huettner, J. E., Gottlieb, D. I. Embryonic stem cells express neuronal properties in vitro. Dev. Biol. 168, 342-357 (1995).
- Dumont, A. Hydrogen peroxide-induced apoptosis is CD95-independent, requires the release of mitochondria-derived reactive oxygen species and the activation of NF-kappaB. Oncogene. 18, 747-757 (1999).
- Hampton, M. B., Orrenius, S. Dual regulation of caspase activity by hydrogen peroxide: implications for apoptosis. FEBS Lett. 414, 552-556 (1997).
- Wood, W. Mesenchymal cells engulf and clear apoptotic footplate cells in macrophageless PU.1 null mouse embryos. Development. 127, 5245-5252 (2000).
- Scott, R. C., Juhasz, G., Neufeld, T. P. Direct induction of autophagy by Atg1 inhibits cell growth and induces apoptotic cell death. Curr. Biol. 17, 1-11 (2007).
- Rodriguez-Enriquez, S., Kim, I., Currin, R. T., Lemasters, J. J. Tracker dyes to probe mitochondrial autophagy (mitophagy) in rat hepatocytes. Autophagy. 2, 39-46 (2006).
- Bampton, E. T., Goemans, C. G., Niranjan, D., Mizushima, N., Tolkovsky, A. M. The dynamics of autophagy visualized in live cells: from autophagosome formation to fusion with endo/lysosomes. Autophagy. 1, 23-36 (2005).
- Boya, P., Mellen, M. A., de la Rosa, E. J. How autophagy is related to programmed cell death during the development of the nervous system. Biochem. Soc. Trans. 36, 813-817 (2008).
- Galluzzi, L. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death Differ. 16, 1093-1107 (2009).
- Klionsky, D. J. Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes. Autophagy. 4, 151-175 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved