Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Embriyolar yılında Programlı Hücre Ölümü Algılama LysoTracker kullanımı ve Embriyonik Kök Hücreler Farklılaşan
Bu Makalede
Özet
Biz fare embriyolarının programlanmış hücre ölümü bölgeleri (PCD) ve LysoTracker adlı oldukça çözünür boya kullanarak embriyonik kök (ES) hücre kültürleri ayırt görselleştirmek için basit bir protokol mevcut.
Özet
Programlanmış hücre ölümü (PCD) normal doku homeostazı muhafaza etmek ve embriyolojik gelişimi sırasında doku ve organların 1,2,6,7 şekillendirmeye yetişkinlerde görülür. Gelişimi sırasında, toksik kimyasallar ve genetik değişiklikler PCD bir artışa neden olabilir veya gelişimsel anomalileri ve doğum kusurlarına 3-5 sonuçlanan PCD kalıplarını değiştirebilirsiniz. Bu defektlerin etyolojisi anlamak için, embriyo çalışmada embriyonik kök (ES) hücreler ayırt kullanabilirsiniz in vitro tayinlerde ile tamamlanabilir.
Apoptoz kaspaz enzim kaskad etkinleştirmek için sinyal içsel ve dışsal hem de içerir PCD iyi çalışılmış şeklidir. Karakteristik hücre değişiklikleri zarı blebbing, nükleer daralma ve DNA fragmantasyonu içerir. PCD diğer formları kaspaz aktivasyonunun içermeyen ve uzun otofaji ve nihai sonucu olabilir. Ne olursa olsun PCD yolunun, ölen hücrelerin çıkarılması gerekir. Erişkinlerde, bağışıklık hücrelerinin perfembriyolarda, bağışıklık sistemi henüz oluşmamış, nerede kaldırma alternatif bir mekanizma ile oluşur ise, bu fonksiyonu yapýnýz. Bu mekanizma alarak komşu hücreleri ("non-profesyonel fagositler" denir) içeren bir fagositik rol onlar ölüyor hücre ve yutmak 8-10 yüzeyinde sinyal 'ye beni' tanır. Yutulma sonra, kalıntı bozulması için lizozom getirilir. Böylece bağımsız PCD mekanizması, lizozomal aktivite artışı artan hücre ölümü ile ilişkili olabilir.
PCD, kalın dokular ve çok katmanlı ayırt kültürlerde lizozomlar görselleştirmek için basit bir tahlil incelemek yararlı olabilir. LysoTracker bu tür boya lizozom 11-13 gibi asidik hücre içi bölmeler içinde tutulan bir yüksek derecede çözünür küçük bir moleküldür. Boya difüzyon ile ve dolaşım yoluyla alınır. Penetrasyon kalın dokular ve çok katmanlı kültürlerinde PCD bir engel, görselleştirme olmadığı 12,13 mümkündür 14, küçük örnekler, histolojik bölümler ve tek tabakalı kültürler ile sınırlıdır.
Yayılır ve çözücüler tarafından çözülür Anilin mavisi, aksine, LysoTracker Kırmızı DND-99 düzeltilebilir, parlak, ve kararlı. Boyama bütün montaj veya sulu veya çözücü bazlı montaj medya 12,13 kullanarak bölümünde standart floresan veya konfokal mikroskopi ile görüntülenebilmektedir. Burada normal ve sonik kirpi boş fare embriyolarının PCD bakmak için bu boya kullanılarak protokolleri tanımlar. Buna ek olarak, ES hücre kültürlerinde ayırt PSD analizi gösteren basit bir miktar yöntem sunuyoruz. Özet olarak, LysoTracker boyama PCD saptanmasında diğer yöntemler için büyük bir tamamlayıcı olabilir.
Protokol
1. Fare Embryolarının LysoTracker Boyama
- Erkek damızlık kafesi içine genç (5-6 haftalık) kadın koyarak fare embriyoları oluşturun. Bu çiftleşme gösteren bir vajinal fiş görünümü için aşağıdaki sabahları Monitör oluştu. Kadın hamile ise, o gün öğlen 0.5 DPC (gün sonrası çiftleşme) denir. Burada sunulan prosedür embriyolar 7-13 DPC için idealdir.
- Ilgi embriyonik gününde, onaylı protokollere göre kadın ötenazi ve rahim kaldırmak. Hanks BSS (fenol kırmızısı olmadan) ile 10 santimetrelik bir petri tabağına desidua dan embriyolar çıkarın. Ekstra embriyonik membranlar çıkarın ve en az bir gereksiz doku ve kan kaldırmak Hanks BSS ile yıkayın yok.
- LysoTracker Embriyo Boyama Çözüm (Hanks BSS 5 mM LysoTracker) hazırlayın. 1-2 litre için uygun bir hacmi 5 ml 'dir. Yavaşça eşit boya dağıtacak karıştırın.
- LysoTracker Embriyo Boyama Solut embriyo ekle45 dakika için bir mikrofüj tüpü ya da 37 ° C 'de ve flakon inkübe iyon.
- Hanks BSS çok yavaşça dört kez, 5 dakika, her yıkama yıkayın.
- Gecede 4% Paraformaldehyde düzelt.
- Düzeltmesini kaldırmak için, Hanks BSS, 10 dakika içinde bir kez yıkayın.
- Arka plan boyama ortadan kaldırmak için bir metanol serisi (% 50,% 75,% 80,% 100, 5 dk her adımda) aracılığıyla kurutmak. Bu görüntüleme sırasında iyi sinyal-gürültü elde etmek için önemlidir.
- Bu noktada ışıktan koruyarak, -20 ° C'de metanol içinde süresiz embriyo örnekleri saklayabilirsiniz.
Not: Bir doku örneği DNA genotipleme için herhangi bir aşamasında alınabilir, ancak, o kadar bu adımı tüm numunelerin toplu işlenmiş olabilir bu yüzden sadece depolama önce bir örnek almak için en uygun olabilir. Her embriyodan kuyruk, bacak veya kafa doku örneği toplayın ve ayrı tüpler içine tüm koymak. Doku örneği rehidrate ve genoty hazırlamakping.
2. ES Kültürleri Farklılaşan arasında LysoTracker Boyama
- 20 ul damla başına 500 hücre, bir başlangıç yoğunluğunda Asılı damla yönteminde, 15 aracılığı ile embriyoid organları hazırlayın.
- 3 gün sonra, 10 cm yapışmaz Petri kapları (bakteriyolojik çalışma için kullanılan bu yani) üzerine süspansiyon kültürü embriyoid organları aktarın. Medya her 2 günde değişen 5 gün, Kültür.
- Günde 7 günü, jelatinize 8-iyi kamara slaytlara embriyoid organları aktarmak (odalarına Jelatin% 0.1 ekleyin, 5 dakika beklemek kaldırmak ve medya ekleyin). Kamara başına 1-2 embriyoid organları aktarın.
- Her geçen gün medyanın değişen 10 gün, Kültür. Embriyoid vücut cam yüzeyine takılarak karıştırmayı vermeyecek şekilde odasına slayt köşesinde pipet yerleştirmek için dikkatli olun. Ayrıca taze medya da odanın köşesinde pipet yerleştirin ve ortamı yavaşça serbest eklerken.
- Kült 10 gün sonraure, bir pozitif kontrol olarak apoptozu indüklemek için, 0.1 mM, 1.0 mM ve H2O 2 ile kuyu bazı tedavi etmek için 60 dakika (taze ortam karışımı H2O 2 ekleyin, daha sonra hücrelere ilave ediniz). D-PBS ve düzenli medya gecede kültürü ile iki kez durulayın.
- Yavaşça mevcut medya aspire ve LysoTracker Hücre boyama çözeltisi (ortam içinde 500 nM LysoTracker (nihai konsantrasyon), bölme başına 300 ul) ilave edilir.
- 15 dakika boyunca 37 ° C'de inkübe edin.
- D-PBS 2 kere, 5 dakika her biri ile iki kere yıkayın.
- RT 15 dakika boyunca% 4 paraformaldehid Fix.
- D-PBS, 5 dakika ile iki kere yıkayın.
3. LysoTracker Vitray Embriyolar veya ES Kültürleri görüntüleniyor
- D-PBS aspire tarafından mikroskopi için hücre örnekleri hazırlayın; slaydın dışına odasına kaldırarak; hava yaklaşık 5 dakika kurutma; sonra sulu bir montaj orta (DAPI veya benzeri Vectashield) ekleyerek. Kurutma dola sırasında folyo bariyer yerleştiring fluorofor ağartma azaltmak için. Vectashield veya benzer bir derin depresyon cam tabak veya küçük Petri kabındaki embriyolar monte edin.
- Bir rodamin veya Texas Red filtresi ile donatılmış bir diseksiyon veya bileşik mikroskop ile Visualize (LysoTracker KIRMIZI DND-99, Uyarma / Emisyon: 577/590 nm). Boyanma genellikle oldukça parlak yani uzun pozlama genellikle gerekli değildir.
4. Görüntüleme Teknikleri Kullanılarak Sonuçlar kantifikasyonu
- Manuel modda aynı pozlama koşulları altında örneklerin dijital fotoğraflar çekin.
- Adobe Photoshop veya benzeri görüntüleme programı görüntüleri açın. LysoTracker boyanma miktarını belirlemek için, kırmızı kanal ve eşik kırmızı leke şimdi beyaz pikseller ile temsil olduğu gibi görüntü (siyah-beyaz görüntü dönüştürür) seçin. Beyaz pikseller seçin ve toplam sayıyı elde etmek için histogramı işlevini kullanın.
- Saymak mavi kanal kullanınalanına çekirdeklerin sayısı. Bu görüntü açıklamalar ekleyerek sayısı kaydını tutmak için yararlı olabilir.
- Değerleri kaydedin ve sonra hücre başına ortalama boyanma düzeyini hesaplamak. Eğer örnek isteyen tüm görüntüler için aynı eşik ayarı ile bu analizi tekrarlayın.
5. Temsilcisi Sonuçlar
Bu tür Sonic hedgehog (Shh) gibi bir büyüme faktörü geni, 16,17 çıkartıldığı zaman değişebilir embriyonik gelişimi sırasında PCD normal bir model vardır. LysoTracker derece difüze olan küçük bir moleküldür boya olduğundan, bütün embriyo mezenşimi 12,13 içinde bile derin PCD alanları değerlendirmek için görüntülenebilmektedir Şekil 1 normal ve Şşş için LysoTracker boyanma paterni gösterir -. Azından mutant fare embriyolarına - / 10.5dpc. Özellikle bacak ve somite regio olarak, mutasyona uğramış embriyoların - / - Bu aşamada, PCD Shh büyük ölçüde artmıştırns. Embriyo kısımları genel dağılımını değerlendirmek için yüksek büyütme (1B) de tüm montaj içinde görüntülenebilir. Dissected bölümleri de titreşimli mikrotom (1C) veya daha ayrıntılı PCD bölgeleri ortaya çıkarmak için bir kriyostat (DF) ile kesitli olabilir.
Transferaz terminali penetrasyonu daha az sorunlu olduğu TUNEL analizi en iyi ince kesitler üzerinde yapılır. LysoTracker boyama ve bir TUNEL yöntemi ile aynı doku (Şekil 1B-G) de yapılabilir. Bu sonuçlar gösteriyor ki LysoTracker ve TUNEL boyama, oldukça PCD örtüşme genel bölgeler arasında sıkı bir korelasyon 01:01 olmamasına rağmen. Daha yüksek bir büyütmede, bu punktumlarda görmek mümkün olduğunu TUNEL yöntemi ile pozitif leke ancak LysoTracker LysoTracker boya ile sadece leke boya ki, punktumlarda, ve punktumlarda boyama ile üst üste gelmiş.
Bir EB bir jelatin kaplı yüzey üzerine ekildi olduğunda, ayırt edici hücreler migrat olacaktıre dışarıya. Kültür 10 gün sonra, hücreler nöronlar, kas hücreleri, ve kardiyomiyositlerde de dahil olmak üzere hücre tiplerinde ayrışmıştır olacaktır. Şekil 2'de gösterildiği gibi kültürler bu hücre tiplerinin karışık popülasyonları içerir, ancak bir ilgi çekici bir belirli hücre tipi PCD incelemek için protokol adapte olabilir. Örneğin, EB nöronların 19 farklılaşmasını arttırmak için retinoik asit ile tedavi edilebilir, ve daha sonra LysoTracker tahlil farklı koşullar altında nöronal hücre ölümünü değerlendirmek için kullanılabilir. ES farklılaşmış hücrelerin normal kültür olarak, LysoTracker ve / veya TUNEL analizi (Şekil 2A) ile PCD tabi tutulurlar ve bu tespit edilebilir bir kaç hücre vardır. PCD oksidatif hasara neden olur ve apoptotik yolu 20,21 başlatır örneğin hidrojen peroksit gibi farklı sitotoksik ajanların bir dizi (H2O 2) ile indüklenebilir. H 2 O 2 A düşük doz hem artırırLysoTracker ve TUNEL boyama, hiçbir tedavi ile karşılaştırıldığında hücre büzüşmesi ve yaygın LysoTracker ve TUNEL pozitifliği yüksek doz sonuç ederken. Embriyo sonuçlarına benzer şekilde, punktumlarda görmek mümkün olduğunu TUNEL yöntemi ile pozitif leke değil LysoTracker LysoTracker boya ile sadece leke o boya, punktumlarda ve punktumlarda boyama örtüşen bununla. Apopotosis neden olan sitotoksik bir ajan uygulanması sonucu otofaji (Şekil 2B) indüklemek açlık serum koşullar ile karşılaştırılır. Serum açlık (1 saat) bir süre geçirmiş Hücreler LysoTracker ve TUNEL boyama yüksek korelasyon farklı bir model sergiler. LysoTracker boyama çok işlenmemiş kültürler karşılaştırıldığında artmış, ancak TUNEL pozitifliği normal seviyelerde olduğunu.
Adobe Photoshop mevcut standart araçları kullanma, LysoTracker boyama basit bir eşikleme yöntemi ile ölçülebilirbu bir hücre popülasyonunun için ortalama leke seviyesini hesaplamak için izin verir. Şekil 3A-B, bir numune görüntü ölçümü sırasında görünümünü göstermektedir. Mavi kanal (panel 3A) kırmızı kanal ve DAPI lekeli çekirdeklerinde LysoTracker boyama ile temel görüntü ile başlayarak, bu görüntünün kırmızı kanal siyah-beyaz görüntü dönüştürmek ve beyaz pikseller vardı için eşiklenir edildi sonra seçilen ve (Şekil 3A ') sayıldı. Bir eşik seviyesi LysoTracker boyanması temsil ettiği seçilmiştir. Görüntüleri kullanan herhangi bir nicel yöntem olduğu gibi, potansiyel olarak aşırı vurgu farklılıkları neden olabilir bu gibi resimleri ışığa maruz kalmaması için önemlidir. Alanında çekirdeklerin sayısı sonra sadece mavi kanal (Şekil 3B) bakarak ve (Şekil 3B ') sayma yaparken böyle bir fırça gibi bir çizim aracını kullanarak çekirdeklerin işaretleyerek sayılabilir. Bir sonra inci ifade edebilirhücre başına boyama ortalama seviyesi hesaplayarak boyanma e seviye (piksel / çekirdeklerin sayısı sayısı). Bir dilek yüksek yoluyla-put taraması için bu algoritmayı kullanmak için, en tarama paketleri belirli bir kanalın parlaklık ölçmek ve aynı zamanda en tipik uygulamalar için manuel yöntem hızlıdır ancak, bir alandaki çekirdekleri sayabilir ve olacağı bir nesne tanımlayıcı işlevi olabilir basit. Bir örnek vermek gerekirse, Şekil 2A-C örnek bir bölge ölçülmesi ve sonuçların teyit ettiği LysoTracker boyanma düzeyi yüksek (Şekil 3C) H 2 O 2 sonuç konsantrasyonu artmaktadır. Edildi
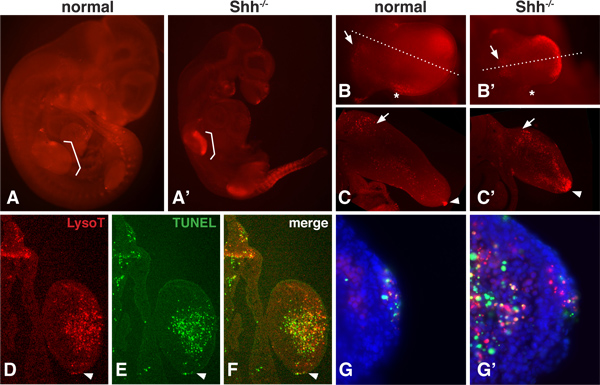
Şekil 1. / - - Embriyo normal ve Şşş yılında LysoTracker boyama. A, A 'Normal ve Sus -. / - LysoTracker Kırmızı ile boyanan 10.5 DPC, az fare embriyolarına Vectashield monte ve altında fotoğraflandıBir epiflourescence mikroskop diseksiyon. Konsollar ayakları yerini gösterecektir B, B 'normal ve Şşş ve yüzgeç -.. / - Embriyoların yüksek büyütmede görüntülenmiş. 'Arka Nekrotik Dilimi' (yıldız ile işaretli) ve ekstremite tomurcuğu (bir ok ile işaretli) proksimal mezenşimi bir bölge de dahil olmak üzere hücre ölümü normal bir etki unutmayın. Şşş boş bacaklarda medial ve distal bölümünde kuvvetli boyanma gösteren Normal ve null hem ekstremite tomurcukları ön ayakları tomurcuk aracılığıyla. C, C '. Medial bölümleri. Boş ekstremite tomurcuğu içinde normal ekstremite tomurcuğu ve dorsal ve ventral ve distal mezenşimi içinde güçlü boyama proksimal mezenşimi (ok) ve AER (ok başı) olarak boyanma varlığı unutmayın. DF. Aynı bölümde (12 mikron, dondurulmuş bölümü) LysoTracker ve TUNEL boyama (Roche 1684795) için görüntülendi. Bölüm Shh boş mesenc distal kısmına geçerhyme. AER ok ucu noktaları. Genel görünüm, her iki yöntem kullanılarak çok benzer ne kadar Bununla birlikte boyama tam olarak üst üste gelmez. G, G '. AER ve mezenşim daha yüksek bir büyütmede, bir ya da LysoTracker TUNEL-pozitif olan punktumlarda varlığı hem de görebilir Sadece yanı punktumlarda sıra boyama örtüşen olduğunu.

Şekil 2. Farklılaşmış ES hücreleri içinde LysoTracker boyama. Hücre ayırımı yapmak LIF yokluğunda oda 8-slaytlar üzerine ekildi. Otofaji yolun serum açlık 1 saat ile oluşturuldu ise LysoTracker ve TUNEL boyama karşılaştırmak nasıl göstermek için, apoptoz yolu, H 2 O 2 2 farklı dozda oluşturuldu. Bu görüntüler bir Zeiss YTM 5 Konfokal Mikroskop ile alınmıştır A-A'':. LysoT tarafından belirtildiği gibi İşlenmemiş kültürlerin bazı normal apoptozisi göstermekRacker ve TUNEL boyama. Çoğunlukla iki teknikler örtüşmektedir (beyaz oklar) kullanarak desen, ancak, bir LysoTracker sadece pozitif (kırmızı oklar) bir kaç punktumlarda görebilirsiniz B-B'', CC ":. H 2 artan miktarlarda tedavisi O 2 apoptozisi uyarır . düşük dozda daha LysoTracker ve Nokodazol göre TUNEL pozitif punktumlarda gösterir. yüksek dozda daha LysoTracker ve TUNEL pozitif punktumlarda yol açmaktadır. Beyaz oklar çakışan boyama, sadece LysoTracker için olumlu olduğunu punktumlarda kırmızı oklar ise. Bu TUNEL boyama (yeşil oklar) için pozitif olan punktumlarda görmek mümkündür DD ":. açlık serum lizozomlar ve autophagolysosomes malzemenin bir birikiminin teşvik edebilir ki, otofaji neden olabilir. Işlenmemiş kültürler karşılaştırıldığında görülebilir daha kaç LysoTracker punktumlarda unutmayın. TUNEL pozitif punktumlarda mevcut (çoğu LysoTracker leke örtüşening, beyaz oklar), ancak, sayı işlenmemiş şartlara göre büyük ölçüde artmış değildir. Buna ek olarak, açlık serum koşullar altında, LysoTracker yalnızca pozitif punktumlarda oldukça yaygındır (kırmızı oklar).
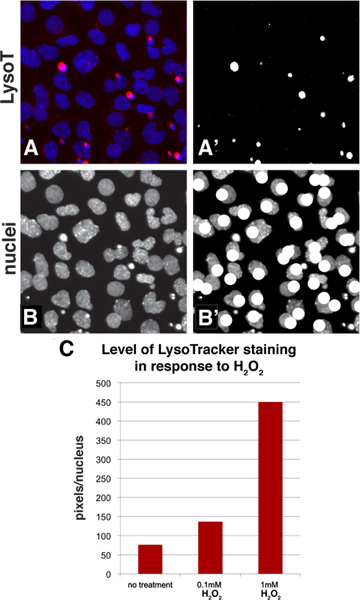
Şekil 3,. Adobe Photoshop kullanarak hücre popülasyonunda boyama düzeyini değerlendirmek için Sayısallaştırma yöntemi. A: Şekil 2A bir kısmı seçildi ve LysoTracker (kırmızı kanal) ve DAPI boyama (çekirdekler, mavi kanal) Bu panelde gösterilir A ':. Şekil 3A kırmızı kanal siyah-ve dönüştürmek için eşiklenir edildi image-beyaz. Beyaz pikseller seçilir ve histogram fonksiyonu kullanılarak sayabiliriz B-B ':. Kanal mavi çekirdekler gösterir ve onları sayma yaparken, görüntü gibi bir fırça gibi bir çizim işlevi ile açıklamalı olabilir C:. Bu expaneller 2A-C örnek bol miktar. Veri çekirdeği başına piksel olarak temsil edilir. büyük bir rakam görmek için buraya tıklayın .
Tartışmalar
Apoptoz Önemli diğerlerinden ayıran kaspaz aktivitesinin tespiti ile birlikte TUNEL yöntemi ile DNA hasar tespiti, (mAb veya ZVAD-FMK olarak bağlayıcı bir molekül ile algılanır), hücresel değişikliklerin gözlenmesi ve fosfatidilserin sunumu (PS dahil membran yüzeyinde) (Annexin V bağlama tarafından algılanır). Bu testlerin her biri ile bazı dezavantajları vardır. Örneğin, TUNEL yöntemi içinde kullanılan terminal transferaz birkaç hücre tabakası ötesine nüfuz etmez. Ayrıca Annexin V gibi ...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Biz protokol düzenleme yardım Mariani laboratuar üyeleri ederim. Bu çalışma CIRM Doktoraüstü Eğitim Grant (JLF), bir CIRM KÖPRÜLER staj (TZTT), Robert E. ve Mayıs R. Wright Vakfı (FVM) ve Güney Kaliforniya Üniversitesi (FVM) tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments | ||||||||||||||
| Reaktif Adı | Şirket | Katalog numarası | |||||||||||||||
| LysoTracker Kırmızı DND-99 | Invitrogen | # L-7528 | |||||||||||||||
| Hanks BSS | Invitrogen | 14025-076 | |||||||||||||||
| Paraformaldehyde | EMD | EM-PX0055-3 | |||||||||||||||
| Vectashield | VEKTÖR | H-1200 | |||||||||||||||
| DMEM | Cellgro | 10-013-CV | |||||||||||||||
| Non-esansiyel amino asitler | Cellgro | 25-025-CI | |||||||||||||||
| Sodyum piruvat | Cellgro | 25-000-CI | |||||||||||||||
| FBS | Hyclone | SH30071.02 | |||||||||||||||
| Kalem-Strep | Invitrogen | 15140-122 | |||||||||||||||
| b-merkaptoetanol, 50 mM | Invitrogen | 21985-023 | |||||||||||||||
| LABTEK-II Odası slaytlar (8-de) | Nalge Nunc Uluslararası | 154534 | |||||||||||||||
| % 0.1 jelatin | Millipore | ES-006-B | |||||||||||||||
| Dulbecco PBS (D-PBS) | Cellgro | 21-031-CV | |||||||||||||||
Çözüm Tarifler 4% Paraformaldehyde 100 ml için:
Uyarı: 'fırfır' şeklinde (ufak topaklar sıkıştırılmış) içinde paraformaldehit daha az toz halinde olan ve bu nedenle de bir başlık dışında ölçülebilir. Ancak yine de bir koruyucu toz maskesi (N95 giymeliEn az) kullanım sırasında. EB Kültür Medya 500 ml EB Medya için:
|
Referanslar
- Baehrecke, E. H. How death shapes life during development. Nat. Rev. Mol. Cell Biol. 3, 779-787 (2002).
- Meier, P., Finch, A., Evan, G. Apoptosis in development. Nature. 407, 796-801 (2000).
- Ikonomidou, C. Ethanol-induced apoptotic neurodegeneration and fetal alcohol syndrome. Science. 287, 1056-1060 (2000).
- Dunty, W. C., Chen, S. Y., Zucker, R. M., Dehart, D. B., Sulik, K. K. Selective vulnerability of embryonic cell populations to ethanol-induced apoptosis: implications for alcohol-related birth defects and neurodevelopmental disorder. Alcohol Clin. Exp. Res. 25, 1523-1535 (2001).
- Price, O. T., Lau, C., Zucker, R. M. Quantitative fluorescence of 5-FU-treated fetal rat limbs using confocal laser scanning microscopy and Lysotracker. Cytometry A. 53, 9-21 (2003).
- Jacobson, M. D., Weil, M., Raff, M. C. Programmed cell death in animal development. Cell. 88, 347-354 (1997).
- Fuchs, Y., Steller, H. Programmed cell death in animal development and disease. Cell. 147, 742-758 (2011).
- Qu, X. Autophagy gene-dependent clearance of apoptotic cells during embryonic development. Cell. 128, 931-946 (2007).
- Grimsley, C., Ravichandran, K. S. Cues for apoptotic cell engulfment: eat-me, don't eat-me and come-get-me signals. Trends Cell Biol. 13, 648-656 (2003).
- Lauber, K., Blumenthal, S. G., Waibel, M., Wesselborg, S. Clearance of apoptotic cells: getting rid of the corpses. Mol. Cell. 14, 277-287 (2004).
- Haller, T., Dietl, P., Deetjen, P., Volkl, H. The lysosomal compartment as intracellular calcium store in MDCK cells: a possible involvement in InsP3-mediated Ca2+ release. Cell Calcium. 19, 157-165 (1996).
- Zucker, R. M., Hunter, S., Rogers, J. M. Confocal laser scanning microscopy of apoptosis in organogenesis-stage mouse embryos. Cytometry. 33, 348-354 (1998).
- Zucker, R. M., Hunter, E. S., Rogers, J. M. Apoptosis and morphology in mouse embryos by confocal laser scanning microscopy. Methods. 18, 473-480 (1999).
- Gavrieli, Y., Sherman, Y., Ben-Sasson, S. A. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J. Cell Biol. 119, 493-501 (1992).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J. Vis. Exp. (51), e2720 (2011).
- Chiang, C. Manifestation of the limb prepattern: limb development in the absence of sonic hedgehog function. Dev. Biol. 236, 421-435 (2001).
- Ishibashi, M., McMahon, A. P. A sonic hedgehog-dependent signaling relay regulates growth of diencephalic and mesencephalic primordia in the early mouse embryo. Development. 129, 4807-4819 (2002).
- Schuldiner, M. Induced neuronal differentiation of human embryonic stem cells. Brain Res. 913, 201-205 (2001).
- Bain, G., Kitchens, D., Yao, M., Huettner, J. E., Gottlieb, D. I. Embryonic stem cells express neuronal properties in vitro. Dev. Biol. 168, 342-357 (1995).
- Dumont, A. Hydrogen peroxide-induced apoptosis is CD95-independent, requires the release of mitochondria-derived reactive oxygen species and the activation of NF-kappaB. Oncogene. 18, 747-757 (1999).
- Hampton, M. B., Orrenius, S. Dual regulation of caspase activity by hydrogen peroxide: implications for apoptosis. FEBS Lett. 414, 552-556 (1997).
- Wood, W. Mesenchymal cells engulf and clear apoptotic footplate cells in macrophageless PU.1 null mouse embryos. Development. 127, 5245-5252 (2000).
- Scott, R. C., Juhasz, G., Neufeld, T. P. Direct induction of autophagy by Atg1 inhibits cell growth and induces apoptotic cell death. Curr. Biol. 17, 1-11 (2007).
- Rodriguez-Enriquez, S., Kim, I., Currin, R. T., Lemasters, J. J. Tracker dyes to probe mitochondrial autophagy (mitophagy) in rat hepatocytes. Autophagy. 2, 39-46 (2006).
- Bampton, E. T., Goemans, C. G., Niranjan, D., Mizushima, N., Tolkovsky, A. M. The dynamics of autophagy visualized in live cells: from autophagosome formation to fusion with endo/lysosomes. Autophagy. 1, 23-36 (2005).
- Boya, P., Mellen, M. A., de la Rosa, E. J. How autophagy is related to programmed cell death during the development of the nervous system. Biochem. Soc. Trans. 36, 813-817 (2008).
- Galluzzi, L. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death Differ. 16, 1093-1107 (2009).
- Klionsky, D. J. Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes. Autophagy. 4, 151-175 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır