需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用LysoTracker检测及鉴别胚胎干细胞在胚胎细胞程序性死亡
摘要
我们提出了一个简单的协议,可视化地区的小鼠胚胎中的细胞程序性死亡(PCD)和鉴别胚胎干(ES)细胞培养,使用高度水溶性染料LysoTracker。
摘要
程序性细胞死亡(PCD)发生于成人,以维持正常组织稳态和胚胎发育过程中形成组织和器官1,2,6,7。在开发过程中,有毒化学物质或基因的改变可以导致PCD增加或改变PCD的模式,导致发育异常和出生缺陷3-5。要了解这些缺陷的病因学,胚胎的研究,使用区分胚胎干细胞(ES细胞) 在体外实验中,可以补充。
细胞凋亡是一种形式的PCD研究,既包括内在的和外在的信号,激活半胱天冬酶的酶级联。细胞特性的变化包括膜皱缩,核收缩,且DNA碎片。不涉及其他形式的PCD半胱天冬酶的激活,最终的结果可能是长期自噬。无论PCD的途径,死亡的细胞需要被删除。在成年人中,免疫细胞PERFORM功能,而在胚胎的免疫系统尚未开发,拆除产生的一种替代机制。这种机制涉及到邻近的细胞(称为"非专业吞噬细胞"),吞噬作用,他们认识到表面上的死细胞和吞噬8-10"吃我"的信号。吞噬后,碎片带来的溶酶体降解。因此无论PCD机制,溶酶体活性的增加可以增加细胞死亡相关。
要学习PCD,一个简单的分析,可视化厚的组织和多层区分文化的溶酶体中是有用的。 LysoTracker染料是一种高度可溶性小分子,被保持在如酸性亚细胞溶酶体11-13。的染料是采取了通过扩散和通过循环。由于是不是一个障碍,可视化的PCD在厚厚的组织和多层次的文化渗透是可能的12,13 14,仅限于小样本,组织切片和单层培养,因为此过程需要进入/渗透终端转移。
相反,扩散和溶解的溶剂苯胺蓝,DND-99 LysoTracker红,是可以解决的,明亮的,稳定的。染色可以可视化与标准荧光或共聚焦显微镜在整个贴装或部分,使用水性或溶剂型的安装媒体12,13。在这里,我们描述了使用此染料看,PCD在正常和 Sonic Hedgehog null小鼠胚胎的协议。此外,我们表现出ES细胞培养鉴别分析PCD,并提出一个简单的量化方法。总之,LysoTracker染色检测PCD的其他方法可以是一个很好的补充。
研究方案
1。 LysoTracker染小鼠胚胎
- 生成的小鼠胚胎放置年轻女性到男性螺柱笼(5-6周龄)。监视以下早晨指示,交配阴道栓的外观发生。如果女性怀孕了,中午在这一天被称为0.5 DPC(天交配后)。这里介绍的是该程序的胚胎7-13 DPC的理想选择。
- 在胚胎的利益,根据经批准的协议和安乐死的女性,切除子宫。从一个10厘米的培养皿中,用Hanks,BSS(无酚红)的蜕膜中取出胚胎。删除多余的胚胎外膜,至少做汉克斯BSS冲洗,以去除多余的组织和血液中。
- 准备LysoTracker胚胎染色解决方案(·汉克斯的5毫米LysoTracker在BSS)。 1-2胎是一个方便的音量5毫升。轻轻地混合均匀地发放染料。
- 添加的LysoTracker胚胎染色Solut的的胚胎在微量离心管中的离子或小瓶中,在37℃下孵育45分钟。
- 冲洗轻轻地汉克斯BSS 4次,每次洗5分钟。
- 固定在4%多聚甲醛过夜。
- 汉克斯BSS,10分钟一次冲洗,删除该修补程序。
- 脱水通过甲醇系列(50%,75%,80%,100%,5分钟每个步骤),以消除背景染色。这是很重要的,在成像过程中,为实现良好的信号 - 噪声。
- 在这一点上,你可以无限期储存的胚胎样品中甲醇在-20°C,避光。
注意:可以采取组织样本在任何步骤,用于DNA分型,然而,它可以是最方便的,只是在储存之前采取的样品,使多达此步骤中所有的样品可以是分批处理。收集组织样本,并把所有的尾巴,四肢或头,从每个胚胎成单独的管。补充水分的组织样本,并准备genoty平。
2。 ES文化的差异LysoTracker染色
- 准备通过悬滴法15的胚状体与起始密度为500个细胞每20μl下拉。
- 3天之后,悬浮培养的胚状体转移到10厘米非粘附培养皿( 即那些用于细菌的工作)。改变介质每2天5天,培养。
- 第7天,胚体转移到的糊化8以及玻片(加入0.1%明胶的腔室,等待5分钟,删除和添加媒体)。传输每室1-2胚体。
- 文化10天,媒体每隔一天。成为移液管小心地放置在拐角处的腔室滑动,以便不扰动胚体附着到玻璃表面。此外,当加入新鲜的培养基中也放置在移液管的拐角处的腔室和慢慢释放介质。
- 经过10天的邪教组织余吕杏茜作为阳性对照,诱导细胞凋亡,治疗一些孔与0.1 mm和1.0 mm H 2 O 2(H 2 O 2,以新媒体,混合,然后加入到细胞)为60分钟。冲洗两次,D-PBS在正规媒体和培养过夜。
- 轻轻吸现有媒体和添加LysoTracker细胞染色溶液(500的纳米LysoTracker(最终浓度)在媒体,每个腔室的300微升)。
- 在37℃下孵育15分钟。
- 冲洗两次,用D-PBS 2次,每次5 min。
- 固定在4%多聚甲醛在室温15分钟。
- 冲洗两次,用D-PBS,5分钟。
3。 ,查看LysoTracker被弄脏的胚胎或ES文化
- 准备用于显微镜的细胞样品,通过抽吸的D-PBS;除去腔室关闭的幻灯片;空气干燥约5分钟,然后加入水溶液安装介质(Vectashield与DAPI染色或类似)。在而dryin将陪衬的障碍g至降低的荧光漂白。安装了深刻的抑郁症玻璃盘或小培养皿在Vectashield或类似的胚胎。
- 可视化解剖或复合式显微镜罗丹明或德克萨斯州的红色过滤器(配备LysoTracker RED DND-99,激发/发射:577/590纳米)。染色通常是相当明亮,所以通常没有必要长时间曝光。
4。使用成像技术定量分析结果
- 在手动模式下相同的曝光条件下对样品的数码照片。
- 打开Adobe Photoshop或类似的成像程序中的图像。要确定的染色的LysoTracker量,选择的红色通道和阈值,使得红染色现在是由白色像素表示的图像(的图像转换为黑色和白色的)。选择白色的像素,并使用直方图功能,得到的总数。
- 使用蓝色通道数数量的核中的字段。它可以是有用的,以记录的计数标注的图像。
- 记录的值,然后计算平均每个细胞的染色水平。重复此分析相同的阈值设置为你想品尝的所有图像。
5。代表性的成果
有一个正常的胚胎发育过程中的PCD模式时,可以改变一个生长因子基因被删除,如刺猬(嘘),16,17。由于LysoTracker是一个小分子染料是高度扩散性,全胚胎可以是可视化评估PCD甚至深范围内的间充质12,13领域。 图1显示了LysoTracker染色模式为正常和 Shh - / -的突变小鼠胚胎10.5dpc。在这个阶段中,PCD 嘘 - / -突变胚胎中大大增加,特别是在四肢和体节的区域选择性纳秒。成像部分的胚胎可以全部安装在更高的放大倍率(1B)评估的总体格局。解剖的部分也可以用振动切片机(1C)或低温恒温器(DF),更详细地揭示的PCD区域截面。
TUNEL分析最好是薄的部分,末端转移酶的渗透问题较少。 LysoTracker染色和TUNEL检测可以做到在同一组织( 图1D-G)。这些结果表明,虽然目前还没有一个严格的1:1之间的相关性LysoTracker和TUNEL染色,一般地区的PCD重叠相当。在一个较高的倍率,是有可能看到泪点TUNEL检测与染色阳性,但不与在LysoTracker染料,泪点仅与LysoTracker染料,染色,和泪点有重叠染色。
当使用EB的明胶涂覆的表面上镀覆,分化细胞将migratË向外。经过10天的培养后,细胞会分化成多种类型的细胞,包括神经细胞,肌细胞,心肌。 图2中所示的培养包含混合种群的这些类型的细胞,但是人们可以适应我们的协议来研究PCD的一个特定的细胞类型的兴趣。例如,可以处理的EB与维甲酸增强分化的神经元19,然后的LysoTracker方法可用于在不同的条件下,以评估神经元细胞死亡。在分化的ES细胞的常规培养,也有少数的细胞经受PCD和这些LysoTracker和/或TUNEL法测定( 图2A),可以检测到与。 PCD可以由许多不同的细胞毒性剂,如过氧化氢 (H 2 O 2)诱导的氧化损伤,并启动凋亡通路20,21诱导。低剂量的H 2 O 2同时增加LysoTracker和TUNEL染色不进行治疗,而高剂量细胞的收缩及的广泛LysoTracker和TUNEL阳性结果。在胚胎的结果相似,它是可以看到泪点TUNEL检测与染色阳性,但不与在LysoTracker染料,泪点仅与LysoTracker染料,染色,和泪点有重叠染色。血清饥饿诱导自噬( 图2D)的条件相比,诱导apopotosis细胞毒性剂的应用的后果。已经历了一段血清饥饿(1小时)的细胞表现出不同的模式,LysoTracker和TUNEL染色不高度相关。处理培养物相比,大大提高LysoTracker染色,但是TUNEL阳性是在正常水平。
采用的标准工具在Adobe Photoshop中,可以量化LysoTracker染色用一个简单的阈值方法,允许一个计算细胞群的平均染色水平。 图3A-B示出了如何在量化过程中的样本图像看起来。开始LysoTracker在蓝色通道(面板图3A)在红色通道和DAPI染色的核染色与一个基准图像,该图像的红色通道的阈值将所述图像转换为黑色和白色的白色像素然后选择和计数( 图3A)。选择一个阈值水平"代表LysoTracker染色模式。任何量化的方法,使用图像,重要的是要避免过度曝光的照片,因为这有可能导致过分强调差异。然后,可以在该领域的原子核的数目计数看着只是蓝色通道( 图3B)和标记的细胞核计数时( 图3B)的使用的绘制工具如画笔。一个可以表达日通过计算每个细胞的平均水平的染色的染色(像素/细胞核计数数)的E级。如果一个人希望使用这种算法的高通量筛选,筛选包可以测量亮度在一个特定的通道,也有一个对象标识符功能,将计算核的一个领域,但最典型的应用手工的方法是快速和简单。举一个例子,一个样品区,从图2A-C进行定量的结果证实,增加浓度的H 2 O 2的结果,在一个较高的水平,LysoTracker染色( 图3C)。
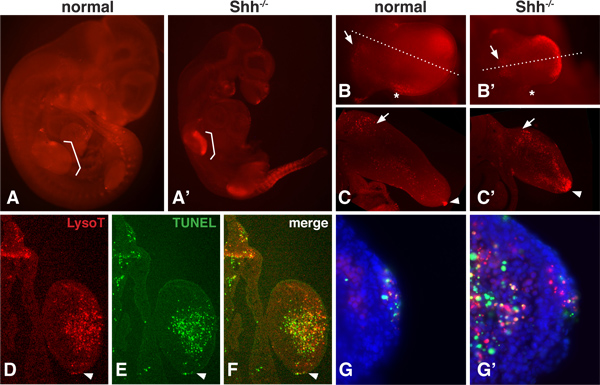
图1。在正常和Shh - / -胚胎LysoTracker染色。 A,A'。正常和 Shh - / -小鼠胚胎10.5 DPC,与LysoTracker红染色,安装在Vectashield的,并拍摄下解剖显微镜的epiflourescence。括号表示的前肢的位置B,B',前肢正常和 Shh - / -胚胎在更高的放大倍率成像。请注意正常域的细胞死亡包括'后路坏死区"(标有星号)和在近端的肢芽的间充质细胞(用箭头标记)的区域。 的Shh文献null四肢表现出更强的染色在内侧和远侧部C,C'内侧的部分,通过前肢正常和空肢芽芽。相同的部分(12微米,冷冻注意近端间充质细胞(箭头)和AER(箭头)的正常肢芽和强染色在背,腹和远端间充质细胞内的空肢芽中存在的染色。DF。一节)被拍摄到的LysoTracker和TUNEL染色(罗氏1684795)。该节通过的嘘空mesenc的远侧部分hyme。箭头指向的AER。然而注意如何整体图案是非常类似的,使用这两种方法,染色不完全重合,G,G',人们可以看到,在较高的放大倍数的AER与间充质的存在,会泪点是LysoTracker或TUNEL阳性仅作为以及泪点有重叠染色。

图2。 LysoTracker染色分化的ES细胞中,分化细胞铺板在8室玻片在没有的LIF。为了显示,如何LysoTracker和TUNEL染色比较,2种不同剂量的H 2 O 2诱导的细胞凋亡途径,而使用1小时的血清饥饿诱导的自噬途径。这些图像A-A":未处理的文化与一个蔡司LSM5的共聚焦显微镜显示一些正常的细胞凋亡的LysoTracker和TUNEL染色。使用这两种技术大多是重叠(白色箭头)的图案,然而,人们可以看到几个泪点,只LysoTracker阳性(红色箭头) 的B-B"CC"的:治疗与增加量的H 2 O 2刺激细胞凋亡较低的的剂量显示LysoTracker和未经处理的细胞相比,的TUNEL积极泪点。高剂量诱导更LysoTracker和TUNEL阳性泪点。白色箭头指向到重叠的染色,而红色箭头指向泪小点,积极LysoTracker只。它也可以看到泪点只阳性TUNEL染色(绿色箭头)。DD":血清饥饿可诱导自噬作用,它可刺激材料在溶酶体和autophagolysosomes的一个积累。注意多少LysoTracker泪点是可见的,未经处理的文化。 TUNEL阳性泪小点(其中大部分有重叠LysoTracker的染色ING,白箭头),但是,数字是不是大大增加相比,未经处理的条件。此外,在血清饥饿条件下,LysoTracker只有积极的泪点是非常普遍的(红色箭头)。
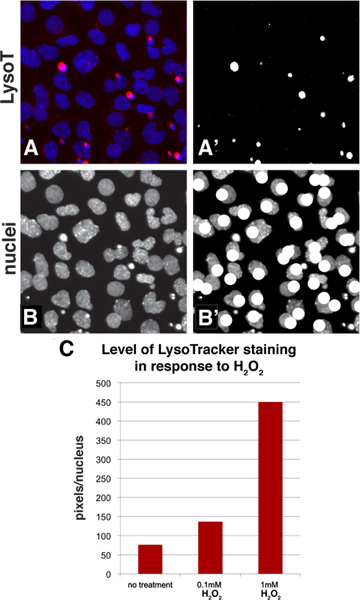
图3。量化方法进行评估水平的人口使用Adobe Photoshop的细胞染色。 A:选择图2A的部分的LysoTracker(红色通道)和DAPI染色(细胞核,蓝色通道)在此面板中,A':图3A阈值,将其转换为黑色和红色通道白图像。白色像素被选择和计算使用直方图功能,B-B'蓝色通道的细胞核和计数时,图像可以进行注释,如画笔绘图功能。C:这是一个前面板一个样品从图2A-C充足的量化。数据表示为每核的像素。 点击此处查看大图 。
讨论
细胞凋亡的重要标志包括与TUNEL检测的DNA损伤的检测,沿与caspase活性的检测(检测的单克隆抗体或结合分子如ZVAD-芬兰马克),观察细胞的变化,和介绍的磷脂酰丝氨酸(PS )在膜表面上(Annexin V结合)中检测到的。与每个这些检测方法也有一些缺点。例如,TUNEL法检测中使用的末端转移不穿透超越几个细胞层。膜联蛋白V可以标记细胞不进行细胞凋亡,如那些具有的膜破坏,(膜联蛋白V得到在细?...
披露声明
没有利益冲突的声明。
致谢
我们感谢帮助编辑的马里亚尼实验室的协议。这项工作是由一个摆围博士后培训津贴(JLF),的CIRM的BRIDGES实习(TZTT),罗伯特·E.五月R.莱特基金会(FVM),美国南加州大学(FVM)。
材料
| Name | Company | Catalog Number | Comments | ||||||||||||||
| 的试剂的名称 | 公司 | 目录编号 | |||||||||||||||
| DND-99 LysoTracker红, | Invitrogen公司 | #L-7528 | |||||||||||||||
| 汉克斯BSS | Invitrogen公司 | 14025-076 | |||||||||||||||
| 多聚甲醛 | EMD | EM-PX0055-3 | |||||||||||||||
| Vectashield | VECTOR | H-1200 | |||||||||||||||
| DMEM | Cellgro | 10-013-CV | |||||||||||||||
| 非必需氨基酸 | Cellgro | 25-025-CI | |||||||||||||||
| 丙酮酸钠 | Cellgro | 25-000-CI | |||||||||||||||
| FBS | Hyclone公司 | SH30071.02 | |||||||||||||||
| 笔链球菌 | Invitrogen公司 | 15140-122 | |||||||||||||||
| β-巯基乙醇,50mM的 | Invitrogen公司 | 21985-023 | |||||||||||||||
| LabTek-II玻片 (8孔) | Nalge Nunc公司国际 | 154534 | |||||||||||||||
| 0.1%明胶 | 密理博 | ES-006-B | |||||||||||||||
| 的Dulbecco PBS(D-PBS) | Cellgro | 21-031-CV | |||||||||||||||
解决方案食谱 4%多聚甲醛 100毫升:
警告:在'做样子'形式(压缩的小颗粒)的多聚甲醛减粉末,因此,可以测量以外的机罩。但是你还是应该戴防尘口罩(N95至少)在处理过程中。 EB文化传媒 对于500毫升EB媒体:
|
参考文献
- Baehrecke, E. H. How death shapes life during development. Nat. Rev. Mol. Cell Biol. 3, 779-787 (2002).
- Meier, P., Finch, A., Evan, G. Apoptosis in development. Nature. 407, 796-801 (2000).
- Ikonomidou, C. Ethanol-induced apoptotic neurodegeneration and fetal alcohol syndrome. Science. 287, 1056-1060 (2000).
- Dunty, W. C., Chen, S. Y., Zucker, R. M., Dehart, D. B., Sulik, K. K. Selective vulnerability of embryonic cell populations to ethanol-induced apoptosis: implications for alcohol-related birth defects and neurodevelopmental disorder. Alcohol Clin. Exp. Res. 25, 1523-1535 (2001).
- Price, O. T., Lau, C., Zucker, R. M. Quantitative fluorescence of 5-FU-treated fetal rat limbs using confocal laser scanning microscopy and Lysotracker. Cytometry A. 53, 9-21 (2003).
- Jacobson, M. D., Weil, M., Raff, M. C. Programmed cell death in animal development. Cell. 88, 347-354 (1997).
- Fuchs, Y., Steller, H. Programmed cell death in animal development and disease. Cell. 147, 742-758 (2011).
- Qu, X. Autophagy gene-dependent clearance of apoptotic cells during embryonic development. Cell. 128, 931-946 (2007).
- Grimsley, C., Ravichandran, K. S. Cues for apoptotic cell engulfment: eat-me, don't eat-me and come-get-me signals. Trends Cell Biol. 13, 648-656 (2003).
- Lauber, K., Blumenthal, S. G., Waibel, M., Wesselborg, S. Clearance of apoptotic cells: getting rid of the corpses. Mol. Cell. 14, 277-287 (2004).
- Haller, T., Dietl, P., Deetjen, P., Volkl, H. The lysosomal compartment as intracellular calcium store in MDCK cells: a possible involvement in InsP3-mediated Ca2+ release. Cell Calcium. 19, 157-165 (1996).
- Zucker, R. M., Hunter, S., Rogers, J. M. Confocal laser scanning microscopy of apoptosis in organogenesis-stage mouse embryos. Cytometry. 33, 348-354 (1998).
- Zucker, R. M., Hunter, E. S., Rogers, J. M. Apoptosis and morphology in mouse embryos by confocal laser scanning microscopy. Methods. 18, 473-480 (1999).
- Gavrieli, Y., Sherman, Y., Ben-Sasson, S. A. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J. Cell Biol. 119, 493-501 (1992).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J. Vis. Exp. (51), e2720 (2011).
- Chiang, C. Manifestation of the limb prepattern: limb development in the absence of sonic hedgehog function. Dev. Biol. 236, 421-435 (2001).
- Ishibashi, M., McMahon, A. P. A sonic hedgehog-dependent signaling relay regulates growth of diencephalic and mesencephalic primordia in the early mouse embryo. Development. 129, 4807-4819 (2002).
- Schuldiner, M. Induced neuronal differentiation of human embryonic stem cells. Brain Res. 913, 201-205 (2001).
- Bain, G., Kitchens, D., Yao, M., Huettner, J. E., Gottlieb, D. I. Embryonic stem cells express neuronal properties in vitro. Dev. Biol. 168, 342-357 (1995).
- Dumont, A. Hydrogen peroxide-induced apoptosis is CD95-independent, requires the release of mitochondria-derived reactive oxygen species and the activation of NF-kappaB. Oncogene. 18, 747-757 (1999).
- Hampton, M. B., Orrenius, S. Dual regulation of caspase activity by hydrogen peroxide: implications for apoptosis. FEBS Lett. 414, 552-556 (1997).
- Wood, W. Mesenchymal cells engulf and clear apoptotic footplate cells in macrophageless PU.1 null mouse embryos. Development. 127, 5245-5252 (2000).
- Scott, R. C., Juhasz, G., Neufeld, T. P. Direct induction of autophagy by Atg1 inhibits cell growth and induces apoptotic cell death. Curr. Biol. 17, 1-11 (2007).
- Rodriguez-Enriquez, S., Kim, I., Currin, R. T., Lemasters, J. J. Tracker dyes to probe mitochondrial autophagy (mitophagy) in rat hepatocytes. Autophagy. 2, 39-46 (2006).
- Bampton, E. T., Goemans, C. G., Niranjan, D., Mizushima, N., Tolkovsky, A. M. The dynamics of autophagy visualized in live cells: from autophagosome formation to fusion with endo/lysosomes. Autophagy. 1, 23-36 (2005).
- Boya, P., Mellen, M. A., de la Rosa, E. J. How autophagy is related to programmed cell death during the development of the nervous system. Biochem. Soc. Trans. 36, 813-817 (2008).
- Galluzzi, L. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death Differ. 16, 1093-1107 (2009).
- Klionsky, D. J. Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes. Autophagy. 4, 151-175 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。