JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
태아의 프로그래밍 셀 죽음을 감지 할 LysoTracker의 이용 및 배아 줄기 세포를 차별화
요약
우리는 마우스 배아의 프로그래밍 세포 죽음의 영역 (PCD)와 LysoTracker라는 높은 가용성 염료를 사용하여 배아 줄기 (ES) 세포 문화를 차별화를 시각화하는 간단한 프로토콜을 제시한다.
초록
프로그래밍 세포 죽음 (PCD)는 일반 조직 항상성을 유지하고 embryological 개발하는 동안 조직과 장기 1,2,6,7를 형성하기 위해 성인에서 발생합니다. 개발하는 동안 독성 화학 물질이나 유전자 변이가 PCD 증가 시키거나 발달 이상이나 기형아 출산은 3-5의 결과 PCD 패턴을 변경할 수 있습니다. 이러한 결함의 병인을 이해하기 위해서는 배아의 연구는 배아 줄기 (ES) 세포를 차별화 사용하는 체외 assays에 구비 할 수 있습니다.
Apoptosis는 caspase 효소 폭포를 활성화 신호 고유와 외부를 모두 포함 PCD의 잘 공부 형태입니다. 특성 세포 변화가 막 blebbing, 원자력 축소, 그리고 DNA의 조각이 포함되어 있습니다. PCD의 다른 형태의 caspase 활성화를 포함하지 않고 장시간 autophagy의 최종 결과 일 수 있습니다. 상관없이 PCD 경로의, 죽어가는 세포를 제거해야합니다. 성인에서 면역 세포 완벽하게태아에 면역 체계가 아직 발달되지 않은 곳, 제거 다른 메커니즘에 의해 발생하는 동안이 기능을 ORM. 이 메커니즘은에 복용 이웃 세포를 ( "비 전문 phagocytes")를 포함 phagocytic 역할들이 죽어 셀 빨아들이다 그것에게 8-10를의 표면에 신호 '내 식사'를 인식하고 있습니다. engulfment 후, 그 잔해가 저하의 lysosome로 이동합니다. 따라서 관계없이 PCD 메커니즘, lysosomal 활동의 증가는 증가 세포 죽음과 상관 될 수 있습니다.
PCD, 두꺼운 조직 및 다층 차별화의 문화권에서 리소좀을 시각화하는 간단한 분석을 공부하려면 유용 할 수 있습니다. LysoTracker의 염료는 lysosome 11-13로 산성 subcellular 구획에서 유지되는 높은 가용성 작은 분자이다. 염료는 확산 의해 순환 통해 이루어집니다. 침투는 두꺼운 조직 및 멀티 레이어 문화에 PCD의 방해, 시각화 아니므로 12,13 수 있습니다 14, 작은 샘플, 조직 학적 부분, 그리고 monolayer 문화로 제한됩니다.
diffuses 및 용매에 의해 용해되어 아닐린 블루, 대조적으로, LysoTracker 레드 DND-99은 고칠 밝고 안정적입니다. 착색는 전체 마운트 또는 수성이나 솔벤트 기반의 설치 미디어 12,13를 사용하여 섹션의 표준 형광 또는 공 촛점 현미경으로 시각화 할 수 있습니다. 여기 정상과 음속의 고슴도치 널 마우스 배아에서 PCD 볼이 염료를 사용하여 프로토콜을 설명합니다. 또한, 우리는 ES 세포의 문화를 차별화의 PCD의 분석을 보여줍니다 및 간단한 정량화 방법을 제시한다. 요약하면, LysoTracker의 착색은 PCD을 검출 다른 방법에 큰 보완 할 수 있습니다.
프로토콜
1. 마우스 태아의 LysoTracker의 착색
- 남성 스터드 케이지에 젊은 (성인 5-6 일주일 정도) 여성을 배치하여 마우스 배아를 생성합니다. 그 결합을 나타내는 질 플러그의 모양에 대한 다음과 같은 아침에 모니터가 발생했습니다. 여성의 임신 인 경우 그 날의 정오에는 0.5 dpc (일 게시물 성교)라고합니다. 여기에 제시된 절차는 배아 7-13 dpc에 이상적입니다.
- 관심 배아 일에 승인 된 프로토콜에 따라 여성을 안락사시켜야과 자궁을 제거합니다. 행크스 BSS (페놀 레드 제외) 10cm 배양 접시에 decidua에서 배아를 제거합니다. 추가 - 배아 세포막을 제거하고 적어도 하나는 관계없는 조직과 혈액을 제거 할 행크스 BSS와 린스 않습니다.
- LysoTracker의 배아 착색 솔루션 (행크스 BSS 5 밀리미터 LysoTracker)를 준비합니다. 1-2 litters을위한 편리한 볼륨은 5 ML입니다. 부드럽게 골고루 염료를 지출 할 수 섞는다.
- LysoTracker의 배아 착색의 Solut에 배아를 추가합니다45 분의 microfuge 튜브 또는 37 ° C에서 유리 병 및 배양에 이온.
- 행크스 BSS에서 매우 부드럽게 네 번, 5 분마다 빨래를 헹굴.
- 밤새 4 % Paraformaldehyde에 해결했습니다.
- 수정 프로그램을 제거 할 행크스 BSS, 10 분에 한 번 씻어.
- 배경 얼룩을 제거 할 수있는 메탄올 시리즈 (50 %, 75 %, 80 %, 100 %, 5 분 각 단계)를 통해 탈수. 이 영상 중에 좋은 신호 대 노이즈를 달성하는 것이 중요합니다.
- 이 시점에서 당신은 빛으로부터 보호, -20 ° C에서 메탄올에 무한정 배아 샘플을 저장할 수 있습니다.
참고 : 조직 샘플은 DNA의 genotyping에 대한 단계에서 촬영 될 수 있지만, 그렇게가이 단계에 대한 모든 샘플 배치 처리 할 수 있도록 단지 저장하기 전에 샘플을 채취하는 것이 가장 편리 할 수 있습니다. 각 배아의 꼬리, 다리, 또는 머리에서 조직 샘플을 수집하고 별도의 튜브에 모두 넣어. 조직 샘플을 Rehydrate하고 genoty 준비핑 (Ping).
2. ES 문화를 차별화 LysoTracker의 착색
- 20 μl 드롭 당 500 세포의 시작 밀도 공중 드롭 방법 15을 통해 embryoid 몸을 준비합니다.
- 삼일 후, 10cm 비 점착성의 배양 접시 (세균 작업에 사용되는 즉)에 정지 문화에 embryoid 몸을 전송할 수 있습니다. 미디어마다 2 일 변경 오일에 대한 문화.
- 일 7, gelatinized 8 잘 챔버 슬라이드에 embryoid 기관을 이전 (챔버에 젤리 0.1 %를 추가, 5 분 기다리 제거 및 미디어 추가). 챔버 1-2 embryoid 몸을 전송합니다.
- 매일 미디어를 변경 십일에 대한 문화. embryoid 몸이 유리 표면에 부착 교란하지 할만큼 챔버 슬라이드의 모서리에있는 피펫을 배치 할주의하십시오. 또한 신선한 미디어는 챔버의 모서리에있는 피펫을 넣고 천천히 미디어를 해제 추가 할 때.
- 컬트 10 일 후우레는 긍정적 인 제어로 apoptosis를 유도하기 위해, 0.1 mm와 1.0 mm까지 H 2 O 2와 우물의 일부를 치료 60 분에 (신선한 미디어 믹스에 H 2 O 2를 추가 한 다음 셀에 추가). D-PBS와 일반 미디어 야간 문화와 두 번 씻어.
- 부드럽게 기존의 미디어를 기음과 LysoTracker 셀 착색 솔루션을 (미디어 500 나노 미터 LysoTracker (최종 농도), 챔버 300 μl)를 추가합니다.
- 15 분에 37 ° C에서 알을 품다.
- D-PBS 2 회, 5 분 각각 두 번 씻어.
- RT에서 15 분에 4 % paraformaldehyde에 고정.
- D-PBS, 5 분으로 두 번 씻어.
3. LysoTracker의 얼룩진의 태아 나 ES의 문화보기
- D-PBS를 aspirating하여 현미경의 세포 샘플을 준비하고, 슬라이드에서 챔버를 제거, 공기는 약 5 분 동안 건조, 그리고 수성 설치 매체 (DAPI 또는 이와 유사한과 Vectashield)을 추가. 마르고 동안 호일 장벽을 놓습니다g는 형광의 표백 감소합니다. Vectashield 또는 유사한에서 깊은 우울증 유리 접시 또는 작은 페트리 접시에 배아를 탑재합니다.
- rhodamine 또는 텍사스 레드 필터를 장착 해부 또는 복합 현미경으로 시각화 (LysoTracker RED DND-99 여기 / 방출 : 590분의 577 nm의).에게 얼룩은 일반적으로 매우 밝은 오랫동안 노출은 일반적으로 필요하지 않습니다.
4. 이미징 기술을 사용하여 결과의 정량화
- 수동 모드에서 동일한 노출 상황에서 샘플의 디지털 사진을 찍습니다.
- 어도비 포토샵 또는 이와 유사한 이미징 프로그램에서 이미지를 엽니 다. LysoTracker의 착색의 양을 확인하려면 빨간색 채널과 임계 값 붉은 얼룩은 이제 흰색 픽셀로 표시되는 등의 이미지 (검은 색과 흰색으로 이미지를 변환)를 선택합니다. 흰색 픽셀을 선택하고 전체 수를 얻기 위해 히스토그램 기능을 사용하십시오.
- 계산하려면 파란색 채널을 사용하여분야에서 핵의 수. 이 이미지를 주석으로 수의 기록을 유지하는 데 유용 할 수 있습니다.
- 값을 기록하고 세포 당 평균 착색 수준을 계산합니다. 당신은 샘플링하고자하는 모든 이미지에 대해 동일한 임계 값 설정으로이 분석을 반복합니다.
5. 대표 결과
이러한 소닉 고슴도치 (쉬)와 같은 성장 인자의 유전자가, 16,17을 제거 할 때 변경할 수 배아 발달 동안 PCD의 정상적인 패턴이 있습니다. LysoTracker 매우 diffusible있는 작은 분자 염료이기 때문에, 전체 난자는 mesenchyme 12,13 내도 깊은 PCD의 영역을 평가하는 시각화 할 수 있습니다 그림 1은 정상과 쉬에 대한 LysoTracker의 착색 패턴 표시 -.에서 돌연변이 마우스 배아 - /를 10.5dpc. 특히 다리와 체절 regio에 돌연변이 배아 - / -이 단계에서, PCD은 크게 쉬에 증가NS. 배아의 일부는 전체 패턴을 평가하기 위해 높은 배율 (1B)에서 전체 마운트에 이미징 할 수 있습니다. 해부하는 부분은 진동 마이크로톰 (1C) 또는 더 자세히 PCD 지역을 표시하는 방법으로 그라 이오 스탯 (DF)와 sectioned 수 있습니다.
transferase 터미널의 침투가 덜 문제가있는 곳 TUNEL 분석은 가장 얇은 부분으로 이루어집니다. LysoTracker의 착색과 TUNEL 분석은 같은 조직 (그림 1D-G)에서 수행 할 수 있습니다. 이러한 결과는 보여주고 LysoTracker 및 TUNEL의 착색, 상당히 PCD 중복의 일반적인 지역 사이에 엄격한 1시 1분 상관 관계가 있지 않지만. 높은 배율에서, 그것은 puncta를 볼 수 있습니다 그 TUNEL 분석과 긍정적 인 얼룩 아니라 LysoTracker의 LysoTracker의 염료와 만 금방 치료 염료, puncta, 그리고 puncta는 착색을 중복 그게.주세요
EB는 젤라틴 코팅 표면에 도금하는 경우, 차별화 세포는 migrat합니다e는 외부. 문화 10 일 후, 세포는 뉴런, 근육 세포, 그리고 cardiomyocytes 등의 세포 유형의 다양한으로 차별화해야합니다. 그림 2에 표시된 문화가 이러한 세포 유형의 혼합 인구를 포함하지만 하나는 관심의 특정 세포 유형의 PCD 공부하기위한 프로토콜을 적응 수 있습니다. 예를 들어, EB는 뉴런 19 차별화를 향상시킬 수 Retinoic 산성과 치료를 할 수 있으며, 다음 LysoTracker 분석은 서로 다른 조건 하에서 neuronal 세포 사망을 평가하는 데 사용할 수 있습니다. 차별화 된 ES 세포의 정상적인 문화에서 LysoTracker 및 / 또는 TUNEL의 assays (그림 2A)로 PCD 받아야하고 이러한이 감지 할 수있는 몇 가지 세포가 있습니다. PCD는 산화 손상을 유도하고 apoptotic 경로주세요 20,21을 시작 이러한 과산화수소 등 다양한 세포 독성 에이전트의 수 (H 2 O 2)에 의해 유도 할 수 있습니다. H 2 O 2의 저용량 둘 다 증가LysoTracker 및 TUNEL의 착색은, 아니 치료에 비해 세포 수축과 확산 LysoTracker 및 TUNEL의 긍정적에서 다량 결과 동안. 배아의 결과와 마찬가지로, 그것은 puncta를 볼 수 있습니다 그 TUNEL 분석과 긍정적 인 얼룩 아니라 LysoTracker의 LysoTracker의 염료와 만 금방 치료 염료, puncta, 그리고 puncta는 착색을 중복 그게.주세요 apopotosis을 유도 세포 독성 에이전트의 응용 프로그램의 결과는 autophagy (그림 2D)을 유도 혈청 기아 조건에 비교됩니다. 혈청 기아 (1 시간)의 기간을받은 세포는 LysoTracker과 TUNEL 염색법의 높은 상관 관계를하지 않는 다른 패턴을 나타냅니다. LysoTracker의 착색은 많은 치료 문화에 비해 증가하지만 TUNEL의 긍정적는 정상 수준에 있습니다.
어도비 포토샵에서 사용할 수있는 표준 도구 고용 LysoTracker의 착색은 단순 임계 값 방식을 정량화 할 수그 하나는 세포의 인구의 평균 착색 수준을 계산 할 수 있습니다. 그림 3A-B는 샘플 이미지가 정량화 과정에서 보이는 방법을 보여줍니다. 파란색 채널 (패널 3A)에 빨간색 채널 및 DAPI-스테인드 핵의 LysoTracker의 착색있는 기준 이미지를 시작으로,이 이미지의 붉은 채널이 흑백으로 이미지를 변환하고 흰색 픽셀이었습니다 thresholded되었습니다 그런 다음 선택하고 (그림 3A ')시켰다. 임계 값 수준은 LysoTracker의 착색 패턴을 나타낸다는 것을 선정되었습니다. 이미지를 사용하는 정량화 방법과 마찬가지로, 그것은 잠재적으로 오버 강조 차이가 발생할 수 있습니다이로 사진을 overexposing 않도록하는 것이 중요합니다. 분야에서 핵의 수는 다음 갑자기 채널 (그림 3B)에서보고 (그림 3B ') 계산하는 동안 같은 붓으로 그리기 도구를 사용하여 핵을 표시하여 계산 될 수있다. 하나는 일을 표현할 수 있습니다셀 당 얼룩의 평균 수준을 계산하여 착색의 전자 수준 (픽셀 / 핵 카운트 수). 바라던가 높은 통한 놔 검사를 위해이 알고리즘을 사용하면 대부분의 심사 패키지는 특정 채널에 밝기를 측정하고 또한 가장 일반적인 응용 프로그램 수동 방법은 빠른 그러나, 현장에서 핵을 계산하고, 될 개체 식별자 기능을 할 수 있습니다 간단합니다. 예를 제공하기 위해,도 2A-C에서 샘플 지역은 정량 및 결과 확인이 LysoTracker의 착색 높은 수준의 (그림 3C)에 H 2 O 2 결과의 농도를 증가시킨다.되었습니다
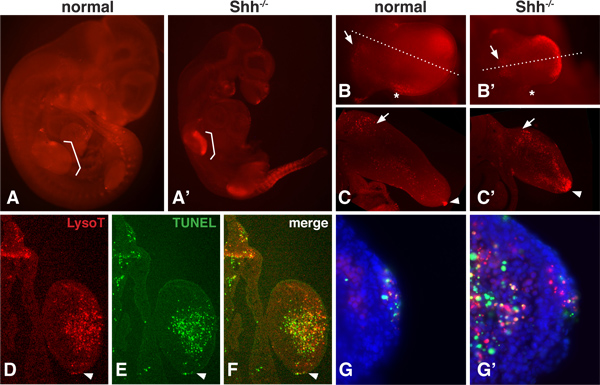
1 그림. / - - 배아 정상과 쉬의 LysoTracker의 착색. A, A '보통과 쉬 -. / - LysoTracker 레드 물들 10.5 dpc,에서 마우스 배아는 Vectashield에 장착하고 아래 사진epiflourescence는 현미경을 해부. 괄호는 forelimbs의 위치를 나타냅니다 B, B '정상과 쉬의 Forelimb -.. / - 배아는 높은 배율의 이미징. '뒤 괴사 지대'(별표로 표시)과 사지 꽃 봉오리 (화살표로 표시)의 근위 mesenchyme의 지역을 포함한 세포 죽음의 정상적인 도메인을 확인합니다. 쉬 수혜 사지 안쪽과 말초 부분에 강한 얼룩을 전시 정상과 널을 모두 사지 봉오리의 forelimb 꽃 봉오리를 통해. C, C '. 중간 섹션을 제공합니다. 널 사지 꽃 봉오리에서 정상 사지 봉오리 등쪽과 복부 및 말초 mesenchyme 내에서 강한 착색의 근위 mesenchyme (화살표)와 AER (화살촉)에 착색의 존재를 확인합니다. DF. 같은 섹션 (12 미크론, 냉동 섹션) LysoTracker과 TUNEL의 착색 (로슈 1684795)에 대한 이미징되었습니다. 섹션 쉬 널 mesenc의 말초 부분을 통과hyme. AER에 화살촉을 가리 킵니다. 전체 패턴이 두 방법을 사용하여 매우 비슷 얼마나 참고 그러나 착색이 완전히 중복되지 않습니다. G, G '가. AER과 mesenchyme 높은 배율에서, 하나는 LysoTracker 또는 TUNEL - 긍정적 인 puncta의 존재를 모두 볼 수 있습니다 만뿐만 아니라 puncta으로 착색을 중복는데.

그림 2. 차별화 된 ES 세포의 LysoTracker의 착색. 세포를 차별화는 난생의 부재에 8 챔버 슬라이드에 도금되었습니다. autophagy 경로는 혈청 기아 1 시간을 사용하여 유도 동안 LysoTracker과 TUNEL 염색법의 비교 방법을 표시하려면, apoptosis 경로는 H 2 O 2 개 중 2 개의 다른 복용을 유도했습니다. 이 이미지는 Zeiss LSM5 공 촛점 현미경으로 촬영 된 A- ':. LysoT로 표시로 치료 문화는 몇 가지 일반적인 apoptosis를 보여racker 및 TUNEL의 착색. 대부분 두 기술 중복 (흰색 화살표)를 사용하여 패턴 그러나, 한 LysoTracker 만 긍정적 인 (빨간색 화살표)입니다 몇 puncta을 볼 수 B-B ', CC ". H 2 증가 양의 치료를 O 2는 apoptosis를 촉진 . 낮은 복용량보다 LysoTracker 및 치료 세포에 비해 TUNEL 긍정적 인 puncta을 보여줍니다. 높은 용량을 더욱 LysoTracker과 TUNEL 긍정적 인 puncta에 유도한다. 흰색 화살표 지점 중복 착색에 만 LysoTracker에 양성 반응이 그 puncta에 빨간색 화살표가 점하는 동안. 이 TUNEL의 착색 (녹색 화살표) 만 긍정적 인 puncta를 볼 수도 있습니다 DD ". 세럼 기아는 리소좀과 autophagolysosomes의 자료 축적을 자극 할 수있는 autophagy를 유도 할 수 있습니다. 치료 문화에 비해 볼 수 있습니다 얼마나 많은 LysoTracker의 puncta합니다. TUNEL 긍정적 인 puncta이 존재 (이 대부분 LysoTracker는 얼룩 중복ING, 흰색 화살표)는 그러나, 그 수는 치료 조건에 비해 크게 증가하지 않습니다. 또한, 혈청 기아 조건 하에서, LysoTracker 전용 긍정적 puncta은 매우 유행 아르 (빨간색 화살표).
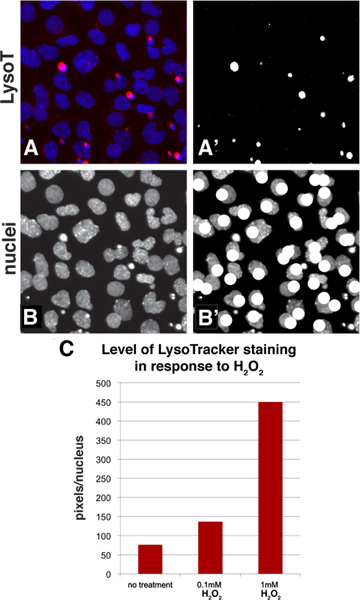
그림 3. 어도비 포토샵을 사용하여 세포의 인구에 얼룩의 수준을 평가하는 정량화 방법. A : 그림 2A의 부분은 선택했고 LysoTracker (적색 채널) 및 DAPI의 얼룩은 (핵, 파랑 채널)이 패널에 표시됩니다 A ':. 그림 3A의 붉은 채널은 검은 색과로 변환 thresholded되었습니다 이미지 흰색. 흰색 픽셀는 선택하고 히스토그램 함수를 사용하여 계산 될 수 B-B ':. 파란색 채널은 핵을 보여줍니다 그들을 계산하는 동안 이미지는 붓으로 그리기 기능을 사용하여 주석을 추가 할 수 있습니다 C :.이가 전합니다패널 2A-C에서 샘플의 충분한 양을 정함. 데이터는 핵 당 픽셀로 표현되는 것은. 큰 그림을 보려면 여기를 클릭하십시오 .
토론
apoptosis의 중요한 특징은 caspase 활동의 검출과 함께 TUNEL 분석과 DNA 손상의 검출 (mAbs 또는 ZVAD-fmk으로 구속력 분자를 감지), 세포 변화의 관찰, 그리고 phosphatidylserine의 표현 (PS를 포함 막 표면에) (Annexin V 구속력을 감지). 이러한 assays의 각 몇 가지 단점이 있습니다. 예를 들어, TUNEL 분석에 사용 transferase 터미널은 몇 세포 층 이상 침투하지 않습니다. 또한 Annexin V는 막 손상 (Annexin V는 세포 안으?...
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
우리는 프로토콜을 편집 도움을 Mariani 연구소의 회원 감사드립니다. 이 작품은 CIRM 박사 과정 이수 교육 기금 (JLF), CIRM 다리 인턴쉽 (TZTT), 로버트 E. 5 월 R. 라이트 재단 (FVM), 그리고 남부 캘리포니아 대학 (FVM)에 의해 재정 지원되었다.
자료
| Name | Company | Catalog Number | Comments | ||||||||||||||
| 시약의 이름 | 회사 | 카탈로그 번호 | |||||||||||||||
| LysoTracker 레드 DND-99 | Invitrogen | # L-7528 | |||||||||||||||
| 행크스 BSS | Invitrogen | 14025-076 | |||||||||||||||
| Paraformaldehyde | EMD | EM-PX0055-3 | |||||||||||||||
| Vectashield | 벡터 | H-1200 | |||||||||||||||
| DMEM | Cellgro | 10-013 - CV | |||||||||||||||
| 비 필수 아미노산 | Cellgro | 25-025 - CI | |||||||||||||||
| 나트륨 pyruvate | Cellgro | 25-000 - CI | |||||||||||||||
| FBS | Hyclone | SH30071.02 | |||||||||||||||
| 펜 패 혈성 | Invitrogen | 15140-122 | |||||||||||||||
| B-메르 캅토 에탄올, 50 MM | Invitrogen | 21985-023 | |||||||||||||||
| LabTek-II 상공 회의소 슬라이드 (8도) | Nalge Nunc 인터내셔널 | 154534 | |||||||||||||||
| 젤리 0.1 % | Millipore | ES-006-B | |||||||||||||||
| Dulbecco의 PBS (D-PBS) | Cellgro | 21-031 - CV | |||||||||||||||
솔루션 요리법 4 % Paraformaldehyde 100 ML는 다음과 같습니다
경고 : '주름'양식 (작은 알약을 압축)에서 Paraformaldehyde이 덜 가루이며, 따라서 후드의 외부 측정 할 수 있습니다. 하지만 당신은 여전히 보호 먼지 마스크 (N95를 착용해야합니다이상) 처리하는 동안. EB 문화 미디어 500 ML EB 미디어를 들면 :
|
참고문헌
- Baehrecke, E. H. How death shapes life during development. Nat. Rev. Mol. Cell Biol. 3, 779-787 (2002).
- Meier, P., Finch, A., Evan, G. Apoptosis in development. Nature. 407, 796-801 (2000).
- Ikonomidou, C. Ethanol-induced apoptotic neurodegeneration and fetal alcohol syndrome. Science. 287, 1056-1060 (2000).
- Dunty, W. C., Chen, S. Y., Zucker, R. M., Dehart, D. B., Sulik, K. K. Selective vulnerability of embryonic cell populations to ethanol-induced apoptosis: implications for alcohol-related birth defects and neurodevelopmental disorder. Alcohol Clin. Exp. Res. 25, 1523-1535 (2001).
- Price, O. T., Lau, C., Zucker, R. M. Quantitative fluorescence of 5-FU-treated fetal rat limbs using confocal laser scanning microscopy and Lysotracker. Cytometry A. 53, 9-21 (2003).
- Jacobson, M. D., Weil, M., Raff, M. C. Programmed cell death in animal development. Cell. 88, 347-354 (1997).
- Fuchs, Y., Steller, H. Programmed cell death in animal development and disease. Cell. 147, 742-758 (2011).
- Qu, X. Autophagy gene-dependent clearance of apoptotic cells during embryonic development. Cell. 128, 931-946 (2007).
- Grimsley, C., Ravichandran, K. S. Cues for apoptotic cell engulfment: eat-me, don't eat-me and come-get-me signals. Trends Cell Biol. 13, 648-656 (2003).
- Lauber, K., Blumenthal, S. G., Waibel, M., Wesselborg, S. Clearance of apoptotic cells: getting rid of the corpses. Mol. Cell. 14, 277-287 (2004).
- Haller, T., Dietl, P., Deetjen, P., Volkl, H. The lysosomal compartment as intracellular calcium store in MDCK cells: a possible involvement in InsP3-mediated Ca2+ release. Cell Calcium. 19, 157-165 (1996).
- Zucker, R. M., Hunter, S., Rogers, J. M. Confocal laser scanning microscopy of apoptosis in organogenesis-stage mouse embryos. Cytometry. 33, 348-354 (1998).
- Zucker, R. M., Hunter, E. S., Rogers, J. M. Apoptosis and morphology in mouse embryos by confocal laser scanning microscopy. Methods. 18, 473-480 (1999).
- Gavrieli, Y., Sherman, Y., Ben-Sasson, S. A. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J. Cell Biol. 119, 493-501 (1992).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J. Vis. Exp. (51), e2720 (2011).
- Chiang, C. Manifestation of the limb prepattern: limb development in the absence of sonic hedgehog function. Dev. Biol. 236, 421-435 (2001).
- Ishibashi, M., McMahon, A. P. A sonic hedgehog-dependent signaling relay regulates growth of diencephalic and mesencephalic primordia in the early mouse embryo. Development. 129, 4807-4819 (2002).
- Schuldiner, M. Induced neuronal differentiation of human embryonic stem cells. Brain Res. 913, 201-205 (2001).
- Bain, G., Kitchens, D., Yao, M., Huettner, J. E., Gottlieb, D. I. Embryonic stem cells express neuronal properties in vitro. Dev. Biol. 168, 342-357 (1995).
- Dumont, A. Hydrogen peroxide-induced apoptosis is CD95-independent, requires the release of mitochondria-derived reactive oxygen species and the activation of NF-kappaB. Oncogene. 18, 747-757 (1999).
- Hampton, M. B., Orrenius, S. Dual regulation of caspase activity by hydrogen peroxide: implications for apoptosis. FEBS Lett. 414, 552-556 (1997).
- Wood, W. Mesenchymal cells engulf and clear apoptotic footplate cells in macrophageless PU.1 null mouse embryos. Development. 127, 5245-5252 (2000).
- Scott, R. C., Juhasz, G., Neufeld, T. P. Direct induction of autophagy by Atg1 inhibits cell growth and induces apoptotic cell death. Curr. Biol. 17, 1-11 (2007).
- Rodriguez-Enriquez, S., Kim, I., Currin, R. T., Lemasters, J. J. Tracker dyes to probe mitochondrial autophagy (mitophagy) in rat hepatocytes. Autophagy. 2, 39-46 (2006).
- Bampton, E. T., Goemans, C. G., Niranjan, D., Mizushima, N., Tolkovsky, A. M. The dynamics of autophagy visualized in live cells: from autophagosome formation to fusion with endo/lysosomes. Autophagy. 1, 23-36 (2005).
- Boya, P., Mellen, M. A., de la Rosa, E. J. How autophagy is related to programmed cell death during the development of the nervous system. Biochem. Soc. Trans. 36, 813-817 (2008).
- Galluzzi, L. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death Differ. 16, 1093-1107 (2009).
- Klionsky, D. J. Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes. Autophagy. 4, 151-175 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유