Method Article
رواية عالية الدقة
In This Article
Summary
نحن تصف رواية في الجسم الحي تقنية التصوير أن الأزواج الفئران خيالية الفلورسنت مع ويندوز داخل الجمجمة وعالية الدقة المجهر 2 الفوتون. هذا التصوير منصة دراسات الإيدز من التغيرات الدينامية في أنسجة المخ والأوعية الدموية الدقيقة، على مستوى وحيدة الخلية، بعد الشتائم المرضية وغير قابلة للتكيف لتقييم تسليم المخدرات داخل الجمجمة والتوزيع.
Abstract
لقد نجح في مزاوجة المحددة سابقا داخل الجمجمة نافذة (ICW) تكنولوجيا 1-4 مع حيوي داخلي المجهري متحد البؤر 2 الفوتون لتطوير منصة رواية التي تسمح لتصور مباشرة طويلة الأجل للتغيرات بنية الأنسجة intracranially. التصوير في قرار خلية واحدة في الأزياء في الوقت الحقيقي يوفر المعلومات الحيوية التكميلية وراء تلك التي يوفرها التحليل النسيجي نقطة النهاية القياسية، والتي تبدو فقط في "فرقعة شوت 'المقاطع العرضية من الأنسجة.
إنشاء هذه التقنية التصوير حيوي داخلي في الفئران خيالية الفلورسنت، ونحن قادرون على صورة أربع قنوات في وقت واحد الفلورسنت. من خلال دمج خلايا fluorescently المسمى، مثل GFP + نخاع العظام، فمن الممكن لتتبع مصير هذه الخلايا دراسة على المدى الطويل الهجرة والاندماج والتمايز داخل الأنسجة. مزيد من خلية مراسل الثانوية، مثل mCherry دبقي خط الورم، والتكامل يسمح لcharacterization من الخلية: التفاعلات الخلية. ويمكن إبراز التغيرات الهيكلية في المكروية الأنسجة من خلال إضافة الأصباغ داخل الحيوية والأجسام المضادة، على سبيل المثال CD31 الأجسام المضادة الموسومة والجزيئات ديكستران.
وعلاوة على ذلك، نحن تصف مزيج من نموذجنا التصوير ICW مع الحيوانات الصغيرة الدقيقة irradiator التي توفر أشعة المجسم، وخلق منصة التي من خلالها يمكن تقييم التغيرات النسيجية الحيوية التي تحدث بعد إعطاء إشعاع المؤين.
القيود الحالية من نموذجنا تشمل انتفاذ من المجهر، الذي يقتصر على عمق يصل إلى 900 ميكرون من سطح القشرية الفرعية، مما يحد من التصوير إلى المحور الظهري من الدماغ. وجود عظم الجمجمة يجعل ICW إجراء تقني أكثر تحديا، بالمقارنة مع النماذج الدائرة أكثر رسوخا والاستفادة المستخدمة حاليا لدراسة الأنسجة الثديية ومنصات الدهون 5-7. بالإضافة إلى ذلك، ICW الأقليمايديس تحديات عديدة عندما الاستفادة المثلى من التصوير.
Introduction
فهم أفضل للتغيرات الهيكلية والبيولوجية التي تنشأ في الدماغ استجابة لمختلف الأمراض، والتدخلات العلاجية هو أمر حاسم لتحسين استراتيجيات العلاج. ومع ذلك، واحدة من التحديات الراهنة في دراسة هذه التغييرات الهيكلية والبيولوجية، ولا سيما فيما يتعلق الأمراض داخل الجمجمة، هو عدم إمكانية الوصول إلى الأنسجة وعدم القدرة على دراسة التطور الزمني وتطور ديناميكية التغيرات في الجسم الحي في الإعداد. جيل من "نافذة" التكنولوجيا قد ثبت سابقا ناجحة في دراسة تغيرات الأنسجة اللينة من خلال التنمية الورم 5-7. تطوير نماذج ICW يبرهن على أن تكون أكثر تحديا من الناحية الفنية، ونظرا لضرورة لإزالة عظم الجمجمة دون الإضرار على التحريض عدوى في الأنسجة الدماغية الكامنة. وقد حاول الأوراق السابقة لرقيقة الجمجمة لتصور 8-10 الأنسجة ومع ذلك، لانتاج عالية ايم قرار واضحمطلوب الأعمار إزالة كاملة من عظم الجمجمة 11. كرر طويلة الأجل التصوير (30 يوما +) أصبح في الآونة الأخيرة فقط خيارا مجديا من خلال التصوير 1،11، وقد تم دراسة أطر زمنية أقصر سابقا 5.
على مدى العقد الماضي كان هدفا رئيسيا لتوضيح أصل الجدد الأوعية الدموية المحفزات المرضية التالية، ولا سيما في استجابة لتشكيل الورم والتقدم، لتوفير أهداف علاجية جديدة لعلاج الأورام. لا يزال الكثير من الجدل حول مصدر الأوعية الدموية الجديدة في الدماغ أثناء التطور ورم أو الإشعاع التالية. تقليديا وقد اعتبر الأوعية الدموية يحدث من خلال الأوعية الدموية، وهي العملية التي تشكل سفن جديدة من تنبت من السفن الموجودة من قبل 12. دراسات أكثر حداثة ومع ذلك، تشير إلى أن عملية الجنينية يفترض في السابق من تكون الأوعية قد يكون لعب دورا أكثر كبيرا في تشكيل الأوعية الدموية المرضية. VAsculogenesis ينطوي على تجنيد من نظرائهم أرومة وعائية الكبار من نخاع العظم والتي بدورها ثم تشارك مباشرة في تشكيل جديد البطانة سفينة 12-14. تراكم الأدلة يشير إلى أن يتم تعبئة الخلايا البطانية السلائف من نخاع العظام للشروع في دي نوفو تشكيل سفينة ردا على الوسطاء أنكجنيك 15-17. ومع ذلك، توفر هذه الدراسات أدلة متناقضة للمساهمة المباشرة لهذه نخاع العظم الخلايا المشتقة (BMDCs) إلى البطانة السفينة مع نسبة مساهمة متفاوتة مع نوع من التحفيز المرضية والاستجابة للعلاج 18-21.
لذلك، وإنشاء الطرق التجريبية استنساخه التي تسمح عالية الدقة التصوير حيوي داخلي لتكرار دراسة طويلة الأجل لعملية التكامل BMDC في الأوعية الدموية للورم، واستجابة للعلاج لا يقدر بثمن. تفشل التقنيات القياسية النسيجي لتوفير تقنية المعلومات الديناميكيةاملعلومات اللازمة لتحديد البقاء على المدى الطويل، التفاضل والتكامل من الخلايا التي تؤدي إلى neovasculature وبالتالي لا يمكن أن تثبت بشكل قاطع آليات التفاعل الخلية.
لقد أظهرنا باستخدام نهجنا التجريبية أن هناك درجة متفاوتة من تجنيد BMDC بعد كل من الإشعاعات المؤينة داخل الجمجمة ونمو الورم، والتوظيف التي هي ومع ذلك، موقع علم الأمراض محددة وليس غزوا من الأنسجة داخل القحف كامل 11،22. لقد أظهرنا أن تجنيد يتبع نمطا وقت حساس يتضح من التصوير المتكرر لحيوان واحد 11،22. وبالمثل، في الجسم الحي التصوير يمكن أن توفر أيضا التعمق في محاكاة الخلايا السرطانية حيث الخلايا السرطانية الموسومة fluorescently ولا يمكن تصوير وتعقب مع البينية الحيوية CD31 الأجسام المضادة لخلايا بطانة الأوعية الدموية لتسليط الضوء على إمكانية transdifferentiation الخلايا السرطانية مباشرة لتشكيل البطانة الخاصة به.
ومما يعزز براعة هذا النموذج من قبل القدرة على صورة 4 قنوات الفلورسنت، وتوفير عدد من مجموعات شاملة لدراسة متفاوتة عملية الخلوية والبيولوجية. ونحن قادرون على intravitally صورة CFP (الأزرق)، GFP (الخضراء)، الكرز / طلب تقديم العروض (الحمراء)، وAlexa647/APC (بعيدة الحمراء)، في وقت واحد في حقل واحد مرارا وتكرارا على مر الزمن. يمكن للباحثين تعديل وراثيا خلايا للتعبير عن fluorochromes لكل من القنوات وكذلك الأصباغ الشراء والأجسام المضادة لتسليط الضوء على التغييرات الهيكلية ذات أهمية خاصة. حتى الآن الأصباغ والأجسام المضادة التي يشيع استخدامها في دراسات تشمل CD31 وديكستران التي على حد سواء تسليط الضوء على الأوعية الدموية الدقيقة وتغيرات في الأنسجة 1،11،23،24، على الرغم من أننا تستخدم القناة بعيدة الأحمر لهذا الغرض على حد سواء متاحة للاستخدام في الآخر القنوات المذكورة. وبالمثل، تم الأصباغ الأخرى بما في ذلك Sytox أورانج، التي ستسلط الضوء على مجالات موت الخلايا المبرمج، وعلامات مثل تلك من Visen شركة، جمعية مهندسي البترولتصميم cifically للاستخدام في الجسم الحي. وبالإضافة إلى قنوات الفلورسنت التي يشيع استخدامها الأربعة المذكورة، وهو الجيل الثاني التوافقي (SHG) قناة يمكن إضافة والأمثل لصورة ألياف الكولاجين الذاتية للنموذج 7، تصور الغشاء القاعدي المحيطة الأوعية الدموية.للتدليل على التكيف من نموذجنا، فضلا عن التفاعلات خلية خلية المذكورة أعلاه، فإننا تمكنا من دراسة التفاعلات خلية المخدرات. لقد نظرت إلى مثبطات المخدرات مثل AMD3100، مثبط SDF-1، ودوره في إشارة شبكات متورطة في تجنيد BMDC 11. وبالمثل قمنا المهندسة وراثيا من الخلايا U87 xenografts دبقي للتعبير عن VEGFTrap، مثبط VEGF 25، جنبا إلى جنب من خلال IRES إلى جزيء GFP. باستخدام RFP + BM نحن قادرون على دراسة دور VEGF له على تجنيد BMDCs إلى الأوعية الدموية. وفي الآونة الأخيرة قمنا الاستفادة من نموذج لدراسة حركية الدواء تبحث في MEChanism وراء الورم ترسيم المخدرات فلوريسئين 26، على المستوى الخلوي. من خلال استخدام مخصص بنيت في منزل irradiator حيوان صغير كنا قادرين على الاندماج المجسم الإشعاع تسليمها لتقييم مدى استجابة الورم على حد سواء وBMDCs للعلاج.
من خلال استخدام لدينا رواية حيوي داخلي طريقة الباحثون التصوير والتبصر في التغييرات في الوقت الحقيقي وحيدة الخلية التي تحدث في مختلف الأمراض والنظم، والمساعدة في توضيح العديد من ميزات وظيفية والبيولوجية من التغيرات النسيجية.
Protocol
كل عمل الحيوان قد نفذت تحت رعاية الحيوان واللجان اللجنة الاستخدامات المعتمدة بروتوكول وأعدم في الامتثال لجميع المبادئ التوجيهية ذات الصلة واللوائح والوكالات التنظيمية.
لاستكشاف الأخطاء وإصلاحها المرجعي الجدول 2.
1. نخاع العظم إعادة إعماره (اختياري) الشكل 1 (30 دقيقة الإعدادية، 5 دقائق لكل الماوس)
يجب أن يتم تنفيذ كل عملية جراحية باستخدام تقنية العقيم صارمة مع معدات معقمة تعقيمها.
الماوس المانحة واحد سوف يعيد تشكيل ثلاثة الفئران المضيف.
- تخدير الفئران المتلقية NODscid والموقف، مع الرصاص لحماية الرأس، داخل مركز irradiator في Gammacell 40 'exactor'.
- أشرق الفئران NODscid مع 2.5 جراى مجموع تشعيع الجسم (TBI).
الخطوة الحرجة: الأمثل من TBI قد تكون هناك حاجة نظرا لاختلاف في الجرعة المطلوبة لكافية المضيف المناعي CEاستنزاف ليرة لبنانية في سلالات الفئران مختلفة.
نقطة وقفة: يمكن للإشعاع الفئران المضيف مقدما ولكن يجب استخدامها في غضون 24 ساعة من اضاءة.
- الموت ببطء الفئران المانحة وفقا للمبادئ التوجيهية لجنة رعاية الحيوان المؤسسية. تنظيف hindlimbs وإزالة الساق وعظم الفخذ من على حد سواء، وتجريد جميع الأنسجة الزائدة من العظام (أرقام 1ai، 1aii).
الخطوة الحرجة: عظام الشظية ليست قابلة للاستخدام بسبب التجويف ضيقة جدا.
- إزالة لوحات من نهاية طرفي أربعة العظام المستخرجة وطردهم باستخدام إبرة G 22 و 1 مل العقيمة PBS حتى أنهم هم من البيض في المظهر (الشكل 1aiii). مرجع الجدول 2.
- مزيج من نخاع العظم (BM) التعليق المستخرج جيدا ورسم 300 ميكرولتر إلى ثلاثة 27 G الإبر السلين. استخراج BM ينبغي أن تتضمن ما يقرب من 2 × 10 7 الخلايا وويكفي لمدة 3 المضيفة الفئران reconstitutions. مرجع الجدول 2.
- حقن في الوريد التعليق الذيل الأفقي من ثلاثة الفئران NODscid المشع سابقا من الخطوة 1.1 (1B الشكل). مرجع الجدول 2.
تنبيه: للتحقق من العقم BM حقن نوصي الطلاء وBM وثقافة المتبقية لمدة 24 ساعة للتأكد من الإصابة. السبب الرئيسي للوفاة في هذه المرحلة هو العدوى في الفئران المعاد حديثا.
2. الجيل نافذة داخل القحف - الشكل 2 (30 دقيقة لكل الماوس)
يجب أن يتم تنفيذ كل عملية جراحية باستخدام تقنية العقيم صارمة مع معدات معقمة تعقيمها وتحت مصباح الحرارة للحفاظ على الحيوانات دافئة (الشكل 2A).
- تخدير الفئران المتلقية NODscid مع IACUC المعتمدة مخدر، آفيرتين حقن IP عند 0.5 ملغ / غ والموقف، مع الرصاص لحماية الرأس، داخل مركز للGammacell 40 'exactor' irradiator. إزالة الشعر من فروة الرأس. وبالإضافة إلى ذلك تطبيق هلام المسيل للدموع لمنع الجفاف القرنية.
- فروة الرأس نظيفة الأولى مع حل بتدين ثم مع الكحول، ثم إجراء شق من نقطة الوسط من الأذنين إلى ما فوق العينين. إزالة فروة الرأس 3 ملم جانبي الشق الأول، وفضح الجمجمة ومعالم سطح الجمجمة (الشكل 2Bi).
- رفع السمحاق عن طريق حقن 2٪ ليدوكائين: حل ادرينالين وتشريح بعيدا عن سطح الجمجمة (الشكل 2Bii).
- باستخدام 2.7 مم منقب الحفر، وتضعف ملم دائرة 2.7 من الجمجمة خلال القشرة من النصف الأيمن بين امدا bregma و. لا تخترق العظام مع الحفر (الشكل 2Biii). مرجع الجدول 2.
الخطوة الحرجة: وإذا حفر يذهب من خلال الجمجمة أن تتلف سطح الدماغ النتائج التأثير مع هيئة تنظيم الاتصالات إضافيةاتحاد المغرب العربي. وبالإضافة إلى ذلك سوف يحدث النزيف منع نافذة واضحة من التي يتم توليدها.
- إزالة رفرف العظام الضعيفة باستخدام الملقط تشريح وربط الأسنان وقوة متعمد ولكن تسيطر عليها (الشكل 2Biii).
- (اختياري) إذا كان يبحث في علم الأمراض السرطانية، حقن خطوط الخلايا السرطانية المختارة (مع الفلورسنت الجين مراسل) في وسط النافذة إنشاؤها في الخطوة 2.5.
- تحميل 10 ميكرولتر 30 G حقنة هاميلتون مع تعليق خلية وإبرة الحمل في إطار المجسم.
الخطوة الحرجة: سوف تحتاج إلى عدد الخلايا يكون الأمثل للخلايا ورم في استخدام وجدول زمني النمو المطلوبة. لU87 الثقافات التي نستخدمها 2 × 10 5 خلايا في 10 ميكرولتر في الماوس. - تحميل الماوس على الإطار التجسيمي الرقمية محاذاة الإبرة إلى نقطة وسط النافذة ولدت.
- انخفاض الإبرة حتى يلمس فقط سطح القشرية وإعادة تعيين إحداثيات رقمية.
- منخفضإيه الإبرة إلى 3.2 ملم في الأنسجة القشرية وحقن في 3 ملم العميق.
- سحب إبرة ببطء ثم إزالة الماوس من الإطار.
الخطوة الحرجة: حقن المحلول فوق مدة 1 دقيقة، وترك إبرة في الموقف بعد الحقن لضمان خفض تدفق إلى الوراء.
الخطوة الحرجة: إذا تم مصادفة نزيف طفيفة ري مع ملحي معقم لمدة 1-5 دقيقة لوقف نزيف سطحي. المضي قدما في الخطوات اللاحقة.
- تحميل 10 ميكرولتر 30 G حقنة هاميلتون مع تعليق خلية وإبرة الحمل في إطار المجسم.
- بلل سطح الدماغ مع قطرة من برنامج تلفزيوني العقيمة للحفاظ على أنسجة المخ المروية.
- تطفو ساترة 3 مم على سطح الدماغ لختم تماما في جميع أنحاء مم نافذة 2.7 إنشاؤها. مرجع الجدول 2.
- الجمجمة الجافة المحيطة عظم ثم تطبيق vetbond في الجمجمة تعرض كامل للأنسجة فروة الرأس إعادة الختم إلى عظم الجمجمة وساترة في مكانها. لا تنطبق جود فائض لأنها سوف تتسرب تحت الزجاج وتقلل من إمكانية التصوير.
- ميلX الطازجة مسحوق الاكريليك الأسنان والحل، ما يقرب من 30٪ (W / V)، وتطبق على الجزء العلوي من vetbond. لضمان ختم ضيق تتداخل قليلا الاكريليك على الزجاج ساترة حافة (الشكل 2Biv). الجدول المرجع 2.
تنبيه: الأسنان الاكريليك خطرة للغاية لذلك نحن ننصح باستخدام القفازات والقناع في جميع أنحاء الإجراءات.
الخطوة الحرجة: يحتاج الاكريليك الأسنان لتبقى طيعة خلال صب لضمان ختم جيدة وتقليل الزائدة. تراكم الاكريليك على النافذة سوف طمس الصور.
- تسمح الفئران لاسترداد في قفص دافئ.
3. الإشعاع المجسم (اختياري) - الشكل (3) (25 دقيقة لكل الماوس)
وتوجد اختلافات في الإشعاعية المختلفة المستخدمة وكما سوف تكون هناك حاجة مثل هذه الأمثل. استخدمنا irradiator مصممة خصيصا.
- تخدير الفئرانباستخدام isoflurane وعند 4٪ لتحريض تليها 1.5-2٪ في جميع أنحاء الداخلي مع 0.5-1 لتر O 2 (أ) دقيقة، ومكان على العرف كابح الرأس داخل irradiator المجسم (الشكل 3Ai).
- الحصول على 360 درجة مخروط شعاع الاشعة المقطعية مع أنبوب الأشعة السينية على التوالي في 40 KVP و 0.05 مللي أمبير من خلال مرشح الألومنيوم 2 مم. استخدام الصورة لتوجيه حركة المسرح، توجيه isocentre إشعاع للنصف الأيمن ضمان أنها أساسية في اتجاه بطني الظهرية.
- إدراج تلسكوب الموازاة في نصف الكرة الغربي، 8 ملم × 11 ملم كتلة.
الخطوة الحرجة: يمكن تصميم Collimators لكثير من الاجهزة المختلفة، وبحيث يمكن تعزيزها لتضمين واستبعاد أجزاء مختلفة من الدماغ. 8 ملم × 11 ملم وتعرف منطقة نصف الكرة الأرضية من الدماغ.
- الحصول على واحد متعامد الصور المقطعية كلا من أعلى (AP) وأسفل (PA) من خلال تلسكوب الموازاة لمواصلة تعزيز وضع الدماغ، عناتالهياكل العظمية omical يمكن استخدامها لاستنساخ.
- تبادل مرشح الألومنيوم لملم العلاج 0.93 النحاس تحديد وإدارة نصف جرعة الإشعاع المطلوب مع أنبوب الأشعة السينية على التوالي في 225 KVP و 13 أمبير من أعلى في اتجاه AP.
- عودة العملاقة إلى الموقف السفلي وإدارة النصف الثاني من جرعة الإشعاع مرة أخرى مع أنبوب الأشعة السينية على التوالي في 225 KVP و 13 مللي أمبير شكل أسفل في اتجاه السلطة الفلسطينية.
الخطوة الحرجة: من الضروري لأشرق من كل من أعلى وأسفل للحد من التدرج RT من خلال أنسجة المخ، كما أنه يساعد مع محاذاة isocentre إلى مركز الدماغ.
4 في الجسم الحي اثنين من الفوتون المجهري بالليزر - الشكل 3 (1-3 ساعة لكل جلسة)
وتوجد اختلافات في المجاهر المختلفة المستخدمة وكما سوف تكون هناك حاجة مثل هذه الأمثل. استخدمنا كارل زايس LSM510 META الليزر الضوئي Confocآل المجهر.
- تخدير الفئران مع IACUC المعتمدة مخدر، آفيرتين حقن IP عند 0.5 ملغ / غ ونظيفة الإطار باستخدام رذاذ الكحول.
- (اختياري) الموسومة حقن الأوعية الدموية 5-10 دقيقة صبغ قبل التصوير، في الوريد ذيل قبل التصوير. Alexa647-ديكستران تستخدم عند 0.35 ميكروغرام / غرام أو APC-CD31 تستخدم عند 0.2 ميكروغرام / غرام. انظر الجدول رقم 2.
- (اختياري) حقن فلوريسئين عن طريق الوريد الذيل عند تناول جرعة مقدارها 7.7 مغ / كغ، 5 دقائق قبل التصوير، لتحديد الورم. مرجع الجدول 2.
- قنوات الإعداد على المجهر متحد البؤر على النحو الذي يحدده تألقي المستخدمة في الماوس خيالية ولدت. الجدول رقم 1 يوضح القنوات الموصوفة في هذا النموذج.
- عكس الماوس على خشبة المسرح المجهر المنقولة وتحقيق الاستقرار في الرأس في موقف قابل للتشكيل مع دائنية. (الشكل 3Aii) الجدول المرجع 2.
- بدوره على الليزر أول قناة واستخدامها لوضع في وسط ICW.
- استخدام عدسة 5X وتأخذ صورة من الإطار بأكمله لاستخدامه كقاعدة الخريطة للحصول على مزيد من الصور دقة أعلى.
- التصوير ينبغي الاضطلاع بها باستخدام 10X 20X وعدسات 'المدى' للحصول على أفضل جودة الصورة.
الخطوة الحرجة: القنوات والأهداف على 2PLM ينبغي إعداد باستخدام الخلايا المهندسة في المختبر قبل التصوير من نماذج الفئران للتأكد من أنها تسلط الضوء على تألقي الصحيح.
| تألقي | CFP | GFP / فلوريسئين / FITC | mCherry / RFP / DsRED | APC / آلexa647 | SHG تألق ذاتي |
| الليزر الإثارة | 458 نانومتر | 488 نانومتر | 543 نانومتر | 633 نانومتر | حرباء الليزر 820 نانومتر |
| جمع تصفية | 480-520 نانومتر | 500-550 نانومتر | 565-615 نانومتر | 650-710 نانومتر | 390-465 نانومتر |
الجدول 1. الإعداد تألقي. دليل للمستخدم لرؤية الليزر الإثارة وانبعاث جامع الأطياف المستخدمة في كل من القنوات المتاحة في النموذج.
النتائج
الخطوة اختياري من إعادة تشكيل BM من الفئران NODscid ينبغي أن يؤدي إلى امتصاص 80٪ من BM والفلورسنت 'المانحة في 100٪ من' المضيف 'الفئران NODscid، سوف تكون هناك حاجة إلا تعظيم الاستفادة من المصرف التجاري العراقي لتعزيز إعادة في أخرى غير -immunocompromsed السلالات. إذا تم تشكيلها دون جدوى الفئران أنها سوف يمرض ويموت بسرعة في أعقاب هذا الإجراء، قد تتطلب الفئران ضعفت المزيد من المواد الغذائية ومصادر المياه.
ينبغي أن ICW مرة واحدة الانتهاء تبدو وكأنها أن ينظر في الشكل 2Biv. ومن المثالي أن يكون سلسلة من التلال المحيطة بها من الاكريليك ساترة الزجاج لأن هذا يعطي قوة للانضمام الى الجمجمة. نوافذ المثالية هي استنساخه وتسمح للتصوير المتكرر لمدة تصل إلى 8 أسابيع بعد جيلهم (الشكل 2C). سوف صور المنتجة من خلال هذه النوافذ الأمثل تبدو كما تلك التي ظهرت في 3Bi الشكل. سوف عيوب في الجيل نافذة تنتج صورا الفقراءجودة على سبيل المثال، سوف فقاعات الهواء تحت النافذة منع حقول كاملة من مشاهدة يجري تصويرها، وسوف تظهر المناطق الداكنة مثل الهواء يمنع التصوير ليزر (الشكل 3Bii). مع الغراء الزائد والاكريليك على ساترة سيكون هناك مستوى عال من خلفية سوف مضان ومجالات الحقل يجري نشف كما رأينا في الشكل 3Biii، وبالمثل إذا كان هناك الاوساخ على نافذة النقاط الصغيرة من مضان الخلفية تكون واضحة في الميدان (الشكل 3Biv).
هو محدد سلفا نجاح ICW التصوير بواسطة سلامة تقنية جراحية، ومع ذلك، يمكن حتى ICWs الأمثل تواجه مشاكل أثناء دورة التصوير. على هذا النحو، ومجموعة ودرجة وضوح موجود في الصور ولدت كما رأينا في الشكل 3. الصورة نوعية المنشور صورت في الشكل 3C يحدث عندما يكون كل شيء هو الأمثل. على الرغم من أنه ليس من الممكن لجميع الفئران، فمن الممكن أن نتوقع 80٪ من الصورةو ولدت لتبدو وكأنها هذا. واحدة من العيوب الرئيسية في الإعداد المجهر الحالي هو استخدام الليزر مقلوب. الفئران لا بد من وضعه على ظهورهم وهذا يؤدي إلى الإجهاد المفرط وعدم الراحة التي قد تؤدي إلى صعوبة في التنفس أثناء التصوير. هذا وتنتج صورة 'مبطنة' كما يتداخل مع التنفس في المتوسط التي تحدث أثناء التصوير، وبموجبها يتم تصوير كل صف بكسل أربع مرات ويتم عرض متوسط من أربعة في الصورة النهائية. تسبب أي حركة خلال حساب المتوسط، مثل تلك التي كتبها صعوبة في التنفس، سيخلق قطعة أثرية الذي يظهر كخط على الصورة، كما رأينا في الشكل 3D. الفئران التي هي مخدرة كاف أثناء التصوير قد تواجه هذه المشكلة أيضا. يمكن تخفيض تأثير 'مبطنة عن طريق الحد من صورة في المتوسط إلى يوم، ولكن هذا سوف تتحول في تقليل جودة الصورة، وربما لا قضاء على المشكلة. وبدلا من الفئران يمكن تعديل أوضاعها أو محاكمته عندما تطبيع التنفس. استخدام سوو ل2PLM تستقيم ينفي هذه المشكلة كما الفئران يمكن تصويرها 'في وضعية الانبطاح'. مشكلة إضافية مع التصوير على 2PLM مقلوب يشمل إمكانية الوصول محدودة لتحديد المواقع ICW مرة واحدة الماوس على المجهر، وهذا يؤدي إلى صور "مجزأة" مثل تلك التي ظهرت في 3E الشكل. هنا الليزر وساترة ليست في وضع عمودي على بعضها البعض، وكما يحدث مثل التصوير بزاوية. هذه النتائج في توليد صورة "مجزأة" حيث لم يتم تصوير جوانب من مجال الرؤية. يتم حل هذه المشكلة بسهولة مع اعادة تموضع من الماوس لضمان ساترة هو أفقي تماما مرة واحدة على رأسه يشن كما رأينا في 3Aii الشكل.
النموذج المقدم هنا كان يستخدم خصيصا لدراسة دور BMDCs في الأوعية الدموية للأنسجة الورم، ويدل على القدرة على استخدام ثلاث قنوات مختلفة في نفس الوقت (الكرز، GFP، بعيدة الحمراء - Alexa647 وAPC) ماكينز CFP ومجموعة المساعدة الذاتية زائدة عن الحاجة لهذه القصة خاصة. كنا قادرين على الفئران صورة طوليا لمدة تصل إلى 8 أسابيع، ودراسة توظيف ودمج الخلايا BM في الأوعية الدموية على مستوى خلية واحدة، مع عدم وجود آثار ضارة الناجمة عن النافذة. يوضح هذا النموذج سهولة جمع المعلومات الحيوية على مصدر وتشكيل الأوعية الدموية والتفاعل من أنواع مختلفة من الخلايا في المصالح، فقد سبق من خلال نقطة نهاية التحليل النسيجي.
| خطوة | مشكلة | منطق | حل |
| 1.4 | العظام تتحطم | أدوات حادة | جمع نخاع العظم تشكيل الماوس الطازجة باستخدام مقص أو شفرة مشرط شحذ الطازجة، سوف شظايا العظام تمنع حقن TV |
| 1.5 | استخراج منخفضة (viscosit منخفضذ) | قطع العظم بشكل أقصى endplates جدا؛ الفقراء طريقة جمع | ينبغي قطع عظام كما قريب ممكن، وجمع مع العظم داخل أنبوب تجميع لكي تمنع دفقة العودة ينبغي أن ينفق الوقت لاستخراج BM الحد الأقصى ومع الرعاية إذا كان الماوس تجمع الضروري أكثر من واحد في 1 مل |
| استخراج عالية (عالية اللزوجة) | العازلة جمع منخفض | تمييع حلا مع اضافية 0.1٪ BSA، انقسم الى ثلاثة الفئران المتلقي يصل إلى 500 ميكرولتر في أقصى الماوس | |
| 1.6 | الحقن في الوريد سيئة | الفقراء توسع الأوعية وضوح السفينة | تعزيز تمدد مع مصباح الحرارة. مكان الماوس في ذيل كابح الوريد مع بني في مصدر الضوء لمساعدة وصول |
| 1 | الفئران المرضى | عدوى | التضحية الفئران وفقا لقواعد المؤسسة. ضمان يتم تنظيف ذيول قبل الحقن وتحقق من العقممن استخراج BM في الثقافة |
| تموت الفئران | الفقراء BM امتصاص | تحقق٪ من امتصاص BM الفلورسنت من فأر ميت. تحسين TBI لسلالة من الفئران تستخدم زيادة كمية BM حقن (على سبيل المثال استخدام الماوس المانحة واحد لاثنين من المستلمين) | |
| 2.4 | نزيف قاصر | الجافية خرق أثناء الحفر | الضغط مع منصات هلام والمستمر وغسل ملحي معقم |
| نزيف الرئيسية | المخ التي تضررت من الحفر | تضحية الماوس وفقا لمبادئ توجيهية مؤسسة | |
| 2.8 | فقاعات الهواء تحت ساترة | سوء الاتصال مع السطح القشري يمنع تحديد المكان المناسب | إزالة ساترة وإضافة PBS إضافية لتعويم ساترة على النافذة لإزالة الفقاعات |
| 2.10 | انزلاق ساترة خلال الإلتصاق | ACRكتلة ylic ثقيل، ووضع الضغط على ساترة ويتحرك ساترة للخروج من الطريق | ملاقط ينبغي أن تستخدم لعقد ساترة إلى أسفل بينما يتم تطبيق vetbond والاكريليك |
| 4.2 | الحقن في الوريد سيئة | الفقراء توسع الأوعية وضوح السفينة | تعزيز تمدد مع مصباح الحرارة. مكان الماوس في ذيل كابح الوريد مع بني في مصدر الضوء لمساعدة وصول |
| 4.4 الشكل 3C | صور 'واصطف' | جاهد أو عدم انتظام التنفس | إزالة الماوس من إطار والسماح للتعافي زيادة مستوى مخدر تديره وضبط الموقف للتأكد من الرقبة وليس أكثر من اللازم استعرضوا أو تمديدها لمنع التنفس |
| الشكل 3C | صورة 'مقطع' | الدماغ ليس موازية لأهداف | ضبط الموقف من ساترة لضمان أنها مسطحة |
| سفينة لا تصور | حقن لا ينظر intravascularly | إعادة الحقن في الوريد الذيل البديل، ذيل الحارة لضمان توسع الأوعية جيدة | |
| خلفية عالية | ساترة القذرة، فقاعات الهواء، أكريليك | مسح ساترة مع رطبة 70٪ من القماش الإيثانول، لا نقع كما قد تخترق تحت الاكريليك وتلف أنسجة المخ |
الجدول 2. استكشاف الأخطاء وإصلاحها. والمبدأ التوجيهي للخطوات التصحيحية اللازمة لمجالات إشكالية الإجراءات.
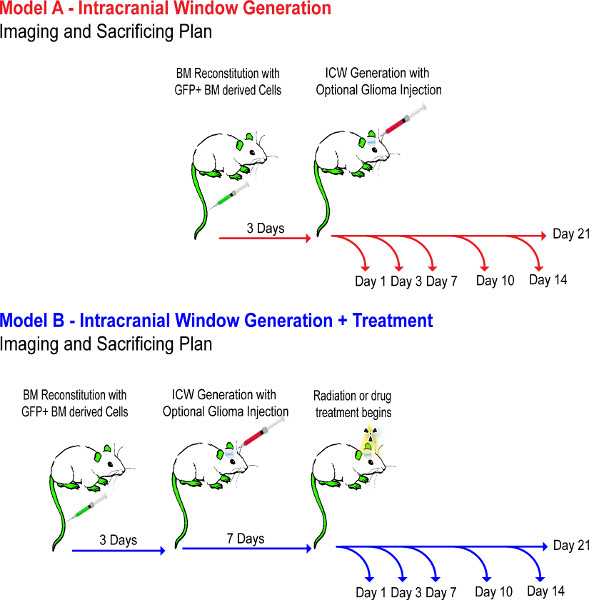
Schemata 1. مخطط تدفق التجريبية. وهذا يدل على الجدول الزمني للأحداث من خلال الخطوات التجريبية 1-4. نماذج الماوس يتم الإعداد أكثر من أسبوع، إلى ضمان BM يعيد بشكل صحيح، وليس تعامل مع المخدرات حتى يوم 7 من ورم لضمان ترقيع الورم. انقر هنا لعرض أكبر شخصية .
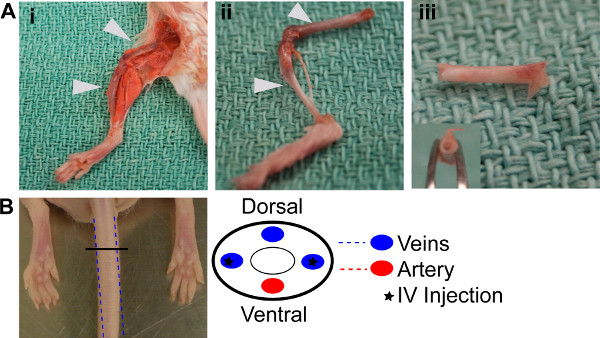
الشكل 1. إعادة إعماره BM. (A) BM إجراءات استخراج ط. تشريح العظام أطرافهم هند. الثاني. عظم الفخذ والساق تشريح من الأطراف الخلفية، وتنظيفها وجاهزة للاستخراج. الثالث. العظام مع نهاية اللوحة وإزالة مسح من خلال، مما يدل على مظهر أبيض من عظام فارغة. (B) Schemata يتظاهرون حيث يتم وضع الأوردة الجانبية للحقن في الذيل.
الصفحات = "دائما"> 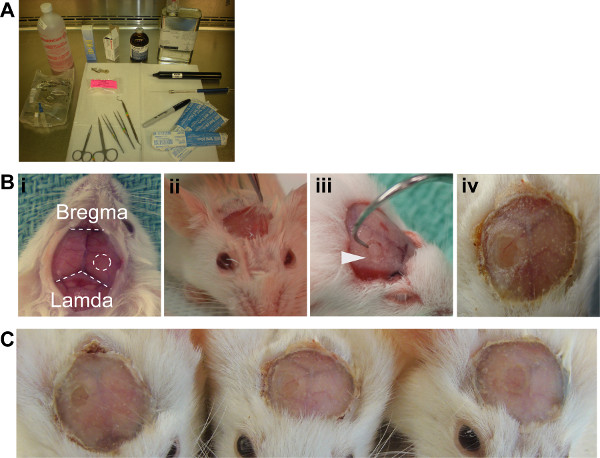
الشكل 2. ICW جيل. (A) الإعداد العقيم موصى بها (B) ط. مكشوف سطح الجمجمة يكشف عن معالم المطلوبة لإجراء عملية جراحية، وينبغي وضع ICW على النصف الأيمن مسافة واحدة من و bregma LAMDA. الثاني. رفع Periostieum مع حل يدوكائين، وعلى استعداد لإزالة ثالثا. ربط الأسنان اللازمة لإزالة شظية العظم ولدت مع الحفر. رابعا. منتهية ICW مع الاكريليك الأسنان. (C) ثلاثة سبيل المثال نظام التشغيل Windows تدليل على استنساخ الأسلوب.
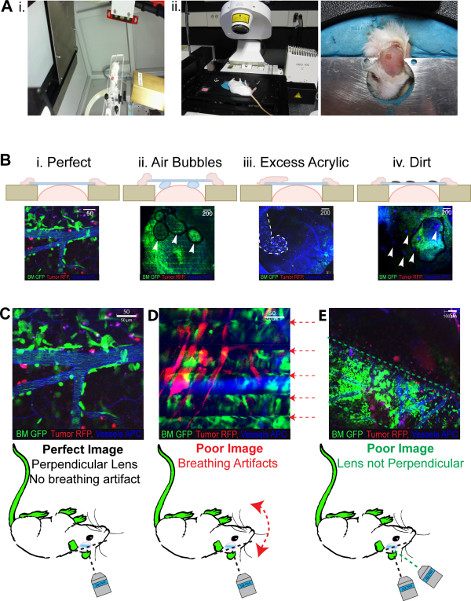
الشكل 3. 2PLM النتائج المتوقعة. جميع الصور تظهر باللون الأخضر BM، ورم الأحمر والأزرق (الزائفة الملونة بعيدا الحمراء) الأوعية الدموية. (A) ط. يوضح الإطار الرأس الذي يحتفظ تدفق isoflurane وداخل irradiator الحيوانات الصغيرة. ويمكن أيضا أن 8 × 11 مم تلسكوب الموازاة أن ينظر يتحرك من خلال العملاقة. الثاني. الماوس في مقلوب وضعه في الإطار رئيس المطلوبة للتصوير، plastercine قابل للتشكيل يضمن يمكن استيعاب جميع النوافذ. (B) صور بيانية لنتائج المشاكل مع الجيل نافذة من أنا. نافذة الأمثل والثاني. نافذة مع فقاعات الهواء محاصرين تحت والثالث انسكاب الاكريليك على ساترة والرابع. الاوساخ على النافذة نفسها. (C) يسلط الضوء على المشاكل التي تحدث مع التصوير بعد جيل الناجح لICW ط. الأمثل التصوير الثاني المصنوعات اليدوية. التنفسخلق صورة 'مبطنة' ثالثا. ساترة ليس عمودي على الليزر توليد صورة "مجزأة". انقر هنا لعرض أكبر شخصية .
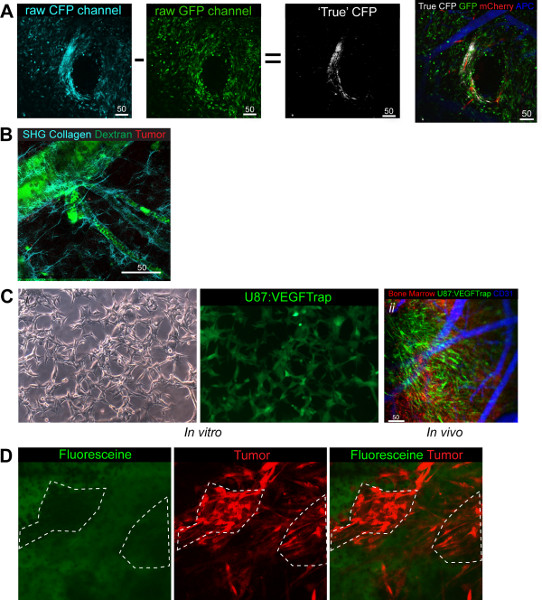
الشكل 4. الاستخدامات الوظيفية والتكييف من طراز (A) CFP تجهيز التصوير آخر حيث يتم طرح صورة من صورة GFP CFP للكشف عن صورة CFP الحقيقية التي يمكن overlayed القنوات الثلاث الأخرى باللون الأبيض. الأخضر BM، ورم أحمر، أبيض الخلايا الجذعية السرطانية، أزرق (الزائفة الملونة بعيدا الحمراء) الأوعية الدموية (B) مظاهرة من ألياف الكولاجين التي يمكن تصويرها مع مجموعات المساعدة الذاتية. الأخضر ديكستران والأحمر BM، سماوي الكولاجين (C) ط. الخلايا VEGFTrap في vitrس إظهار إشارة GFP المنتجة مع VEGFtrap. الثاني. في الجسم الحي التصوير يوضح الخلايا VEGFtrap بشكل واضح وبالإضافة إلى ذلك يسلط الضوء على سهولة التحول قنوات للتدليل على نظام كنت تبحث في. VEGFTRap الأخضر + ورم، BM الأحمر والأزرق (الزائفة الملونة بعيدا الحمراء) الأوعية الدموية. (D) يوضح جمع فلوريسئين في سدى الورم وليس في الخلايا مباشرة، كما هو موضح من قبل عدم وجود تراكب إشارة خضراء مع ورم أحمر. الأخضر فلوريسئين، ورم الأحمر. انقر هنا لعرض أكبر شخصية .
Discussion
القنوات الثلاث المذكورة في جميع الصور هي حتى الآن قابلة للتبديل لمدة ثلاث علامات من الفائدة في نماذج أخرى، وأوراق الباحثين مع مجموعة لا تقدر بثمن من الأدوات لتبدو عديدة وأنواع الخلايا والتفاعلات. مطلوب التخطيط لضمان أن جميع علامات وأنواع الخلايا قد نجح في مزاوجة جزيء مضان مراسل في قناة متميزة.
بالإضافة إلى القنوات الثلاث القياسية المستخدمة هنا كنا أيضا قادرة دمج قناة CFP الرابع (الشكل 4A) والكولاجين مقرها SHG قناة 7 (الشكل 4B). ويمتد هذا إمكانية النظر في التفاعلات الخلوية في الجسم الحي، وبالإضافة إلى ذلك يسمح لل مستخدم للقيام سكان خلط لدراسة التفاعلات خلية خلية محددة مع الاحتفاظ قناتين للعلامات أخرى. على سبيل المثال، ولقد بحثنا في خلايا الورم (RFP) والخلايا الجذعية السرطانية (CFP) في نسبة 1:3 لديه مصلحة في مقارنة intratum بهمالتفاعلات عن طريق الفم (الشكل 4A). لاحظنا أن 7 أيام آخر غرس السكان المختلطة وأيدت هذه النسبة، ويمكن أن ينظر إليه على حد سواء لا يزال السكان الخلية.
يوفر قناة CFP المسائل التقنية ويرجع ذلك إلى التداخل مع قناة GFP في كل من الإثارة وانبعاث الأطياف وعلى هذا النحو يتطلب معالجة التصوير آخر لتحديد CFP صحيح + الخلايا من تلك التي هي في الواقع GFP +. يمكن أن يتم تجهيز التصوير آخر خارج على المجاهر 2 الفوتون بنيت في زايس LSM البرمجيات مباشرة بموجبها يتم طرح صورة من الصورة GFP CFP الناتجة في الخلايا CFP الحقيقية للتخلف عن الركب (الشكل 4A). فرضية لنسبة الطرح يعتمد على صور مشرقة على قدم المساواة وهذا يرجع إلى CFP الليزر (458 نانومتر) الاستشعاع كلا CFP والخلايا GFP بينما GFP الليزر (488 نانومتر) مرتفع جدا ليتألق الخلايا CFP. بالإضافة إلى الحراجية المعتمدة كنا أيضا قادرا على استخدام الاجهزة التي تم نشرها مسبقا أن ننظر إلى SHGالمستويات، وحتى تصوير ألياف الكولاجين التي تشكل الغشاء القاعدي المحيطة الأوعية الدموية، (الشكل 4B).
وقد اتخذت التكيف آخر من هذا النموذج الاستفادة من العرف بنيت irradiator الحيوانات الصغيرة التي لديها القدرة على استخدام الإشعاع المجسم الموجهة لأشرق أقسام الأنسجة صغيرة مثل 2 ملم في القطر. من خلال استهداف نافذة مع التشعيع فمن الممكن أن ننظر إلى الإشعاع قد أثر على النسيج الأساسي. لقد نشرت مؤخرا دراسة تبحث في تأثير الإشعاع لديها على أنسجة المخ العادي فيما يتعلق تجنيد BMDCs إلى الأوعية الدموية، وتبحث على وجه التحديد دورها في التغيرات النسيجية الإشعاع آخر. وجدنا أن توظيف BMDCs كان كل من الوقت والجرعة التي تعتمد في الأنسجة الطبيعية 11.
فمن الممكن لدراسة آليات التسليم والتكامل من التداوي توفير المخدرات غير الموسومة مع علامة فلوري. خلالبحثنا تمكنا لتتبع إنتاج VEGFTrap، عقار مضاد للعائية الذي يمنع جميع الإشارات VEGF في المنطقة المحلية الإنتاج 25. عن طريق تعديل وراثيا الخلايا السرطانية لدينا للتعبير عن الجينات VEGFtrap مقرونا IRES إلى EGFP (الشكل 4Ci) واستخدام BM RFP 'المانحة' كنا قادرين على صورة EGFP: إنتاج VEGFtrap، والتفاعل BMDC والأوعية الدموية في وقت واحد (الشكل 4Cii). وهذا يبرهن على براعة النموذج والقنوات المتاحة. بل هو أيضا ممكنا أن ننظر إلى حركية الدواء بسبب وعد من قرار وحيد الخلية. يستخدم فلوريسئين (GFP +) لتحديد الأورام أثناء عملية جراحية لاستئصال ضمان تحقيق أقصى 26. عن طريق حقن الوريد في حين التصوير من الممكن أن تثبت أن ترسيم لا يحدث من خلال امتصاص نشطة من فلوريسئين في الخلايا السرطانية نفسها، ولكن بدلا من ذلك من خلال مجموعة من المخدرات في منطقة اللحمية مع خميسIME، التي اطلعت عليها عدم المشاركة في توطين 10 دقيقة بعد الحقن من فلوريسئين (الشكل 4D).
وعموما يجمع استراتيجيتنا تقنيات الرواية والموجودة لتحقيق منصة تجريبية فريدة من نوعها، وهو أمر مفيد في دراسة التفاعلات الخلوية الحيوية. وقد أثبتت هذه الاستراتيجية لتكون نهجا لا تقدر بثمن لدراسة عالية الدقة التطور الدينامي وحيدة الخلية من BMDC، ورم الأوعية الدموية في الدماغ وطبيعية في الاستجابة للعلاج، intracranially. حيوي داخلي التصوير يمكن أن توفر فهما أفضل من المنظمين الجزيئي للتجنيد BMDC والهجرة والتمايز في داخل الجمجمة الدماغ الأوعية الدموية للورم وكذلك العديد من العمليات الحيوية الأخرى قابلة للتكيف مع مجالات البحوث الأخرى. العوامل المفترضة تثبيط التي تنظم BMDC في تركيبة مع الاستراتيجيات العلاجية الأخرى يمكن أن تساعد في التعرف على التوقيت الدقيق من العلاجات اندماجي. وعلاوة على ذلك، يمكن تكييفها لهذه الاستراتيجية العديد من العلاقات العامة في المستقبلojects الاستفادة ليس فقط في الجسم الحي الأصباغ تلوين حيوي داخلي، ولكن أيضا مثبطات الجزيئية الصغيرة والجسيمات النانوية التي يتم الموسومة fluorescently مما يسمح للباحثين لتتبع التوزيع وأنماط الهجرة من العلاجات أكثر استهدافا وكذلك تبدو بشكل طولي في حركية بهم.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
ونود أن نشكر مرفق المجهر الضوئي المتقدمة في مستشفى الأميرة مارجريت، ولا سيما جيمس Jonkman لما قدموه من مساعدة في الإعداد الأولي من القنوات على المجهر 2Photon. فإن الكتاب أود أن أنوه استهداف المكانية والزمانية والتضخيم من الإشعاع الاستجابة (STTARR) برنامج ووكالات التمويل التابعة لها. نشكر الدكتور بيتر تونغ، Dr.Iacovos مايكل وDr.Andras ناجى لتوريد البلازميدات VEGFTrap وللتصحيحات مخطوطة وردود الفعل. لقد كان الدعم المستمر والمناقشة من الموظفين في BTRC لا تقدر بثمن، ونود لإحياء ذكرى Dr.Abhijit جوها لله المدخلات العلمية. وقد تم تمويل العمل من قبل المعاهد الوطنية للصحة والمنح CIHR.
Materials
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| NODSCID mice | Jackson Lab | 001303 | 8 week old |
| B5/EGFP Mice | Jackson Lab | 003516 | |
| ACTB/DsRED mice | Jackson Lab | 005441 | |
| Tear Gel | Novartis | T296/2 | |
| 2% Lidocaine-Epinephrine | Bimeda MTC | 25SP | Use neat |
| Vetbond | 3M | 1469SB | |
| Self curing acrylic kit | Bosworth | 166260 | Use ~30% (w/v) |
| 10K MW Dextran-Alexa647 | Invitrogen | D22914 | Use @ 0.6 mg/kg in Saline |
| CD31-APC | BDPharmingen | 551262 | Use @ 0.3 mg/kg in Saline |
| AK-fluor (Fluorescein) 10% | AKORN inc. | NDC 17478-253-10 | Use @ 7.7 mg/kg in Saline |
| Betadine solution | Purdue Products | NDC 67618-150 | |
| Equipment | |||
| Fine Tweezers | VWR | 82027-402 | |
| Fine Dissection Scissors | VWR | 25870-002 | |
| 22G Needle | BD | 305156 | |
| 27G 0.5 ml TB syringe | BD | 305620 | |
| Handheld Micro-Drill | Fine Science Tools | 18000-17 | |
| 2.7 mm Trephine drillbit | Fine Science Tools | 18004-27 | |
| 10 μl 30G Hamilton syringe | Sigma Aldrich | 20909-U | |
| Glass Coverslip 3 mm | Warner Instruments | 64-0720 CS-3R | |
| Fluorescence goggles | BLS | FHS/T01 | Basic head frame |
| Stereotaxic frame | stoelting | 51950 | |
| Mouse restrainer for IV injection | Brain Tree Lifescience | MTI | |
References
- Kienast, Y. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16, 116-122 (2010).
- Holtmaat, A. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat. Protoc. 4, 1128-1144 (2009).
- Hansen-Algenstaedt, N., et al. Long-term observation reveals time-course-dependent characteristics of tumour vascularisation. Eur. J. Cancer. 41, 1073-1085 (2005).
- Kherlopian, A. R., et al. A review of imaging techniques for systems biology. BMC Systems Biology. 2, 74(2008).
- Kedrin, D. Intravital imaging of metastatic behavior through a mammary imaging window. Nature Methods. 5, 1019-1021 (2008).
- Perentes, J. Y., et al. In vivo imaging of extracellular matrix remodeling by tumor-associated fibroblasts. Nature Methods. 6, 143-145 (2009).
- Brown, E., et al. Dynamic imaging of collagen and its modulation in tumors in vivo using second-harmonic generation. Nature Medicine. 9, 796-800 (2003).
- Marker, D. F., Tremblay, M. -E., Lu, S. -M., Majewska, A. K., Gelbard, H. A. A Thin-skull Window Technique for Chronic Two-photon In vivo Imaging of Murine Microglia in Models of Neuroinflammation. J. Vis. Exp. (43), e2059(2010).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Yang, G., Pan, F., Parkhurst, C. N., Grutzendler, J., Gan, W. -B. Thinned-skull cranial window technique for long-term imaging of the cortex in live mice. Nature Protocols. 5, 201-208 (2010).
- Burrell, K., Hill, R. P., Zadeh, G. High-resolution in-vivo analysis of normal brain response to cranial irradiation. PLoS ONE. 7, e38366(2012).
- Tate, M. C., Aghi, M. K. Biology of angiogenesis and invasion in glioma. NURT. 6, 447-457 (2009).
- Aghi, M., Chiocca, E. A. Contribution of bone marrow-derived cells to blood vessels in ischemic tissues and tumors. Mol. Ther. 12, 994-1005 (2005).
- Nussenbaum, F., Herman, I. M. Tumor angiogenesis: insights and innovations. J. Oncol. 2010, 132641(2010).
- Zhang, H. -r Incorporation of endothelial progenitor cells into the neovasculature of malignant glioma xenograft. J. Neuroonco. 93, 165-174 (2009).
- Blouw, B., et al. The hypoxic response of tumors is dependent on their microenvironment. Cancer Cell. 4, 133-146 (2003).
- Du, R., et al. HIF1alpha induces the recruitment of bone marrow-derived vascular modulatory cells to regulate tumor angiogenesis and invasion. Cancer Cell. 13, 206-220 (2008).
- Rajantie, I. Adult bone marrow-derived cells recruited during angiogenesis comprise precursors for periendothelial vascular mural cells. Blood. 104, 2084-2086 (2004).
- Shin de Patil, V. R., et al. marrow-derived lin(-)c-kit(+)Sca-1+ stem cells do not contribute to vasculogenesis in Lewis lung carcinoma. Neoplasia. 7, 234-240 (2005).
- Purhonen, S. Bone marrow-derived circulating endothelial precursors do not contribute to vascular endothelium and are not needed for tumor growth. Proc. Natl. Acad. Sci. U.S.A. 105, 6620-6625 (2008).
- Aghi, M., Cohen, K. S., Klein, R. J., Scadden, D. T., Chiocca, E. A. Tumor stromal-derived factor-1 recruits vascular progenitors to mitotic neovasculature, where microenvironment influences their differentiated phenotypes. Cancer Research. 66, 9054-9064 (2006).
- Burrell, K., Zadeh, G. Molecular Mechanisms of Tumor Angiogenesis. , InTech. (2012).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Tolentino, M. J., et al. Angiography of fluoresceinated anti-vascular endothelial growth factor antibody and dextrans in experimental choroidal neovascularization. Arch. Ophthalmol. 118, 78-84 (2000).
- Holash, J. VEGF-Trap: a VEGF blocker with potent antitumor effects. Proceedings of the National Academy of Sciences of the United States of America. 99, 11393-11398 (2002).
- Shinoda, J., et al. Fluorescence-guided resection of glioblastoma multiforme by using high-dose fluorescein sodium. , 1-7 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved