Method Article
一种新型的高分辨率
摘要
我们描述了一种新在体内成像技术,夫妻颅内窗户和高分辨率的双光子显微镜的荧光嵌合体小鼠。此成像平台助剂在脑组织和微脉管系统中的动态变化,在单细胞水平后,病理损伤的研究,是适应评估颅内药物输送和分配。
摘要
我们已经成功地整合先前建立1-4颅内窗口(ICW)技术与活体双光子共聚焦显微镜,以开发一种新型的平台,允许长期直接可视化组织结构的变化颅内。在单细胞成像分辨率在一个实时的方式提供补充超出标准的终点组织学分析,这看起来仅仅在'快照'的横截面组织提供的动态信息。
荧光嵌合体小鼠中建立这个活体成像技术,我们能够形象四个荧光通道同时进行。通过将荧光标记的细胞,如GFP +骨髓,它可以跟踪研究长期的迁移,在组织内的积分和微分这些细胞的命运。进一步整合的二次mCherry胶质瘤肿瘤细胞系的报道细胞,如,允许字符terization细胞:细胞相互作用。通过加入内活体染料和抗体可以高亮显示组织的微环境中的结构变化,例如CD31标记的抗体和葡聚糖分子。
此外,我们描述了我们的的ICW成像模型相结合,与小动物的微辐射器,提供了立体定向照射,建立一个平台,通过动态组织发生变化,电离辐射的管理,可以评估。
电流的限制,我们的模型中包括的显微镜,它被限制为从副皮质表面深度达900微米,限制成像大脑背侧轴的外显率。颅骨的存在使得ICW一个更具挑战性的技术过程相比,更具规模及动用室模型,目前用于研究乳腺组织和脂肪垫5-7。此外,ICW省新娘许多挑战时,优化成像。
引言
更好地理解的结构和生物学上的变化,在大脑中产生在响应各种病症,治疗干预是改善治疗策略的关键。然而,在研究这些结构和生物学上的变化,特别是关于颅内病理学当前的挑战之一,是无法获得的组织,无法研究体内设置的变化随时间的演化和动态进展。检查软组织肿瘤的发展变化,通过5-7代的“窗口”技术先前已证明是成功的。 ICW模型的发展证明是技术上具有挑战性,由于取出颅骨而不损坏煽动感染相关的脑组织的必要性。以前的论文试图瘦的头骨,以可视化的组织8-10然而,产生高分辨率的清晰IM年龄完全去除颅骨需要11。重复长期成像(30天)最近才成为一个可行的选择,通过成像1,11,以前短的时间框架已经研究5。
在过去的十年中,已经澄清的起源新血管的病理刺激,特别是在肿瘤的形成和发展,提供新的治疗目标的治疗肿瘤的一个主要目标。很大争议仍然围绕新血管在肿瘤的发生发展过程中大脑或以下的辐射来源。传统的血管生成被认为是发生血管生成,从预先存在的血管12发芽的一个过程,其中新血管形成。然而,更近期的研究,表明先前假设的胚胎的血管发生过程中可能会发挥更相当大的作用,在病理性血管形成。 VAsculogenesis涉及招聘的骨髓,然后又直接参与形成新的血管内皮12-14的成人angioblast同行的。越来越多的证据表明,血管内皮前体细胞从骨髓动员到启动新生血管的形成在致癌基因介质15-17。然而,这些研究提供这些骨髓细胞的直接贡献(BMDCs的贡献百分比不同类型的病理刺激和反应的治疗18-21)血管内皮矛盾的证据。
因此,建立可重复的实验高分辨率活体成像的方法,允许长期反复研究的过程中,北京现代舞团融合到肿瘤血管和对治疗的反应是无价的。标准组织学技术无法提供动态信息的MATION需要确定长期存活,分化和整合的细胞产生新生血管,因此不能明确证明细胞相互作用的机制。
我们已经表明,使用我们的实验方法,有不同程度的BMDC招聘两个电离辐射和颅内肿瘤生长,然而,一个招聘,病理学站点特定的,而不是一个入侵的整个颅内组织11,22。我们已经表明,招聘如下时间敏感的图案表明由一个单一的动物11,22重复成像。同样, 在体内成像也可以提供宝贵的见解可以使荧光标记的肿瘤细胞成像和跟踪内重要的血管内皮细胞的CD31抗体突出肿瘤细胞转分化的可能性直接形成自己的内皮进入肿瘤细胞模仿。
模型的通用性增强了图像的4个荧光通道的能力,提供一个详尽的研究不同的细胞和生物过程的组合数。我们能够图像CFP intravitally(蓝色),GFP(绿色),樱桃/ RFP(红色),和Alexa647/APC(远红光),同时在一个单一的领域,随着时间的推移反复。研究人员可以基因修饰细胞表达的频道,以及购买染料和抗体的荧光染料,以反白显示的结构变化,特别感兴趣的。到目前为止,研究中常用的染料和抗体包括CD31和葡聚糖的微脉管系统及其变化的在1,11,23,24组织,虽然利用用于此目的的远红光的信道可用于在其他两个亮点提到的渠道。其它染料包括SYTOX橙色,将突出区域的细胞凋亡的标记,如从公司VISEN的,同样,已被特定cifically设计用于在体内 。进一步的二次谐波产生(SHG)信道的四个常用的荧光所述途径,可以添加和优化,可视化图像模型7的内源性胶原纤维周围血管的基底膜。为了展示我们的模型中的适应性,以及上面提到的细胞 - 细胞相互作用,我们一直在研究药物 - 细胞相互作用。我们看着抑制剂药物,如AMD3100,SDF-1的抑制剂,其作用是在信令网参与在BMDC招聘11。同样,我们遗传工程出脑胶质瘤U87移植瘤细胞表达VEGFTrap,VEGF抑制剂25,通过IRES的GFP分子结合。通过使用RFP + BM,我们能够研究VEGF对招聘的BMDCs血管的作用。最近,我们利用模型来研究药物动力学看着MEC大汉族主义背后的肿瘤划定的药物荧光26日 ,在细胞水平上。通过使用一个定制建房子,我们已经能够,整合立体交付辐射评估治疗的反应,肿瘤和BMDCs的小动物辐照。
通过使用我们的新型活体成像方法研究人员将深入了解单细胞的实时变化中出现的各种病症和系统,帮助澄清了许多功能和生物学特性的组织变化。
研究方案
所有动物的工作已经进行下动物保健使用COMMITEE批准的协议,并遵守所有相关的指南,法规和监管机构执行。
故障排除参考表2。
1。骨髓重建(可选)图1(30分钟准备,5分钟每鼠)
所有手术应该采用严格的无菌技术与蒸压无菌设备。
一个捐助鼠标将重组三大主机小鼠。
- 的麻醉收件人NODscid的老鼠和位置,与铅屏蔽头,Gammacell 40'赃官照射器的中心内。
- 照射NODscid的小鼠2.5 Gy的全身照射(TBI)。
关键的一步:由于脑外伤的优化可能需要剂量变化,需要有足够的宿主免疫CELL耗尽不同小鼠品系。
暂停点:主机老鼠可以提前照射,但照射后24小时内应使用。
- 安乐死的供体小鼠的体制动物保健委员会的指导方针。清洁后肢,并取出胫骨和股骨,都剥离所有多余的组织从的骨头(图1AI 1aii)。
关键步骤:腓骨的骨头是不可行的使用由于非常管腔狭窄。
- 取出从四个提取的骨骼两端的端板,并使用22 G针和1ml无菌PBS冲洗出来,直到他们是白色的外观(图1aiii)。参考表2。
- 混合提取的骨髓(BM)暂停以及三个27 G结核菌素针头吸取300微升。提取BM应包含大约2×10 7细胞,并3主机小鼠重组是足够的。参考表2。
- 成横向三个以前照射NODscid的的老鼠从步骤1.1(图1b)的尾静脉中注射悬浮液。参考表2。
注意:要检查不育的BM注入我们推荐电镀剩余的BM和培养24小时,检查是否感染。在这一点上死亡的首要原因是在新改组的小鼠感染。
2。颅内窗口发生 - 图2(30分钟每鼠)
所有手术应采用严格的无菌技术蒸压消毒设备和热灯保持温暖动物(图2A)。
- 的麻醉收件人NODscid的小鼠IACUC批准的麻醉剂,:圣阿韦坦IP注射在0.5毫克/克,和位置,与铅屏蔽的头部,在中心内的Gammacell 40'赃官'辐照。去除头发从头皮。此外,申请撕裂的凝胶,以防止角膜脱水。
- 清洁的头皮先用聚维酮碘溶液中,然后用酒精,然后做一个切口从耳朵的中点正上方的眼睛。取出头皮3毫米一左一右的第一个切口,露出头骨和地标颅骨表面(图2BI)的。
- 骨膜提升2%利多卡因注射肾上腺素溶液远从颅骨表面(图2Bii)的解剖。
- 使用2.7毫米的环钻,削弱大脑右半球皮层lambda和前囟门之间2.7毫米的圆的头骨。, 不穿透骨钻(图2Biii)。参考表2。
关键步骤:如果通过头骨钻脑表面会损坏额外TRA的影响结果乌玛。此外,会发生出血过多,防止产生一个清晰的窗口。
- 取下骨瓣减弱使用解剖镊和牙科钩和故意的,但控制力量(图2Biii)。
- (可选)如果想要在肿瘤病理学,选择肿瘤细胞系(荧光报道基因)注入到在步骤2.5中生成的窗口的中心。
- 细胞悬液和负载针装入10微升30 G汉密尔顿注射器成一个立体的框架。
关键步骤:单元号码需要进行优化,以肿瘤细胞生长所需的使用和时间轴。 U87的文化,我们使用2×10 5个细胞,每只小鼠在10微升。 - 将鼠标拖到数字立体定向帧生成的窗口的中心点对齐针。
- 下针,直到它刚好接触到皮质表面和重置数字坐标。
- 低呃针至3.2毫米到3毫米深皮层组织,并注入。
- 慢慢缩回针然后取出鼠标从框架。
关键步骤 :注射液在1分钟的时间和位置注射后留针,以确保减少回流。
关键步骤:如果遇到轻微的出血灌溉用无菌生理盐水为1-5分钟,停止肤浅出血。继续进行后续的步骤。
- 细胞悬液和负载针装入10微升30 G汉密尔顿注射器成一个立体的框架。
- 用无菌PBS下降,以保持脑组织灌溉用水脑表面。
- 浮法3毫米盖玻片上脑表面大约2.7毫米的窗口产生完全密封。参考表2。
- 干周围的颅骨到整个暴露的头骨重新密封头皮组织颅骨和盖玻片到位然后应用vetbond的“, 但请不要对多余的,因为它会漏到玻璃板下面,降低成像潜力。
- 宓所述新鲜牙科丙烯酸粉末和解决方案,约30%(W / V),并申请过顶vetbond。为了确保形成紧密密封到玻璃上,盖玻片边缘(图2Biv)稍微重叠的丙烯酸类参考表2。
注意:牙科 丙烯酸是极其危险的,所以我们建议使用手套和口罩整个程序。
关键步骤:牙科丙烯酸需要在成型过程中的韧性,以确保良好的密封,减少多余。建立压克力窗口将图像模糊。
- 让老鼠在一个温暖的笼子中恢复。
3。立体定向放射(可选) - 图3(25分钟每鼠)
的变化会存在使用这样的优化将被要求在不同的辐照。我们使用一个自定义设计的辐照。
- 麻醉小鼠使用异氟醚诱导4%,其次是整个过程中的1.5-2%0.5-1升O 2分钟,到立体定向辐射器内的自定义头阻挡(图3AI)。
- 取得一个360°的锥束CT扫描的X射线管通过2毫米的铝过滤器运行在40 kVp和0.05毫安的。使用图像引导运动的阶段,指挥的辐射等中心点的右半球,确保它是在背腹方向中央。
- 将半球准直器,8毫米×11毫米的块。
关键步骤:准直器可设计为许多不同的设置,因此可以提高包括和排除的大脑的不同部位。 8毫米×11毫米定义的半球的大脑区域。
- 获得单CT正交立体图像,从顶部(AP)和底部(PA)通过准直,以进一步提高的大脑,解剖学和组织的位置可用于omical骨结构的可重复性。
- 交易所为0.93 mm的铜处理的铝过滤器过滤并管理与X射线管225 kVp和13毫安的在运行在AP的方向从顶部的所需辐射剂量的一半。
- 回到台架底部位置,再次与X射线管在225 kVp和13毫安的形式在PA的方向的底部运行和管理的第二个一半的辐射剂量。
关键步骤是必不可少的照射,同时在顶部和底部,以减少通过脑组织的RT梯度,它也有助于大脑的中心与对应的等中心点。
(4) 在体内双光子激光显微镜-图3(每节1-3小时)
的变化会存在使用这样的优化将被要求在不同的显微镜。我们采用的是卡尔蔡司LSM510 META激光扫描ConfocAL显微镜。
- 麻醉IACUC批准的麻醉小鼠,圣阿韦坦IP注射0.5毫克/克和干净的窗口,使用酒精喷雾器。
- (可选)注入染料标记血管5-10分钟,成像之前,前尾静脉成像。 Alexa647-葡聚糖0.35微克/克或使用APC-CD31在0.2微克/克。 见表2。
- (可选)注入荧光素经尾静脉,剂量为7.7毫克/公斤,5分钟在成像之前,描绘肿瘤。参考表2。
- 设置频道上的共聚焦显微镜产生的嵌合体小鼠中使用的荧光色素所确定的表1表明本模型中描述的信道。
- 反转鼠标到可移动显微镜阶段和稳定头部位置可塑橡皮泥。(图3Aii)参考表2。
- 打开第一通道激光和使用ICW的中心定位。
- 使用5倍的透镜,并采取进一步更高分辨率的图像作为地图使用整个窗口的图像。
- 应进行成像使用10X和20X'远距离镜头,以获得最佳的图像质量。
关键步骤:通道和目标在2PLM上的应设置使用前工程细胞在体外成像的小鼠模型,以确保他们强调正确的荧光。
| 荧光 | CFP | GFP /荧光素/ FITC | mCherry / RFP /红色荧光蛋白 | APC /铝exa647 | SHG自体荧光 |
| 激励激光器 | 458纳米 | 488纳米 | 543纳米 | 633 nm的 | 变色龙激光820纳米 |
| 收集过滤器 | 480-520纳米 | 500-550纳米 | 565-615纳米 | 650-710纳米 | 390-465纳米 |
表1中。荧光设置指南用户看到的用于模型中的每一个可用的信道的激光激发和发射光谱的集电极。
结果
重组的NODscid小鼠的BM可选的步骤应导致吸收荧光'供体骨髓的80%,在100%的“主机”NODscid的老鼠,但是优化TBI将被要求在其他非增强的重组 - immunocompromsed株。如果小鼠重组失败,他们会得病,并迅速死亡后的程序,削弱老鼠可能需要额外的食物和水源。
一旦完成ICW应该看像图2Biv看到。它是理想的脊周围的玻璃盖玻片,因为这给了实力与头骨连接的丙烯酸。完美的窗户是重复性的,并允许重复成像长达8周后,他们这一代人(图2C)。,通过这些最佳窗口图像看起来像那些图3BI看到。在窗口中生成的不完善之处会产生较差的图像例如质量,根据窗口的气泡将防止整个领域被成象的视图,区域将显得较暗的空气一样,可以防止激光成像(图3Bii)的盖玻片上的多余的胶水和丙烯,将有一个高的水平的背景荧光和领域被抹杀看到在图3Biii,同样,如果有污垢窗口上的小圆点背景荧光的领域将是可见的在现场(图3Biv)。
ICW成像的成功是预定的手术技术的完整性,但是,即使是最佳的ICWS可能会遇到的问题的成像会话期间。存在清晰的范围和程度,因此,在生成的图像如图3所示。 图3C出版质量形象发生时,一切是最佳的。虽然这是没有可能的所有小鼠,这是可行的,期望80%的图像方法生成的,看起来像这样。在当前的显微镜设置的主要缺陷之一是使用倒激光器。小鼠被放置在自己的背上,这会导致过度紧张和不适,可能会导致呼吸困难在成像。这将产生一个“内衬”的形象,作为呼吸干扰发生的平均,从而在成像过程中,每个象素行成像四次,在最终图像中显示的四个平均。在任何运动中,如平均,造成呼吸困难,出现线图3D图像,将创建一个神器。不够麻醉的小鼠,在成像过程中可能会遇到这样的问题。 “成荫”的效果,可以减少限制上的图像平均,但是这将反过来降低图像质量,可能无法消除的问题。或者老鼠当呼吸已经归时,可以重新定位或重试。使用老鼠可以成像'俯卧'f一个堂堂正正的2PLM的会否定这个问题。另外一个问题在一个倒置2PLM成像包括对ICW定位鼠标一次是在显微镜上,这会导致'分割'的图像,如在图3E中所看到的有限的可访问性。在这里,激光和盖玻片位置不相互垂直,并在一个角度,就会发生这样的摄像。这将导致产生一个“分段”的侧面的视场成像的图像。这个问题是很容易解决的鼠标重新定位,以确保盖玻片是完全水平的一次头部作为安装图3Aii看到。
这里提出的模型是专门用来检查在肿瘤组织中血管的作用的BMDCs和演示的能力,同时使用三个不同的渠道(樱桃,GFP,远红 - Alexa647和APC)马金g为的CFP和SHG冗余这个特别的故事。我们能够形象小鼠纵向长达8周,招聘和融入骨髓细胞进入血管在单细胞水平研究,没有窗口所造成的不利影响。该模型表明了便于收集动态信息的来源和形成血管的相互作用不同类型的细胞失去的兴趣,以前通过终点的组织学分析。
| 步骤 | 问题 | 推理 | 解 |
| 1.4 | 骨粉碎 | 钝的工具 | 形成了一个新鲜的鼠标使用锋利的剪刀或新鲜的手术刀刀片,收集骨髓,骨碎片将抑制电视注入 |
| 1.5 | 低萃取(低viscositY) | 远端骨终板切得太收集方法不佳 | 应切断骨头近侧骨头里面收集管收集,以防止回溅 应该花时间,最大限度地提取BM小心 如果必要的池超过一个鼠标为1毫升 |
| 高提取(高粘度) | 低收集缓冲区 | 额外的0.1%BSA稀释方案,分裂三个受体小鼠每只小鼠最大高达500μL | |
| 1.6 | 不好静脉注射 | 可怜的血管扩张和血管能见度 | 加强扩张热灯。将小鼠尾静脉限制器内置光源,以帮助访问 |
| 1 | 老鼠生病 | 感染 | 根据机构规则牺牲老鼠。确保尾巴注射前清洗和检查不育提取BM文化 |
| 小鼠死 | 差BM摄取 | 检查荧光灯BM摄取死耗子%。 优化TBI正在使用的小鼠株 增加BM注射量(例如使用一个捐助鼠标两个收件人) | |
| 2.4 | 轻微出血 | 在钻井过程中违反杜拉 | 凝胶垫的压力和连续的无菌生理盐水冲洗 |
| 主要出血 | 钻脑损伤 | 根据机构指引牺牲鼠标 | |
| 2.8 | 盖玻片下的气泡 | 皮质表面防止接触不良妥善安置 | 删除盖玻片和添加额外的PBS到窗口去除气泡浮动盖玻片 |
| 2.10 | 在涂胶过程中打滑盖玻片 | 弧线噻质量为重,放置盖玻片上的压力,移动盖玻片的出路 | 应使用镊子举行盖玻片,而vetbond和丙烯酸应用 |
| 4.2 | 不好静脉注射 | 可怜的血管扩张和血管能见度 | 加强扩张热灯。将小鼠尾静脉限制器内置光源,以帮助访问 |
| 4.4 图3C | “内衬图像的 | 吃力或呼吸不规则 | 拔下鼠标框架,并允许恢复 增加麻醉药的水平,并调整位置,以确保颈部过度弯曲或延长,以防止呼吸 |
| 图3C | '分段'的形象 | 大脑是不平行目标 | 调整位置,以确保它是平的盖玻片 |
| 船舶可视化 | 注射没有看到血管 | 重做替代尾静脉注入,温暖的尾巴,以确保良好的血管扩张 | |
| 高背景 | 肮脏的盖玻片, 气泡,压克力 | 盖玻片潮湿70%乙醇布擦拭,千万不要浸泡下可以穿透丙烯酸,损害脑组织 |
表2中。故障排除所需的纠正措施程序的问题区域。指引。
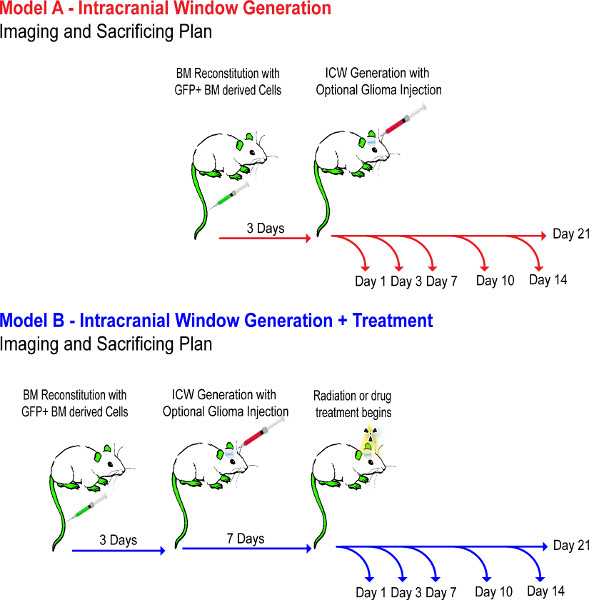
图式1。实验流程图,这表明通过实验步骤1-4事件的时间表。小鼠模型建立了一个多星期,确保BM重组正确的,而不是用药物治疗,直到第7天,以确保肿瘤移植肿瘤。 点击此处查看大图 。
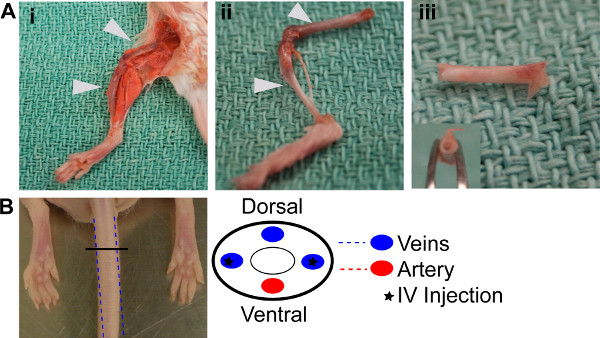
图1。的BM重建。(A)BM提取过程。解剖后肢骨骼解剖二后肢股骨和胫骨,清洗和准备提取。 三骨头与端板取出冲洗,展示了白色的外观空骨(B)图式展示被定位在尾部静脉注射用的侧面。
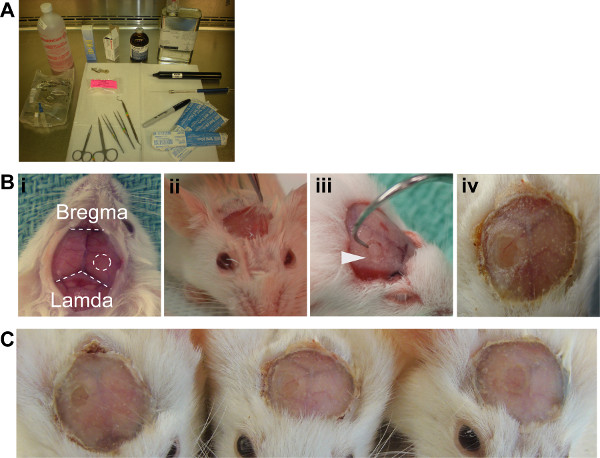
图2。 ICW代(A)无菌设置建议(B)。外露颅骨表面揭示了手术所需的地标,ICW应定位于大脑右半球,前囟门和LAMDA等距离。Periostieum解除与利多卡因溶液,准备拆除三。牙科钩所需的钻头产生的骨头碎片的去除。 四完成ICW牙科丙烯酸(C)的三个示例窗口证明了该方法的再现性。
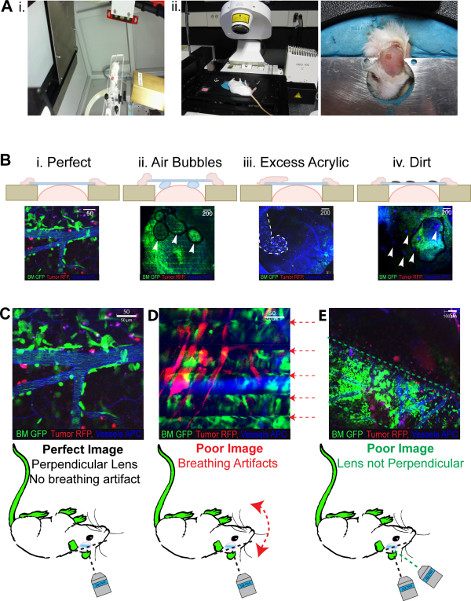
图3。 2PLM预期的结果。 所有图像显示红色的肿瘤,绿BM,蓝(伪彩色远红)脉管 (A)I演示头架,里面的小动物辐照保留异氟醚的流动。 8 x 11毫米准直仪也可看出,通过台架2。小鼠走动反转位于成像所需的帧头部,可模制plastercine确保所有窗口可以容纳(B)指示的问题的结果的照片从我的窗口生成。 (C)的最佳窗口, 二,被困车底,盖玻片,IV III丙烯酸溢出的气泡一个窗口。窗口本身的污垢。亮点出现的问题与成功之后,一个ICW 我的一代成像最佳成像II呼吸文物。创建“成荫”的形象三盖玻片不垂直的激光生成一个'分段'的形象。 点击这里查看大图 。
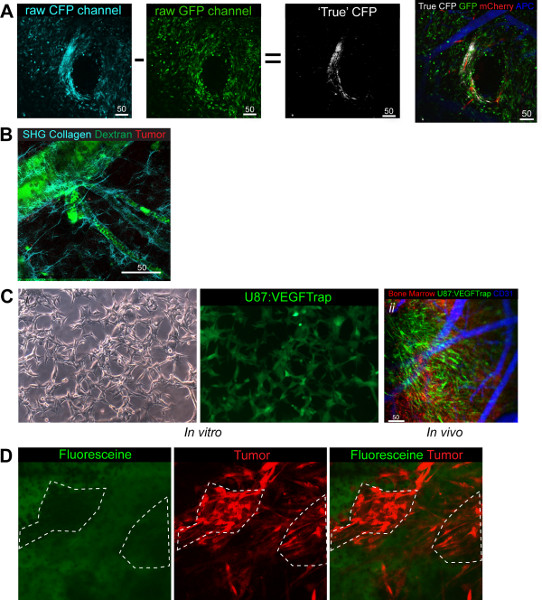
图4。功能用途和适应示范(A)CFP成像后处理,使GFP图像中减去从的CFP图像揭示真正的CFP图像可以叠加其他三个通道中的白色, 绿色BM,蓝,白,红肿瘤干细胞(伪彩色远红)血管 (B)示范可以与SHG成像的胶原蛋白纤维。 绿色葡聚糖,红骨髓,青色胶原(C)。VITR VEGFTrap细胞Ø证明了GFP信号与二 VEGFtrap生产。 在体内成像演示的VEGFtrap细胞清楚,除了凸显了切换频道以证明你正在寻找系统的易用性。 绿色VEGFTRap +肿瘤,蓝,红BM(伪彩色远红)(D)演示血管。肿瘤基质细胞直接收集荧光,显示绿色信号覆盖用红色肿瘤缺乏。绿色荧光,红色的肿瘤。 点击这里查看大图 。
讨论
到目前为止,所有的图像中描述的三个渠道是可以互换的三个标记的利益在其他车型和叶子的研究人员提供了一个宝贵的工具看许多细胞类型和相互作用。规划要求,以确保所有的标记和细胞类型已经成功地集成了记者的荧光分子在不同的通道。
除了 这里使用的标准的三个通道,我们也能够整合的第四CFP通道(图4A)和胶原蛋白的SHG通道7( 图4B)。延伸看细胞相互作用在体内和另外的可能性允许用户承接人口混合研究特定的细胞与细胞间的相互作用,同时保留其他标记的两个通道。例如,我们已经看了书(RFP)在肿瘤细胞和癌症干细胞(CFP)在1:3的比例比较他们的兴趣intratum口服相互作用(图4A)。我们观察到,坚持7天植入后的混合人口的比例,仍然可以被看作两个细胞群。
CFP通道提供与GFP激发和发射光谱通道,因此重叠的技术问题,由于需要确定真正的CFP那些实际上GFP + +细胞成像后处理。成像后处理,可以进行内置在蔡司LSM软件从而直接对双光子显微镜,在GFP图像中减去从CFP图像的被留下( 图4A)在真正的CFP细胞产生。比减法的前提是依赖于同样明亮的图像的CFP激光(458 nm)的荧光,而GFP激光(488纳米),CFP和GFP的细胞是由于过高荧光CFP细胞。除了CFP,我们也已经能够使用先前公布的设置看SHG水平等描绘的胶原纤维,使周围血管基底膜(图4B)。
另一个适应这种模式已利用一个定制的使用立体定向制导的辐射照射直径为2毫米的小组织部分有能力的小动物辐照。通过照射目标窗口,它是可以看一下对下面的组织的影响辐射。我们最近发表的一项研究,在影响辐射对正常脑组织就招聘的BMDCs血管,专门寻找他们的作用,辐射后的组织变化。我们发现,招聘的BMDCs时间和剂量依赖性的正常组织11。
送货和整合提供药物治疗学研究的机制是可行的被标记有荧光标记物。中我们的研究中,我们已经能够跟踪生产VEGFTrap的,抗血管生成的药物阻断VEGF信号在当地生产25。我们通过基因修饰肿瘤细胞表达IRES EGFP与(4CI图)加上VEGFtrap基因和使用RFP'捐赠'BM是能够形象的EGFP:生产VEGFtrap,的BMDC互动和血管同时(图4Cii)。这表明了模型的通用性和可用信道。这也是可行的药物动力学由于单细胞分辨率的承诺来看看。荧光素(GFP +)是用来划定肿瘤在手术过程中,以确保最大的切除来实现26。通过静脉内注射,而成像,它是可能的,以证明发生的分界不通过活性的荧光素的摄取到肿瘤细胞本身,但的药物,而不是通过收集到的基质区,吨输入法,看到的缺乏共定位10分钟后注射荧光素(图4D)。
总的来说,我们的策略结合新颖的和现有的技术实现了独特的实验平台,这是有利的,在动态细胞相互作用的研究。这一战略已被证明是一个非常宝贵的方法研究高分辨率的单细胞在治疗反应,动态演化的北京现代舞团,肿瘤与正常脑血管颅内。活体成像可以提供更好地理解颅内脑肿瘤血管BMDC招聘,迁移和分化,以及许多其他的动态过程等研究领域适应的分子调节。抑制推定因素调节BMDC组合与其他的治疗策略可以帮助组合疗法的精确定时的识别。此外,这种策略可以适应未来许多公关ojects不仅利用体内活体染色的染料,但也小分子抑制剂和荧光标记的纳米粒子,使研究人员能够追踪的分布和迁移模式更有针对性的疗法,以及纵向看在他们的动力学。
披露声明
作者什么都没有透露。
致谢
我们想感谢先进的光学显微镜基金在玛嘉烈医院,尤其是詹姆斯Jonkman得知他们协助渠道上2Photon显微镜的初始设置。笔者想承认辐射响应(STTARR)程序及其附属资助机构的时空定位和扩增。我们感谢彼得痛恶,迈克尔Dr.Iacovos和Dr.Andras的纳吉博士为提供的VEGFTrap质粒和他们的手稿更正和反馈。 BTRC的工作人员继续支持和讨论是非常宝贵的,我们想他的科学输入纪念Dr.Abhijit古哈。工作是由CIHR和美国国立卫生研究院拨款。
材料
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| NODSCID mice | Jackson Lab | 001303 | 8 week old |
| B5/EGFP Mice | Jackson Lab | 003516 | |
| ACTB/DsRED mice | Jackson Lab | 005441 | |
| Tear Gel | Novartis | T296/2 | |
| 2% Lidocaine-Epinephrine | Bimeda MTC | 25SP | Use neat |
| Vetbond | 3M | 1469SB | |
| Self curing acrylic kit | Bosworth | 166260 | Use ~30% (w/v) |
| 10K MW Dextran-Alexa647 | Invitrogen | D22914 | Use @ 0.6 mg/kg in Saline |
| CD31-APC | BDPharmingen | 551262 | Use @ 0.3 mg/kg in Saline |
| AK-fluor (Fluorescein) 10% | AKORN inc. | NDC 17478-253-10 | Use @ 7.7 mg/kg in Saline |
| Betadine solution | Purdue Products | NDC 67618-150 | |
| Equipment | |||
| Fine Tweezers | VWR | 82027-402 | |
| Fine Dissection Scissors | VWR | 25870-002 | |
| 22G Needle | BD | 305156 | |
| 27G 0.5 ml TB syringe | BD | 305620 | |
| Handheld Micro-Drill | Fine Science Tools | 18000-17 | |
| 2.7 mm Trephine drillbit | Fine Science Tools | 18004-27 | |
| 10 μl 30G Hamilton syringe | Sigma Aldrich | 20909-U | |
| Glass Coverslip 3 mm | Warner Instruments | 64-0720 CS-3R | |
| Fluorescence goggles | BLS | FHS/T01 | Basic head frame |
| Stereotaxic frame | stoelting | 51950 | |
| Mouse restrainer for IV injection | Brain Tree Lifescience | MTI | |
参考文献
- Kienast, Y. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16, 116-122 (2010).
- Holtmaat, A. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat. Protoc. 4, 1128-1144 (2009).
- Hansen-Algenstaedt, N., et al. Long-term observation reveals time-course-dependent characteristics of tumour vascularisation. Eur. J. Cancer. 41, 1073-1085 (2005).
- Kherlopian, A. R., et al. A review of imaging techniques for systems biology. BMC Systems Biology. 2, 74(2008).
- Kedrin, D. Intravital imaging of metastatic behavior through a mammary imaging window. Nature Methods. 5, 1019-1021 (2008).
- Perentes, J. Y., et al. In vivo imaging of extracellular matrix remodeling by tumor-associated fibroblasts. Nature Methods. 6, 143-145 (2009).
- Brown, E., et al. Dynamic imaging of collagen and its modulation in tumors in vivo using second-harmonic generation. Nature Medicine. 9, 796-800 (2003).
- Marker, D. F., Tremblay, M. -E., Lu, S. -M., Majewska, A. K., Gelbard, H. A. A Thin-skull Window Technique for Chronic Two-photon In vivo Imaging of Murine Microglia in Models of Neuroinflammation. J. Vis. Exp. (43), e2059(2010).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Yang, G., Pan, F., Parkhurst, C. N., Grutzendler, J., Gan, W. -B. Thinned-skull cranial window technique for long-term imaging of the cortex in live mice. Nature Protocols. 5, 201-208 (2010).
- Burrell, K., Hill, R. P., Zadeh, G. High-resolution in-vivo analysis of normal brain response to cranial irradiation. PLoS ONE. 7, e38366(2012).
- Tate, M. C., Aghi, M. K. Biology of angiogenesis and invasion in glioma. NURT. 6, 447-457 (2009).
- Aghi, M., Chiocca, E. A. Contribution of bone marrow-derived cells to blood vessels in ischemic tissues and tumors. Mol. Ther. 12, 994-1005 (2005).
- Nussenbaum, F., Herman, I. M. Tumor angiogenesis: insights and innovations. J. Oncol. 2010, 132641(2010).
- Zhang, H. -r Incorporation of endothelial progenitor cells into the neovasculature of malignant glioma xenograft. J. Neuroonco. 93, 165-174 (2009).
- Blouw, B., et al. The hypoxic response of tumors is dependent on their microenvironment. Cancer Cell. 4, 133-146 (2003).
- Du, R., et al. HIF1alpha induces the recruitment of bone marrow-derived vascular modulatory cells to regulate tumor angiogenesis and invasion. Cancer Cell. 13, 206-220 (2008).
- Rajantie, I. Adult bone marrow-derived cells recruited during angiogenesis comprise precursors for periendothelial vascular mural cells. Blood. 104, 2084-2086 (2004).
- Shin de Patil, V. R., et al. marrow-derived lin(-)c-kit(+)Sca-1+ stem cells do not contribute to vasculogenesis in Lewis lung carcinoma. Neoplasia. 7, 234-240 (2005).
- Purhonen, S. Bone marrow-derived circulating endothelial precursors do not contribute to vascular endothelium and are not needed for tumor growth. Proc. Natl. Acad. Sci. U.S.A. 105, 6620-6625 (2008).
- Aghi, M., Cohen, K. S., Klein, R. J., Scadden, D. T., Chiocca, E. A. Tumor stromal-derived factor-1 recruits vascular progenitors to mitotic neovasculature, where microenvironment influences their differentiated phenotypes. Cancer Research. 66, 9054-9064 (2006).
- Burrell, K., Zadeh, G. Molecular Mechanisms of Tumor Angiogenesis. , InTech. (2012).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Tolentino, M. J., et al. Angiography of fluoresceinated anti-vascular endothelial growth factor antibody and dextrans in experimental choroidal neovascularization. Arch. Ophthalmol. 118, 78-84 (2000).
- Holash, J. VEGF-Trap: a VEGF blocker with potent antitumor effects. Proceedings of the National Academy of Sciences of the United States of America. 99, 11393-11398 (2002).
- Shinoda, J., et al. Fluorescence-guided resection of glioblastoma multiforme by using high-dose fluorescein sodium. , 1-7 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。