Method Article
新規高分解能
要約
私たちは、小説を記述イメージング技術。このイメージングプラットフォームエイズは病的な侮辱に続く単一細胞レベルでの脳組織と微小血管系のダイナミックな変化の研究、および頭蓋内薬物送達およびディストリビューションを評価することが適応可能である。
要約
我々は成功した頭蓋内組織構造変化の直接の長期的可視化を可能にした新規のプラットフォームを開発するために生体2光子共焦点顕微鏡と以前に確立された頭蓋内窓(ICW)技術1-4を統合しました。リアルタイム方式で単一細胞の解像度でイメージングは、組織の 'スナップショット'断面でもっぱら見える標準エンドポイント組織学的分析、によって提供されるものを超えて補足動的な情報を提供します。
蛍光キメラマウスでは、この生体イメージング技術を確立し、我々は同時に画像4蛍光チャネルすることができます。例えば、GFP +骨髄などの蛍光標識された細胞を組み込むことにより、組織内での長期的な移行、統合および分化を研究するこれらの細胞の運命を追跡することができる。このようなmCherryグリオーマ腫瘍ラインなどの二次レポーター細胞のさらなる統合は、特性を可能にし細胞間相互作用:細胞のterization。組織微小環境の構造変化は、例えばCD31タグ付け抗体およびデキストラン分子を、イントラ不可欠染料および抗体の添加によって強調することができます。
さらに、電離放射線の投与後に発生する動的な組織変化を評価することができるようなプラットフォームを構築、定位照射を提供する小動物のマイクロ照射装置とのICWのイメージングモデルの組み合わせを記載している。
我々のモデルの現在の制限は、脳の背側軸にイメージングを制限し、サブ皮質表面から900ミクロンまでの深さに制限されている顕微鏡の浸透度が含まれています。頭蓋骨の存在は現在5-7乳腺組織と脂肪パッドを研究するために使用さより確立され、利用室のモデルに比べて、ICWより挑戦的な技術の手順になります。また、ICWプロブIDEの多くの課題イメージングを最適化する。
概要
種々の病態に応じて、脳内で発生する構造的および生物学的変化をよりよく理解し、治療的介入治療戦略を向上させるために重要である。しかし、特に頭蓋病理に関して、これらの構造および生物学的変化を研究における現在の課題の一つは、組織の到達不能と時間変化およびインビボ環境の中で変化の動的な進行を研究することができないことである。 "ウィンドウ"技術の世代は、以前5-7腫瘍の開発を通じて、軟組織の変化を調べることに成功した証明した。 ICWモデルの開発は、基礎となる脳組織に感染を扇動に損傷を与えることなく、頭蓋骨の骨を除去する必要性のために、より多くの技術的に困難であることが分かる。以前の論文は、高解像度鮮明IMを生成する、しかし組織8-10を可視化する頭蓋骨を薄くしようとしてい頭蓋骨の年齢完全除去が11必要です。長期イメージング(30日+)はごく最近イメージング1,11を通じて可能オプションになっている繰り返し、以前より短い時間枠は5研究されている。
過去十年間の主要な目的は、腫瘍の治療のための新規治療標的を提供するために、腫瘍形成および進行に応じて、特に、新脈管次の病理学的な刺激の原因を解明することであった。多くの論争は、腫瘍の発生または次放射線の間に脳内の新しい血管系のソースの周りのまま。従来、血管新生、血管新生、新しい血管が既存の血管12の出芽から形成されるプロセスを介して行われると考えられている。より最近の研究は、しかし、血管の先に想定胚プロセスは病的な血管系の形成に多くのかなりの役割を果たしていることかもしれないことを示唆している。 VAsculogenesisは、順番に、その後直接新しい血管内皮12-14の形成に関与している骨髄から成体血管芽細胞の対応の募集を伴います。証拠を蓄積すると、内皮前駆細胞が発癌性メディエーター15-17に応答して、 新生血管形成を開始するために骨髄から動員されることを示している。しかし、これらの研究は、病理学的な刺激と治療18-21への応答の種類によって変化する割合の寄与と血管内皮へのこれらの骨髄由来の細胞(たBMDC)の直接的な貢献のために矛盾する証拠を提供する。
したがって、腫瘍脈管構造にし、治療に対する反応におけるBMDC統合のプロセスを繰り返し長期研究のための高分解能生体内イメージングを可能にする再現性の実験方法を確立することが非常に重要である。標準的な組織学的手法、動的情を提供するために失敗する報は、新生血管を生じさせるため、決定的に細胞の相互作用のメカニズムを示すことができない細胞の長期生存、分化および統合を決定するために必要。
私たちは、頭蓋内電離放射線と腫瘍増殖の両方続くBMDC採用の様々な程度、しかしであるリクルート、病理特定のサイト全体ではなく、頭蓋内組織11,22の侵入があることを我々の実験的なアプローチを用いて示している。私たちは、募集は、単一の動物11,22の繰り返しイメージングによって実証時間に敏感なパターンに従うことが示されている。同様に、 インビボ撮像においても蛍光標識腫瘍細胞を直接自身の内皮細胞を形成する腫瘍細胞の分化転換の可能性を強調するために、内皮細胞に対するイントラ不可欠なCD31抗体を用いて撮像され、追跡することができる腫瘍細胞擬態に貴重な洞察を提供することができる。
モデルの汎用性は、細胞および生物学的プロセスの変化の研究のための組み合わせの網羅数を提供し、画像4蛍光チャネルする能力によって強化されています。我々は時間をかけて何度も同時に単一のフィールドで、intravitally画像CFP(青)、GFP(緑色)、チェリー/ RFP(赤)、およびAlexa647/APC(遠赤)にできます。研究者は、遺伝的に特に関心のある構造変化を強調するためにチャネルと同様に、購入染料および抗体のそれぞれの蛍光色素を表現するためのセルを変更することができます。一般的に研究に使用される染料や抗体をこれまでに、我々はこの目的のために遠赤のチャネルを利用したものの両方が、他に使用可能なハイ微小血管や組織1,11,23,24で、その変化の両方、CD31およびデキストランを含むチャンネルは言及した。同様に、SYTOXアポトーシスの領域をハイライト表示されますオレンジ、、そのような会社Visenからのもののようにマーカーを含む他の染料は、SPEであったcifically in vivoでの使用のために設計されています。の4つの一般的に使用される蛍光チャネルにさらに、第二高調波発生(SHG)チャネルが脈管を取り囲む基底膜の可視化、モデル7の内因性コラーゲン繊維を添加して画像を最適化することができる。我々のモデルの適応性、ならびに前述の細胞間相互作用を実証するため、我々は、薬物 - 細胞相互作用を研究することができた。我々はAMD3100、SDF-1阻害剤、及びBMDC募集11に関わるシグナル伝達ネットワークにおけるその役割のような薬物阻害を見てきました。同様に、我々は遺伝的にGFP分子にIRESを通じて一緒にVEGFTrap、VEGF阻害剤25を 、表現するためにU87神経膠腫異種移植細胞のう ち設計しました。 RFP + BMを使用することにより、私たちは、VEGFが血管系にたBMDCの動員に及ぼす役割を研究することができます。最近私たちは、MECを見て薬物動態を研究するためのモデルを利用してきた細胞レベルでの腫瘍線引き薬フルオレセイン26、背後hanism。を使用することにより、カスタム構築された我々は、治療に対する腫瘍とたBMDC両方の応答を評価するために、定位放射線配信を統合することができました家小動物照射インチ
我々の小説生体イメージング法の研究を使用することにより組織変化の多くは、機能と生物学的特徴の解明を助ける、さまざまな病態やシステムで発生する単一セルのリアルタイム変化への洞察を得ることができる。
プロトコル
全ての動物WORKは、動物のケアの下で行われ、USEの実行委員会は、関連するすべてのガイドライン、規制、規制機関に準拠したプロトコルを承認し、実行されています。
参考表2のトラブルシューティング。
1。骨髄再構成(オプション)図1(30分準備、マウス当たり5分)
すべての手術はオートクレーブ滅菌機器と厳しい無菌操作を使用して実行されるべきである。
Oneドナーマウスは再構成する3つのホストマウスを務める。
- Gammacell 40 '正確さ'照射器の中心の内側、頭を保護する鉛で、受信者NODscidマウスと位置をAnaesthetize。
- 2.5 Gyの全身照射(TBI)でNODscidマウスを照射。
重要なステップ:TBIの最適化は十分な宿主免疫CEに必要な線量の変動による必要になることがあります異なるマウス系統におけるLL枯渇。
一時停止ポイント:ホストマウスを事前に照射することができるが、照射の24時間以内に使用する必要があります。
- 制度上の動物ケア委員会のガイドラインに従ってドナーマウスを安楽死させる。後肢を清掃し、両方から脛骨と大腿骨を除去し、骨(図1AI、1aii)からすべての余分な組織を除去。
重要なステップ:腓骨骨が非常に狭い内腔のための使用のために実行可能ではありません。
- 4抽出された骨の両端からエンドプレートを取り外し、それらは外観(図1aiii)で白色になるまで22 G針と1ミリリットル滅菌PBSを使用してそれらを洗い流す。参照表2。
- うまく抽出された骨髄(BM)懸濁物を混合し、3 27 Gツベルクリン針に300μLを描く。 BMは、約2×10 7個の細胞が含まれている必要が抽出され、3ホストマウスreconstitutionsのために十分である。参照表2。
- 工程1.1(図1b)から三予め照射NODscidマウスの外側尾静脈に懸濁液を注入する。参照表2。
注意:BMの無菌性を確認するには、我々は感染を確認するために24時間の残りBMや文化をめっき勧め注入。この時点での死亡の主な原因は、新たに再構成されたマウスでは感染症である。
2。頭蓋ウィンドウ生成 - 図2(マウス当たり30分)
すべての手術が(図2A)、動物を暖かく保つためにオートクレーブ滅菌装置で、熱ランプの下で厳格な無菌操作を使用して実行されるべきである。
- IACUC承認された麻酔薬、0.5でアベルチンIP注射でAnaesthetizeレシピエントNODscidマウス頭部を保護するために、リードとMG / gであり、位置、のセンター内Gammacell 40 '正確さ'照射。頭皮から髪を削除します。また角膜の脱水を防ぐために、涙ゲルを適用します。
- その後ベタジンソリューションとアルコールとの最初のきれいな頭皮、そしてちょうど目の上に耳の中点からの切開を行います。頭蓋骨と頭蓋骨表面のマーク(図2BI)を露出させ、頭皮3ミリメートルのどちらか最初の切開の側を外します。
- 2%リドカイン注射することによって骨膜を高める:エピネフリンソリューションと頭蓋骨の表面(図2Bii)から離れて解剖する。
- 2.7ミリメートルトレパンドリルを使用して、ラムダとブレグマ間に右半球の皮質上の頭蓋骨の2.7ミリメートルの円を弱める。ドリル(図2Biii)で骨を貫通しない。参照表2。
重要なステップ:ドリルが頭蓋骨を通過した場合、脳の表面には、追加TRAに影響を与える結果を破損しますUMA。さらに、過度の出血は、生成されているから透明な窓を防止発生します。
- 解剖ピンセット、歯科フックと故意が、制御された力(図2Biii)を使用して、弱体化骨弁を外します。
- 腫瘍病変を見た場合(オプション)、ステップ2.5で生成されたウィンドウの中心に選択された腫瘍細胞系(蛍光レポーター遺伝子を有する)を注入。
- 定位フレームに細胞懸濁液と負荷針で10μlの30 Gハミルトンシリンジをロードします。
CRITICAL STEP:セル番号が必要成長の使用と、タイムラインで腫瘍細胞のために最適化される必要がある。 U87文化のために我々はマウス当たり10μlの2×10 5個の細胞を使用しています。 - 生成されたウィンドウの中心点に針を合わせるデジタル定位フレームにマウスを読み込む。
- それだけで皮質表面に触れるとデジタル座標をリセット下部ニードルまで。
- ローERは、皮質組織に3.2ミリメートルに針と深い3ミリメートルで注入する。
- 針を引っ込めるゆっくりその後フレームからマウスを削除します。
重要なステップ :1分の期間にわたってソリューションを注入し、削減逆流を確実にするために注射した後の位置に針を残す。
重要なステップ:マイナーな出血が発生した場合は表面的な出血を止めるために1-5分間滅菌した生理食塩水で灌漑。その後のステップに進みます。
- 定位フレームに細胞懸濁液と負荷針で10μlの30 Gハミルトンシリンジをロードします。
- 脳組織が灌漑維持する滅菌PBSのドロップと脳表面を湿らせます。
- 生成された2.7ミリメートルウィンドウの周りに完全密封するために、脳の表面に3ミリメートルのカバースリップをフロート。参照表2。
- ドライ周辺頭蓋骨はその後頭蓋骨と場所でカバースリップに再シール頭皮組織への全体さらさ頭蓋骨にvetbond適用ボーヌ。それはガラスの下に漏れとイメージングの可能性を減少させるような過剰をかけないでください 。
- ミX新鮮な歯科用アクリル系粉末、溶液、およそ30%(w / v)であり、vetbondの上に適用される。密封性を確保するには、ガラスカバースリップの端(図2Biv)に少しアクリル重なっている。参照表2。
注意:歯科 我々は手順全体手袋とマスクの使用をお勧めしますので、アクリルは非常に危険です。
重要なステップ:歯科アクリルは良好なシール性を確保し、過剰減らすため成形時の柔軟なままにする必要があります。窓にアクリルの蓄積は、画像をぼかします。
- マウスは暖かいケージで回復することができます。
3。定位放射線(オプション) - 図3(マウス当たり25分)
バリエーションは、使用される、そのような最適化が必要とされるように、異なる照射装置内に存在します。我々は、カスタム設計された照射器を使用していました。
- マウスAnaesthetize0.5〜1リットルO 2分であり、定位照射(図3AI)の内部カスタムヘッド拘束の上に場所と手順を通して1.5から2パーセントに続く誘導のために4%でイソフルラン使用。
- X線管が2mmのアルミフィルターを通して40のkVp及び0.05 mAで実行されていると360°コーンビームCTスキャンを取得します。それは背腹方向の中央で確実に右半球への放射線アイソセンターを演出、ステージの移動を導くために画像を使用してください。
- 半球コリメータ、8ミリメートル×11ミリメートルブロックを挿入します。
CRITICAL STEP:コリメータは、多くの異なる設定のために設計することができるので、脳の異なる部分を含み、除外することを高めることができる。 8ミリメートル×11ミリメートル、脳の半球の領域を定義します。
- アナト、さらに脳の配置を強化するためにトップ(AP)とコリメータを通してボトム(PA)から、シングルCT直交画像を得るomical骨構造を再現するために使用することができる。
- 交換0.93ミリメートルの銅処理フィルタのアルミニウムフィルタ225のkVp及びAP方向の上から13ミリアンペアで動作するX線管を所望の放射線量の半分を投与する。
- 一番下の位置にガントリーを戻り、X線管225のkVpと13ミリアンペアフォームPA方向の下部に実行に再び放射線量の後半を管理します。
CRITICAL STEP:これは、上部および脳組織を介してRT勾配を低減するために下部の両方から照射することが不可欠であり、それはまた、脳の中心までのアイソセンターの位置合わせを助ける。
4 生体内で 2光子レーザー顕微鏡-図3(セッションあたりの1-3時間)
バリエーションは、使用される、そのような最適化が必要とされるように、異なる顕微鏡で存在します。私たちは、カールツァイスLSM510 METAレーザ走査Confoc使用アル顕微鏡。
- IACUC承認された麻酔薬、アルコールスプレーを使用しては0.5mg / gであり、きれいな窓でアベルチンIP注射をマウスにAnaesthetize。
- (オプション)前のイメージングに尾静脈に、イメージングの前にタグ付けされた血管の染料5-10分を注入。 Alexa647-デキストランは、0.35μgの0.2μgの/ gで使用/ g以下APC-CD31で使用。 表2を参照してください。
- (オプション)は 、腫瘍の輪郭を描くために、5分前のイメージングに、7.7 mg / kg体重の用量で尾静脈を介してフルオレセインを注入。参照表2。
- 生成されたキメラマウスで使用蛍光色素によって決定された共焦点顕微鏡のセットアップチャンネル。 表1は、このモデルで説明するチャネルを示しています。
- 可動顕微鏡ステージ上にマウスを反転し、成形用粘土との位置に頭を安定させます(図3Aii)参照表2。
- 最初のチャンネルのレーザーをオンにして、ICWの中央に配置するために使用します。
- 5倍のレンズを使用し、さらに高解像度の画像のためのマップとして使用するようにウィンドウ全体のイメージを取る。
- イメージングは、最高の画質を得るために10Xと20X '遠距離'のレンズを用いて行われるべきである。
CRITICAL STEP:2PLMにチャネルと目的は、彼らが正しい蛍光色素を強調確実に前マウスモデルのイメージングにin vitroで操作された細胞を使用して設定されるべきである。
| 蛍光色素 | CFP | GFP /フルオレセイン/ FITC | mCherry / RFP / DsRedの | APC /アルexa647 | SHG自己蛍光 |
| 励起レーザ | 458 nmの | 488nmで | 543 nmの | 633 nmの | カメレオンレーザー820 nmの |
| コレクションフィルター | 480から520 nmの | 500-550 nmの | 565から615 nmの | 650から710 nmの | 390から465 nmの |
表1。蛍光色素セットアップ。モデルで利用可能なチャネルのそれぞれに使用励起レーザと発光スペクトルのコレクタを参照するには、ユーザーのためのガイド。
結果
NODscidマウスのBMを再構成のオプションのステップは、しかし、TBIの最適化は他の非で再構成を強化する必要があります、NODscid 'ホスト' 100%のマウスに蛍光 'ドナー' BMの80%の取り込みをもたらすべき-immunocompromsed株。マウスが失敗した再構成されている場合、彼らは病気になるし、手順に従って急速に死んでしまう、弱体化したマウスは、追加の食料や水源が必要になる場合があります。
一度終わっICWは、 図2Bivに見られるようになるはずです。これは頭蓋骨との結合に強度を与えるようにカバーガラスを取り巻くアクリルの尾根を持つことが理想的です。パーフェクト窓が再現され、彼らの世代(図2C)に続いて、最大8週間のために繰り返しイメージングを可能にします。これらの最適な窓を通して生成された画像は、図3BIに見られるようになります。ウィンドウ生成の不完全性は、貧しい人々の画像を生成します空気はレーザーイメージング(図3Bii)を防ぐように例えば品質は、窓の下に気泡が撮像されているビューの全体のフィールドを防ぐことができ、地域が暗く表示されます。カバースリップ上の過剰接着剤とアクリルで背景の高レベルがあるだろう蛍光および汚れがバックグラウンド蛍光の窓小さなドットに存在する同様にあれば、 図3Biiiで見られるように消されているフィールドの領域は、フィールド(図3Biv)に表示されます。
ICWイメージングの成功は手術手技の完全性によって予め決められている、しかし、さえ最適ICWSは、撮像セッション中に問題が発生することができます。このように、透明度の範囲および程度は、 図3に見られるように生成された画像内に存在する。すべてのものが最適であると、図3Cに描か出版品質の画像が発生します。それはすべてのマウスは不可能であるが、画像の80%を期待することは可能であるsがこのように見えるように生成された。現在の顕微鏡のセットアップの主な欠陥の1つは、逆レーザの使用である。マウスは彼らの背中に配置されなければならないと撮影中に呼吸こじつけにつながる可能性が過度のストレスや不快感でこの結果。各画素行を4回結像される四の平均値を最終イメージで表示される、呼吸が、撮像時に発生する平均化と干渉するので、これは "並ぶ"画像を生成する。呼吸こじつけによって引き起こされているような平均化時にどのような動きは、 図3Dに見られるように、画像上の線として現れるアーティファクトが作成されます。撮像中不十分麻酔したマウスにも、この問題が発生することがあります。 '並ぶ'効果がオンに平均化画像を制限することによって低下させることができるが、これはの画像品質を低下させるになり、問題を排除しないことができる。あるいは、マウスが位置を変えたり、呼吸が正規化されたときに再試行することができます。使用Oマウスは "腹臥位 '結像することができるようにウェブ直立2PLMは、この問題を否定するであろう。倒立2PLMでイメージングを持つ追加の問題は、マウス、顕微鏡上にあり、これは、図3Eに見られるような"セグメント化された'イメージにつながる一度ICWを位置決めするための限定されたアクセシビリティを含む。ここで、レーザーとカバーガラスは、互いに垂直に配置し、そのような撮像角度で発生するとされていない。視野の両側が撮像されていない "セグメント化"画像の生成をもたらす。問題は簡単にカバースリップを頭の上に一度完全に水平であることを確認するには、マウスの再配置で解決されて、 図3Aiiで見られるマウント。
ここで紹介するモデルは、具体的に腫瘍組織の血管新生でたBMDCの役割を調べるために使用し、同時に三つの異なるチャネルを使用する能力(チェリー、GFP、遠赤 - Alexa647およびAPC)を示していたのmakinをgのこの特定の物語のためのCFPとSHG冗長。私たちは、窓によって生じる有害な効果を、単一細胞レベルでの血管系へのBM細胞の動員と統合を検討し、最大8週間の縦画像マウスにできました。このモデルは、ソース及び脈管構造の形成と予め終点組織学的分析によって失われた関心のある異なる種類の細胞の相互作用に関する動的情報を収集しやすさを示す。
| 手順 | 問題 | 推論 | ソリューション |
| 1.4 | 粉々に骨 | ブラントツール | 鋭利なはさみまたは新鮮な外科用メスの刃を用いて新鮮なマウスを形成骨髄を採取し、骨片は、TV噴射を阻害する |
| 1.5 | 低抽出(低viscosity)は | あまりに遠カット骨終板、貧しい収集方法 | 骨は、近位にできるだけカットし、バックスプラッシュを防ぐために、コレクションチューブの内側骨で収集されるべきである 時間は最大限にと注意してBMを抽出するために使われるべき 1ミリリットル中に必要なプールであれば、複数のマウス |
| 高い抽出(高粘度) | 低収集バッファ | マウス最大あたり500μlに3レシピエントマウスに分割、余分な0.1%BSAでソリューションを希釈 | |
| 1.6 | バート·静脈内注射 | 悪い血管拡張と血管の可視性 | 熱ランプと拡張性を高める。アクセスを支援するために、光源を内蔵した尾静脈拘束に置きマウス |
| 1 | 病気のマウス | 感染 | 機関の規則に従ってマウスを生け贄に捧げる。尾は注射前に清掃されていることを確認し、無菌性を確認文化の中で抽出されたBMの |
| マウスは死ぬ | 悪いBM取り込み | 死んだマウスの蛍光BM取り込みの%を確認してください。 使用されているマウスの株についてTBI最適 (例では、2つの受信者の1ドナーマウスを使用)BM噴射量を増やす | |
| 2.4 | マイナー出血 | 硬膜は、掘削中に破ら | ジェルパッドと、連続滅菌生理食塩水洗浄付圧力 |
| 主要な出血 | 掘削によって損傷脳 | 機関のガイドラインに従ってマウスを生け贄に捧げる | |
| 2.8 | カバースリップの下に気泡 | 皮質表面との接触不良は、適切な配置を防ぎ | カバースリップを取り外し、気泡を除去するには、ウィンドウ上にカバースリップをフロートに余分なPBSを追加 |
| 2.10 | 接着時のカバースリップの滑り | ACRカルボン質量はカバースリップに圧力を置き、重いと邪魔にカバースリップを外に移動 | vetbondとアクリルが適用されているピンセットはカバースリップを押したままにするために使用されるべき |
| 4.2 | バート·静脈内注射 | 悪い血管拡張と血管の可視性 | 熱ランプと拡張性を高める。アクセスを支援するために、光源を内蔵した尾静脈拘束に置きマウス |
| 4.4 図3C | '裏地'画像 | こじつけまたは不規則な呼吸 | フレームからマウスを削除し、回復できるようにする 麻酔薬投与のレベルを上げると首を確保するための位置を調整を過度に屈曲または呼吸を防止するために拡張されていない |
| 図3C | 'セグメント'画像 | 脳は目標と平行ではない | それは平坦であることを確認するためにカバースリップの位置を調整する |
| 容器は可視化しない | 注射は血管見ていない | 良い血管拡張性を確保するための代替尾静脈、暖かい尾への注射をやり直す | |
| 高いバックグラウンド | 汚れたカバースリップ、 気泡、アクリル | 湿気70%エタノールの布でカバースリップを拭き、アクリル、損傷した脳組織の下に浸透するように浸漬しないでください |
表2。トラブルシューティング手順の問題の分野に必要な是正手順のガイドライン。
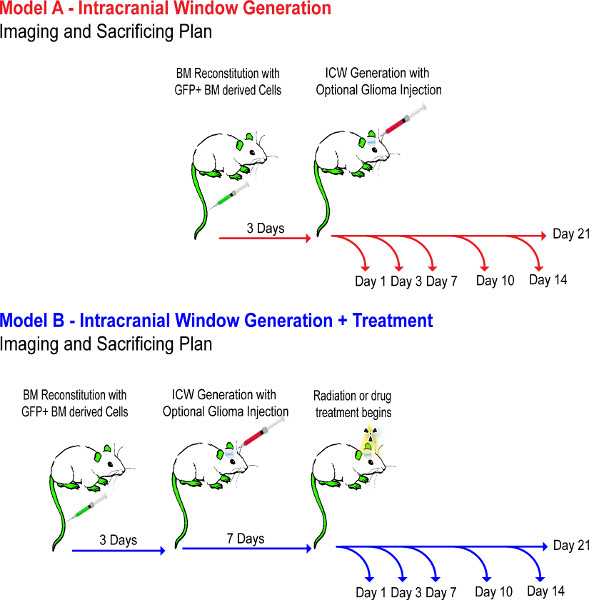
スキーマ1。実験的なフロー図。これは実験の手順1-4を通じたイベントのタイムラインを示しています。マウスモデルでは、に、一週間以上セットアップされBMが正しく再構成を確認し、腫瘍移植を確実にするために、腫瘍の7日目まで、薬で治療されていません。 より大きい数字を表示するには、ここをクリックしてください 。
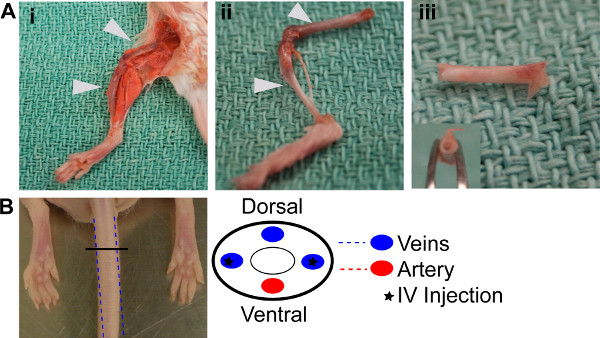
図1。 BM再構成。()BM抽出手順I。後肢の骨の解剖。後肢からII。解剖大腿骨と脛骨、洗浄および抽出のための準備III。骨エンドプレートとを介して除去とフラッシュは、白色の外観を示す空の骨。(B)注射用左右静脈は尾に配置される場合に、どのスキーマが実証された。
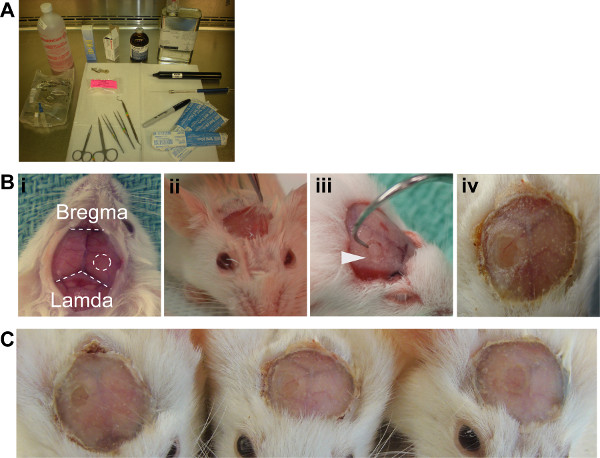
図2。 ICW生成。(A)を推奨無菌セットアップが(B)は、i。露出頭蓋骨の表面は、手術に必要なランドマークを明らかにし、ICWがブレグマとラムダから等距離右半球上に配置されるべきであるII。Periostieumを安全に取り外すことができ、リドカイン溶液を持ち上げIII。ドリルで生成された骨片を除去するために必要な歯科フック。 ニ。歯科アクリルとICWを終えた。(C)三例のウィンドウは、メソッドの再現性を実証する。
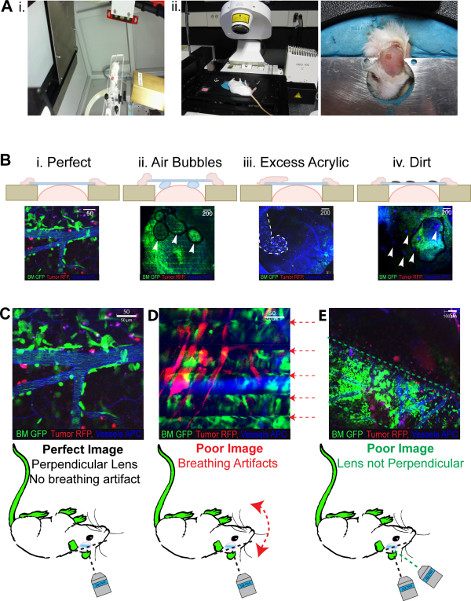
図3。 2PLM予想される結果。 の全ての画像の緑BM、赤腫瘍、ブルー(擬似色の遠赤色)血管系を示しています (A)私は。小動物照射器内部イソフルランフローを保持ヘッドフレームを示します。 8×11ミリメートルコリメータもにガントリーII。マウスを通して動き回る見ることができるイメージングに必要なヘッドフレームに配置反転、成形plastercineすべてのウィンドウを収容することができることが保証されます。問題の結果の(B)の実証写真私からウィンドウ世代。最適なウィンドウ、II。カバースリップおよびIVにわたってIIIアクリルこぼれ、下に閉じ込められた空気の泡を持つウィンドウ。ウィンドウ自体に汚れが。(C)ICW私の成功した世代に続くイメージングで発生する問題を強調表示します。最適なイメージングIIは。呼吸のアーチファクト'並ぶ'イメージIIIを作成します。カバースリップではなく垂直にレーザに'セグメント化された'イメージを生成します。 より大きい数字を表示するには、ここをクリックしてください 。
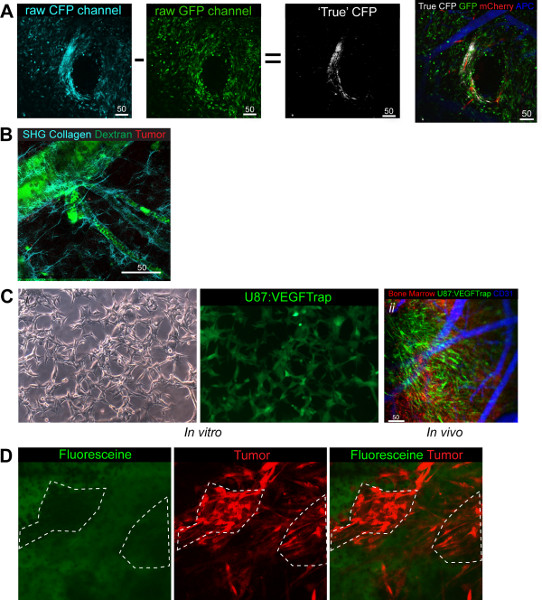
図4。機能的な目的で使用するとモデルの適応。GFPイメージは白の他の3つのチャンネルをオーバーレイすることができ、真CFP像を明らかにするためにCFP画像から減算される()CFPポスト撮影処理。 グリーンBM、赤腫瘍、白CSCは、ブルー(疑似着色遠赤)脈管構造 (B)SHGで撮像することができるコラーゲン繊維の実証。 グリーンデキストラン、赤BM、シアンコラーゲン (C)は、i。vitr で VEGFTrapセルVEGFtrap。IIで生産GFPシグナルを示さO。 生体内イメージングが明確VEGFtrap細胞を示し、加えて、あなたが見ているシステムを実証するためにチャンネルを切り替えのしやすさを強調しています。 グリーンVEGFTRap +腫瘍、赤BM、ブルー(色の擬似遠赤色)血管系は (D)赤腫瘍と緑信号オーバーレイの欠如によって示されるように、直接、腫瘍の間質ではなく、細胞内のフルオレセインのコレクションを示します。グリーンフルオレセイン、レッド腫瘍が。 大きい数字を表示するには、ここをクリックしてください 。
ディスカッション
すべての画像で説明した3つのチャネルは、これまでに多数の細胞の種類との相互作用を調べるためのツールの貴重なセットで、他のモデルと葉の研究者の関心の3つのマーカーのために互換性があります。計画はすべてのマーカーと細胞タイプが正常に異なるチャネルにおけるレポーター蛍光分子を統合していることを確認する必要があります。
我々はまた、第四のCFPチャネル(図4A)とSHGベースコラーゲンチャンネル7( 図4B)を統合することができましたここで使用される標準的な3つのチャネルに加えて、 これはin vivoでの細胞間相互作用を見ての可能性を拡張し、加えて、できユーザーは、他のマーカーの2つのチャネルを維持しながら、特定の細胞間相互作用を研究するために、混合集団に着手する。例えば、我々は彼らのintratumを比較に関心を持つ1:3割合で腫瘍細胞(RFP)と癌幹細胞(CFP)を見てきました経口相互作用が(図4A)。我々は混合集団の7日後に注入率が支持されたとの両方の細胞集団がまだ見ることができることを観察した。
CFPチャネルは励起および発光スペクトルの両方でGFPチャネルとの重複に起因する技術的な問題を提供し、そのように実際にGFP +であるものから真のCFP +細胞を定義するためのポスト撮影処理を必要とします。ポストの撮像処理を直接せるツァイスLSMソフトウェアで構築された2光子顕微鏡で行うことができる、GFP画像( 図4A)取り残される真CFP細胞において得られたCFP画像から減算される。減算が均等に明るいイメージに依存し、GFPレーザー(488 nm)をしながら、CFPとGFP細胞の両方を蛍光CFPレーザー(458 nm)のが原因である比率の前提は、CFPの細胞を蛍光を発するには高すぎる。 CFPに加えて、我々はまた、SHGを見て以前に発行された設定を使用することができましたレベルとその血管系、(図4B)を囲む基底膜を構成するコラーゲン繊維を示す。
このモデルのもう一つの適応は直径2mmのような小さな組織の切片を照射する定位誘導放射を使用する能力を有する特注小動物照射装置を利用してきた。照射でウィンドウを標的とすることで、それは放射線が下にある組織に及ぼす影響を調べることが可能です。我々は最近、効果の放射線を見て研究を発表した血管系へたBMDCの募集に関して正常な脳組織に及ぼす、ポスト放射組織変化における役割を特に探しています私たちは、たBMDCの募集は、時間と正常組織11で用量依存性の両方であることがわかった。
それは、薬物を提供する治療薬のデリバリーと統合のメカニズムは蛍光マーカーでタグ付けされて勉強することが可能である。間に我々の研究は、我々はVEGFTrapの生産、生産25のローカルエリア内のすべてのVEGFシグナル伝達をブロックする抗血管新生薬剤を追跡することができました。同時にVEGFtrap生産、BMDC相互作用と血管系(図4Cii):遺伝的にEGFP(図4Ci)にIRESと相まってVEGFtrap遺伝子を発現させるために我々の腫瘍細胞を変更し、RFP 'ドナー' BMを使用することにより、我々は画像EGFPをすることができました。これは、モデルと利用可能なチャネルの多様性を示した。これは、単一セルの解像度の約束のために、薬物の動態を調べることも可能である。フルオレセイン(GFP +)が最大の切除は26を達成していることを確認するために手術中に腫瘍の輪郭を描くために使用されます。一方静脈イメージングを注入することにより、それはトンで間質領域に薬剤のコレクションを代わりに描写が腫瘍細胞にフルオレセインの能動的取り込みを通じてNOT起こることを実証するために、自分自身をも可能ですが、フルオレセイン(図4D)の注射後に共局在10分の欠如によって見IME、。
全体的な戦略は、動的な細胞間相互作用の研究に有利であるユニークな実験的なプラットフォームを実現するために小説や既存の技術を組み合わせたものです。この戦略は、頭蓋内、治療に応答してBMDC、腫瘍と正常な脳血管の高解像度の単一セルの動的変化を調べるための貴重なアプローチであることが判明した。生体内イメージングは、BMDC採用、移動および分化頭蓋脳の腫瘍脈管構造においてだけでなく、他の研究分野に適応し、他の多くの動的過程の分子量調節剤のより良い理解を提供することができる。他の治療法と組み合わせてBMDCを調節推定阻害因子は、組み合わせ治療の正確なタイミングの識別を助けることができる。さらに、この戦略は、多くの将来の広報に適合させることができるだけでなく、 生体内で生体染色色素だけでなく、蛍光の研究者はよりターゲットを絞った治療法の分布と移行パターンをトレースするだけでなく、その反応速度で縦方向に見てできるようにタグ付けされている低分子阻害剤とナノ粒子を利用しないオブジェクト。
開示事項
著者らは、開示することは何もありません。
謝辞
我々は2Photon顕微鏡のチャンネルの初期設定での支援のために、特にジェームズJonkmanで、王女マーガレット病院で高度な光学顕微鏡施設に感謝したいと思います。著者らは、放射線応答(STTARR)プログラムおよびその関連資金提供機関の時空間ターゲティングと増幅を承認したいと思います。我々はVEGFTrapプラスミドを供給するため、それらの原稿の修正やフィードバックのためのピーターTongeの、Dr.IacovosマイケルとDr.Andrasナジに感謝します。 BTRCのスタッフからの継続的な支援との議論は非常に貴重であったと我々は彼の科学的な入力のためにDr.Abhijitグハを記念したいと思います。作業はCIHRとNIHの助成金によって賄われていた。
資料
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| NODSCID mice | Jackson Lab | 001303 | 8 week old |
| B5/EGFP Mice | Jackson Lab | 003516 | |
| ACTB/DsRED mice | Jackson Lab | 005441 | |
| Tear Gel | Novartis | T296/2 | |
| 2% Lidocaine-Epinephrine | Bimeda MTC | 25SP | Use neat |
| Vetbond | 3M | 1469SB | |
| Self curing acrylic kit | Bosworth | 166260 | Use ~30% (w/v) |
| 10K MW Dextran-Alexa647 | Invitrogen | D22914 | Use @ 0.6 mg/kg in Saline |
| CD31-APC | BDPharmingen | 551262 | Use @ 0.3 mg/kg in Saline |
| AK-fluor (Fluorescein) 10% | AKORN inc. | NDC 17478-253-10 | Use @ 7.7 mg/kg in Saline |
| Betadine solution | Purdue Products | NDC 67618-150 | |
| Equipment | |||
| Fine Tweezers | VWR | 82027-402 | |
| Fine Dissection Scissors | VWR | 25870-002 | |
| 22G Needle | BD | 305156 | |
| 27G 0.5 ml TB syringe | BD | 305620 | |
| Handheld Micro-Drill | Fine Science Tools | 18000-17 | |
| 2.7 mm Trephine drillbit | Fine Science Tools | 18004-27 | |
| 10 μl 30G Hamilton syringe | Sigma Aldrich | 20909-U | |
| Glass Coverslip 3 mm | Warner Instruments | 64-0720 CS-3R | |
| Fluorescence goggles | BLS | FHS/T01 | Basic head frame |
| Stereotaxic frame | stoelting | 51950 | |
| Mouse restrainer for IV injection | Brain Tree Lifescience | MTI | |
参考文献
- Kienast, Y. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16, 116-122 (2010).
- Holtmaat, A. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat. Protoc. 4, 1128-1144 (2009).
- Hansen-Algenstaedt, N., et al. Long-term observation reveals time-course-dependent characteristics of tumour vascularisation. Eur. J. Cancer. 41, 1073-1085 (2005).
- Kherlopian, A. R., et al. A review of imaging techniques for systems biology. BMC Systems Biology. 2, 74(2008).
- Kedrin, D. Intravital imaging of metastatic behavior through a mammary imaging window. Nature Methods. 5, 1019-1021 (2008).
- Perentes, J. Y., et al. In vivo imaging of extracellular matrix remodeling by tumor-associated fibroblasts. Nature Methods. 6, 143-145 (2009).
- Brown, E., et al. Dynamic imaging of collagen and its modulation in tumors in vivo using second-harmonic generation. Nature Medicine. 9, 796-800 (2003).
- Marker, D. F., Tremblay, M. -E., Lu, S. -M., Majewska, A. K., Gelbard, H. A. A Thin-skull Window Technique for Chronic Two-photon In vivo Imaging of Murine Microglia in Models of Neuroinflammation. J. Vis. Exp. (43), e2059(2010).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Yang, G., Pan, F., Parkhurst, C. N., Grutzendler, J., Gan, W. -B. Thinned-skull cranial window technique for long-term imaging of the cortex in live mice. Nature Protocols. 5, 201-208 (2010).
- Burrell, K., Hill, R. P., Zadeh, G. High-resolution in-vivo analysis of normal brain response to cranial irradiation. PLoS ONE. 7, e38366(2012).
- Tate, M. C., Aghi, M. K. Biology of angiogenesis and invasion in glioma. NURT. 6, 447-457 (2009).
- Aghi, M., Chiocca, E. A. Contribution of bone marrow-derived cells to blood vessels in ischemic tissues and tumors. Mol. Ther. 12, 994-1005 (2005).
- Nussenbaum, F., Herman, I. M. Tumor angiogenesis: insights and innovations. J. Oncol. 2010, 132641(2010).
- Zhang, H. -r Incorporation of endothelial progenitor cells into the neovasculature of malignant glioma xenograft. J. Neuroonco. 93, 165-174 (2009).
- Blouw, B., et al. The hypoxic response of tumors is dependent on their microenvironment. Cancer Cell. 4, 133-146 (2003).
- Du, R., et al. HIF1alpha induces the recruitment of bone marrow-derived vascular modulatory cells to regulate tumor angiogenesis and invasion. Cancer Cell. 13, 206-220 (2008).
- Rajantie, I. Adult bone marrow-derived cells recruited during angiogenesis comprise precursors for periendothelial vascular mural cells. Blood. 104, 2084-2086 (2004).
- Shin de Patil, V. R., et al. marrow-derived lin(-)c-kit(+)Sca-1+ stem cells do not contribute to vasculogenesis in Lewis lung carcinoma. Neoplasia. 7, 234-240 (2005).
- Purhonen, S. Bone marrow-derived circulating endothelial precursors do not contribute to vascular endothelium and are not needed for tumor growth. Proc. Natl. Acad. Sci. U.S.A. 105, 6620-6625 (2008).
- Aghi, M., Cohen, K. S., Klein, R. J., Scadden, D. T., Chiocca, E. A. Tumor stromal-derived factor-1 recruits vascular progenitors to mitotic neovasculature, where microenvironment influences their differentiated phenotypes. Cancer Research. 66, 9054-9064 (2006).
- Burrell, K., Zadeh, G. Molecular Mechanisms of Tumor Angiogenesis. , InTech. (2012).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Tolentino, M. J., et al. Angiography of fluoresceinated anti-vascular endothelial growth factor antibody and dextrans in experimental choroidal neovascularization. Arch. Ophthalmol. 118, 78-84 (2000).
- Holash, J. VEGF-Trap: a VEGF blocker with potent antitumor effects. Proceedings of the National Academy of Sciences of the United States of America. 99, 11393-11398 (2002).
- Shinoda, J., et al. Fluorescence-guided resection of glioblastoma multiforme by using high-dose fluorescein sodium. , 1-7 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved