Method Article
A Novel Hochauflösende
In diesem Artikel
Zusammenfassung
Wir beschreiben eine neuartige In vivo Bildgebendes Verfahren, dass Paare fluoreszierenden chimären Mäusen mit intrakraniellen Fenster und hochauflösende 2-Photonen-Mikroskopie. Das Imaging-Plattform Hilfsmittel Studien von dynamischen Veränderungen im Hirngewebe und Mikrovaskulatur, bei einer Ebene einzelner Zellen, nach pathologischer Beleidigungen und ist anpassungsfähig an intrakraniellen Droge Lieferung und Verteilung zu beurteilen.
Zusammenfassung
Wir haben erfolgreich integriert zuvor Intracranial Fenster (ICW)-Technologie mit 1-4 intravital etablierten 2-Photonen konfokalen Mikroskopie, eine neuartige Plattform, die für die direkte langfristige Visualisierung der Gewebestruktur ermöglicht Änderungen intrakranial entwickeln. Imaging in einer einzigen Zelle Auflösung in einer Echtzeit-Mode bietet zusätzliche dynamische Informationen über die von Standard-Endpunkt histologische Analyse, die allein betrachtet "Snap-shot 'Querschnitte von Gewebe zur Verfügung gestellt.
Die Errichtung dieser intravital bildgebendes Verfahren in fluoreszierenden chimären Mäuse, sind wir in der Lage, Bild vier fluoreszierende Kanälen gleichzeitig. Durch die Integration von fluoreszenzmarkierten Zellen, wie zB GFP + Knochenmark, ist es möglich, das Schicksal dieser Zellen studieren ihre langfristige Migration, Integration und Differenzierung innerhalb des Gewebes zu verfolgen. Eine weitere Integration von einem sekundären Reporter Zelle, wie einer mCherry Gliomtumor Linie ermöglicht Zeichenrakterisierung der Zelle: Zell-Interaktionen. Strukturelle Veränderungen im Gewebe Mikroumgebung kann durch die Zugabe von intra-vital Farbstoffe und Antikörper markiert werden, zum Beispiel CD31 Antikörper markiert und Dextranmolekülen.
Darüber hinaus beschreiben wir die Kombination unserer ICW Imaging-Modell mit einem kleinen Tier Mikro-Strahler, die stereotaktische Bestrahlung stellt, die Schaffung einer Plattform, über die die dynamischen Veränderungen, die Gewebe nach der Verabreichung von ionisierender Strahlung auftreten beurteilt werden können.
Diese Einschränkungen der Modell umfassen penetrance des Mikroskops, die bis zu einer Tiefe von bis zu 900 um von der subkortikalen Oberfläche begrenzt ist, die Begrenzung Bildgebung zur dorsalen Achse des Gehirns. Die Anwesenheit der Schädelknochen macht die ICW eine anspruchsvolle technische Verfahren, im Vergleich zu den etablierten und genutzt Kammer Modelle, die gerade verwendet werden, um Brustgewebe und Fettpolster 5-7 studieren. Darüber hinaus ist die ICW provides viele Herausforderungen bei der Optimierung der Bildgebung.
Einleitung
Ein besseres Verständnis für die strukturelle und biologische Veränderungen im Gehirn entstehen in Abhängigkeit von verschiedenen Pathologien, und therapeutischen Maßnahmen sind zur Verbesserung Behandlungsstrategien. Allerdings ist eine der aktuellen Herausforderungen bei der Untersuchung dieser strukturelle und biologische Veränderungen, insbesondere in Bezug auf die intrakraniellen Pathologien ist die Unzugänglichkeit des Gewebes und die Unfähigkeit, die zeitliche Entwicklung und Progression von dynamischen Veränderungen in einem in vivo Einstellung zu studieren. Die Generation der "Fenster"-Technologie hat bereits bewiesen, bei der Prüfung der Weichgewebe durch Änderungen Tumorentwicklung 5-7 erfolgreich. Entwicklung der ICW Modelle erweist sich als technisch anspruchsvoll, aufgrund der Notwendigkeit, die Schädelknochen ohne Beschädigung auf Anstiftung Infektion in der zugrunde liegenden zerebralen Gewebe zu entfernen. Zurück Papiere haben versucht, den Schädel, um das Gewebe zu visualisieren 8-10 jedoch dünn, um eine hohe Auflösung im klaren produzierenAlter vollständige Entfernung des Schädelknochens wird 11 erforderlich. Wiederholen langfristige Bildgebung (30 Tage +) hat erst vor kurzem eine mögliche Option durch bildgebende 1,11 geworden, haben kürzere Zeitrahmen wurde 5 untersucht.
Während des letzten Jahrzehnts ein wichtiges Ziel war es, die Herkunft des neo-Gefäßsystem folgenden pathologischen Stimuli aufzuklären, insbesondere in Reaktion auf die Tumorbildung und Progression, um neue therapeutische Targets für die Behandlung von Tumoren bieten. Viel Streit bleibt rund um die Quelle für neue Blutgefäße im Gehirn während der Tumorentwicklung oder folgenden Strahlung. Traditionell Vaskularisierung ist betrachtet worden, durch Angiogenese, ein Prozess, durch den neue Gefäße bilden aus dem Sprießen von bereits vorhandenen Gefäßen 12 auftreten. Neuere Untersuchungen deuten jedoch darauf hin, dass der bisher angenommen embryonalen Prozess der Vaskulogenese spielen möglicherweise eine wichtige Rolle in der Bildung von pathologischen Gefäßsystem. Vasculogenesis beinhaltet die Einstellung der erwachsenen Angioblasten Kollegen aus dem Knochenmark, die dann wiederum direkt in die Bildung neuer Gefäßendothel 12-14 beteiligt. Immer mehr deutet darauf hinweisen, dass endotheliale Vorläuferzellen aus dem Knochenmark mobilisiert werden, um de novo Gefäßneubildung in Reaktion auf onkogenen Mediatoren 15-17 einzuleiten. Allerdings bieten diese Studien widersprüchliche Aussagen zur direkten Beitrag dieser Knochenmark stammende Zellen (BMDCs) an Gefäßendothel mit prozentuale Anteil variiert mit der Art der Anregung und pathologische Reaktion auf die Behandlung 18-21.
Daher Gründung reproduzierbare experimentelle Methoden, die hochauflösende Bildgebung intravital ermöglichen wiederholt Langzeitstudie des Prozesses der Integration in BMDC Tumorvaskulatur und in Reaktion auf die Therapie ist von unschätzbarem Wert. Standard-histologische Techniken versagen, um die dynamische Informationen liefernmationen erforderlich, um die langfristige Überleben, die Differenzierung und Integration der Zellen, die zu neovasculature geben und kann daher nicht eindeutig nachweisen, die Mechanismen der Zell-Interaktion zu bestimmen.
Wir haben gezeigt, mit unserem experimentellen Ansatz, dass es einen unterschiedlichen Grad der BMDC Rekrutierung sowohl nach intrakraniellen ionisierender Strahlung und Tumorwachstum, eine Einstellung, die jedoch, Pathologie ortsspezifische und nicht eine Invasion des gesamten intrakraniellen Gewebe 11,22. Wir haben gezeigt, dass die Einstellung eine zeitkritische Muster durch die wiederholte Abbildung eines einzelnen Tieres 11,22 gezeigt, folgt. In ähnlicher Weise kann in-vivo-Bildgebung auch wertvolle Einblicke in die Tumorzelle Mimikry wobei fluoreszierend markierten Tumorzellen abgebildet und mit einem intra-vital CD31 Antikörper für Endothelzellen verfolgt werden, um die Möglichkeit von Tumorzellen transdifferentiation um direkt eine eigene Endothel zu markieren.
Die Vielseitigkeit des Modells wird durch die Fähigkeit, Bild 4 fluoreszierenden Kanäle erweitert, eine erschöpfende Anzahl der Kombinationen für das Studium der unterschiedlichen zellulären und biologischer Prozess. Wir sind in der Lage, intravital Bild CFP (blau), GFP (grün), Kirsche / RFP (rot) und Alexa647/APC (weit-rot), gleichzeitig in einem einzigen Feld wiederholt über die Zeit. Forscher können genetisch zu verändern Zellen Fluorochrome für jeden der Kanäle sowie Kauf Farbstoffe und Antikörper ausdrücken zu strukturellen Veränderungen von besonderem Interesse hervorzuheben. Um Farbstoffe und Antikörper häufig in Studien verwendet Bisher gehören CD31 und Dextran die beide das Highlight Mikrovaskulatur und ihre Veränderungen im Gewebe 1,11,23,24, obwohl wir die weit-roten Kanal für diesen Zweck verwendet sowohl für den Einsatz in der anderen sind Kanäle erwähnt. Ebenso haben andere Farbstoffe einschließlich Sytox Orange, welche Bereiche der Apoptose Highlight wird und Marker, wie sie von der Firma Visen, wurde specifically zur Verwendung in vivo bestimmt. Zusätzlich zu den vier üblichen Fluoreszenzkanälen erwähnt, kann eine Erzeugung einer zweiten Harmonischen (SHG) Kanal aufgenommen und optimiert werden, um die endogenen Bild Kollagenfasern des Modells 7, Visualisierung der Basalmembran umgibt Gefäßsystem.Um die Anpassungsfähigkeit unseres Modells, sowie die Zell-Zell-Interaktionen erwähnt zu demonstrieren, haben wir in der Lage, Arzneimittel-Zell-Interaktionen zu studieren. Wir haben bei Drogen-Inhibitoren wie AMD3100 eine SDF-1 Inhibitor, und seine Rolle bei der Signalisierung Netzwerke in der Personalbeschaffung BMDC 11 beteiligt sah. Ebenso haben wir genetisch heraus U87 Gliom Xenotransplantate Zellen entwickelt, um VEGFTrap, ein VEGF Inhibitor 25, in Verbindung auszudrücken durch eine IRES GFP zu einem Molekül. Durch die Verwendung von RFP + BM sind wir in der Lage, die Rolle VEGF hat sich auf die Rekrutierung von BMDCs dem Gefäßsystem zu studieren. Vor kurzem haben wir das Modell auf Drogen untersuchen Kinetik genutzt Blick auf die mechanism hinter dem Tumor-Medikament Abgrenzung Fluorescein 26, auf zellulärer Ebene. Durch den Einsatz von einem speziell angefertigten Haus in Kleintier-Strahler konnten wir stereotaktische geliefert Strahlung zu integrieren, um die Reaktion des Tumors und BMDCs sowohl auf die Behandlung zu beurteilen haben.
Durch den Einsatz unseres neuartigen intravital Bildgebungsverfahren Forscher Einblick in die Single-Cell-Änderungen in Echtzeit, die in verschiedenen Pathologien und Systemen auftreten gewinnen, Unterstützung der Aufklärung der vielen funktionellen und biologischen Eigenschaften von Gewebeveränderungen.
Protokoll
Alle tierischen Arbeit wurde unter einer Tierpflege getragen und USE COMMITEE genehmigte Protokoll und unter Einhaltung aller einschlägigen Richtlinien, Vorschriften und Aufsichtsbehörden ausgeführt.
Zur Fehlersuche Referenz Tabelle 2.
1. Bone Marrow Reconstitution (Optional) Abbildung 1 (30 min Vorbereitung, 5 min pro Maus)
Jede Operation sollte mit strengen aseptischen Bedingungen mit steriler Ausrüstung autoklaviert werden.
Ein Spender Maus rekonstruieren drei Host-Mäusen.
- Betäuben Empfänger NODscid Mäusen und Position, mit Blei, um den Kopf zu schützen, in der Mitte des Gammacell 40 'exactor' Strahler.
- Bestrahlen NODscid Mäuse mit 2,5 Gy Ganzkörperbestrahlung (TBI).
Entscheidender Schritt: Optimierung der TBI kann erforderlich aufgrund der Variation der Dosis für eine ausreichende Wirtsimmunsystem ce erforderlichll Erschöpfung in verschiedenen Maus-Stämme.
Pause Punkt: Host Mäuse können im Voraus bestrahlt werden, sollte aber innerhalb von 24 Stunden der Bestrahlung verwendet werden.
- Euthanize Donormäusen nach den institutionellen Tierpflege Ausschuss Leitlinien. Reinigen Sie die Hinterbeine und entfernen Sie die Schienbein und Oberschenkelknochen von beiden, Abisolieren Alle überschüssige Gewebe aus den Knochen (Abb. 1ai, 1aii).
Entscheidender Schritt: Fibular Knochen sind nicht für die Verwendung durch sehr engen Lumen lebensfähig.
- Das Lagergehäuse von beiden Enden der vier extrahierten Knochen und spülen sie unter Verwendung einer 22 G Nadel und 1 ml sterilem PBS bis sie weißes Aussehen (Abbildung 1aiii) sind. Reference Table 2.
- Mischen Sie die extrahierten Knochenmark (BM) Suspension gut und zeichnen 300 ul in drei 27 G Tuberkulin Nadeln. Extrahiert BM sollte etwa 2 x 10 7 Zellen undreicht für 3 Wirtsmäuse Rekonstruktionen. Reference Table 2.
- Injizieren Sie die Suspension in die laterale Schwanzvene von drei zuvor bestrahlten NODscid Mäuse aus Schritt 1.1 (Abbildung 1b). Reference Table 2.
ACHTUNG: Um die Sterilität des BM überprüfen injiziert empfehlen wir die verbleibende Beschichtung BM und Kultur für 24 h bis auf eine Infektion. Primäre Ursache des Todes an diesem Punkt ist die Infektion in den neu konstituierten Mäusen.
2. Intracranial Fenster Generation - Bild 2 (30 min pro Maus)
Jede Operation sollte mit strengen aseptischen Bedingungen mit autoklaviertem steriler Ausrüstung und unter einer Wärmelampe Tiere zu halten warm (2A) werden.
- Betäuben Empfänger NODscid Mäusen mit IACUC zugelassenen Anästhetikum Avertin IP-Injektion von 0,5 mg / g und die Position, mit Blei, um den Kopf zu schützen, in der Mitte desGammacell 40 'exactor' Strahler. Entfernen Sie Haare aus der Kopfhaut. Darüber hinaus gelten Träne Gel Hornhaut Austrocknung zu verhindern.
- Saubere Kopfhaut zuerst mit Betadine Lösung und dann mit Alkohol, dann einen Einschnitt vom Mittelpunkt der Ohren bis knapp über die Augen. Entfernen Kopfhaut 3 mm auf beiden Seiten der ersten Einschnitt, Aussetzen der Schädel und Sehenswürdigkeiten des Schädels Oberfläche (Abbildung 2Bi).
- Elevate das Periost durch Einspritzen von 2% Lidocain: Adrenalin-Lösung und sezieren vom Schädel Oberfläche (Abbildung 2Bii).
- Mit 2,7 mm Trepanfräse, schwächen 2,7 mm Kreis der Schädel über dem Kortex der rechten Hemisphäre zwischen Lambda und Bregma. Dringen nicht in den Knochen mit dem Bohrer (Abbildung 2Biii). Reference Table 2.
Entscheidender Schritt: Wenn Bohrer geht durch den Schädel das Gehirn Oberfläche beeinflussen Ergebnisse mit zusätzlichen tra beschädigt werdenuma. Darüber hinaus starke Blutungen auftreten verhindert ein durchsichtiges Fenster aus erzeugt wird.
- Entfernen Sie die geschwächten Knochen Klappe mit Dissektion Pinzette und zahnärztliche Haken und bewusste, aber kontrollierte Kraft (Abbildung 2Biii).
- (Optional) sieht Tumorpathologie injizieren gewählt Tumorzelllinien (mit fluoreszierenden Reporter-Gen) in der Mitte des Fensters in Schritt 2.5 erzeugt.
- Legen Sie 10 ul 30 G Hamilton Spritze mit Zellsuspension und Last Nadel in einem stereotaktischen Rahmen.
Entscheidender Schritt: Die Zellzahl müssen für Tumorzellen im Einsatz und Zeitplan des Wachstums erforderlich optimiert werden. Für U87 Kulturen verwenden wir 2 x 10 5 Zellen in 10 ul pro Maus. - Legen Maus auf dem digitalen stereotaktischen Rahmen ausrichten Nadel auf den Mittelpunkt des Fensters erzeugt werden.
- Lower Nadel bis sie gerade berührt die kortikale Oberfläche und setzen Sie die digitale Koordinaten.
- Niedriger die Nadel bis 3,2 mm in der kortikalen Gewebe injizieren und bei 3 mm tief.
- Einfahren Nadel langsam entfernen Sie dann mit der Maus aus dem Rahmen.
Entscheidender Schritt: Spritzen Lösung über die Dauer von 1 min und lassen Nadel in Position nach der Injektion reduziert Rückfluss zu gewährleisten.
Entscheidender Schritt: Wenn kleinere Blutungen festgestellt wird mit einer sterilen Kochsalzlösung Bewässerung für 1-5 min auf oberflächliche Blutung zu stoppen. Fahren Sie mit den nachfolgenden Schritten.
- Legen Sie 10 ul 30 G Hamilton Spritze mit Zellsuspension und Last Nadel in einem stereotaktischen Rahmen.
- Befeuchten Hirnoberfläche mit einem Tropfen sterilem PBS, um das Gehirn Gewebe bewässert.
- Float eine 3 mm Deckglas auf Hirnoberfläche vollständig abzudichten um die 2,7 mm Fenster erzeugt. Reference Table 2.
- Dry umgebenden Schädelknochen dann gelten Vetbond auf die gesamte ausgesetzt Schädel zu verschließen Kopfhautgewebe der Schädelknochen und das Deckglas in Kraft. NICHT gelten einen Überschuss, wie es unter dem Glas undicht wird und verringern die Bildgebung Potenzial.
- Mix frisch Dentalacryl Pulver und Lösung, etwa 30% (w / v), und über die Oberseite des Vetbond gelten. Um eine sichere Abdichtung zu gewährleisten überlappen Acryl leicht auf die Deckglas Kante (Abbildung 2Biv). Reference Table 2.
ACHTUNG: Dental Acryl ist extrem gefährlich, so dass wir den Einsatz von Handschuhen und Maske während der Verfahren empfehlen.
Entscheidender Schritt: Dental Acryl muss bleiben geschmeidig während der Formgebung, um eine gute Abdichtung zu gewährleisten und zu reduzieren Exzess. Aufbau von Acryl auf dem Fenster wird verschwimmen Bilder.
- Erlauben Mäuse an einem warmen Käfig erholen.
3. Stereotaktischen Bestrahlung (Optional) - 3 (25 min pro Maus)
Variationen werden in den verschiedenen Strahlern verwendet und als solche Optimierung benötigt werden existieren. Wir verwendeten eine maßgeschneiderte Strahler.
- Betäuben Mäuseunter Verwendung von 4% Isofluran für die Induktion von 1,5-2% während des gesamten Verfahrens mit 0,5-1 Liter O 2 a min, und setzen auf individuelle Kopf Restrainer innerhalb des stereotaktischen Strahler (Abbildung 3Ai) gefolgt.
- Besorgen Sie sich eine 360 °-Cone-Beam-CT-Scan mit der Röntgenröhre läuft bei 40 kV und 0,05 mA durch ein 2 mm Aluminium-Filter. Verwenden Sie das Bild, um die Bewegung der Bühne führen, die Strahlung lsozentrum auf der rechten Hemisphäre Gewährleistung ist es zentral in der Dorsal ventrale Richtung.
- Legen Sie die hemisphärische Kollimator, 8 mm x 11 mm Block.
Entscheidender Schritt: Kollimatoren kann für viele verschiedene Setups zu gestalten und so verbessert, um ein-und ausschließen verschiedenen Teile des Gehirns werden. 8 mm x 11 mm definiert eine halbkugelförmige Bereich des Gehirns.
- Erhalten einzigen CT orthogonal Bilder sowohl von oben (AP) und unten (PA) durch den Kollimator zur weiteren Verbesserung der Platzierung des Gehirns, anatomical Knochenstrukturen können Reproduzierbarkeit verwendet werden.
- Tauschen Sie den Filter für eine Aluminium 0,93 mm Kupfer Behandlung filtern und verwalten Hälfte der gewünschten Strahlendosis mit der Röntgenröhre läuft bei 225 kV und 13 mA von der Spitze in einem AP-Richtung.
- Zurück Gantry in die untere Position und verwalten die zweite Hälfte der Strahlendosis wieder mit der Röntgenröhre läuft bei 225 kV und 13 mA Form der Boden in einer Richtung PA.
Kritischer Schritt: Es ist wesentlich, von oben und unten, um die RT Gradienten durch das Gehirngewebe reduzieren bestrahlen, es hilft auch bei der Ausrichtung des Isozentrum zum Zentrum des Gehirns.
4 In vivo Two Photon Laser Microscopy -. Abbildung 3 (1-3 Stunden pro Sitzung)
Variationen werden in den verschiedenen Mikroskopen und als solche Optimierung benötigt werden existieren. Wir verwendeten eine Carl Zeiss LSM510 META Laser Scanning Confocal Mikroskop.
- Betäuben Mäusen mit IACUC zugelassenen Anästhetikum Avertin IP-Injektion von 0,5 mg / g und saubere Fenster mit Alkohol Spray.
- (Optional) injizieren verschlagwortet vaskulären Farbstoff 5-10 min vor der Bildgebung, in die Schwanzvene vor der Bildgebung. Alexa647-Dextran bei 0,35 pg / g oder APC-CD31 bei 0,2 pg / g verwendet. Siehe Tabelle 2.
- (Optional) Injizieren Fluorescein über die Schwanzvene in einer Dosis von 7,7 mg / kg, 5 min vor der Bildgebung zu Tumor abzugrenzen. Reference Table 2.
- Setup-Kanäle auf der Konfokales Mikroskop nach dem Fluorochrom in der chimären Maus erzeugt bestimmt. Tabelle 1 zeigt die Kanäle in diesem Modell beschrieben.
- Umkehren Maus auf dem beweglichen Objekttisch und stabilisieren den Kopf in Position formbare Knetmasse. (Abbildung 3Aii) Referenz Tabelle 2.
entscheidender Schritt: Die ICW muss senkrecht zum Laser-Punkt und als solche muss horizontal positioniert werden, um sicherzustellen, dass die Bildgebung ist optimal.
- Schalten ersten Kanal Laser und nutzen, um in der Mitte der ICW zu positionieren.
- Verwenden 5x Objektiv und nehmen ein Bild des gesamten Fensters als Karte für weitere Bilder mit höherer Auflösung verwenden.
- Imaging durchgeführt werden soll mit 10X und 20X 'long range' Linsen, um die beste Bildqualität zu erhalten.
Entscheidender Schritt: Kanäle und Ziele auf dem 2PLM eingerichtet werden soll, mit gentechnisch veränderten Zellen in vitro vor der Bildgebung von Mausmodellen, um sicherzustellen, dass sie die richtige Fluorochrom markieren.
| Fluorochrom | CFP | GFP / Fluorescein / FITC | mCherry / RFP / DsRED | APC / Alexa647 | SHG Autofluoreszenz |
| Anregungslaser | 458 nm | 488 nm | 543 nm | 633 nm | Chameleon Laser 820 nm |
| Sammlung Filter | 480-520 nm | 500-550 nm | 565-615 nm | 650-710 nm | 390-465 nm |
Tabelle 1. Fluorochrom-Setup. Guides für den Benutzer, um die Anregung Laser-und Emissionsspektren Kollektor für jeden der Kanäle in dem verwendeten Modell zu sehen.
Ergebnisse
Der optionale Schritt der Wiederherstellung der BM von NODscid Mäuse sollten in einem 80% igen Aufnahme des fluoreszierenden "Spender" BM in 100% der NODscid "Wirt" Mäusen führen, werden jedoch Optimierung des TBI erforderlich, um die Rekonstitution in anderen nicht verbessern immunocompromsed-Stämme. Wenn Mäuse erfolglos rekonstituiert werden sie krank werden und sterben schnell nach dem Eingriff kann geschwächt Mäusen zusätzliche Nahrung und Wasser-Quellen.
Die ICW einmal fertig sollte wie in Abbildung 2Biv gesehen aussehen. Es ist ideal, um einen Grat von Acryl rund um das Deckglas wie diese gibt Kraft für den Join mit dem Schädel haben. Perfekte Fenster sind reproduzierbar und erlauben wiederholte Abbildung für bis zu 8 Wochen nach ihrer Generation (Abbildung 2C). Images durch diese optimale Fenster hergestellt werden, wie sie in Abbildung 3Bi gesehen aussehen. Unvollkommenheiten in dem Fenster Generation erzeugen Bilder von schlechterQualität zum Beispiel Luftblasen unter dem Fenster wird das gesamte Gesichtsfeld abgebildet wird verhindern, werden Bereiche dunkler erscheinen als die Luft verhindert, dass die Laser-Imaging (Abbildung 3Bii). Mit überschüssigen Leim und Acryl auf dem Deckglas wird es ein hohes Maß an Hintergrund sein Fluoreszenz und Bereiche des Feldes wird ausgelöscht, wie in Abbildung 3Biii gesehen, ebenso, wenn sich Schmutz auf dem Fenster kleine Punkte von Hintergrund-Fluoreszenz wird im Bereich (Abbildung 3Biv) sichtbar.
Der Erfolg der ICW Abbildung durch die Integrität der chirurgischen Technik vorgegeben, kann jedoch auch eine optimale ICWs Probleme bei der Imaging-Sitzung auftreten. Als solches besteht ein Spektrum und der Klarheit der Bilder erzeugt werden, wie in 3 zu sehen. Die Veröffentlichung Bildqualität in 3C dargestellt tritt auf, wenn alles optimal ist. Es ist zwar nicht bei allen Mäusen möglich ist, ist es möglich, 80% der Bildfläche erwartens erzeugt werden, um so aussehen. Einer der größten Mängel in der Mikroskopie Einrichtung ist die Verwendung von invertierten Lasern. Mäuse haben auf dem Rücken, und dies führt zu einer übermäßigen Stress und Unbehagen, die führen zu Atemnot bei der Abbildung positioniert werden kann. Dies erzeugt einen "gefüttert" Bild als das Atmen behindert die Mittelung, die auftritt, während der Bildgebung, wobei jede Pixelzeile viermal und der Durchschnitt der vier in der Aufnahme angezeigt wird abgebildet. Jede Bewegung während der Mittelung, wie sie verursacht durch erschwerte Atmung, wird ein Artefakt, das als Linie auf dem Bild, wie in 3D gesehen erscheint erstellen. Mäuse, die nicht ausreichend betäubt sind während der Bildgebung kann auch dieses Problem zu begegnen. Die 'gefüttert' Effekt durch die Begrenzung der Bild Mittelung auf verringert werden, aber dies wird wiederum reduzieren die Bildqualität und kann nicht das Problem zu beseitigen. Alternativ Mäuse können neu oder wiederholt werden, wenn die Atmung normalisiert hat. Die Verwendung of eine aufrechte 2PLM negieren würde dieses Problem als Mäuse konnte abgebildet 'in Bauchlage "werden. Ein zusätzliches Problem bei Abbildung auf einem invertierten 2PLM beinhaltet die eingeschränkte Zugänglichkeit für die Positionierung des ICW, sobald die Maus ist auf dem Mikroskop, und dies führt zu "segmentiert" Bilder, wie sie in 3E gesehen. Hier ist die Laser-und Deckglas nicht senkrecht zueinander angeordnet sind und als solche die Abbildung erfolgt in einem Winkel. Dies führt zu der Erzeugung eines "segmentiert" Bild, in dem die Seiten des Sichtfelds nicht abgebildet werden. Das Problem lässt sich mit der Neupositionierung der Maus, um sicherzustellen, dass das Deckglas ist völlig horizontal einmal auf der Kopfhalterung wie in Abbildung 3Aii gesehen gelöst.
Das hier vorgestellte Modell wurde gezielt eingesetzt, um die Rolle der BMDCs in der Vaskularisation von Tumorgewebe untersucht und demonstriert die Fähigkeit, drei verschiedene Kanäle gleichzeitig nutzen (Kirsche, GFP, Far-rot - Alexa647 und APC) Making der GFP und SHG redundante für diese besondere Geschichte. Wir waren in der Lage, Bild Mäusen Längsrichtung für bis zu 8 Wochen, das Studium der Rekrutierung und Integration von BM-Zellen in das Gefäßsystem in einer einzelnen Zelle Ebene, ohne nachteilige Auswirkungen durch das Fenster verursacht. Dieses Modell zeigt die Leichtigkeit des Sammelns dynamische Informationen über die Quelle und die Bildung von Gefäßen und dem Zusammenspiel verschiedener Zelltypen von Interesse, die vorher durch Endpunkt histologische Analyse verloren.
| Schritt | Problem | Reasoning | Lösung |
| 1.4 | Knochen splittern | Blunt Werkzeuge | Sammle Knochenmark bilden eine frische Maus mit geschärften Schere oder Skalpell frisch, wird Knochenfragmente hemmen TV Injektion |
| 1.5 | Low-Extraktion (niedrigen viscosity) | Knochen Endplatten geschnitten zu distal; schlechte Erhebungsmethode | Bones sollte so proximal wie möglich geschnitten werden gesammelt und mit dem Knochen in der Sammlung Rohr Rückwand verhindern Die Zeit sollte ausgegeben, um die BM maximal und mit Sorgfalt zu extrahieren Gegebenenfalls Pool mehr als eine Maus in 1 ml |
| Hohe Extraction (hohe Viskosität) | Low Sammlung Puffer | Verdünnen out-Lösung mit zusätzlichen 0,1% BSA, aufgeteilt auf drei Empfängermäuse bis zu 500 ul pro Maus maximale | |
| 1.6 | Bad intravenöse Injektion | Schlechte Durchblutung und Gefäß Sichtbarkeit | Verbessern Dilatation mit Wärmelampe. Bewegen Sie die Maus in die Schwanzvene Restrainer mit in Lichtquelle gebaut, um den Zugang erleichtern |
| 1 | Mäuse krank | Ansteckung | Sacrifice Mäusen nach Institution Regeln. Stellen Sie sicher, Schwänze vor der Injektion werden gereinigt und überprüfen Sterilitätder extrahierten BM in Kultur |
| Mäuse sterben | Schlechte BM Aufnahme | Überprüfen% der fluoreszierenden BM Aufnahme von toten Maus. Optimieren für Stamm von Mäusen verwendet TBI Erhöhungsbetrag von BM Injektion (zB Verwendung eines Spenders Maus für zwei Empfänger) | |
| 2.4 | Minor Blutungen | Dura verletzt beim Bohren | Druck mit Gel-Pads und und kontinuierliche steriler Kochsalzlösung waschen |
| Wichtige Blutungen | Gehirn durch Bohren beschädigt | Sacrifice Maus nach Institution Richtlinien | |
| 2.8 | Air-Blasen unter Deckglas | Schlechter Kontakt mit kortikalen Oberfläche verhindert richtige Platzierung | Deckglas entfernen und fügen Sie zusätzliche PBS auf das Deckglas auf dem Fenster schweben um Luftblasen zu entfernen |
| 2.10 | Slippage von Deckglas während Kleben | Acrylic Masse ist schwer, wodurch zusätzlicher Druck auf das Deckglas und bewegt das Deckglas aus dem Weg | Pinzette sollte verwendet werden, um Deckglas halten werden, während Vetbond und Acryl aufgebracht |
| 4.2 | Bad intravenöse Injektion | Schlechte Durchblutung und Gefäß Sichtbarkeit | Verbessern Dilatation mit Wärmelampe. Bewegen Sie die Maus in die Schwanzvene Restrainer mit in Lichtquelle gebaut, um den Zugang erleichtern |
| 4.4 3C | 'Gefüttert' Bilder | Erschwerte oder unregelmäßiger Atmung | Entfernen Sie mit der Maus aus dem Rahmen und lassen sich zu erholen Steigern Ebene des Anästhetikums verabreicht und passen Position auf den Hals zu gewährleisten ist nicht übermäßig gebeugt oder gestreckt, um die Atmung zu verhindern |
| 3C | "Segmentierte" image | Brain ist nicht parallel zu Zielen | Stellen Sie Position Deckglas, um sicherzustellen, es ist flach |
| Schiff nicht visualisiert | Injektion nicht gesehen intravasal | Redo Injektion in alternative Schwanzvene, warm Schwanz gute Durchblutung zu gewährleisten | |
| Hohe Hintergrund | Schmutzige Deckglas, Air Bubbles, Acryl | Wischen Sie mit einem feuchten Deckglas 70% Ethanol Tuch, nicht einweichen, wie unter Acryl eindringen kann und Schäden am Hirngewebe |
Tabelle 2. Fehlerbehebung. Ein Leitfaden für Korrekturmaßnahmen für problematische Bereiche der Verfahren erforderlich.
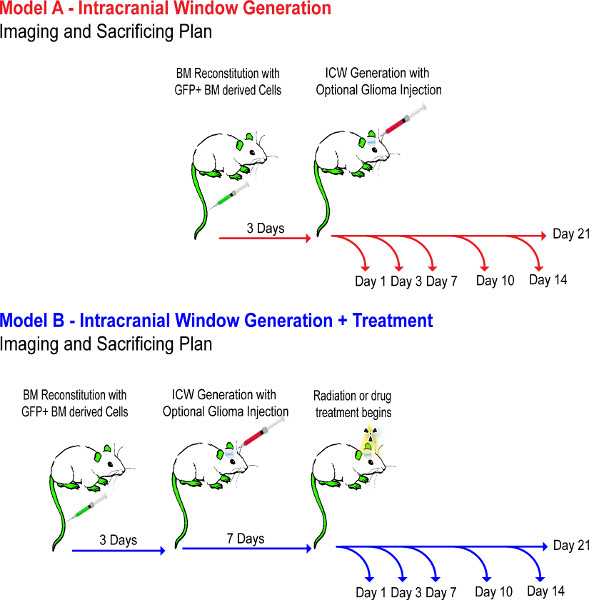
Schemata 1. Experimentelle Flussdiagramm. Dies zeigt die Chronologie der Ereignisse durch experimentelle Schritte 1-4. Mausmodelle sind Setup über eine Woche,sicherzustellen, dass das BM wiederherstellt richtig, und nicht mit Medikamenten behandelt, bis Tag 7 des Tumors auf die Tumortransplantate gewährleisten. Klicke hier, um eine größere Abbildung anzuzeigen .
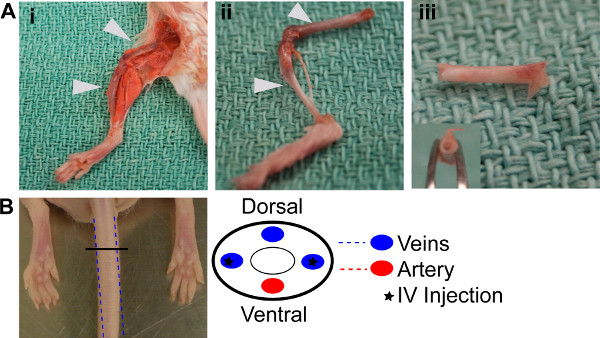
Abbildung 1. BM Reconstitution. (A) BM Extraktionsverfahren i. Präparation der hinteren Extremität Knochen. Ii. Dissected Oberschenkel und Schienbein von den Hinterbeinen, gereinigt und bereit für die Extraktion. Iii. Bones mit Endplatte entfernt und durchgespült, was die weiße Erscheinung der leeren Knochen. (B) Schemata zeigen, wo seitliche Venen für die Injektion in den Schwanz positioniert sind.
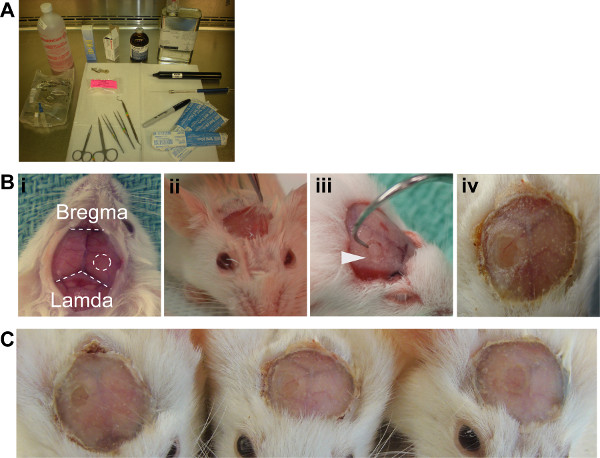
Abbildung 2. ICW Generation. (A) Aseptik Setup empfohlen (B) i. Exposed Schädel Oberfläche zeigt die Landmarken für eine Operation erforderlich, ICW sollte auf der rechten Hemisphäre gleich weit von der Bregma und Lamda positioniert werden. Ii. Periostieum hob mit Lidocain-Lösung zum Ausbau bereit . iii. Dental Haken zur Entfernung von Knochen-Fragment mit dem Bohrer erzeugten erforderlich. iv. Fertig ICW mit Dentalacryl. (C) Drei Beispiel Windows die Reproduzierbarkeit des Verfahrens zu demonstrieren.
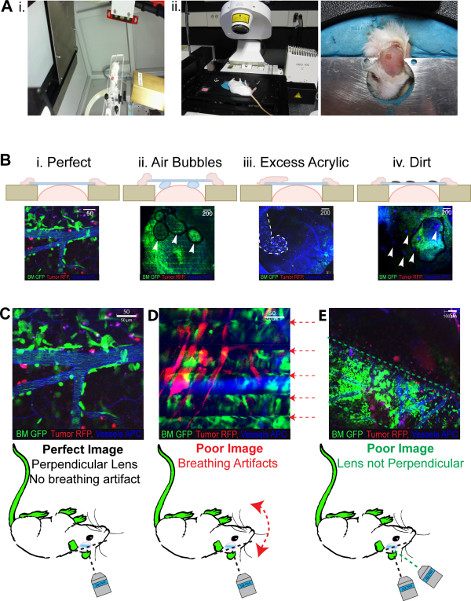
Abbildung 3. 2PLM erwarteten Ergebnisse. Alle Bilder zeigen grüne BM, rot Tumor, Blau (pseudo farbigen weit red) Gefäßsystem. (A) i. Den Kopf Rahmen, Isofluran Strömung behält in dem kleinen Tier Strahler Veranschaulicht. Die 8 x 11 mm Kollimator kann auch gesehen bewegen durch die Gantry. Ii. Mouse in die invertiert werden positioniert in der Kopf-Rahmen für die Bildgebung erforderlich, sorgt formbaren plastercine alle Fenster untergebracht werden können. (B) Demonstrative Fotos von den Ergebnissen der Probleme mit dem Fenster-Generation von i. eine optimale Fenster, ii. ein Fenster mit Luftblasen unter, iii Acryl Verschütten über dem Deckglas und iv gefangen. Schmutz auf dem Fenster selbst. (C) zeigt die Probleme, die mit bildgebenden nach erfolgreicher Generierung eines ICW i auftreten. optimale Bildgebung ii . Atmung Artefakteerstellen 'gefüttert' Bild iii. Deckglas nicht senkrecht zum Laser erzeugen eine "segmentierte" Bild. Klicken Sie hier, um eine größere Abbildung anzuzeigen .
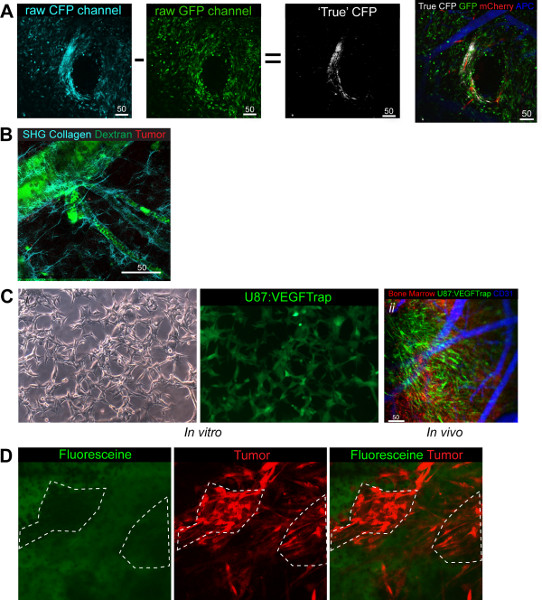
Abbildung 4. Funktionale Anwendungen und Anpassungen des Modells. (A) CFP Beitrag Bildverarbeitung wobei GFP Bild von CFP Bild, um das wahre Bild GFP, die die anderen drei Kanäle in weiß überlagert werden, offenbaren subtrahiert wird. Grüne BM, Rot Tumor, Weiß KSZ, Blau (pseudo farbigen weit red) Gefäßsystem (B) Demonstration der Kollagenfasern, die mit SHG abgebildet werden können. Grüne Dextran, rot BM, Cyan Collagen (C) i. VEGFTrap Zellen in vitro zeigen die GFP-Signal mit dem VEGFtrap. ii produziert. In-vivo-Bildgebung zeigt die VEGFtrap Zellen deutlich und zusätzlich unterstreicht die Leichtigkeit des Umschaltens Kanäle, um das System sind Sie bei uns zu demonstrieren. Grüne VEGFTRap + Tumor, Red BM, Blau (pseudo farbigen weit red) Gefäßsystem. (D) Demonstriert die Sammlung von Fluorescein in das Stroma des Tumors und nicht in den Zellen direkt, durch das Fehlen von Grün-Signal Overlay mit roter Tumor gezeigt. Grün Fluorescein, Rot Tumor. Klicke hier, um eine größere Abbildung anzuzeigen .
Diskussion
Die drei Kanäle in allen Bildern bisher beschriebenen drei Marker von Interesse in anderen Modellen und Blätter Forscher eine unschätzbare Sammlung von Tools, um eine Vielzahl von Zelltypen und Wechselwirkungen aussehen austauschbar. Planung ist erforderlich, um sicherzustellen, dass alle Markierungen und Zelltypen haben erfolgreich eine Reporterfluoreszenz Molekül in einem gesonderten Kanal integriert.
Zusätzlich zu den Standard-drei Kanäle verwendet hier waren wir auch in der Lage zu integrieren einen vierten Kanal CFP (4A) und eine SHG basierten Kollagen Kanal 7 (4B). Dadurch erhöht sich die Möglichkeit der Blick auf zelluläre Interaktionen in vivo und erlaubt zusätzlich die Benutzer verpflichten Bevölkerung Mischen auf bestimmte Zell-Zell-Interaktionen zu untersuchen unter Beibehaltung zwei Kanäle für andere Marker. Zum Beispiel haben wir bei Tumorzellen (RFP) und Krebs-Stammzellen (GFP) in einem Verhältnis von 1:3 mit einem Interesse an den Vergleich ihrer intratum sahmündliche Wechselwirkungen (Abbildung 4A). Wir beobachteten, dass 7 Tage nach der Implantation der gemischten Bevölkerung das Verhältnis gewahrt wurde und beide Zellpopulationen konnte noch gesehen werden.
Die GFP-Kanal bietet technische Probleme aufgrund der Überschneidung mit dem GFP-Kanal in beiden Anregungs-und Emissionsspektren und als solche erfordert Beitrag Bildverarbeitung, um die wahre GFP + Zellen von denen, die eigentlich GFP + definieren. Beitrag Bildverarbeitung heraus kann auf der 2-Photonen-Mikroskope in Zeiss LSM Software direkt wodurch gebaut durchgeführt werden, wird die GFP Bild von der GFP Bild was den wahren GFP Zellen hinter (4A) links abgezogen. Die Prämisse für das Verhältnis Subtraktion abhängig ist ebenso helle Bilder und ist aufgrund der GFP-Laser (458 nm) fluoreszieren sowohl GFP und GFP-Zellen, während die GFP-Laser (488 nm) ist zu hoch, um die GFP fluoresziert Zellen. Neben CFP haben wir auch in der Lage, bereits veröffentlichten Setups verwenden, um bei der SHG aussehenEbenen und so zeigen die Kollagenfasern, aus denen sich die Basalmembran umgibt Gefäßsystem (4B).
Eine weitere Anpassung dieses Modells hat den Vorteil einer speziell angefertigten Kleintier-Strahler, die die Fähigkeit zur stereotaktischen geführte Strahlung zu verwenden, um Abschnitte des Gewebes so gering wie 2 mm im Durchmesser hat bestrahlen gemacht. Durch die Ausrichtung des Fensters mit Bestrahlung ist es möglich, die Wirkung Strahlung auf das darunter liegende Gewebe zu sehen. Wir haben kürzlich eine Studie veröffentlicht, Blick auf die Wirkung Strahlung auf normalem Hirngewebe in Bezug auf die Rekrutierung von BMDCs auf das Gefäßsystem, die sich speziell an ihre Rolle beim Strahlung Gewebeveränderungen. Wir fanden, dass die Rekrutierung der BMDCs Zeit und dosisabhängig in normalem Gewebe 11 war.
Es ist möglich, die Mechanismen der Lieferung und Integration von Therapeutika Bereitstellung der Studienmedikation mit einem fluoreszierenden Marker markiert. Währendunserer Forschung ist es uns gelungen, die Produktion von VEGFTrap, ein Anti-Angiogenese-Medikament, das alle VEGF Signalisierungsblöcken im lokalen Bereich der Produktion 25 zu verfolgen. Durch gentechnisch veränderte unsere Tumorzellen, die VEGFtrap Gen mit einem IRES zu EGFP gekoppelt (Abbildung 4CI) auszudrücken und mit RFP "Spender" BM konnten wir das Bild EGFP: VEGFtrap Produktion, BMDC Interaktion und Gefäßsystem gleichzeitig (Abbildung 4Cii). Dies zeigte die Vielseitigkeit des Modells und Kanäle zur Verfügung. Es ist auch möglich, auf die Kinetik des Medikaments aufgrund der Versprechen der Single-Cell-Auflösung anschauen. Fluorescein (GFP +) wird verwendet, um Tumoren während der Operation zu beschreiben, um sicherzustellen, maximal Resektion 26 erreicht. Durch die Injektion intravenös während Bildgebung ist es möglich zu zeigen, dass die Abgrenzung NICHT erfolgt durch die aktive Aufnahme des Fluorescein in die Tumorzellen selbst, sondern durch die Sammlung des Medikaments in den Stromazellen mit time, durch den Mangel an Co-Lokalisation 10 min nach der Injektion der Fluorescein (4D) zu sehen.
Insgesamt vereint neuartige Strategie die vorhandenen Verfahren, um eine einzigartige experimentelle Plattform, die vorteilhaft bei der Untersuchung von dynamischen zellulären Interaktionen zu erreichen. Diese Strategie hat sich als eine unschätzbare Ansatz für die Prüfung hochauflösende Single-Cell-dynamischen Entwicklung BMDC, Tumor-und normalem Gehirn Durchblutung in Ansprechen auf die Therapie, intrakranial sein. Intravital Bildgebung kann zu einem besseren Verständnis der molekularen Regulatoren der BMDC Rekrutierung, Migration und Differenzierung in intrakraniellen Hirntumor Gefäßsystem sowie viele andere dynamische Prozesse anpassbar an anderen Forschungsbereichen. Hemmung putative Faktoren, BMDC in Kombination mit anderen therapeutischen Regulierung Strategien helfen die Identifikation der genaue Zeitpunkt der Kombinationstherapien. Darüber hinaus kann diese Strategie auf viele weitere pr angepasst werdenojekte Verwendung nicht nur in vivo intravital Färbung Farbstoffen, aber auch kleine molekulare Inhibitoren und Nanopartikel, die fluoreszenzmarkierten werden so dass die Forscher die Verteilung und Migration Muster von gezielten Therapeutika sowie längs Blick auf ihre Kinetik zu verfolgen.
Offenlegungen
Autoren haben nichts zu offenbaren.
Danksagungen
Wir würden gerne die Advanced Optical Microscopy Facility am der Prinzessin Margaret Krankenhaus danken, insbesondere James Jonkman für ihre Unterstützung bei der Ersteinrichtung der Kanäle auf der 2Photon Mikroskop. Die Autoren bedanken sich bei der räumlich-zeitlichen Targeting und Amplifikation von Strahlung Response (STTARR) Programm und seine verbundenen Förderorganisationen anzuerkennen. Wir danken Dr. Peter Tonge, Dr.Iacovos Michael und Dr.Andras Nagy für die Versorgung der VEGFTrap Plasmiden und für ihr Manuskript Korrekturen und Feedback. Die kontinuierliche Unterstützung und Diskussion über das Personal des BTRC ist von unschätzbarem Wert, und wir möchten Dr.Abhijit Guha für seine wissenschaftlichen Input zu gedenken. Die Arbeit wurde durch CIHR und NIH Zuschüsse finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| NODSCID mice | Jackson Lab | 001303 | 8 week old |
| B5/EGFP Mice | Jackson Lab | 003516 | |
| ACTB/DsRED mice | Jackson Lab | 005441 | |
| Tear Gel | Novartis | T296/2 | |
| 2% Lidocaine-Epinephrine | Bimeda MTC | 25SP | Use neat |
| Vetbond | 3M | 1469SB | |
| Self curing acrylic kit | Bosworth | 166260 | Use ~30% (w/v) |
| 10K MW Dextran-Alexa647 | Invitrogen | D22914 | Use @ 0.6 mg/kg in Saline |
| CD31-APC | BDPharmingen | 551262 | Use @ 0.3 mg/kg in Saline |
| AK-fluor (Fluorescein) 10% | AKORN inc. | NDC 17478-253-10 | Use @ 7.7 mg/kg in Saline |
| Betadine solution | Purdue Products | NDC 67618-150 | |
| Equipment | |||
| Fine Tweezers | VWR | 82027-402 | |
| Fine Dissection Scissors | VWR | 25870-002 | |
| 22G Needle | BD | 305156 | |
| 27G 0.5 ml TB syringe | BD | 305620 | |
| Handheld Micro-Drill | Fine Science Tools | 18000-17 | |
| 2.7 mm Trephine drillbit | Fine Science Tools | 18004-27 | |
| 10 μl 30G Hamilton syringe | Sigma Aldrich | 20909-U | |
| Glass Coverslip 3 mm | Warner Instruments | 64-0720 CS-3R | |
| Fluorescence goggles | BLS | FHS/T01 | Basic head frame |
| Stereotaxic frame | stoelting | 51950 | |
| Mouse restrainer for IV injection | Brain Tree Lifescience | MTI | |
Referenzen
- Kienast, Y. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16, 116-122 (2010).
- Holtmaat, A. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat. Protoc. 4, 1128-1144 (2009).
- Hansen-Algenstaedt, N., et al. Long-term observation reveals time-course-dependent characteristics of tumour vascularisation. Eur. J. Cancer. 41, 1073-1085 (2005).
- Kherlopian, A. R., et al. A review of imaging techniques for systems biology. BMC Systems Biology. 2, 74(2008).
- Kedrin, D. Intravital imaging of metastatic behavior through a mammary imaging window. Nature Methods. 5, 1019-1021 (2008).
- Perentes, J. Y., et al. In vivo imaging of extracellular matrix remodeling by tumor-associated fibroblasts. Nature Methods. 6, 143-145 (2009).
- Brown, E., et al. Dynamic imaging of collagen and its modulation in tumors in vivo using second-harmonic generation. Nature Medicine. 9, 796-800 (2003).
- Marker, D. F., Tremblay, M. -E., Lu, S. -M., Majewska, A. K., Gelbard, H. A. A Thin-skull Window Technique for Chronic Two-photon In vivo Imaging of Murine Microglia in Models of Neuroinflammation. J. Vis. Exp. (43), e2059(2010).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Yang, G., Pan, F., Parkhurst, C. N., Grutzendler, J., Gan, W. -B. Thinned-skull cranial window technique for long-term imaging of the cortex in live mice. Nature Protocols. 5, 201-208 (2010).
- Burrell, K., Hill, R. P., Zadeh, G. High-resolution in-vivo analysis of normal brain response to cranial irradiation. PLoS ONE. 7, e38366(2012).
- Tate, M. C., Aghi, M. K. Biology of angiogenesis and invasion in glioma. NURT. 6, 447-457 (2009).
- Aghi, M., Chiocca, E. A. Contribution of bone marrow-derived cells to blood vessels in ischemic tissues and tumors. Mol. Ther. 12, 994-1005 (2005).
- Nussenbaum, F., Herman, I. M. Tumor angiogenesis: insights and innovations. J. Oncol. 2010, 132641(2010).
- Zhang, H. -r Incorporation of endothelial progenitor cells into the neovasculature of malignant glioma xenograft. J. Neuroonco. 93, 165-174 (2009).
- Blouw, B., et al. The hypoxic response of tumors is dependent on their microenvironment. Cancer Cell. 4, 133-146 (2003).
- Du, R., et al. HIF1alpha induces the recruitment of bone marrow-derived vascular modulatory cells to regulate tumor angiogenesis and invasion. Cancer Cell. 13, 206-220 (2008).
- Rajantie, I. Adult bone marrow-derived cells recruited during angiogenesis comprise precursors for periendothelial vascular mural cells. Blood. 104, 2084-2086 (2004).
- Shin de Patil, V. R., et al. marrow-derived lin(-)c-kit(+)Sca-1+ stem cells do not contribute to vasculogenesis in Lewis lung carcinoma. Neoplasia. 7, 234-240 (2005).
- Purhonen, S. Bone marrow-derived circulating endothelial precursors do not contribute to vascular endothelium and are not needed for tumor growth. Proc. Natl. Acad. Sci. U.S.A. 105, 6620-6625 (2008).
- Aghi, M., Cohen, K. S., Klein, R. J., Scadden, D. T., Chiocca, E. A. Tumor stromal-derived factor-1 recruits vascular progenitors to mitotic neovasculature, where microenvironment influences their differentiated phenotypes. Cancer Research. 66, 9054-9064 (2006).
- Burrell, K., Zadeh, G. Molecular Mechanisms of Tumor Angiogenesis. , InTech. (2012).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Tolentino, M. J., et al. Angiography of fluoresceinated anti-vascular endothelial growth factor antibody and dextrans in experimental choroidal neovascularization. Arch. Ophthalmol. 118, 78-84 (2000).
- Holash, J. VEGF-Trap: a VEGF blocker with potent antitumor effects. Proceedings of the National Academy of Sciences of the United States of America. 99, 11393-11398 (2002).
- Shinoda, J., et al. Fluorescence-guided resection of glioblastoma multiforme by using high-dose fluorescein sodium. , 1-7 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten