Method Article
قوية FISH DNA 3D استخدام مجسات إعتبر مباشرة
In This Article
Summary
نحن تصف بروتوكول قوية وتنوعا لتحليل العمارة النووي DNA من قبل الأسماك 3D باستخدام تحقيقات الفلورسنت صفت مباشرة.
Abstract
أصبح FISH DNA 3D أداة رئيسية لتحليل منظمة ثلاثي الأبعاد للنواة، ونشرت العديد من الاختلافات من هذه التقنية. في هذه المادة ونحن تصف البروتوكول الذي تم الأمثل لمتانة، استنساخ، وسهولة الاستخدام. يتم إنشاؤها الزاهية الفلورسنت تحقيقات صفت مباشرة من قبل نيك الترجمة مع الأميني allyldUTP تليها اقتران الكيميائية للصبغ. يتم تنفيذ 3D FISH الحمض النووي باستخدام خطوة تجميد أذاب لpermeabilization الخلية وخطوة التسخين لتمسخ في وقت واحد من التحقيق والدنا النووي. البروتوكول ينطبق على مجموعة واسعة من أنواع الخلايا ومجموعة متنوعة من المسابير (تسلسل كروموسوم البكتيريا الصناعي، البلازميدات، fosmids، أو دهانات كروموسوم الجامعة) ويسمح للتصوير الآلي عالية الإنتاجية. مع هذا الأسلوب بشكل روتيني ونحن التحقيق في توطين النووية لمدة تصل إلى ثلاث مناطق الكروموسومات.
Introduction
الحمض النووي مضان التهجين في الموضع (FISH DNA) يسمح التصور ثلاثي الأبعاد من مواضع الجينات الفردية، المجالات subchromosomal والكروموسومات حتى بأكمله خلال جميع مراحل دورة الخلية. يستخدم FISH 2D للدراسات الطورية بينما السمك 3D وقد استخدم على نطاق واسع للتحقيق في العلاقة بين التنظيم المكاني للجينوم وظيفتها أثناء الطور البيني (1،2 والمراجع فيه). تاريخيا، تم إجراء دراسات المشارك جمعية عن طريق التحقيق في عشرات ومئات من مواضع الفردية من قبل الأسماك. وقد وضعت أكثر قوة في الآونة الأخيرة تقنيات عالية الإنتاجية المستندة إلى 3C مثل 4C ومرحبا-C 3، مما يسمح التحقيق في الجزيئية عبر الحديث بين عدة آلاف من مواضع مختلفة. في حين التقنيات المعتمدة على 3C والأسماك الحمض النووي يمكن أن تكون أساليب تكميلية، فإنها لا تجيب بالضرورة نفس الأسئلة. على أساس أساليب 3C توفير قراءات الفرقة من السكان الخلية المختلطة، مما أدى إلى probabilإيتي لمشاركتها في الجمعيات. في المقابل، في حين انخفاض في الإنتاجية، التقنيات المعتمدة FISH توفر إمكانية لتحليل الترتيبات المكانية من مواضع أو الكروموسومات في الخلايا الفردية وفقا لنمو أو خلية مراحل دورتهن. وبالتالي، سوف FISH الاستمرار في أن تكون أداة هامة لبحث العلاقات هيكل الوظائف النووية.
هناك نوعان من الاعتبارات الرئيسية في أداء ناجح التجارب السمك 3D. هذه هي: 1. الحصول على تحقيقات المسمى على النحو الأمثل و2. اختيار العلاجات الخلوية، بما في ذلك التثبيت، وقبل خطوات ما بعد التهجين، للحفاظ على مورفولوجيا النووية قدر الإمكان في حين جعل الحمض النووي يمكن الوصول إليها بما فيه الكفاية لتهجين التحقيق. وضع العلامات التحقيق كفاءة من المهم للغاية بالنسبة للأسماك. تقليديا، وقد استخدمت نيك الترجمة لعرض إما ناشبة أو النيوكليوتيدات fluorophore مترافق 4. وبالمثل، هي مجموعات نيك الترجمة التجارية المتاحة للناشبة مباشرة أو دمج fluorophore، بور أيضا لوضع العلامات على مرحلتين باستخدام النيوكليوتيدات aminoallyl والأصباغ أمين التفاعلي. وهذا الأخير يجعل التأسيس صبغ أكثر كفاءة من خلال إعطاء البلمرة DNA جزيء أقل حجما للعمل مع. وفي الآونة الأخيرة، تم تطوير مجموعات لوضع العلامات غير الأنزيمية من الحمض النووي التي تستغل ملزم التنسيقية للالبلاتين إلى الأحماض النووية. يمكن حتى تحقيقات FISH شراؤها صفت بالفعل 5. بينما مجموعات وتحقيقات تصنيعها تجاريا لا شك يعطي سهولة الاستخدام، فهي أكثر تكلفة بكثير من شراء المكونات الفردية وإنتاج تحقيقات في المنزل. نحن الأمثل بروتوكول ترجمة نيك منخفضة التكلفة من أجل تسمية مباشرة العديد من تحقيقات BAC مختلفة في ألوان متعددة. اكتشفنا أن الحصول نقية للغاية DNA BAC أمر بالغ الأهمية والنتائج في اشتراط فقط 10-20 نانوغرام من مسبار لكل شريحة FISH، مقارنة ب 10 - 20 أضعاف أكثر عند استخدام نجس الحمض النووي القالب، مما أدى إلى كبرى من حيث التكلفة والوقت الادخار. استخدام الأميني allyldUTP يسمح وضع العلامات مرنة منتحقيقات مع الأصباغ المتاحة أمين التفاعلي (مثل اليكسا فلور أو قبرصي، صبغ) أو الأنواع ل(مثل البيوتين، digoxigenin). تم الكشف عن تحقيقات ناشبة المسمى من قبل الأجسام المضادة، مترافق fluorophore أو streptavidin لتضخيم وتصور إشارة. مشرق تحقيقات صفت مباشرة تظهر عادة أقل تلوين الخلفية وتجنب الإفراط في تضخيم الإشارات، وبالتالي يؤدي إلى تمثيل أكثر دقة للتوطين النووية والتشكل مكان.
هناك العديد من التقنيات الأسماك المختلفة التي تستخدم مثبتات مختلفة، ما قبل العلاج، ويغسل بعد التهجين ولكن هذه تندرج عموما في الفئات التالية: تثبيت غلوتارالدهيد مع هيدروكسيد الصوديوم تمسخ، تثبيت الفورمالديهايد مع حمض الهيدروكلوريك تمسخ، وتثبيت الفورمالديهايد مع تمسخ حرارة 6-9 . كل من هذه مزاياه وعيوبه. النتائج تثبيت غلوتارالدهيد في المحافظة جيدة الهيكلية النووية، ولكنها تتطلب العلاج مع عوامل الاختزال إلى تقليلتألق ذاتي الناتجة عن ذلك، والعلاج هيدروكسيد الصوديوم يحتاج إلى أن تسيطر عليها بعناية لتحقيق التوازن تمسخ الحمض النووي كافية والأضرار المحتملة لهيكل النووية 6. تثبيت الفورمالديهايد هو أقل قوة، وهو ما يعطي احتمال زيادة الاضطرابات العمارة النووية، ولكن أيضا عادة إشارات أقوى وأكثر موثوقية وأقل تألق ذاتي 9. حمض الهيدروكلوريك العلاج depurinates الحمض النووي والبروتينات من الشرائط، وتوفير سهولة الوصول إلى الحمض النووي للتحقيقات، ولكن قد يعرض أيضا فواصل الحمض النووي. التدفئة يفصل جسديا حمض النووي، الذي أسفر عن هدف جيد التهجين وإشارات قوية ولكن يمكن أن يسبب بعض الاضطراب من هيكل النووية 8. الدرجة التي كل من هذه التقنيات تؤثر الحواتم بروتين تختلف على نطاق واسع 6،9، مما أدى إلى الشرط لتحديد تجريبيا لكل بروتين بروتوكول الأمثل لاستخدامها في التجارب المناعية FISH.
في حين ليس هناك 'الكمال' الحمض النووي FISH الشركة المصرية للاتصالاتchnique، أنها يمكن أن تكون مفيدة إذا كل تسيطر عليها بشكل جيد. كان هدفنا لتحسين بروتوكول للقوة واستنساخه FISH الحمض النووي للتحقيق لتحديد المواقع المكانية للمواضع متعددة في مجموعة متنوعة من أنواع الخلايا 10، مع التركيز على طريقة التدفئة بالنسبة لمعظم إشارات موثوقة. مع هذا، واستخدام نظام التصوير الآلي نحن تهدف إلى زيادة الإنتاجية للتحليل خلية واحدة من الترتيبات النووية.
Protocol
1. توليد مجسات DNA إعتبر مباشرة من قبل نيك الترجمة
ملاحظة: تحقيقات صفت مباشرة مصنوعة من تسلسل كروموسوم البكتيريا الصناعي (100-250 KB) تنتج باستمرار إشارات مشرق. إذا كانت هناك حاجة تحقيقات أصغر، استخدم fosmids (40-50 KB) أو حتى البلازميدات تحتوي على 5-10 إدراج كيلو بايت. تحديد BAC أو استنساخ fosmid المقابلة لجينات محددة باستخدام فرقة أو متصفحات الجينوم UCSC. إعداد جودة عالية BAC الحمض النووي عن طريق هطول الأمطار المتكرر أو استخدام مجموعات المتاحة تجاريا. أقل ملوثة إعداد مع الحمض النووي الجيني البكتيري، يطلب من أقل مسبار لكل شريحة. أداء وصفها في خطوتين: نيك ترجمة إدخال aminoallyl-dUTP واقتران الكيميائية لصبغ أمين التفاعلي.
1.1. نيك الترجمة
خلال نيك ترجمة، يتم استخدام الدناز الأول لإنشاء فواصل حبلا واحدة. البلمرة DNA أنا يستطيل 'طرفي هذه' النكات 3 '، لتحل محل النيوكليوتيدات الموجودة بأخرى جديدة، ر بموجب هذه الوثيقة 'ترجمة' ونيك وبالتالي توفير الفرصة لدمج النيوكليوتيدات المسمى. يتم اختيار Aminoallyl-dUTP بسبب إدماج كفاءة من خلال البلمرة DNA الأول وقدرته على اقتران الكيميائية في وقت لاحق إلى الأصباغ أمين التفاعلي أو الأنواع ل. فمن الأهمية بمكان لتحقيق التوازن الصحيح بين الدناز أنا الخدش والحمض النووي بوليميريز أنا الترجمة؛ سوف الدناز كثيرا أنا يؤدي إلى الإفراط في الهضم الحمض النووي إعطاء العائد المنخفض وأحجام جزء قصير، أيضا سوف القليل لا تنتج ما يكفي من النكات لالبلمرة لبدء الترجمة، إعطاء حجم شظية كبيرة والفقراء إدماج aminoallyl-dUTP. بروتوكول التالية يعمل بشكل جيد ولكن قد يكون من الضروري أن يعاير الدناز أنا من دفعات مختلفة أو شركات مختلفة.
- إعداد وصفها رد فعل على الجليد واحتضان لمدة 2 ساعة على 16 درجة مئوية. هذا يجب أن ينتج 0.5-1 ميكروغرام نيك المترجمة الحمض النووي ويمكن زيادتها. تمييع الدناز أنا في 01:30 الدناز أنا العازلة (أي 0.3 U / ميكرولتر).
- تشغيل 1 ميكرولتر على 2٪ الاغاروز هلام للتحقق من حجم شظايا المسمى. أثناء تشغيل هلام، والحفاظ على رد فعل على الجليد. ناجح نيك translatiعلى سيؤدي إلى تشويه مع الجزء الأكبر من شظايا تشغيل ما بين 150 و 700 شركة بريتيش بتروليوم BP مع بعض الشظايا الكبيرة في ~ 1 كيلو بايت (STEP الحرجة: انظر نتائج الممثل). إذا لزم الأمر، إضافة 1 ميكرولتر آخر من جديد 01:30 الدناز أنا التخفيف واحتضان عند 16 درجة مئوية لمدة 15-30 دقيقة. سوف تختلف فترة حضانة وفقا لكمية ونوعية BAC الحمض النووي.
- تعطيل الدناز أنا عن طريق التسخين إلى 75 درجة مئوية لمدة 10 دقيقة.
- تنظيف DNA أمين وراثيا باستخدام طقم تنقية PCR. أزل في 100 ميكرولتر H 2 O.
- الإيثانول يعجل الحمض النووي عن طريق إضافة 10 ميكرولتر 3 M NaOAc (الرقم الهيدروجيني 5.2) و 275 ميكرولتر الإيثانول. ترك في -20 درجة مئوية لمدة 1 ساعة على الأقل أو طوال الليل. تدور في أقصى سرعة لمدة 30 دقيقة في 4 درجات مئوية. غسل بيليه مع 500 ميكرولتر الإيثانول 70٪ والسماح للهواء الجاف. هذه الخطوة يزيل الأمينات التتبع التي سوف تتداخل مع رد فعل التوسيم. بيليه resuspend في 6 ميكرولتر H 2 O في 1X رد الفعل الأولي.
- استخدم 1 ميكرولتر إلى تحديد تركيز الحمض النووي أمين المعدلةبواسطة التحليل الطيفي للأشعة فوق البنفسجية microvolume.
1.2. اقتران من صبغة الفلورسنت
ويتحقق الفلورسنت وصفها من لجنة التحقيق من قبل اقتران الكيميائية للصبغ. اليكسا فلور succinimidyl الأصباغ استر تتفاعل مع الأمينات من الحمض النووي الأميني allyldUTP تعديل لتشكيل الرابطة التساهمية، وبالتالي إنتاج تحقيقات صفت مباشرة. اليكسا فلور 488، 555، 647 والأصباغ كانت ناجحة لهذه العملية.
- ضبط 4 ميكروغرام من الحمض النووي الأميني الآليل المعدلة إلى حجم 5 ميكرولتر، والحرارة إلى 95 درجة مئوية لمدة 5 دقائق، المفاجئة بارد على الجليد، وإضافة 3 ميكرولتر من 0.2 M NaHCO 3.
- حل قسامة واحدة من صبغ رد الفعل أمين في 2 DMSO اللامائية ميكرولتر في درجة حرارة الغرفة. إضافة 8 ميكرولتر الحمض النووي مع تعديل NaHCO 3، دوامة، نبض تدور ويحضن في درجة حرارة الغرفة في الظلام لمدة 1 ساعة.
ملاحظة: الأصباغ على رد الفعل أمين يمكن استخدامها لتسمية التحقيق أكثر من واحد على أساس مخطط التالية. منذ سيستخدم نلي 10-20 نانوغرام من التحقيق في وضع العلامات الشريحة، 1 ميكروغرام يعطي ما يكفي من دقق في 50-100 الشرائح. ومن الممكن أيضا لتخزين الحمض النووي أمين المعدلة للتفاعلات وضع العلامات المستقبل في -20 درجة مئوية.
| كمية الحمض النووي | حجم الحمض النووي | 0.2 M NaHCO 3 | حجم صبغ | مجموع | يكفي لل |
| 4 × 1 ميكروغرام | 1.25 ميكرولتر كل | 0.75 ميكرولتر كل | 0.5 ميكرولتر كل | 2.5 ميكرولتر (1/4) | 50-100 الشرائح كل |
| 3 × 1.35 ميكروغرام | 1.67 ميكرولتر كل | 1 ميكرولتر كل | 0.67 ميكرولتر كل | 3.34 ميكرولتر (1/3) | 65-130 شريحة كل |
| 2 × 2 ميكروغرام | 2.5 ميكرولتر كل | 1.5 ميكرولتر كل | 1 ميكرولتر كل | 5 ميكرولتر (1/2) | 100-200كل الشرائح |
| 1 × 4 ميكروغرام | 5 ميكرولتر | 3 ميكرولتر | 2 ميكرولتر | 10 ميكرولتر (كاملة) | 200-400 الشرائح |
- إضافة 90 ميكرولتر H 2 O وتنقية المسبار المسمى باستخدام طقم تنقية PCR. أزل في 100 ميكرولتر 10 mMTris-CL (الرقم الهيدروجيني 8.5).
- تحديد تركيز التحقيق وكفاءة وضع العلامات من قبل microvolume الطيفي الطيف الكامل (انظر الشكل 2) باستخدام المعادلات بير لامبرت (وأعطيت تعليمات في ورقة البيانات المصاحبة للفلور اليكسا الأصباغ على رد الفعل أو يمكن العثور عليها على الانترنت). تحقيقات التي تحتوي على الأصباغ 3-6 لكل 100 BP تعمل بشكل جيد. تحقيقات مع انخفاض درجة التأسيس قد تعطي إشارات FISH ضعيفة. بدلا من ذلك، تشغيل 5 ميكرولتر على 2٪ الاغاروز هلام دون الحمض النووي وصمة عار والتحقق من إدراج صبغة الفلورسنت باستخدام phosphoimager. أضف وصمة عار الجل مع بروميد إيثيديوم أو بدائل تلطيخ DNA ومقارنة الحمض النووي المسمى DNA إلى مجموع.
عبر الخطوات التالية، يتم إصلاح الخلايا التي تهم الشرائح وpermeabilized. ثم يتم التشويه والتحريف DNA الخلوية وصفت تحقيقات مباشرة معا على طبق ساخن وتهجين بين عشية وضحاها في غرفة ترطيب ضوء محكم.
2.1. يوم 1
- مسبار الهطول
ملاحظة: تحقيقات يعجل في مرحلة ما خلال اليوم 1. وهذا يمكن أن يؤديها بشكل مريح بالتوازي مع علاج الخلايا وليس من الضروري أن يتم ذلك في بداية اليوم.- مزيج 10-20 نانوغرام المسبار المسمى مباشرة، 6 ميكرولتر C 0 T-1 الحمض النووي (6 ميكروغرام)، 1 ميكرولتر الحمض النووي الذين تقطعت بهم السبل واحدة من الخصيتين سمك السلمون (9.7 ميكروغرام) وضبط مستوى الصوت إلى 100 ميكرولتر مع الماء.
- إضافة 10 ميكرولتر 3 M NaOAc و 275 ETOH ميكرولتر، ومزيج قبل vortexing. يعجل لا يقل عن 1 ساعة عند درجة حرارة -20 درجة مئوية.
- تدور في microfuge في أقصى سرعة لمدة 30 دقيقة في 4 درجات مئوية. غسل بيليه مع 70٪ ETOH وتدور مرة أخرى. الجافة بيليهو resuspend في 5 الفورماميد منزوع الأيونات ميكرولتر. Resuspend لمدة 30 دقيقة عند 37 درجة مئوية في حين تهتز في 1000 دورة في الدقيقة محمية من الضوء (مكان احباط خلال thermomixer).
- إضافة 5 ميكرولتر من ديكستران كبريتات المزيج ويهز لمدة 10 دقيقة إضافية عند 37 ° C المحمية مرة أخرى عن الضوء. ماصة صعودا وهبوطا قبل pipetting لعلى ساترة.
ملاحظة: للحصول على اللوحة كروموسوم جنبا إلى جنب مع تحقيقات BAC، كلها تحقيقات اللوحة كروموسوم الذي يتم توفيره في جاهزة للاستخدام مزيج التهجين هي خيار مناسب. Resuspend عجلت BAC التحقيق (مع C 0 T1 الحمض النووي والحمض النووي الذين تقطعت بهم السبل واحدة من الخصيتين سمك السلمون) في كروموسوم 10 ميكرولتر مزيج الطلاء من قبل pipetting صعودا وهبوطا. احتضان عند 37 درجة مئوية في حين تهتز في 300-500 دورة في الدقيقة لمدة 10 دقيقة. استخدام 10 ميكرولتر من الطلاء كروموسوم / BAC التحقيق المزيج في بقعة.
- ربط الخلايا على الشرائح
ملاحظة: الميل الخلايا التمسك الشرائح بشكل كبير مع نوع من الخلايا. لكل نوع من الخلايا، وتحديدالأمثل تسوية الوقت وكثافة الخلايا تجريبيا. لنتائج متسقة، وينبغي أن تكون الخلايا في تعليق خلية واحدة.
لسهولة دائرة استخدام المنطقة الخلايا سيتم رصدت على بالقلم مسعور، على الرغم من الخلايا معلق في برنامج تلفزيوني هذا ليس ضروريا تماما. A حاجز مسعور يمنع تعليق من الانتشار على الشريحة، وتبقي ما يصل إلى ثلاث عينات لكل شريحة فصل جيد ويسمح لاستخدام كميات صغيرة جدا من محلول الأجسام المضادة المناعية في FISH. أيضا، يمكن أن تظل في منطقة اكتشاف إلى الحد الأدنى إذا أرقام الخلية منخفضة. - الماوس خلايا الكبد الجنين
- جمع كل E13.5 الماوس كبد الجنين في ما يقرب من 1.5 مل من برنامج تلفزيوني و resuspend من قبل pipetting صعودا وهبوطا. تدور في microfuge في 3،000 دورة في الدقيقة لمدة 2 دقيقة. كرر يغسل ثلاث مرات. في غسل الماضي، وخلايا سلالة من خلال غربال ميكرون 70. Resuspend الخلايا من الكبد واحد في 160 ميكرولتر PBS واستخدام 50 μ لكل بقعة. ترك الخلايا ليستقر لمدة 2 دقيقة في درجة حرارة الغرفة.
- M[أوس] خلايا ES
1. سوف خلايا ES الماوس لا عصا بسهولة إلى الشريحة. على شريحة، دائرة منطقة سيتم رصدت الخلايا على بالقلم مسعور. إعداد تعليق من 20،000-50،000 الخلايا لكل ميكرولتر 80-100 في مستنبت طبيعي، ماصة في دائرة وتترك لنعلق لحوالي 3 ساعة في ترطيب حاضنة ملاحظة: بدلا من ذلك، يمكن تربيتها خلايا ES على الشرائح، ولكن ستشكل ثم المستعمرات التي قد تعيق التصوير الآلي. - خلايا ثابتة
1. بعض التجارب تتطلب استخدام الخلايا الثابتة التي لا نعلق على الشرائح من قبل أنفسهم. الغزل لطيف في 300 دورة في الدقيقة لمدة 3 دقائق باستخدام cytocentrifuge يحافظ على بنية ثلاثية الأبعاد للخلايا ويضمن أن الخلايا لا تسقط.
| نوع من الخلايا | تعليق في | تسوية وقت | تعليق |
| فأركبد الجنين | برنامج تلفزيوني | 2 دقيقة | على مقاعد البدلاء |
| الماوس ES | DMEM مع ملاحق | 4 الموارد البشرية | 37 درجة مئوية في حاضنة مرطب |
| الخلايا الليمفاوية الماوس | برنامج تلفزيوني | 2 دقيقة | على مقاعد البدلاء |
| الماوس P20 الخلايا الجرثومية | الإصلاح في حل | Cytospin | على مقاعد البدلاء |
- لإصلاح الخلايا، بلطف الشريحة يغرق في PFA 4٪ (تنبيه: أداء في غطاء الدخان) لمدة 10 دقيقة. إصلاح الخلايا مع الشريحة شقة في صينية للحصول على أفضل الاحتفاظ الخلايا (على سبيل المثال 50 مل PFA 4٪ في غطاء مربع TIP) ملاحظة: لا تنطبق هذه الخطوة على خلايا ثابتة قبل التعلق الشرائح.
لجميع الخطوات اللاحقة، استخدم 50 مل أو 100 مل الجرار Coplin. والحرص على عدم كشط الخلايا قبالة عندما تتحرك الشرائح بين الجرار.
- إخماد في 0.1 M تريس-Cلتر، ودرجة الحموضة 7.4 لمدة 10 دقيقة في RT.
- Permeabilize الخلايا في 0.1٪ saponin/0.1٪ تريتون X-100 في برنامج تلفزيوني لمدة 10 دقيقة في RT.
- يغسل مرتين في برنامج تلفزيوني لمدة 5 دقائق على RT.
- احتضان لمدة 20 دقيقة على الأقل في 20٪ الجلسرين / برنامج تلفزيوني في RT ملاحظة: عند هذه النقطة، يمكن تخزين الشرائح في 50٪ الجلسرين / PBS في -20 درجة مئوية لمدة عدة أسابيع على الأقل. وقد لوحظ أن تخزين ما لا يقل عن النتائج يوم في زيادة في قوة الإشارة 9. إعادة تقويم في درجة حرارة الغرفة 20٪ الجلسرين / PBS قبل الشروع ملاحظة: هذه نقطة مريحة لبدء عجل تحقيقات (انظر 2.1.1).
- 3X تجميد / الذوبان في النيتروجين السائل. يغرق شريحة واحدة في وقت واحد في النيتروجين السائل باستخدام ديوار الصغيرة. الانسحاب بعد بضع ثوان، وصوت فرقعة مميزة، ومكان على منشفة ورقية لتذويب. انتظر الجلسرين المجمدة مبهمة لتختفي ثم تجمد مرة أخرى. ما يصل الى 15 الشرائح ويمكن أن يتم بشكل مريح في تناوب لمدة ثلاث دورات تجميد / الذوبان.
- Wالرماد مرتين في برنامج تلفزيوني لمدة 5 دقائق على RT.
- احتضان في 0.1 M حمض الهيدروكلوريك لمدة 30 دقيقة في RT.
- يغسل في برنامج تلفزيوني لمدة 5 دقائق على RT.
- Permeabilize في 0.5٪ saponin/0.5٪ X-100/PBS تريتون لمدة 30 دقيقة في RT.
- يغسل مرتين في برنامج تلفزيوني لمدة 5 دقائق على RT.
- تتوازن في 50٪ formamide/2x SSC لا يقل عن 10 دقيقة في RT.
- ماصة التحقيق على ساترة. إزالة الشريحة من الجرة وتجفيف قبالة أي السائل الزائد حول بقعة الخلية (s) مع منشفة ورقية. كما أن يجف الفورماميد بسرعة، والحرص على عدم تجف الخلايا. للشرائح مع اثنين أو ثلاثة اماكن الخلية، وتطبيق 10 ميكرولتر من التحقيق في بقعة الصعود إلى 22 ملم × 50 ملم ساترة المقابلة لبقعة موقع على الشريحة. عكس ساترة على الشريحة أكثر من بقعة (ق). ختم مع الاسمنت والمطاط ونسمح لهذا أن يجف تماما. حماية من الضوء في جميع المراحل اللاحقة.
- الشرائح الحرارة إلى 78 درجة مئوية لمدة 2 دقيقة على وجه التحديد على طبق ساخن (مثل كتلة التدفئة مقلوب، خطوة حاسمة: انظر المناقشة). ضع الغطاء (صندوق من الورق المقوى أو SIM ILAR) على صفيحة ساخنة للحماية من الضوء خلال تمسخ.
- احتضان بين عشية وضحاها في 37 درجة مئوية في غرفة ترطيب ضوء محكم. لترطيب، وضع المناشف الورقية في ضوء مربع محكم وتخفيف بالماء.
2.2 يوم 2
- إعداد الجرار Coplin مع الحلول في درجة الحرارة الصحيحة لغسل الخطوات اللاحقة. حماية الشرائح من الضوء قدر الإمكان خلال جميع الخطوات اللاحقة. A القهوة يمكن أن يجعل تغطية جيدة ضوء محكم لالجرار Coplin.
- تقشر الاسمنت والمطاط ومكان الشريحة في 2X SSC حتى coverslips على تخفيف والانزلاق بعيدا.
- يغسل في 50٪ formamide/2x SSC لمدة 15 دقيقة عند 45 درجة مئوية. مكان غطاء على بالحمام المائي للحماية من ضوء.
- يغسل في SSC 0.2x لمدة 15 دقيقة عند 63 درجة مئوية.
- يغسل في 2X SSC لمدة 5 دقائق عند 45 درجة مئوية.
- يغسل في 2X SSC لمدة 5 دقائق على RT.
- يغسل في برنامج تلفزيوني لمدة 5 دقائق على RT.
- وصمة عار مع دابي (5 ميكروغرام / مل في 2X SSC) لمدة 2 دقيقة في جرة Coplin في RT.
- يزيل اللون في برنامج تلفزيوني لمدة 5 دقائق على RT.
- لتحميل ساترة، ماصة تصاعد المتوسطة على ساترة. استخدام 10 ميكرولتر لكل بقعة الخلية، وذلك باستخدام 22 مم × 22 مم coverslips على لبقعة واحدة، و 22 ملم × 50 ملم coverslips على ل02:58 البقع. تجف قبالة PBS حول بقعة الخلية إلى أقصى حد ممكن ولكن الحرص على عدم تجفيف الخلايا. عكس ساترة على الشريحة، وختم مع طلاء الأظافر.
النتائج
بروتوكول الموصوفة هنا (الشكل 1 لمحة عامة) وقد استخدمت لتأثير كبير على الجمع بين الحمض النووي FISH مع الإنتاجية العالية التقاط الصور للتحليل من منظمة الجينوم. الجيل تحقيقات نوعية جيدة أمر بالغ الأهمية لنجاح (انظر المناقشة). الشكل 2 يوضح اثنين من ضوابط الجودة مهمة لتحقيقات FISH. بعد نيك الترجمة، يجب أن مسحة من الحمض النووي تكون واضحة مع الجزء الأكبر من شظايا تشغيل ما بين 150 و 700 سنة مضت (الشكل 2A). بعد اقتران الكيميائية، إدماج صبغة الفلورسنت يمكن قياسه من خلال التحليل الطيفي لجنة التحقيق (الشكل 2B).
عند استخدام تحقيقات جيدة، بعد بروتوكول FISH DNA عادة ما ينتج في إشارات FISH DNA مشرق على خلفية منخفضة. وقد استخدمنا بنجاح هذا البروتوكول على مجموعة متنوعة من أنواع مختلفة من الخلايا، وإما مع المجاهر برنامج التحصين الموسع ومضان أو متحد البؤر. التصوير الآلي باستخدام برنامج التحصين الموسع-fluorescenc ه المجهر يتطلب، إشارات FISH يسهل التعرف عليها حاد مع الخلفية قليلا (الشكل 3)، في حين أن الفحص المجهري متحد البؤر يتطلب إشارات أكثر كثافة. الشكل 4A يظهر ممثل الصور ومعالجتها. ويمكن الحصول على إحداثيات النووية من إشارات FISH، والعلاقات المكانية من مناطق الجينوم يمكن حسابها (للحصول على مثال انظر الشكل 4B). وقد استخدمنا أيضا مداخن صورة تم الحصول عليها عن طريق الفحص المجهري متحد البؤر ل 3D النمذجة من إشارات FISH داخل الأراضي كروموسوم الخاصة بهم (فيلم 1).
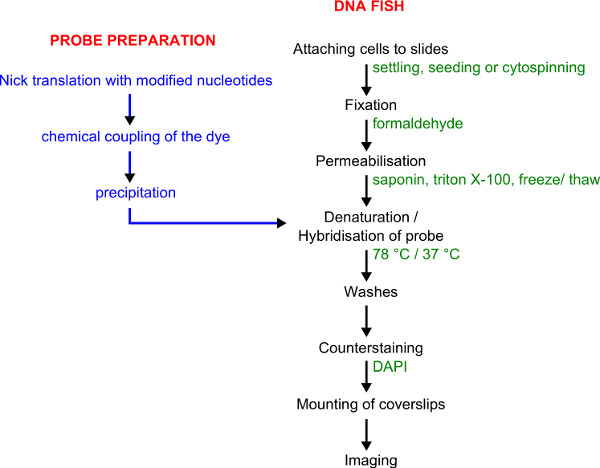
الشكل 1. ويبين سير العمل لوضع العلامات التحقيق والأسماك الحمض النووي. إعداد دقق في الزرقاء. ويرد الإجراء FISH DNA باللون الأسود مع التفاصيل الواردة في اللون الأخضر.
= "دائما"> 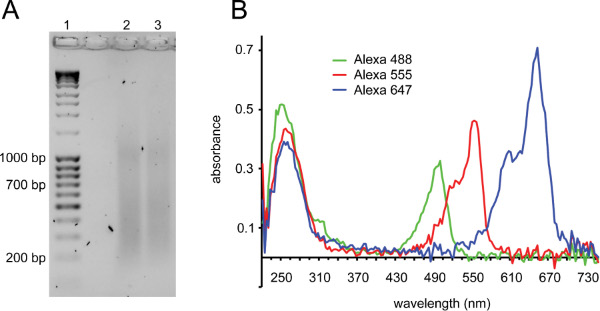
الشكل 2. وضع العلامات تحقيقات من قبل نيك الترجمة ومراقبة الجودة من تحقيقات المسمى. A) جل تظهر مسحة مثالية قبل التسخين لتعطيل الدناز الأول (حارة 1: سلم الحمض النووي، لين 2 و 3: تسلسل كروموسوم البكتيريا الصناعي بعد نيك الترجمة). يجب أن تكون شظايا في BP مجموعة 150-700. كثيرا ما لوحظ حدوث تشويه إضافية في ~ 1 كيلو بايت مع ردود الفعل نيك الترجمة الناجحة. B) Microvolume تحليل الطيف الكامل للتحقيقات المسمى. ويلاحظ وجود ذروة الحمض النووي في 260 نانومتر مع ذروة الثانية المقابلة لطول الموجة الامتصاصية من fluorophore هو المسمى التحقيق مع: اليكسا فلور 488: 495 نانومتر، اليكسا فلور 555: 555 نانومتر، اليكسا فلور 647: 650 نانومتر. المعروضة هي ثلاثة تحقيقات مع إدماج جيدة: قمم الامتصاصية fluorophore هي ارتفاع مماثل أو أعلى من القمم الحمض النووي. اليكسا فلور 647 لديه عادة أعلى الامتصاصيةمن اليكسا فلور 555، والتي بدورها لديها الامتصاصية أعلى من فلور اليكسا 488. اليكسا فلور 488 أيضا يمتص بعض الضوء في 260 نانومتر، ومن هنا جاءت الذروة الأولى لهذا التحقيق هو أعلى من الآخرين. تحقيقات مع الفقراء إدراج عرض fluorophore الامتصاصية 2-3 أضعاف أقل من امتصاص الحمض النووي. تحقيقات مع أكثر من ذروة fluorophore أعلى 2 أضعاف من ذروة DNA تحتوي عادة صبغ اللامقترن التي قد تسبب الخلفية في الأسماك.
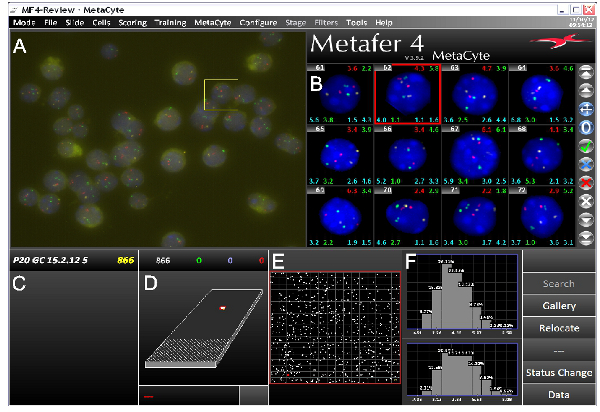
الشكل (3). لقطة شاشة من برنامج التصوير السمك 3D MetaCyte تظهر تجربة FISH ثلاثة ألوان نموذجية. وتنقسم الشاشة إلى عدة أجزاء. A) حقل من رأي (فوف) الصورة الخام التي تلتقطها Metafer / MetaCyte نظام مسح الشريحة. B) معرض من الصور التي تم تحديدها من نوى أن يكون للأمم المتحدة dergone معالجة الصور وتجزئة للإشارات FISH. يمكن عرض أنواع مختلفة من البيانات على كل صورة معرض. في هذا المثال عدد الخلايا يظهر أعلى يسار مع مختلف والمسافات بين الألائل interlocus اليمنى العليا وعلى جانبي أسفل كل صورة. C) اسم الشرائح مع عدد من النوى التي تم تحديدها في التحليل. D) تصوير من الشريحة مع المنطقة الممسوحة ضوئيا من قبل نظام. E) توسيع المنطقة الممسوحة ضوئيا. بقع بيضاء تمثل نواة المحددة في مجال الرؤية. F) البيانات التي تتم معالجتها. في هذا المثال يتم عرض المسافات بين الألائل القصوى بين الإشارات الخضراء (أعلى) والإشارات الحمراء (القاع). البيانات المعروضة من P20 الخلايا الجرثومية الماوس. وتقع على الكروموسومات تحقيقات مختلفة، وتغطي سداسي البروم ثنائي الفينيل والجينات HBA وكتلة هيستون. انقر هنا لعرض أكبر شخصية .
. ضمن الصفحات = "دائما"> 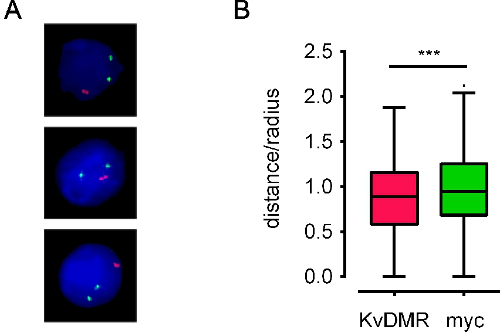
الشكل 4. أمثلة من الصور المجهزة والبيانات الموضعية مشتقة. A صور) المجهزة للE13.5 الماوس خلايا الكبد الجنين ملطخة تحقيقات BAC تقع على الكروموسومات المختلفة التي تغطي MYC وKcnq1 الجينات (وهو ما يسمى MYC وKvDMR، الملونة الخضراء والحمراء، على التوالي). B) توكي المؤامرات مربع ضئيلة للغاية تمثل المسافة بين الألائل توزيع لنفس مواضع في 600 نواة. يتم رسم مسافة بين الألائل ككسر من نصف قطر نواة '(المسافة / دائرة نصف قطرها) لحساب التغيرات في حجم النووية. ES نوى الخلايا لديها دائرة نصف قطرها حوالي 5 ميكرون. تحقيقات الأحمر بشكل ملحوظ أقرب معا من تحقيقات الخضراء (***: P <0.01، المفردة اختبار t). البيانات من 10.
الفيلم 1. 3D النمذجة اثنين من مواضع داخل كروموسوم ر بهمerritory. وصفت تحقيقين BAC تقع على مقربة من طرفي كروموسوم الماوس 7 (الأحمر وحتى الأحمر، (أبيض الزائفة ملونة)) وتهجين جنبا إلى جنب مع الطلاء كروموسوم كامل (الأخضر) إلى خلايا ES الماوس. انقر هنا لمشاهدة الفيلم .
Discussion
أصبح FISH DNA 3D أداة المعترف بها على نطاق واسع لتحليل الترتيبات المكانية في النواة. بينما FISH يوفر نتائج البصرية ومباشرة، كما هو الحال مع كل تقنية، ويحتاج المرء أن يكون مدركا لحدوده. يواجه FISH DNA المشكلة الكامنة أن هناك حاجة إلى علاجات قاسية نسبيا لجعل لونين للوصول للتحقيقات السمك الذي يعطل في النهاية النووية هيكل الشيء الذي هو ليتم تحليلها. اتبعت عدة استراتيجيات لتزييف الوصول والحفاظ على هيكل. في بروتوكول الموصوفة هنا، يتم الوصول إليها عن طريق الحمض النووي الكروموسومات permeabilization تجميد ذوبان الجليد من الخلايا وتمسخ الحرارة قبل التهجين التحقيق. Solovei، وآخرون، (2002) بتحليل التغيرات الهيكلية بعد معاملة مماثلة، ووجدت أن متوسط النزوح من المجالات لونين كان 300 نانومتر مما يحد القرار من التحليل البنيوي إلى ما يقرب من 1 ميغابايت في مناطق الجينوم 8. في حين أن هذا ليس ارتفاع القرار، وذلكهو مقياس معقول لتحليل الموقف النووي.
وهناك اعتبار أكثر عملية للتحليل FISH هو أن الحصول على الصور وقياسات للمسافات النووية هي العمليات تستغرق وقتا طويلا مما يحد من عدد النوى التي يمكن تحليلها. من أجل دراسة الأحداث نادرة كنا نهدف إلى القيام عالية الإنتاجية التصوير الآلي. ثم، مع وجود ضوابط مناسبة في مكان، بأعداد كافية ويمكن مقارنة للسماح للتحليل الإحصائي قوية من العلاقات المكانية. نحن نحلل بشكل روتيني 600 نواة لكل نقطة البيانات التي لدينا تحديد إحداثيات 3D من جميع الاشارات FISH ضمن وحدة التخزين النووي. تتطلب هذه البيانات مساحة التخزين القليل جدا، والسماح لتحليل المسافات بين وداخل أليلية، أو مواقف شعاعي في أي نقطة في وقت لاحق. وعلاوة على ذلك، يمكن أن يتم التجهيز الآلي بطريقة الباحث الأعمى الذي يقلل بدرجة كبيرة من احتمال التحيز اللاوعي.
لتمكين هذا النوع من analys إنتاجية عاليةهو، كان هدفنا لإقامة وسيلة سريعة وفعالة لأداء FISH الحمض النووي. وجدنا بروتوكول الموصوفة هنا أن تكون قوية للغاية، وتنتج باستمرار إشارات مشرق مع خلفية منخفضة. لأنها عملت كل أنواع الخلايا حاولنا شريطة أن تتكيف الخطوة من ربط الخلايا على الشريحة. وعلاوة على ذلك، مع استثناء واحد، كل تسلسل كروموسوم البكتيريا الصناعي كنا يمكن أن تتحول إلى تحقيقات مشرق. ونحن أيضا الكشف بنجاح عددا من البروتينات النووية من قبل تلوين الأجسام المضادة بعد FISH الحمض النووي. بينما لبعض البروتينات هذا يعمل بشكل جيد، ونحن نوصي مقارنة مع التقليدية المناعي (IF) لضمان الاتساق في نمط تلوين الأجسام المضادة بين IF والحمض النووي المناعية FISH (قارن 11).
عموما، وجدنا أن تحقيقات المسمى في الألوان المختلفة التي تنتج نفس النتائج. ومع ذلك، ينبغي النظر في الجوانب التالية عند اختيار الصبغة وضع العلامات. أولا، ولون من fluorophore يجب أن يكون كشفها بشكل جيد من قبل يو المجهرااا. ثانيا، يتعين على الطول الموجي للضوء المنبعث من fluorophores تكون مختلفة بما فيه الكفاية لتجنب تنزف من خلال في القناة الأخرى. وهذا يعتمد على عوامل التصفية في المجهر. والثالث، على الأقل في أيدينا، وبعض الألوان تنتج إشارات مشرق أكثر اتساقا من غيرهم. وقد استخدمنا دائما دابي (الأزرق) على أنه مباين مما يجعل اليكسا فلور 555 (الحمراء)، 488 (أخضر)، و647 (الحمراء بعيدة) خيارات جيدة لوصفها تحقيقات. مع نظام التصوير لدينا، وجدنا اليكسا فلور 555 (الحمراء) لإنتاج ألمع الإشارات، تليها اليكسا فلور 488 (أخضر). فلور اليكسا 647 (بعيدا الحمراء) لديه عيب وأنه لا يمكن الكشف عنها بواسطة العين البشرية وبالتالي عدم وجود إشارات يمكن أن ينظر إليه عند النظر إلى أسفل المجهر. وبالتالي، إذا فعل FISH اللونين، نوصي مزيج من الأصباغ الحمراء والخضراء.
قد تنشأ اثنين من المشاكل الرئيسية: الخلايا غسل قبالة الشرائح والإشارات الضعيفة. كيف الخلايا جيدا التمسك الشريحة هو betw متغير بشكل كبيرأنواع الخلايا التابعين، وأفضل بروتوكول لتسوية / بذور الخلايا يحتاج يحدد لاحقا. لقد استخدمت بنجاح إما موجبة أو الشرائح المغلفة بولي-L-يسين (اشترى جاهزة للاستخدام)، ولكن العثور على خلايا الالتزام عموما أفضل على الشرائح المغلفة بولي-L-يسين. وجدنا أيضا أنه عندما كانت خلايا من شأنه مناطق بأكملها كثيفة جدا تقشر ورقة، في حين كان يعوق التصوير الآلي إذا كانت الخلايا متفرق جدا. وبالتالي، إذا كانت العينة ليست ثمينة جدا، وينبغي أن يكون المصنف أعداد مختلفة من الخلايا لتحديد كثافة مثالية. إذا الخلايا عرضة ليغسل بشكل خاص، قلم حاجز مسعور يمكن استخدامها، ويمكن تنفيذ الخطوات FISH من قبل pipetting بعناية حلول مباشرة على الشريحة. pipetting لأيضا يقلل بشكل كبير من حجم الكواشف اللازمة، ولكنه يأخذ فترة أطول بكثير عند القيام عدة شرائح.
الإشارات الضعيفة وعادة ما تكون بسبب تحقيقات الفقراء، وأنها تستحق استثمار الوقت في صنع الجيد منها. نظيفة BAC الحمض النووي ينبغي استخدامد في بدء المواد التي يمكن الحصول عليها عن طريق الترسيب المتكررة أو مجموعات المتاحة تجاريا. التلوث مع الحمض النووي الجيني البكتيري يؤثر سلبا على نوعية التحقيق ومعالجة متأنية خلال تحلل الخلايا وتصفية من المحللة الخلية هو مطلوب للحفاظ على الحد الأدنى. هو عليه، ومع ذلك، ليس من الضروري استخدام خطوة نوكلياز خارجية لهضم الحمض النووي الخطية، لأن هذا يقلل بدرجة كبيرة من المحصول. وضع العلامات كفاءة لجنة التحقيق أمر بالغ الأهمية. مراقبة الجودة الأكثر أهمية لهذه الخطوة هو التحقق من حجم شظية بعد نيك ترجمة (انظر ممثل النتائج). سوف مسحة 'جيدة' يؤدي دائما تقريبا في التحقيق الملونة الزاهية. ومع ذلك، فقد وجدنا أن في بعض الأحيان على بعض BAC لا يمكن معالجتها في تحقيق جيد، وBAC مختلفة تحتاج إلى أن يتم اختيار. خطوة هامة أخرى هي تمسخ الحرارة. إذا كانت درجة الحرارة منخفضة جدا، فإن الحمض النووي أن يكون إلا جزئيا والتشويه والتحريف، سوف تضعف والتهجين التحقيق. إذا كانت درجة الحرارة مرتفعة جدا وبناء واي النوويةسوف يكون قلق أكثر من اللازم. في أيدينا، 78 ° C على كتلة الساخنة المقلوب هو الحل الوسط المثالي، ولكن هذا قد تختلف اعتمادا على كتلة الساخنة منها استخدامها.
لقد حققنا نتائج جيدة باستخدام Vectashield المتوسطة المتزايدة، ولكن وجدت أن SlowFade الذهب لديه أقل الخلفية ويحافظ على إشارة الفلورسنت لمدة أطول. نحن لا نوصي باستخدام الصلب مجموعة المتوسطة المتزايدة كما وجدنا أن يؤثر ذلك على هيكل 3D وتشكيل فقاعات الهواء مع مرور الوقت.
في الختام، الزاهية الفلورسنت تحقيقات صفت مباشرة مع بروتوكول FISH الحمض النووي الموصوفة هنا نقدم حلا فعالة لتحليل قوي وسريع للهندسة النووية والتي تنطبق على طائفة واسعة من المسائل البيولوجية.
Disclosures
وقد رعت إنتاج هذه المادة جزئيا بواسطة كارل زايس وMetaSystems.
Acknowledgements
وقد تم تمويل هذا العمل من قبل BBSRC ويلكوم ترست. ونود أن نشكر سايمون ووكر للحصول على المساعدة مع التصوير وفيليكس كروجر للمساعدة في تحليل المعلوماتية الحيوية.
Materials
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||||||||||
| Reagent/Material | |||||||||||||||||||||||||||||||||||||||
| NTB buffer | Step 1.1.1 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||||
| DTT | Invitrogen | D-1532 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| dNTPs | Bioline | BIO-39025 | Step 1.1.1 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| Aminoallyl-dUTP | Ambion | AM8439 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| DNA Polymerase I | New England Biolabs | M02095 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| DNase I recombinant RNase free | Roche | 4716728001 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| QIAquick PCR purification kit | Qiagen | 28104 | Step 1.1.4, 1.2.3 | ||||||||||||||||||||||||||||||||||||
| NaOAc | VWR | 27653 | Step 1.1.5, Step 2.1.1.2 | ||||||||||||||||||||||||||||||||||||
| NaHCO3 | Sigma | S5761 | Step 1.2.1 | ||||||||||||||||||||||||||||||||||||
| Alexa Fluor Reactive Dye Decapacks for Microarray Applications | Invitrogen (Molecular Probes) | A32750, A32756, A32757 | Step 1.2.2 | ||||||||||||||||||||||||||||||||||||
| DMSO (anhydrous) | Sigma Aldrich | 276855 | Step 1.2.2 | ||||||||||||||||||||||||||||||||||||
| SYBR Safe DNA gel stain | Life Technologies | S33102 | Step 1.2.4 (alternative to ethidium bromide) | ||||||||||||||||||||||||||||||||||||
| Cot-1 DNA | Invitrogen | 18440-016 | Step 2.1.1.1 (Cot-1 DNA can be home-made in large quantities and works just as well) | ||||||||||||||||||||||||||||||||||||
| Single stranded DNA from salmon testes | Sigma | D7656 | Step 2.1.1.1 | ||||||||||||||||||||||||||||||||||||
| Deionised formamide | Sigma | F-9037 | Step 2.1.1.3 (Health hazard) | ||||||||||||||||||||||||||||||||||||
| Dextran sulphate | Sigma Life Sciences | D8906 | Step 2.1.1.4 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| XMP painting probes | MetaSystems | 000000-0528-837 | Step 2.1.1.4 | ||||||||||||||||||||||||||||||||||||
| Poly-L-lysine coated slides | Sigma Aldrich | P0425 | Step 2.1.2 | ||||||||||||||||||||||||||||||||||||
| Hydrophobic pen (ImmEdge) | Vector Laboratories | H-4000 | Step 2.1.2 | ||||||||||||||||||||||||||||||||||||
| 70 μm sieve (Mouse f–tal liver cells only) | BD Falcon | 352350 | Step 2.1.2.1 | ||||||||||||||||||||||||||||||||||||
| PFA | Sigma Aldrich | P6148 | Step 2.1.3 (Flammable, corrosive, acute toxicity, health hazard) (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| Tris-Cl | Step 2.1.3 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||||
| Saponin from Quillaja bark | Sigma Aldrich | 47036 | Step 2.1.4, 2.1.11 (Acute toxicity), (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| Triton X-100 | Sigma | T9284 | Step 2.1.4, 2.1.11 (Acute toxicity, hazardous to the environment) | ||||||||||||||||||||||||||||||||||||
| 10 x PBS | Life Technologies (GIBCO) | 70011-036 | Step 2.1.4, 2.1.5, 2.1.6, 2.1.8, 2.1.10, 2.1.11, 2.1.12, 2.2.7, 2.2.9, | ||||||||||||||||||||||||||||||||||||
| Glycerol | Fisher Scientific | G/0650 | Step 2.1.6 | ||||||||||||||||||||||||||||||||||||
| HCl | VWR | 20252 | Step 2.1.9 (Acute toxicity, corrosive) | ||||||||||||||||||||||||||||||||||||
| Formamide | Sigma Aldrich | 47670 | Step 2.1.14, 2.2.3 (Health hazard) | ||||||||||||||||||||||||||||||||||||
| SSC | Step 2.1.14, 2.2.2-2.2.6, 2.2.8 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||||
| Coverslips 22 x 22 | Menzel-Glaser | BB022022A1 | Step 2.1.15 | ||||||||||||||||||||||||||||||||||||
| Coverslips 22 x 50 | Menzel-Glaser | BB022050A1 | Step 2.1.15 | ||||||||||||||||||||||||||||||||||||
| Rubber cement | Marabu | 2901 (10 000) | Step 2.1.15 (Flammable, health hazard, danger to the environment) | ||||||||||||||||||||||||||||||||||||
| DAPI | Invitrogen Molecular Probes | D3571 | Step 2.2.8 (Health hazard) | ||||||||||||||||||||||||||||||||||||
| SlowFade Gold | Invitrogen | S36936 | Step 2.2.10 (mounting medium) | ||||||||||||||||||||||||||||||||||||
| Clear nail polish | Any supplier | Step 2.2.10 | |||||||||||||||||||||||||||||||||||||
| Equipment | |||||||||||||||||||||||||||||||||||||||
| Nanodrop 2000 | Thermo Scientific | Step 1.1.6, 1.2.4 (microvolume spectroscopy) | |||||||||||||||||||||||||||||||||||||
| Typhoon FLA 7000 phosphoimager | GE Life Sciences | Step 1.2.4 | |||||||||||||||||||||||||||||||||||||
| Coplin jars | Sigma-Aldrich | S6016 (6EA)/S5516 (6EA) | Step 2.1.3 onwards | ||||||||||||||||||||||||||||||||||||
| Liquid nitrogen dewar | Any supplier | Step 2.1.7 | |||||||||||||||||||||||||||||||||||||
| Base with Black Lid (light-tight chamber) | Simport | M920-2 | Step 2.1.17 | ||||||||||||||||||||||||||||||||||||
| Thermomixer comfort | Eppendorf | 5355 000.011 | Step 2.2.3 (or use shaker in a 37 °C room) | ||||||||||||||||||||||||||||||||||||
| Imaging and Image processing | |||||||||||||||||||||||||||||||||||||||
| Metafer - Imaging Automation Platform | MetaSystems | automated imaging software | |||||||||||||||||||||||||||||||||||||
| MetaCyte - Automated Interphase FISH analysis | MetaSystems | automated imaging software | |||||||||||||||||||||||||||||||||||||
| Axio Imager Z2 upright | Zeiss | epifluorescence microscope used with automated imaging | |||||||||||||||||||||||||||||||||||||
| IX81 confocal microscope (FV1000) | Olympus | confocal microscope | |||||||||||||||||||||||||||||||||||||
| Bitplane, version 7.3 | Imaris | image analysis and 3D modelling software | |||||||||||||||||||||||||||||||||||||
| Scientific volume Imaging, version 4.1 | Huygens | image analysis and deconvolution software | |||||||||||||||||||||||||||||||||||||
FISH buffers and reaction mixes
| |||||||||||||||||||||||||||||||||||||||
References
- Chakalova, L., Debrand, E., Mitchell, J. A., Osborne, C. S., Fraser, P. Replication and transcription: shaping the landscape of the genome. Nat. Rev. Genet. 6, 669-677 (2005).
- Misteli, T. Beyond the sequence: cellular organization of genome function. Cell. 128, 787-800 (1016).
- de Wit, E., de Laat, W. A decade of 3C technologies: insights into nuclear organization. Genes Dev. 26, 11-24 (2012).
- Sambrook, J., Russell, D. . Molecular Cloning: A laboratory Manual. , (2000).
- Boyle, S., Rodesch, M. J., Halvensleben, H. A., Jeddeloh, J. A., Bickmore, W. A. Fluorescence in situ hybridization with high-complexity repeat-free oligonucleotide probes generated by massively parallel synthesis. Chromosome Res. 19, 901-909 (2011).
- Brown, K. Visualizing nuclear proteins together with transcribed and inactive genes in structurally preserved cells. Methods. 26, 10-18 (2002).
- Hewitt, S. L., Yin, B., et al. RAG-1 and ATM coordinate monoallelic recombination and nuclear positioning of immunoglobulin loci. Nat. Immunol. 10, 655-664 (2009).
- Solovei, I., Cavallo, A., et al. Spatial preservation of nuclear chromatin architecture during three-dimensional fluorescence in situ hybridization (3D-FISH. Experimental Cell Research. 276, 10-23 (2002).
- Solovei, I., Beatty, B., Mai, S., Squire, J. FISH on three-dimensionally preserved nuclei. FISH: A Practical Approach. , (2002).
- Krueger, C., King, M. R., et al. Pairing of homologous regions in the mouse genome is associated with transcription but not imprinting status. PLoS One. 7, e38983 (2012).
- Solovei, I., Cremer, M., Bridger, J. M., Volpi, E. V. 3D-FISH on Cultured Cells Combined with Immunostaining. Fluorescence in situ hybridization (FISH): Protocols and Applications. , (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved