Method Article
Прочная 3D рыбу ДНК с использованием меченых зондов непосредственно
В этой статье
Резюме
Мы описываем надежный и универсальный протокол для анализа ядерной архитектуры 3D рыбу непосредственно ДНК с использованием меченых флуоресцентными зондами.
Аннотация
3D FISH ДНК стала одним из основных инструментов для анализа трехмерной организации ядра, и несколько вариаций техники были опубликованы. В этой статье мы опишем протокол, который был оптимизирован для надежности, воспроизводимости и простоте использования. Ярко флуоресцентных меченых зондов непосредственно генерируются ник-трансляции с амино-allyldUTP следуют химическая связь красителя. 3D ДНК FISH выполняется с помощью замораживания-оттаивания шаг для ячейки проницаемости и стадию нагревания для одновременного денатурации зонда и ядерной ДНК. Протокол применим к различным типам клеток и различных датчиков (БАС, плазмиды fosmids или полного краски хромосомы) и обеспечивает высокую пропускную способность автоматизированной обработки изображений. С помощью этого метода мы регулярно рассматривают ядерную локализацию до трех участках хромосом.
Введение
ДНК флуоресценции в гибридизация (ДНК FISH) позволяет трехмерной визуализации отдельных локусов гена, subchromosomal доменов и даже целые хромосомы на всех стадиях клеточного цикла. 2D FISH используется для исследований, а метафаза 3D рыбу был широко использован для исследования взаимосвязи между пространственной организации генома и его функции во время интерфазы (1,2 и ссылки там). Исторически, со-ассоциации исследования проводились путем изучения десятков до сотен отдельных локусов рыбой. Совсем недавно мощный высокую пропускную способность 3C на основе методов, таких как 4С и Привет-C были разработаны 3, позволяя исследования молекулярных перекрестные помехи между множеством тысячи различных локусах. В то время как 3C методов, основанных на ДНК, и рыба может быть дополнительным методам, они не обязательно отвечать на те же вопросы. 3C основе метода обеспечивают ансамбль считывания смешанной популяции клеток, в результате чего вероятностиности для сотрудничества ассоциаций. В противоположность этому, в то время как низкий по пропускной способности, на основе методов FISH предлагаем возможность анализировать пространственные расположения локусов хромосом или в отдельных камерах, в соответствии с их развитием или ячейки стадиях цикла. Таким образом, рыба продолжает быть важным инструментом для исследования ядерных структурно-функциональных отношений.
Есть два основных соображения при проведении успешных экспериментов 3D FISH. Это: 1. получение оптимально меченых зондов и 2. выбор сотовой лечения, включая фиксации, пред-и пост-гибридизации шаги для сохранения морфологии ядра как можно больше, делая ДНК достаточно доступной для гибридизации с зондом. Эффективная маркировка зонда является критически важным для рыб. Традиционно ник-перевод был использован для введения или гаптен или флуорофора конъюгированных нуклеотидов 4. Кроме того, коммерческие ник-трансляции комплекты доступны для прямого или Гаптен флуорофором включения, бут также для двухступенчатого мечение с применением aminoallyl нуклеотидов и амин-реактивных красителей. Последняя оказывает включение красителя более эффективным, давая ДНК-полимераза менее громоздким молекулы работать. Совсем недавно, наборы для неферментативном маркировки ДНК были разработаны, которые эксплуатируют координационного связывания платины с нуклеиновыми кислотами. FISH зондов даже может быть приобретена уже помечены 5. В то время как наборы и серийно выпускаемые зонды Нет сомнения, дают простоту использования, они значительно дороже, чем покупка отдельных компонентов и производства зондов в доме. Мы оптимизировали низкой стоимости ник-трансляции протоколов для того, чтобы непосредственно маркировать различные зонды BAC в нескольких цветах. Мы обнаружили, что получение высокочистого BAC ДНК является критическим и приводит к требованию только 10-20 нг зонд за FISH слайдов, по сравнению с 10 - 20 раз больше, когда ДНК нечистый шаблон используется, что приводит к большой стоимости и времени сбережений. Использование амино-allyldUTP позволяет гибко маркировкиЗонды с имеющимися амина активных красителей (например, Alexa Fluor или Cy-красителей) или гаптенам (например, биотин, дигоксигенина). Гаптен-меченных зондов обнаружено флуорофора конъюгированных антител или стрептавидина для усиления и вывода сигнала. Яркие непосредственно меченых зондов обычно показывают менее фоновое окрашивание и избежать чрезмерного усиления сигналов, следовательно, в результате чего более точное представление о ядерной локализации и локус морфологии.
Есть несколько различных методов FISH, которые используют различные фиксаторы, предварительная обработка и пост-гибридизации моет но они обычно подразделяются на следующие категории: глутаральдегиде фиксации NaOH денатурации, формальдегида фиксации HCl денатурации и формальдегид фиксации тепловой денатурации 6-9 . Каждая из них имеет свои преимущества и недостатки. Глутаральдегида фиксации приводит к хорошим ядерный структурный сохранения, но требует лечения восстановителей, чтобы минимизироватьв результате флуоресценции и NaOH лечение необходимо тщательно контролировать, чтобы уравновесить достаточным денатурации ДНК и возможность повреждения структуры ядра 6. Формальдегид фиксации меньше мощное устройство, обеспечивающее повышенную вероятность возмущения ядерной архитектуры, но и обычно дает более сильные и надежные сигналы и нижней аутофлюоресценция 9. HCl лечения depurinates ДНК и удаляет белки, обеспечивая хороший доступ к ДНК для зондов, но могут также ввести разрывов ДНК. Отопление физически разделяет две нити ДНК в результате гибридизации хорошая цель и сильных сигналов, но может вызвать некоторое возмущение структуры ядра 8. Степень, в которой каждый из этих методов влияет белковые эпитопы колеблется в широких пределах 6,9, что приводит к требованию экспериментально определить для каждого белка оптимального протокола для использования в иммуно-FISH экспериментов.
В то время как нет «идеальных» ДНК FISH TEchnique, все они могут быть полезны, если хорошо контролируются. Нашей целью было оптимизировать протокол для надежной и воспроизводимой ДНК FISH исследовать пространственное расположение нескольких локусов в различных типах клеток 10, сосредоточив внимание на способ нагрева для самых надежных сигналов. С этим и использования автоматизированной системы визуализации мы, направленные на повышение пропускной способности для одного анализа клетки ядерных договоренностей.
протокол
1. Создание Непосредственно меченых зондов ДНК ник-трансляцией
Примечание: Непосредственно меченых зондов из ВАС (100-250 кб) постоянно производить ярких сигналов. Если меньше зонды необходимо, использовать fosmids (40-50 кб) или даже плазмиды, содержащие 5-10 вставками кб. Определить BAC или фосмиду клоны, соответствующие специфические гены использованием ансамбля или УСК браузеров генома. Подготовьте высокого качества BAC ДНК повторяются осадков или использовать коммерчески доступных наборов. Чем меньше препарат загрязненных бактериальной геномной ДНК, тем меньше зонд требуется на слайд. Выполнить маркировку в два этапа: ник-трансляция введения aminoallyl-дУТФ и химических сочетание амина-реактивный краситель.
1.1. Ник-трансляция
Во время перевода Ника, ДНКаза I используется для создания однонитевых разрывов. ДНК-полимераза I удлиняется 'концы этих' 3 вмятин, замены существующих нуклеотидов с новыми, т Настоящим 'переводить' Ника и, таким образом предоставляя возможность включить меченых нуклеотидов. Aminoallyl-дУТФ выбрано потому, что эффективного включения путем ДНК-полимеразы I и его потенциал для последующей химической связи в амин активных красителей или гаптенам. Это имеет решающее значение для достижения правильного баланса между ДНКаза I засечки и ДНК-полимеразы I перевод, слишком много ДНКаза I приведет к чрезмерному пищеварение ДНК дает низкий выход и короткие фрагменты размером, слишком мало не будет производить достаточно ники для полимеразы для инициации трансляции, предоставление больших размеров фрагмента и бедными включение aminoallyl-дУТФ. Следующий протокол работает хорошо, но это может быть необходимо для титрования ДНКазы I из различных партий или разных производителей.
- Настройка реакции мечения на льду и инкубировать в течение 2 ч при 16 ° С. Это должно производить 0,5-1 мкг Ника-переводе ДНК и могут быть расширены. Развести ДНКазы I 1:30 в буфере ДНКазы I (т.е. 0,3 ед / мкл).
- Выполнить 1 мкл на 2% агарозном геле, чтобы проверить размер меченых фрагментов. В то время как вы запустите гель, продолжение реакции на льду. Успешное Ник translatiприведет к росту мазка при этом большая часть фрагментов работает от 150 б.п. и 700 б.п., более крупные фрагменты при ~ 1 Кб (Важнейший шаг: см. Представитель Результаты). При необходимости добавить еще один мкл свежей 1:30 ДНКазы I разбавление и инкубируют при 16 ° С в течение 15-30 мин. Время инкубации будет варьировать в зависимости от количества и качества BAC ДНК.
- Деактивировать ДНКаза I при нагревании до 75 ° С в течение 10 мин.
- Очистка амин модифицированного ДНК с использованием набора ПЦР-очистки. Элюировать в 100 мкл H 2 O.
- Этанол осадок ДНК путем добавления 10 мкл 3 М ацетата натрия (рН 5,2) и 275 мкл этанола. Оставьте при -20 ° С в течение не менее 1 часа или на ночь. Спин при максимальной скорости в течение 30 минут при 4 ° C. Вымойте гранул с 500 мкл 70% этанола и дайте высохнуть на воздухе. Этот шаг удаляет след аминов, которые будут мешать реакции мечения. Ресуспендируют осадок в 6 мкл H 2 O в 1x первоначальную реакцию.
- Использование 1 мкл для определения концентрации амина модифицированной ДНКспектроскопия микрообъема УФ.
1.2. Соединение флуоресцентного красителя
Флуоресцентные метки в образец достигается путем химического связывания на красителе. Alexa Fluor сукцинимидил эфир красители вступают в реакцию с аминами амино-allyldUTP модифицированную ДНК с образованием ковалентной связью, с получением таким образом непосредственно меченых зондов. Alexa Fluor 488, 555, 647 и красители были успешными для этого процесса.
- Регулировка 4 мкг амино-аллил модифицированной ДНК в объеме 5 мкл, нагревают до 95 ° С в течение 5 мин, оснастки прохладный на льду и добавляют 3 мкл 0,2 М NaHCO3.
- Растворить одну аликвоту аминный реакционноспособный краситель в 2 мкл безводного диметилсульфоксида при комнатной температуре. Добавить 8 мкл модифицированной ДНК с NaHCO 3, вихревые, пульс спина и инкубируют при комнатной температуре в темноте в течение 1 часа.
Примечание: амин активные красители могут быть использованы для обозначения более одного датчика на основе следующей схеме. Так как оолько 10-20 нг зонд используется на слайд маркировки, 1 мкг дает достаточно зонд для 50-100 слайдов. Кроме того, можно хранить амин модифицированного ДНК для будущих реакций маркировки при -20 ° C.
| Количество ДНК | Объем ДНК | 0,2 М NaHCO 3 | Объем красителя | Общий | Достаточно для |
| 4 х 1 мкг | 1,25 мкл | 0,75 мкл | 0,5 мкл каждого | 2,5 мкл (1/4) | 50-100 слайдов каждая |
| 3 х 1,35 мкг | 1,67 мкл | 1 мкл каждого | 0,67 мкл | 3,34 мкл (1/3) | 65-130 каждого слайда |
| 2 х 2 мкг | 2,5 мкл каждого | 1,5 мкл каждого | 1 мкл каждого | 5 мкл (1/2) | 100-200скользит каждого |
| 1 х 4 мкг | 5 мкл | 3 мкл | 2 мкл | 10 мкл (полное) | 200-400 слайды |
- Добавить 90 мкл H 2 O и очищают меченым зондом использованием набора для очистки ПЦР. Элюировать в 100 мкл 10 мМ Трис-Cl (рН 8,5).
- Определить концентрацию зонда и маркировки эффективности микрообъема полный спектр спектроскопии (см. рисунок 2) с использованием Ламберта-Бера уравнений (инструкции приведены в сопроводительной спецификации Alexa Fluor или активные красители можно найти в Интернете). Зондами, содержащими красители 3-6 на 100 б.п. работает хорошо. Зонды с более низкой степенью включения может дать слабые сигналы FISH. Альтернативы можно запустить 5 мкл в 2% агарозном геле ДНК без пятна и проверьте включение использованием флуоресцентного красителя phosphoimager. Сообщение-пятно геля этидия бромид или альтернативы окрашивания ДНК и сравнить меченой ДНК к общему ДНК.
Через следующие шаги, представляющих интерес клеток крепятся к слайдов и проницаемыми. Клеточную ДНК и непосредственно меченых зондов затем денатурируют вместе на горячей плите и гибридизовали в течение ночи в светонепроницаемый влажной камере.
2.1. День 1
- Датчик осадков
Примечание: Осадок зондов в какой-то момент во время Дня 1. Это может удобно быть выполнены параллельно обработки клеток и не должны быть сделаны в начале дня.- Смешайте 10-20 нг непосредственно меченым зондом, 6 мкл C 0 т-1 ДНК (6 мг), 1 мкл одноцепочечной ДНК из семенников лосос (9,7 мкг) и регулировать объем до 100 мкл с водой.
- Добавить 10 мкл 3 М ацетата натрия и 275 мкл этанола и перемешивают встряхиванием. Осадок течение по крайней мере 1 ч при -20 ° С.
- Спина в микроцентрифуге при максимальной скорости в течение 30 мин при 4 ° C. Вымойте гранул с 70% этанола и спина снова. Сухие гранулыи ресуспендируют в 5 мкл деионизированной формамида. Ресуспендируют в течение 30 мин при 37 ° C при встряхивании со скоростью 1000 оборотов в минуту в защищенном от света (место фольги на термосмеситель).
- Добавляют 5 мкл смеси сульфата декстрана и встряхивают в течение еще 10 мин при 37 ° С снова защищенном от света месте. Внесите вверх и вниз только перед отбором на покровное.
Примечание: для хромосомы картины в сочетании с датчиками BAC, целые хромосомы картина зондов, которые поставляются в готовом к использованию гибридизации смеси представляют собой удобный вариант. Ресуспендируйте осаждают BAC зонд (с C 0 T1 ДНК и одноцепочечной ДНК из лосося яичек) в 10 мкл смеси краски хромосомы с помощью пипетки вверх и вниз. Инкубировать при 37 ° C при встряхивании при 300-500 оборотов в минуту в течение 10 мин. Используйте 10 мкл краски хромосомы / БАК зонд смеси на месте.
- Прикрепление клеток к слайдам
Примечание: клетки склонности придерживаться слайды значительно варьируется в зависимости от типа клеток. Для каждого типа клеток, определяютвремя установления оптимальной плотности клеток и эмпирически. Для достижения одинаковых результатов, клетки должны быть в суспензии отдельных клеток.
Для удобства использования кругу области клетки, должен быть выставлен на гидрофобной пера, хотя для клеток ресуспендировали в PBS это не является строго обязательным. Гидрофобный барьер предотвращает распространение подвески на слайде, сохраняет до трех образцов на слайд хорошо разделены и допускает использование очень малых объемов раствора антител в иммуно-FISH. Кроме того, кровянистые выделения области может быть сведено к минимуму, если число клеток являются низкими. - Мышь эмбриональных клеток печени
- Сбор каждой E13.5 мыши печени плода примерно в 1,5 мл PBS и ресуспендируют с помощью пипетки вверх и вниз. Спина в микроцентрифуге при 3000 оборотов в минуту в течение 2 мин. Повторите моет три раза. На последней промывки клетки штамма через 70 мкм сито. Ресуспендируйте клетки печени от одного в 160 мкл PBS и использовать 50 μ на пятно. Оставьте клетки урегулировать в течение 2 мин при комнатной температуре.
- MУз клеток ES
1. ЭС клетки мыши не будет придерживаться готовностью к слайду. На слайде, круг области клетки, должен быть выставлен на гидрофобной пера. Подготовка суспензии 20,000-50,000 клеток на 80-100 мкл нормальной культуральной среде, пипетки в круг и оставляют прикрепляться в течение примерно 3 часов в увлажненном инкубаторе. Примечание: Кроме того, ЭС клетки могут быть выращены на предметных стеклах, а затем образуют колонии, которые могут препятствовать автоматизированной обработки изображений. - Фиксированные клетки
1. Некоторые эксперименты требуют использования фиксированных клетках, не прикрепленных к слайдам сами по себе. Нежный вращающийся со скоростью 300 оборотов в минуту в течение 3 минут с использованием cytocentrifuge сохраняет трехмерную структуру клетки и гарантирует, что клетки не упасть.
| Тип клеток | Подвеска в | Время успокоения | Комментировать |
| Мышьфетальной печени | PBS | 2 мин | На скамейке |
| Мышь ES | DMEM с добавками | 4 ч | 37 ° С в увлажненном инкубаторе |
| Мышь лимфоцитов | PBS | 2 мин | На скамейке |
| Мышь P20 половых клеток | Исправить в растворе | Cytospin | На скамейке |
- Чтобы исправить клетки, осторожно погрузите слайд в 4% PFA (ВНИМАНИЕ: выполнять в вытяжном шкафу) в течение 10 мин. Fix клетки с горкой квартиру в лоток для лучшего удержания клеток (например, 50 мл 4% PFA в крышке коробка чаевых). Примечание: Этот шаг не распространяется на камеры, назначенные до привязанности к слайдам.
Для всех последующих шагов, используйте 50 мл или 100 мл Коплин банки. Заботьтесь, чтобы не царапать, когда клетки от перемещения слайдов между банками.
- Quench в 0,1 М Трис-Cл, рН 7,4 в течение 10 мин при комнатной температуре.
- Проницаемыми клеток в 0,1% saponin/0.1% Тритон Х-100 в PBS в течение 10 мин при комнатной температуре.
- Мыть два раза в PBS в течение 5 мин при комнатной температуре.
- Инкубируют в течение 20 мин в 20%-ном глицерине / PBS при комнатной температуре. Примечание: В этой точке, слайдов могут быть сохранены в 50% глицерине / PBS при -20 ° С в течение по крайней мере нескольких недель. Было отмечено, что для хранения по меньшей мере один день приводит к увеличению уровня сигнала 9. Повторная калибровка при комнатной температуре 20% глицерина / PBS, прежде чем приступить. Примечание: Это удобный момент, чтобы начать осаждение зондов (см. 2.1.1).
- 3x замораживание / оттаивание в жидком азоте. Погружение один слайд одновременно в жидком азоте с помощью небольшого Дьюара. Вывод через несколько секунд и характерным хлопком, и положите на бумажное полотенце, чтобы разморозить. Подождите непрозрачные замороженных глицерина исчезнуть затем заморозить снова. До 15 слайдов можно сделать удобно в ротации в течение трех циклов замораживания / оттаивания.
- Wпепел дважды в PBS в течение 5 мин при комнатной температуре.
- Инкубируют в 0,1 М HCl в течение 30 мин при комнатной температуре.
- Промыть в PBS в течение 5 мин при комнатной температуре.
- Проницаемыми в 0,5% saponin/0.5 X-100/PBS% Triton в течение 30 мин при комнатной температуре.
- Мыть два раза в PBS в течение 5 мин при комнатной температуре.
- Равновесие в 50% formamide/2x SSC в течение 10 минут при комнатной температуре.
- Внесите зонда на покровное. Удалить слайд из банки и сушить излишки жидкости вокруг клетки месте (ы) с бумажным полотенцем. Как формамидом быстро сохнет, старайтесь не высыхают клеток. Для слайдов с двумя или тремя пятнами клетки, применяют 10 мкл зонда на пятно на 22 мм х 50 мм покровным соответствующие определить местоположение на слайде. Обратить на покровное скользят месте (ы). Уплотнение с резиновым клеем и дайте этому полностью высохнуть. Защищать от света на всех последующих этапах.
- Тепло горки до 78 ° С в течение 2 мин точно на горячей плите (например, перевернутый блок отопления, Важнейший шаг: см. Обсуждение). Место крышку (картонная коробка или SIM ILAR) над плитой для защиты от света при денатурации.
- Инкубируют в течение ночи при 37 ° С в светонепроницаемой увлажненной камере. Увлажнить, поместите бумажные полотенца в светонепроницаемой коробки и смочите ее водой.
2.2 День 2
- Подготовьте банки с Коплин решений при правильной температуре для последующих шагов стирки. Защита слайдов из света в максимально возможной степени во всех последующих шагов. Кофе может делает хороший светонепроницаемом крышки для банок Коплин.
- Снимите резиновый клей и место слайда в 2х SSC до покровные не ослабить и соскальзывать.
- Стирать в 50% formamide/2x SSC в течение 15 мин при 45 ° С. Место крышку на водяной бане для защиты от света.
- Стирать в 0,2 x SSC в течение 15 мин при 63 ° C.
- Стирать в 2х SSC в течение 5 мин при 45 ° С.
- Стирать в 2х SSC в течение 5 мин при комнатной температуре.
- Промыть в PBS в течение 5 мин при комнатной температуре.
- Пятно с DAPI (5 мкг / мл в 2х SSC) в течение 2 мин в банке Коплин при комнатной температуре.
- Destain в PBS в течение 5 мин при комнатной температуре.
- Чтобы смонтировать покровное, пипетка монтажа среды на покровное. Использование 10 мкл на ячейку месте, используя 22 мм х 22 мм покровные на одном месте, и 22 мм х 50 мм покровные течение двух-трех точках. Высушите PBS вокруг клетки месте как можно больше, но будьте осторожны, чтобы не иссякнуть клеток. Обратить покровное на слайде, и печать с лаком для ногтей.
Результаты
Протокол, описанный здесь (рис. 1 для обзора) был использован для большого эффекта объединить ДНК рыбы с высокой пропускной способностью захвата изображения для анализа геномной организации. Поколение хороших зонды качество имеет решающее значение для успеха (см. обсуждение). 2 демонстрирует два важных контролем качества для рыб зондов. После ник-трансляции, мазок из ДНК должна быть видна при этом большая часть фрагментов работает между 150 и 700 п.н. (рис. 2А). После химической связью, включение флуоресцентного красителя можно судить по спектроскопического анализа зонда (фиг. 2В).
При использовании хорошо зондов, в соответствии с протоколом ДНК FISH обычно приводит к яркой ДНК FISH сигналов на низкий фон. Мы успешно использовали этот протокол на различные типы клеток, и с любым флуоресценции или конфокальной микроскопии. Автоматизированная визуализации с использованием эпи-fluorescencэлектронной микроскопии требует острый, легко идентифицировать FISH сигналов с небольшой фон (рис. 3), в то время конфокальной микроскопии требует более интенсивных сигналов. рисунке 4а показаны представителя обработанных изображений. Ядерный координаты FISH сигналы могут быть получены, и пространственные соотношения геномных областей могут быть вычислены (в качестве примера см. фиг.4В). Мы также использовали стеки получены с помощью конфокальной микроскопии для 3D моделирования FISH сигналы на их территории хромосомы (Фильм 1).
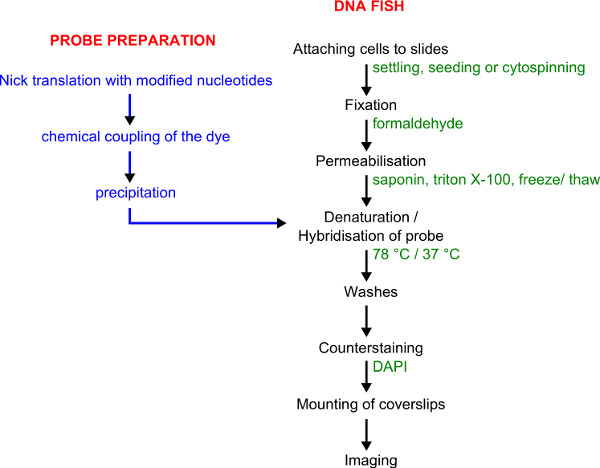
Рисунок 1. Последовательность действий для маркировки зондом и ДНК FISH. Зонд подготовки показаны синим цветом. Процедура ДНК FISH показан в черном, с параметрами, указанными в зеленый цвет.
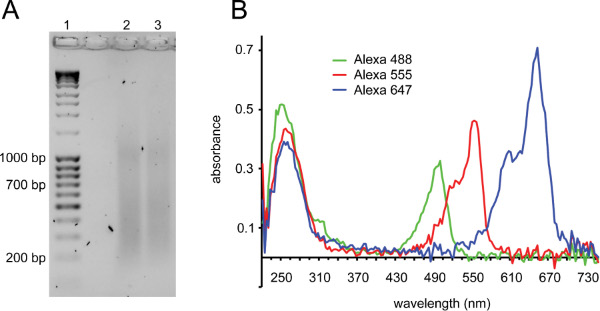
Рисунок 2. Маркировка зондов ник-трансляции и контроля качества меченых зондов. ) Гель показывает идеальный мазок перед нагреванием для инактивации ДНКазы I (дорожка 1: лэддер ДНК, полоса 2 и 3: BACs после ник-перевод). Фрагменты должны быть в диапазоне 150-700 б.п.. Дополнительных мазков при ~ 1 кб часто наблюдается с успешными ник-трансляции реакций. B) микрообъема полный анализ спектра меченых зондов. ДНК пик при 260 нм наблюдается со второй пик, соответствующий длине волны поглощения флуорофора зонд помечен: Alexa Fluor 488: 495 нм, Alexa Fluor 555: 555 нм, Alexa Fluor 647: 650 нм. Показаны три зонда с хорошим включение: пики поглощения флуорофора является одинаковой высоты или выше ДНК пиков. Alexa Fluor 647 обычно имеет более высокое поглощениечем Alexa Fluor 555, который, в свою очередь, имеет более высокую, чем поглощение Alexa Fluor 488. Alexa Fluor 488 также поглощает свет при 260 нм, следовательно, первый пик для этого зонда выше, чем другие. Зонды с плохим поглощения шоу флуорофором включения 2-в 3 раза ниже, чем поглощение ДНК. Зонды с более, чем в 2 раза выше, чем пик флуорофор ДНК пик обычно содержат неконъюгированный краситель, который может вызвать фона в FISH.
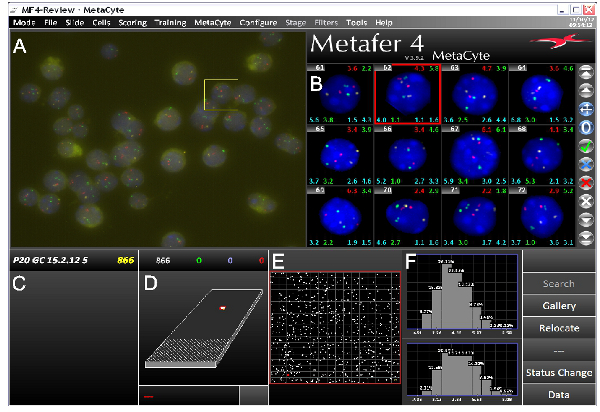
Рисунок 3. Скриншот из MetaCyte 3D FISH ПО для обработки изображений, показывающей типичную трехцветного FISH эксперимента. Экран разделен на несколько частей.) Сырье поля-обзора (FOV) изображение, снятое Metafer / MetaCyte слайд сканирование системы. B) Галерея изображений выявленных ядрышки с ООНпретерпевших обработки изображений и сегментации для рыб сигналов. Различные типы данных могут быть отображены на каждой галереи изображения. В этот номер сотового пример показан верхний левый с различными межаллельной и interlocus расстояния верхнем правом и в обе стороны под каждым изображением.) Вложите имя с числом ядер определена в ходе анализа. D) изображением слайда с областью сканируется системы. Е) Расширение области сканирования. Белые пятна представляют определены ядер в поле зрения. F) обрабатываемых данных. В этом примере максимальный межаллельной расстояния между зеленым сигналов (вверху) и красный сигналы (внизу) показаны. Отображаются данные от мыши P20 половых клеток. Зонды расположены на разных хромосомах, охватывающих Hbb и Hba генов и гистонов кластера. Нажмите здесь, чтобы увеличить рисунок .
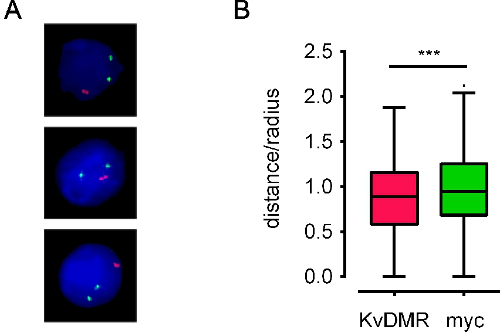
Рисунок 4. Примеры обработанных изображений и производных данных о местоположении. А) Обработанные изображения для E13.5 мыши клетки печени эмбриона окрашивали зондов BAC расположены на разных хромосомах покрытие Myc и Kcnq1 генов (называемых Myc и KvDMR, цветной зеленый и красный, соответственно). B) Тьюки коробчатого усами представляющая межаллельной расстояние Распределение по той же локусов в 600 ядер. Межаллельной расстояние нанесена в виде доли от радиуса ядра (расстояние / радиус) для учета изменений размера ядра. Ядер ЭС клеток иметь радиус около 5 мкм. Красный зондов значительно ближе друг к другу, чем зеленый зондов (***: р <0,01, непарного т-теста). Данные от 10.
Фильм 1. 3D моделирование двух локусов хромосомы в пределах их тerritory. Два BAC зондов, расположенных близко к любому концу хромосоме 7 мыши были помечены (красного и дальнего красного, (псевдо-белого цвета)) и гибридизовали вместе с целой хромосомы краски (зеленый), чтобы ЭС клеток мыши. Нажмите здесь, чтобы посмотреть фильм .
Обсуждение
3D FISH ДНК стала широко признанным инструментом для анализа пространственных механизмов в ядре. В то время как рыба обеспечивает визуальное и непосредственные результаты, как с каждым технику, нужно быть в курсе свои ограничения. ДНК FISH сталкивается с проблемой, которая присуща относительно суровых лечения необходимы, чтобы сделать доступными для хроматина FISH зондов, которые в конечном итоге разрушает структуры ядра-то самое, что должен быть проанализирован. Несколько стратегии были преследовали жонглировать доступность и сохранение структуры. В протокол, описанный здесь, хромосомную ДНК, становится доступной на замораживание-оттаивание проницаемости клеток и тепловой денатурации до гибридизации зонда. Соловей и др.., (2002) проанализированы структурные изменения после подобного лечения и обнаружили, что среднее смещение доменов хроматина составлял 300 нм, что ограничивает разрешение структурного анализа примерно 1 Мб регионов в геноме 8. Хотя это не высокое разрешение, оноэто разумный масштаб для анализа ядерных положение.
Более практичным учетом FISH анализа заключается в том захвата изображений и измерения ядерного расстояния являются трудоемкими процессами, которые ограничивают число зародышей, которые могут быть проанализированы. С целью изучения редких событий и надо достичь высокой пропускной способности автоматизированной обработки изображений. Затем, соответствующий контроль на месте, достаточного числа можно сравнивать, чтобы обеспечить надежный статистический анализ пространственных отношений. Мы регулярно анализируем 600 ядер на каждую точку данных, для которых мы 3D координаты всех FISH сигналов в пределах объема ядра. Эти данные требуют очень мало места для хранения и позволяют анализировать меж-и внутри-аллельных расстояния, или радиальные положения впоследствии в любой точке. Кроме того, автоматизированная обработка может быть сделано в исследователя слепым способом, который значительно снижает вероятность смещения бессознательного.
Чтобы включить этот вид высокой пропускной Analysесть, наша цель заключается в создании быстрый и эффективный способ выполнения ДНК FISH. Мы обнаружили, что Протокол, описанный здесь, чтобы быть чрезвычайно надежной, последовательно производству ярких сигналов с низким фоном. Он работал для всех типов клеток, мы попытались условии, что мы адаптировали шаг прикрепления клеток к слайду. Кроме того, за одним исключением, все мы использовали ВАС может быть превращен в яркое зондов. Мы также успешно обнаружен количество ядерных белков антител после окрашивания ДНК FISH. Хотя для некоторых белков это работает хорошо, мы рекомендуем сравнению с традиционными иммунофлюоресценции (ИФ) для обеспечения согласованности модели окрашивания антителами между IF и ДНК иммуно FISH (ср. 11).
Как правило, мы обнаружили, что зондов, меченных в разных цветах производятся те же результаты. Тем не менее, следующие аспекты должны учитываться при выборе маркировки краситель. Во-первых, цвет флуорофора должен быть хорошо обнаруживается микроскопом уСЕПГ. Во-вторых, от длины волны света, излучаемого флуорофоров должны быть достаточно различными, чтобы избежать протечки в другом канале. Это будет зависеть от фильтров в микроскоп. И, в-третьих, по крайней мере, в наших руках, некоторые цвета производят яркие сигналы более последовательно, чем другие. Мы всегда использовали DAPI (синий) как контрастирующая что делает Alexa Fluor 555 (красный), 488 (зеленый), и 647 (дальнего красного) Хороший выбор для маркировки зондов. С нашей системой визуализации, мы обнаружили, Alexa Fluor 555 (красный) для получения ярких сигналов, а затем Alexa Fluor 488 (зеленый). Alexa Fluor 647 (дальний красный) имеет тот недостаток, что он не может быть обнаружен человеческим глазом, и, следовательно, никакие сигналы не видно если смотреть в микроскоп. Таким образом, если делать двухцветной FISH, мы рекомендуем сочетание красного и зеленого красителей.
Две основные проблемы могут возникнуть: клетки смывая горки и слабых сигналов. Насколько хорошо клетки придерживаться слайд чрезвычайно переменной Betwееп типов клеток, и лучший протокол для урегулирования / семян клетки должна быть определена. Мы успешно использовали либо положительно заряженных или поли-L-лизин покрытием слайды (купил готовый к использованию), но обнаружил клетки в целом соблюдается лучше поли-L-лизин покрытием слайды. Мы также обнаружили, что, когда клетки были слишком плотные целые районы будет шелушиться, как лист, в то время как автоматизированные изображений было затруднено, если клетки были слишком редкие. Таким образом, если образец не слишком драгоценно, различных номеров сотовых должны быть посеяны для определения идеальной плотности. Если клетки особенно подвержены смыть, гидрофобный барьер ручка может быть использована, и рыба шаги могут быть выполнены тщательно пипеткой растворы непосредственно на слайде. Пипетирование также резко снижает объемы реактивов, необходимых, но занимает значительно больше времени при выполнении нескольких слайдов.
Слабые сигналы, как правило, из-за плохого зондов, и это хорошо стоит инвестировать время в создание хороших. Чистый BAC ДНК следует использоватьг в качестве исходного материала, который можно получить повторным осаждением или коммерчески доступных наборов. Загрязнение бактериальной ДНК геномного негативно сказывается на качестве зонда и бережного обращения во время лизиса клеток и фильтрации клеточного лизата обязан держать его до минимума. Это, однако, нет необходимости использовать экзонуклеазная шаг переварить линейной ДНК, так как это значительно снижает выход. Эффективное метки в образец имеет решающее значение. Самое важное качество управления на данной стадии, проверяя размер фрагмента после ник-трансляцией (см. Представитель Результаты). «Хорошо» мазка почти всегда приводит в ярких зонда. Тем не менее, мы обнаружили, что иногда определенные BAC не могут быть обработаны в хорошем зонда, а другой BAC должен быть выбран. Другим важным шагом является тепловой денатурации. Если температура слишком низка, ДНК будет только частично денатурированный и гибридизации зонда будет нарушена. Если температура слишком высока, ядерной структуры шбудете возмущенных больше, чем необходимо. В наших руках, 78 ° C на перевернутом горячем блоке идеальный компромисс, но это может варьироваться в зависимости от соответствующего блока, используемого горячей.
У нас были хорошие результаты, используя Vectashield монтажную среду, но обнаружил, что SlowFade Золото имеет меньше фона и сохраняет флуоресцентный сигнал дольше. Мы не рекомендуем использовать жесткий набор монтажа среды, как мы обнаружили, что это влияет на структуру и 3D, чтобы сформировать пузырьки воздуха с течением времени.
В заключение, ярко флуоресцентный непосредственно меченых зондов вместе с протоколом ДНК FISH описанных здесь предлагают эффективное решение для надежного и быстрого анализа ядерных архитектуры, которая применима к широкому разнообразию биологических вопросы.
Раскрытие информации
Производство этой статьи был частично финансировалось Zeiss Карл и MetaSystems.
Благодарности
Эта работа финансировалась BBSRC и Wellcome Trust. Мы хотели бы поблагодарить Саймон Уокер за помощь в визуализации и Феликс Крюгер за помощью биоинформатики анализа.
Материалы
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||||||||||
| Reagent/Material | |||||||||||||||||||||||||||||||||||||||
| NTB buffer | Step 1.1.1 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||||
| DTT | Invitrogen | D-1532 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| dNTPs | Bioline | BIO-39025 | Step 1.1.1 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| Aminoallyl-dUTP | Ambion | AM8439 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| DNA Polymerase I | New England Biolabs | M02095 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| DNase I recombinant RNase free | Roche | 4716728001 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| QIAquick PCR purification kit | Qiagen | 28104 | Step 1.1.4, 1.2.3 | ||||||||||||||||||||||||||||||||||||
| NaOAc | VWR | 27653 | Step 1.1.5, Step 2.1.1.2 | ||||||||||||||||||||||||||||||||||||
| NaHCO3 | Sigma | S5761 | Step 1.2.1 | ||||||||||||||||||||||||||||||||||||
| Alexa Fluor Reactive Dye Decapacks for Microarray Applications | Invitrogen (Molecular Probes) | A32750, A32756, A32757 | Step 1.2.2 | ||||||||||||||||||||||||||||||||||||
| DMSO (anhydrous) | Sigma Aldrich | 276855 | Step 1.2.2 | ||||||||||||||||||||||||||||||||||||
| SYBR Safe DNA gel stain | Life Technologies | S33102 | Step 1.2.4 (alternative to ethidium bromide) | ||||||||||||||||||||||||||||||||||||
| Cot-1 DNA | Invitrogen | 18440-016 | Step 2.1.1.1 (Cot-1 DNA can be home-made in large quantities and works just as well) | ||||||||||||||||||||||||||||||||||||
| Single stranded DNA from salmon testes | Sigma | D7656 | Step 2.1.1.1 | ||||||||||||||||||||||||||||||||||||
| Deionised formamide | Sigma | F-9037 | Step 2.1.1.3 (Health hazard) | ||||||||||||||||||||||||||||||||||||
| Dextran sulphate | Sigma Life Sciences | D8906 | Step 2.1.1.4 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| XMP painting probes | MetaSystems | 000000-0528-837 | Step 2.1.1.4 | ||||||||||||||||||||||||||||||||||||
| Poly-L-lysine coated slides | Sigma Aldrich | P0425 | Step 2.1.2 | ||||||||||||||||||||||||||||||||||||
| Hydrophobic pen (ImmEdge) | Vector Laboratories | H-4000 | Step 2.1.2 | ||||||||||||||||||||||||||||||||||||
| 70 μm sieve (Mouse f–tal liver cells only) | BD Falcon | 352350 | Step 2.1.2.1 | ||||||||||||||||||||||||||||||||||||
| PFA | Sigma Aldrich | P6148 | Step 2.1.3 (Flammable, corrosive, acute toxicity, health hazard) (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| Tris-Cl | Step 2.1.3 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||||
| Saponin from Quillaja bark | Sigma Aldrich | 47036 | Step 2.1.4, 2.1.11 (Acute toxicity), (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| Triton X-100 | Sigma | T9284 | Step 2.1.4, 2.1.11 (Acute toxicity, hazardous to the environment) | ||||||||||||||||||||||||||||||||||||
| 10 x PBS | Life Technologies (GIBCO) | 70011-036 | Step 2.1.4, 2.1.5, 2.1.6, 2.1.8, 2.1.10, 2.1.11, 2.1.12, 2.2.7, 2.2.9, | ||||||||||||||||||||||||||||||||||||
| Glycerol | Fisher Scientific | G/0650 | Step 2.1.6 | ||||||||||||||||||||||||||||||||||||
| HCl | VWR | 20252 | Step 2.1.9 (Acute toxicity, corrosive) | ||||||||||||||||||||||||||||||||||||
| Formamide | Sigma Aldrich | 47670 | Step 2.1.14, 2.2.3 (Health hazard) | ||||||||||||||||||||||||||||||||||||
| SSC | Step 2.1.14, 2.2.2-2.2.6, 2.2.8 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||||
| Coverslips 22 x 22 | Menzel-Glaser | BB022022A1 | Step 2.1.15 | ||||||||||||||||||||||||||||||||||||
| Coverslips 22 x 50 | Menzel-Glaser | BB022050A1 | Step 2.1.15 | ||||||||||||||||||||||||||||||||||||
| Rubber cement | Marabu | 2901 (10 000) | Step 2.1.15 (Flammable, health hazard, danger to the environment) | ||||||||||||||||||||||||||||||||||||
| DAPI | Invitrogen Molecular Probes | D3571 | Step 2.2.8 (Health hazard) | ||||||||||||||||||||||||||||||||||||
| SlowFade Gold | Invitrogen | S36936 | Step 2.2.10 (mounting medium) | ||||||||||||||||||||||||||||||||||||
| Clear nail polish | Any supplier | Step 2.2.10 | |||||||||||||||||||||||||||||||||||||
| Equipment | |||||||||||||||||||||||||||||||||||||||
| Nanodrop 2000 | Thermo Scientific | Step 1.1.6, 1.2.4 (microvolume spectroscopy) | |||||||||||||||||||||||||||||||||||||
| Typhoon FLA 7000 phosphoimager | GE Life Sciences | Step 1.2.4 | |||||||||||||||||||||||||||||||||||||
| Coplin jars | Sigma-Aldrich | S6016 (6EA)/S5516 (6EA) | Step 2.1.3 onwards | ||||||||||||||||||||||||||||||||||||
| Liquid nitrogen dewar | Any supplier | Step 2.1.7 | |||||||||||||||||||||||||||||||||||||
| Base with Black Lid (light-tight chamber) | Simport | M920-2 | Step 2.1.17 | ||||||||||||||||||||||||||||||||||||
| Thermomixer comfort | Eppendorf | 5355 000.011 | Step 2.2.3 (or use shaker in a 37 °C room) | ||||||||||||||||||||||||||||||||||||
| Imaging and Image processing | |||||||||||||||||||||||||||||||||||||||
| Metafer - Imaging Automation Platform | MetaSystems | automated imaging software | |||||||||||||||||||||||||||||||||||||
| MetaCyte - Automated Interphase FISH analysis | MetaSystems | automated imaging software | |||||||||||||||||||||||||||||||||||||
| Axio Imager Z2 upright | Zeiss | epifluorescence microscope used with automated imaging | |||||||||||||||||||||||||||||||||||||
| IX81 confocal microscope (FV1000) | Olympus | confocal microscope | |||||||||||||||||||||||||||||||||||||
| Bitplane, version 7.3 | Imaris | image analysis and 3D modelling software | |||||||||||||||||||||||||||||||||||||
| Scientific volume Imaging, version 4.1 | Huygens | image analysis and deconvolution software | |||||||||||||||||||||||||||||||||||||
FISH buffers and reaction mixes
| |||||||||||||||||||||||||||||||||||||||
Ссылки
- Chakalova, L., Debrand, E., Mitchell, J. A., Osborne, C. S., Fraser, P. Replication and transcription: shaping the landscape of the genome. Nat. Rev. Genet. 6, 669-677 (2005).
- Misteli, T. Beyond the sequence: cellular organization of genome function. Cell. 128, 787-800 (1016).
- de Wit, E., de Laat, W. A decade of 3C technologies: insights into nuclear organization. Genes Dev. 26, 11-24 (2012).
- Sambrook, J., Russell, D. . Molecular Cloning: A laboratory Manual. , (2000).
- Boyle, S., Rodesch, M. J., Halvensleben, H. A., Jeddeloh, J. A., Bickmore, W. A. Fluorescence in situ hybridization with high-complexity repeat-free oligonucleotide probes generated by massively parallel synthesis. Chromosome Res. 19, 901-909 (2011).
- Brown, K. Visualizing nuclear proteins together with transcribed and inactive genes in structurally preserved cells. Methods. 26, 10-18 (2002).
- Hewitt, S. L., Yin, B., et al. RAG-1 and ATM coordinate monoallelic recombination and nuclear positioning of immunoglobulin loci. Nat. Immunol. 10, 655-664 (2009).
- Solovei, I., Cavallo, A., et al. Spatial preservation of nuclear chromatin architecture during three-dimensional fluorescence in situ hybridization (3D-FISH. Experimental Cell Research. 276, 10-23 (2002).
- Solovei, I., Beatty, B., Mai, S., Squire, J. FISH on three-dimensionally preserved nuclei. FISH: A Practical Approach. , (2002).
- Krueger, C., King, M. R., et al. Pairing of homologous regions in the mouse genome is associated with transcription but not imprinting status. PLoS One. 7, e38983 (2012).
- Solovei, I., Cremer, M., Bridger, J. M., Volpi, E. V. 3D-FISH on Cultured Cells Combined with Immunostaining. Fluorescence in situ hybridization (FISH): Protocols and Applications. , (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены