Method Article
דגי ה-DNA 3D חזקים באמצעות בדיקות שכותרתו ישירות
In This Article
Summary
אנו מתארים פרוטוקול חזק ותכליתי לניתוח ארכיטקטורה גרעינית ידי דגי DNA 3D באמצעות בדיקות ניאון שכותרתו ישירות.
Abstract
דגי ה-DNA 3D הפך לכלי עיקרי לניתוח ארגון תלת ממדי של הגרעין, וכמה וריאציות של הטכניקה שפורסמו. במאמר זה אנו מתארים פרוטוקול אשר עברו אופטימיזציה עבור חוסן, שחזור, וקלויות שימוש. מאור בדיקות ישירות כותרת ניאון מופקות על ידי ניק-תרגום עם אמינו-allyldUTP אחרי הצימוד כימי של הצבע. דגי ה-DNA 3D מתבצע באמצעות צעד הקפאת הפשרה לpermeabilization התא וצעד לחימום denaturation סימולטני של בדיקה ה-DNA והגרעינית. הפרוטוקול הוא ישים למגוון של סוגי תאים ומגוון רחב של בדיקות (BACS, פלסמידים, fosmids, או צבעי כרומוזום שלמים) ומאפשר הדמיה אוטומטית תפוקה גבוהה. בשיטה זו אנו שיגרתי לחקור לוקליזציה גרעינית של עד שלושה אזורים בכרומוזומים.
Introduction
ה-DNA הקרינה הכלאה באתר (FISH-DNA) מאפשרת הדמיה תלת ממדית של לוקוסים בודדים גן, תחומים subchromosomal וכרומוזומים אפילו כולו בכל שלבי מחזור החיים של התא. דגי 2D משמש למחקרי metaphase בעוד דגי 3D כבר נעשו שימוש נרחב כדי לחקור את הקשר בין הארגון המרחבי של הגנום ותפקודו במהלך שלבי ביניים (1,2 והפניות בו). מבחינה היסטורית, מחקרי שיתוף עמותה בוצעו על ידי חקירת עשרות עד מאות בודדים לוקוסים על ידי דגים. טכניקות רב עוצמה גבוהות יותר לאחרונה תפוקה מבוססת 3C כגון 4C וHi-C פותחו 3, המאפשרות חקירה צולבת דיבורים מולקולריים בין אלפים רבים של לוקוסים שונים. בעוד טכניקות מבוססות 3C ודגי DNA יכולים להיות שיטות משלימות, הם לא בהכרח לענות על אותן השאלות. שיטות מבוססות 3C לספק readout הרכב של אוכלוסיות תאים מעורבות, וכתוצאה מכך probability לעמיתים לעמותות. בניגוד לכך, בעוד בתפוקה נמוכה, המבוססות על טכניקות דגים מציעות את האפשרות לנתח סידורים מרחביים של לוקוסים או כרומוזומים בתאים בודדים על פי שלבי המחזור התפתחותיים או סלולריים שלהם. לפיכך, דגים ימשיכו להיות כלי חשוב לחיטוט יחסי פונקצית מבנה גרעיניים.
ישנם שני שיקולים עיקריים בביצוע ניסויי דגים 3D מוצלחים. אלה הם: 1. קבלת בדיקות שכותרתו בצורה אופטימלית ו -2. בחירה של טיפולים סלולריים, כולל קיבעון, לפני וצעדים שלאחר הכלאה, כדי לשמור על מורפולוגיה גרעינית עד כמה שניתן בעת ביצוע ה-DNA נגישה מספיק להכלאת חללית. תיוג בדיקה יעיל חשוב מאוד לדגים. באופן מסורתי, ניק-תרגום נעשה שימוש כדי להציג או hapten או נוקלאוטידים fluorophore-מצומדות 4. בדומה לכך, ערכות ניק-תרגום המסחרי זמינות עבור hapten הישיר או התאגדות fluorophore, buלא גם לתיוג שני שלבי שימוש בנוקלאוטידים aminoallyl וצבעים אמין-תגובתי. זה האחרון הופך את שילוב צבע יעיל יותר על ידי מתן פולימראז ה-DNA מולקולה פחות מגושמת לעבוד איתו. לאחרונה, ערכות לתיוג הלא האנזימטית של ה-DNA פותחו אשר מחייבים לנצל קואורדינטיבית של פלטינה לחומצות גרעין. אפילו ניתן לרכוש כבר 5 בדיקות שכותרתו דגים. בעוד ערכות ובדיקות שיוצרו באופן מסחרי ללא ספק נותנים נוחות שימוש, הם הרבה יותר יקרים מאשר לקנות רכיבים הבודדים ובייצור בדיקות בבית. אנחנו מותאמים פרוטוקול תרגום ניק עלות נמוך כדי לתייג ישירות רבות בדיקות שונות BAC במספר צבעים. גילתה שקבלת דנ"א BAC הטהור ביותר היא קריטית ותוצאות בדרישה רק 10-20 ng של חללית לכל שקופית דגים, בהשוואה ל 10 - 20 של פי יותר כאשר ה-DNA משמש תבנית טמאה, וכתוצאה מכך העלות גדולה וזמן חיסכון. השימוש באמין allyldUTP מאפשר תיוג גמיש שלבדיקות עם צבעים אמין-reactive זמינים (למשל אלקסה פלואוריד או CY-צבעים) או haptens (למשל ביוטין, digoxigenin). בדיקות hapten שכותרתו מזוהות על ידי נוגדני fluorophore-מצומדות או streptavidin להגביר ולדמיין את האות. בדיקות ישירות כותרתו בהירה בדרך כלל מראות פחות מכתים רקע ולהימנע יתר הגברה של אותות, ולכן כתוצאה מייצוג מדויק יותר של לוקליזציה גרעינית ומורפולוגיה לוקוס.
קיימות מספר טכניקות דגים שונים שמשתמשות בfixatives שונה, טיפולים מראש, ושטיפות לאחר הכלאה אבל אלה בדרך כלל נופלים לתוך הקטגוריות הבאות: קיבעון glutaraldehyde עם NaOH denaturation, קיבעון פורמלדהיד עם HCl denaturation, וקיבעון פורמלדהיד עם denaturation חום 6-9 . לכל אלה יש יתרונות וחסרונות. תוצאות glutaraldehyde קיבעון בשימור מבני גרעין טוב, אבל דורש טיפול עם צמצום סוכנים כדי למזערautofluorescence כתוצאה מכך, וטיפול NaOH צריך להיות מבוקרים בקפידה כדי לאזן denaturation DNA מספיק ונזק אפשרי למבנה גרעיני 6. קיבעון פורמלדהיד הוא פחות חזק, נותן סבירות מוגברת של הפרעות של אדריכלות גרעינית, אלא גם נותן בדרך כלל אותות ונמוכים autofluorescence 9 חזקים יותר ואמינים יותר. HCl טיפול depurinates DNA ורצועות את החלבונים, ומספק גישה טובה ל-DNA לבדיקות, אלא גם עשוי להציג את הפסקות DNA. חימום פיזי שמפריד בין שני גדילי דנ"א וכתוצאה מהכלאת המטרה טובה ואותות חזקים, אבל יכול לגרום להפרעות במבנה גרעיני 8. המידה שבה כל אחת מטכניקות אלה משפיע epitopes החלבון משתנית מאוד 6,9, וכתוצאה מכך הדרישה לקבוע באופן ניסיוני עבור כל חלבון הפרוטוקול האופטימלי לשימוש בניסויים חיסוני דגים.
אמנם אין DNA FISH te "מושלם"chnique, כולם יכול להיות שימושי אם גם בשליטה. המטרה שלנו הייתה לעשות אופטימיזציה של פרוטוקול ה-DNA לדגים חזקים ולשעתק לחקור מיקום המרחבי של לוקוסים רבים במגוון רחב של סוגי תאים 10, תוך התמקדות בשיטת החימום עבור רוב האותות אמינים. עם זה ושימוש במערכת הדמיה האוטומטית נועדו להגדיל את התפוקה לניתוח תא בודד של הסדרים גרעיניים.
Protocol
1. יצירת בדיקות דנ"א תווית ישירות על ידי תרגום לניק
הערה: בדיקות שנעשו מBács כותרתו ישירות (100-250 קילו) באופן עקבי לייצר אותות בהירים. אם בדיקות קטנות יותר נדרשות, השתמש fosmids (40-50 קילו) או אפילו פלסמידים המכיל מוסיף kb 5-10. זהה BAC או שיבוטים fosmid מתאימים לגנים ספציפיים באמצעות אנסמבל או דפדפני הגנום UCSC. הכן את האיכות הגבוהה BAC-DNA על ידי ממטרים חזרו או להשתמש בערכות זמינות מסחרי. פחות ההכנה מזוהמת עם הדנ"א הגנומי חיידקים, נדרשת הבדיקה פחות לכל שקופית. התיוג לבצע בשני שלבים: תרגום ניק מציג aminoallyl-dUTP וצימוד כימי של צבע אמין-תגובתי.
1.1. ניק תרגום
במהלך תרגום ניק, DNase אני משמש ליצירת הפסקות-גדיל בודדות. פולימראז ה-DNA אני מתארך 'הקצוות האלה של' 3 ניקס ', החלפת נוקלאוטידים קיימים בחדשים, t בזאת 'תרגום' ניק וכך לספק את ההזדמנות לשלב נוקלאוטידים שכותרתו. Aminoallyl-dUTP נבחר בגלל שילוב יעיל על ידי DNA פולימראז אני והפוטנציאל שלה לצימוד כימי מאוחר יותר לצבעים או haptens אמין-תגובתי. זה קריטי כדי להשיג את האיזון הנכון בין לסחוב DNase אני ופולימראז ה-DNA אני תרגום; יותר מדי DNase אני יגרום לעיכול ה-DNA מוגזם נותן תשואה נמוכה וגדלים שבר קצרים, מעט מדי לא מייצר מספיק ניקס לפולימראז ליזום תרגום, נותן גודל שבר גדול והתאגדות של עניי aminoallyl-dUTP. הפרוטוקול הבא עובד היטב, אבל זה עשוי להיות נחוץ כדי לכייל אני DNAse מקבוצות שונות או יצרנים שונים.
- הגדר תיוג תגובה על קרח ודגירה עבור שעה 2 ב 16 ° C. זה אמור לייצר 0.5-1 DNA ניק-תרגם מיקרוגרם, וניתן לשנותו. לדלל DNase אני 1:30 בDNase אני חיץ (כלומר 0.3 U μl /).
- הפעל μl 1 על 2% ג'ל agarose כדי לבדוק את גודל שברי שכותרתו. זמן שאתה מפעיל את הג'ל, לשמור את התגובה על קרח. מוצלח ניק translatiביגרמו למריחה עם כמות גדולה של שברי ריצה בין 150 נ"ב ו -700 נ"ב עם כמה שברים גדולים יותר ב ~ 1 KB (שלב קריטי: לראות נציג תוצאות). במידת צורך, להוסיף עוד 1 μl של דילול טרי 01:30 DNase אני ולדגור על 16 מעלות צלזיוס במשך 15-30 דקות. זמן הדגירה ישתנה בהתאם לכמות והאיכות של BAC ה-DNA.
- להשבית DNase אני על ידי חימום עד 75 מעלות צלזיוס למשך 10 דקות.
- ה-DNA אמין-modified לנקות באמצעות ערכת טיהור PCR. Elute בH μl 100 2 א '
- ה-DNA משקע אתנול על ידי הוספת 3 μl 10 ז NaOAc (pH 5.2) ו275 אתנול μl. תעזוב ב -20 מעלות צלזיוס במשך שעה לפחות 1 או הלילה. ספין במהירות המרבית למשך 30 דקות ב 4 ° C. לשטוף עם גלולה 500 70% אתנול μl ולאפשר לאוויר יבש. צעד זה מסיר אמינים קורט אשר מפריעים לתגובת התיוג. Resuspend גלולה בH 2 O 6 μl ל1x תגובה ראשונית.
- השתמש μl 1 כדי לקבוע את הריכוז של ה-DNA אמין-modifiedעל ידי ספקטרוסקופיית UV microvolume.
1.2. צימוד של הצבע פלואורסצנטי
ניאון תיוג של החללית מושגת על ידי צימוד כימי של הצבע. צבעי אלקסה פלואוריד succinimidyl אסתר להגיב עם האמינים של ה-DNA אמין allyldUTP הותאם ליצירת קשר קוולנטי, וכך לייצר חלליות שכותרתו ישירות. אלקסה פלואוריד 488, 555, 647 וצבעים היו מוצלחים לתהליך הזה.
- התאם 4 מיקרוגרם של ה-DNA שונה אמין allyl להיקף של 5 μl, חום עד 95 מעלות צלזיוס למשך 5 דקות, הצמד מגניב על קרח, ולהוסיף 3 μl של 0.2 מ 'NaHCO 3.
- ממיסים aliquot אחד של צבע תגובתי אמין ב DMSO נטול מים μl 2 בטמפרטורת חדר. הוסף DNA שונה 8 μl עם 3 NaHCO, מערבולת, ספין דופק ודגירה בטמפרטורת חדר בחושך במשך שעה 1.
הערה: צבעים תגובתי אמין יכולים לשמש כדי לתייג את הבדיקה יותר מזה המבוסס על התכנית הבאה. מאז Only ng 10-20 של חללית משמש לכל שקופית תיוג, 1 מיקרוגרם נותן מספיק לבדיקת 50-100 שקופיות. זה אפשרי גם לאחסון אמין DNA-שונה לתגובות תיוג עתידיות ב -20 ° C.
| כמות ה-DNA | נפח ה-DNA | 0.2 מ 'NaHCO 3 | נפח של צבע | סך הכל | מספיק לי |
| מיקרוגרם 4 x 1 | 1.25 μl כל | 0.75 μl כל | 0.5 μl כל | 2.5 μl (1/4) | 50-100 שקופיות כל אחת |
| מיקרוגרם 3 x 1.35 | 1.67 μl כל | μl 1 כל אחד | 0.67 μl כל | 3.34 μl (1/3) | 65-130 שקופית כל |
| מיקרוגרם 2 X 2 | 2.5 μl כל | 1.5 μl כל | μl 1 כל אחד | 5 μl (1/2) | 100-200מחליק כל |
| 1 מיקרוגרם x 4 | 5 μl | 3 μl | 2 μl | 10 μl (מלא) | 200-400 שקופיות |
- הוסף 90 H 2 O μl ובדיקה לטהר כותרתו באמצעות ערכת טיהור PCR. Elute ב100 μl 10 mMTris-Cl (pH 8.5).
- לקבוע ריכוז בדיקה ויעילות על ידי תיוג ספקטרוסקופיה ספקטרום מלא microvolume (ראה איור 2) באמצעות משוואות באר למברט (הוראות הניתנות בגיליון הנתונים המלוות את הצבעים תגובתי אלקסה פלואוריד או ניתן למצוא באינטרנט). בדיקות המכילות 3-6 צבעים לכל 100 נ"ב לעבוד היטב. בדיקות עם מעלות נמוכות יותר של התאגדות עשויות לתת אותות דג חלשים. לחלופין, להפעיל 5 μl על 2% ג'ל agarose בלי ה-DNA כתם ולבדוק את השילוב של צבע פלואורסצנטי באמצעות phosphoimager. לאחר כתם ג'ל עם ethidium ברומיד או חלופות מכתים DNA ולהשוות DNA ל-DNA שכותרתו המוחלטת.
באמצעות השלבים הבאים, תאים של עניין קבועים לשקופיות וpermeabilized. ה-DNA התאי ובדיקות ישירות כותרתו אז מפוגלים יחד על פלטה חשמלית והכלאה בין לילה בתא humidified אור חזק.
2.1. יום 1
- בדיקה רטיבות
הערה: בדיקות משקע בשלב כלשהו במהלך יום 1. זה יכול להתבצע בנוחות במקביל לטיפול בתאים ולא חייב להיעשות בתחילתו של היום.- מערבבים 10-20 ng בדיקה ישירות כותרתו, ה-DNA 6 μl C 0 t-1 (6 מיקרוגרם), ה-DNA 1 μl אחת גדילים מאשכי סלמון (9.7 מיקרוגרם) ולהתאים את עוצמת קול עד 100 μl עם מים.
- הוסף 3 μl 10 ז NaOAc ו275 EtOH μl, ומערבב על ידי vortexing. לזרז במשך שעה לפחות 1 ב -20 ° C.
- ספין בmicrofuge במהירות המרבית למשך 30 דקות ב 4 ° C. לשטוף עם גלולה EtOH 70% ומסתחררים שוב. יבש גלולהוresuspend ב5 לפוראמיד deionized μl. Resuspend למשך 30 דקות ב 37 מעלות צלזיוס בזמן רועד ב 1000 סל"ד מוגן מפני אור (מקום נייר כסף מעל thermomixer).
- הוסף 5 μl תמהיל סולפט dextran ולנער לעוד 10 דקות ב 37 מעלות צלזיוס מוגנת שוב מפני אור. פיפטה מעלה ומטה רק לפני pipetting על coverslip.
הערה: לציור בשילוב עם בדיקות כרומוזום BAC, דגנים בדיקות ציור כרומוזום אשר מסופקות במוכן לשימוש, תמהיל הכלאה הן אפשרות נוחה. Resuspend זירז BAC בדיקה (עם C 0 T1-DNA וה-DNA גדילים בודד מאשכי סלמון) בשילוב צבע כרומוזום 10 μl ידי pipetting למעלה ולמטה. לדגור על 37 מעלות צלזיוס בזמן רועד ב 300-500 סל"ד במשך 10 דקות. השתמש 10 μl של צבע כרומוזום / בדיקה תמהיל BAC לכל מקום.
- חיבור תאים לשקופיות
הערה: נטיית התאים לדבוק שקופיות מאוד משתנה בהתאם לסוג התא. לכל סוג תא, לקבוע אתאופטימלי שיקוע זמן וצפיפות תאים באופן אמפירי. לקבלת תוצאות עקביות, תאים צריכים להיות בהשעית תא בודד.
על מנת להקל על שימוש בעיגול את אזור התאים יהיה הבחין בעם עט הידרופובי, אם כי לתאי resuspended ב PBS זה לא הכרחי. מחסום הידרופובי מונע השעיה מלהתפשט בשקופית, שומר עד שלוש דוגמאות לכל שקופית נפרדה יפה ומאפשר שימוש בכמויות קטנות מאוד של פתרון נוגדן חיסוני בדגים. כמו כן, באזור תצפית יכול להישמר עד למינימום אם מספרי תא הם נמוכים. - תאי כבד עובריים של עכבר
- אסוף כל כבד העובר E13.5 עכבר בכ 1.5 מ"ל של PBS ו resuspend ידי pipetting למעלה ולמטה. ספין בmicrofuge בסל"ד 3000 למשך 2 דקות. חזרו על שטיפת שלוש פעמים. בשטיפה האחרונה, מתח התאים דרך מסננת מיקרומטר 70. Resuspend תאי כבד מאחד ב160 PBS μl ולהשתמש 50 μ לכל מקום. השאר תאים להתיישב למשך 2 דקות בטמפרטורת חדר.
- זתאי גזע עובריים ouse
1. תאי הגזע העובריים של עכבר לא יידבקו בקלות לשקופית. בשקופית, מעגל שטח התאים יהיו הבחין בעם עט הידרופובי. הכן השעיה של 20,000-50,000 תאים לכל 80-100 μl במדיום התרבות נורמלית, פיפטה לתוך המעגל ולהשאיר לצרף לכ -3 שעות בחממת הערה humidified:. לחלופין, יכולים להיות מתורבתים תאי גזע עובריים בשקופיות, אבל אז יהיה בצורה מושבות אשר עשוי לעכב הדמיה אוטומטית. - תאים קבועים
1. ניסויים מסוימים דורשים את השימוש בתאים קבועים שאינו לצרף לשקופיות על ידי עצמם. ספינינג העדין ב300 סל"ד במשך 3 דקות באמצעות cytocentrifuge משמר שלושה המבנה התל ממדים של התאים ומבטיח כי תאים לא ליפול.
| סוג התא | השעיה ב | זמן התייצבות | הערה |
| עכברכבד העובר | PBS | 2 דקות | על ספסל |
| עכבר ES | DMEM עם תוספים | 4 שעות | 37 מעלות צלזיוס בחממת humidified |
| לימפוציטים עכבר | PBS | 2 דקות | על ספסל |
| P20 בתאי הנבט של עכבר | לתקן בפתרון | Cytospin | על ספסל |
- כדי לתקן את תאים, החלק בעדינות לצלול בPFA 4% (זהירות: לבצע במנדף) למשך 10 דקות. תקן תאים עם השקופית שטוחה במגש לשימור הטוב ביותר של תאים (לדוגמה: 50 מ"ל PFA 4% במכסה של תיבת טיפ). הערה: בשלב זה לא יחול על תאים קבועים לפני קובץ מצורף לשקופיות.
את כל הצעדים הבאים, השתמש 50 מ"ל או 100 מ"ל צנצנות Coplin. יש להיזהר שלא לגרד את תאים בעת מעבר בין שקופיות צנצנות.
- להרוות ב0.1 מ 'טריס-CL, pH 7.4 במשך 10 דקות ב RT.
- Permeabilize תאים ב0.1% saponin/0.1% טריטון X-100 ב PBS במשך 10 דקות ב RT.
- שטוף פעמיים ב PBS במשך 5 דקות ב RT.
- דגירה של לפחות 20 דקות ב20% גליצרול הערה / PBS ב RT:. בשלב זה, יכול להיות מאוחסנים בשקופיות גליצרול 50% / PBS ב -20 מעלות צלזיוס למשך לפחות כמה שבועות. זה כבר ציין כי אחסון ללפחות תוצאות ביום עלייה בעוצמת אות 9. לכייל מחדש בטמפרטורת חדר גליצרול 20% / PBS לפני שתמשיך הערה:. זוהי נקודה נוחה להתחיל מזרז הבדיקות (ראה 2.1.1).
- 3x הקפאה / הפשרה בחנקן נוזלי. להטביע שקופית אחת בכל פעם בחנקן נוזלי באמצעות דיואר קטן. לסגת לאחר מספר שניות וקולות נפץ אופייניים, ומניח על מגבת נייר לפשרה. חכה לגליצרול הקפוא האטום להיעלם ואז להקפיא שוב. ניתן לעשות זאת עד 15 שקופיות בנוחות בסיבוב עבור שלושה מחזורי הקפאה / הפשרה.
- Wאפר פעמים PBS במשך 5 דקות ב RT.
- דגירה ב 0.1 M HCl למשך 30 דקות ב RT.
- שטוף בPBS במשך 5 דקות ב RT.
- Permeabilize בX-100/PBS טריטון saponin/0.5% 0.5% למשך 30 דקות ב RT.
- שטוף פעמיים ב PBS במשך 5 דקות ב RT.
- לאזן ב50% formamide/2x SSC לפחות 10 דקות ב RT.
- הבדיקה פיפטה על coverslip. הסר שקופית מהצנצנת ולייבש את כל נוזל עודף סביב נקודת התא (ים) עם מגבת נייר. מהר מתייבש לפוראמיד, לדאוג שלא להתייבש תאים. לשקופיות עם שניים או שלושה כתמים סלולריים, להחיל 10 μl של חללית לכל מקום על גבי 22 מ"מ x 50 מ"מ coverslip מקביל לזהות מיקום בשקופית. הפוך coverslip לשקופית על מקום (ים). לאטום בבטון גומי ולאפשר לזה להתייבש לחלוטין. להגן מפני אור בכל השלבים שלאחר מכן.
- שקופיות לחום 78 מעלות צלזיוס למשך 2 דקות בדיוק על פלטה חשמלית (למשל בלוק חימום הפוך, שלב קריטי: ראה דיון). הנח כיסוי (קופסא קרטון או SIM ilar) על הצלחת החמה כדי להגן מפני אור במהלך denaturation.
- דגירה הלילה על 37 מעלות צלזיוס בתא humidified אור חזק. כדי ללחלח, הנח מגבות נייר בתיבת אור חזק ולצנן במים.
2.2 יום 2
- הכן צנצנות Coplin עם פתרונות בטמפרטורה הנכונה לצעדים לשטוף לאחר מכן. הגן על שקופיות מאור עד כמה שניתן במהלך כל הצעדים הבאים. קפה יכול עושה כיסוי אור חזק טוב לצנצנות Coplin.
- לקלף מלט גומי ושקופית מקום ב2x SSC עד coverslips לשחרר ולהחליק ולנפול.
- שטוף ב50% formamide/2x SSC במשך 15 דקות ב -45 מעלות צלזיוס מכסה מניח על waterbath כדי להגן מפני אור.
- שטוף ב0.2X SSC במשך 15 דקות ב 63 ° C.
- שטוף ב2x SSC למשך 5 דקות בשעה 45 ° C.
- שטוף ב2x SSC למשך 5 דקות ב RT.
- שטוף בPBS במשך 5 דקות ב RT.
- כתם עם DAPI (5 מיקרוגרם / מ"ל ב2x SSC) למשך 2 דקות בצנצנת Coplin ב RT.
- Destain בPBS במשך 5 דקות ב RT.
- לעלות coverslip, פיפטה הרכבה בינונית על גבי coverslip. השתמש 10 μl למקום נייד, באמצעות 22 מ"מ x 22 מ"מ coverslips למקום אחד, ו22 מ"מ x 50 מ"מ coverslips למשך שתיים עד שלוש נקודות. להתנגב PBS סביב נקודת התא ככל האפשר אך היזהר שלא לייבש את התאים. הפוך coverslip לשקופית, וחותם עם לכה מסמר.
תוצאות
הפרוטוקול מתואר כאן (איור 1 לסקירה) נעשה שימוש כדי אפקט נהדר לשלב דגי DNA עם לכידת תמונת תפוקה גבוהה לניתוח של ארגון הגנומי. הדור של בדיקות איכות טובות הוא קריטי להצלחה (ראה דיון). איור 2 מדגים שתי בקרות איכות חשובות לבדיקות דגים. אחרי שניק-תרגום, כתם של ה-DNA צריך להיות גלוי עם כמות גדולה של שברי הריצה נ"ב בין 150 ל 700 (איור 2 א). לאחר צימוד כימי, שילוב של צבע פלואורסצנטי ניתן ללמוד על ידי ניתוח ספקטרוסקופיות של החללית (איור 2).
בעת שימוש בבדיקות טובות, בעקבות פרוטוקול FISH-DNA גורם בדרך כלל לאותות דגים DNA בהירים על רקע נמוך. אנחנו השתמשנו בהצלחה בפרוטוקול זה על מגוון רחב של סוגי תאים שונים, וגם עם מיקרוסקופים עלית הקרינה או confocal. הדמיה אוטומטית באמצעות עלית fluorescenc מיקרוסקופ האלקטרוני דורש אותות דגים חדים, הניתנים לזיהוי בקלות עם קצת רקע (איור 3), ואילו מיקרוסקופיה confocal דורשת אותות אינטנסיביים יותר. איור 4 א מציג תמונות המעובדות מייצגות. ניתן להשיג קואורדינטות גרעיניות של אותות דגים, ויחסים מרחביים של אזורים גנטיים ניתן לחשב (לדוגמה ראה איור 4). יש לנו גם בשימוש ערימות תמונה המתקבלות על ידי מיקרוסקופיה confocal למודלי 3D של אותות דגים בתוך שטחי כרומוזום (סרט 1).
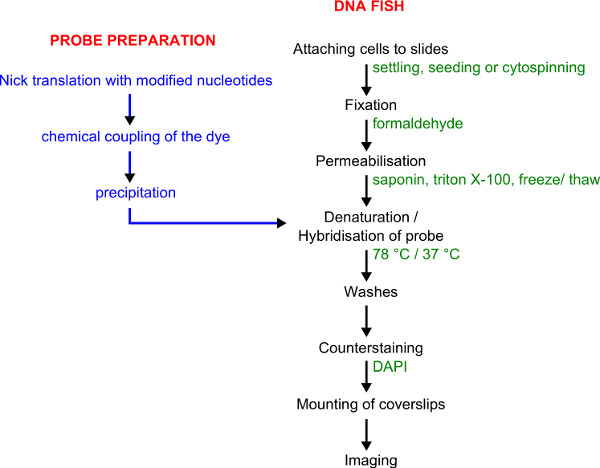
איור 1. זרימת עבודה לתיוג הבדיקה ה-DNA ודגים. הכנת חללית היא מוצגת בכחול. הליך ה-DNA FISH מוצג בשחור עם פרטים שנמסרו בירוק.
= "תמיד"> 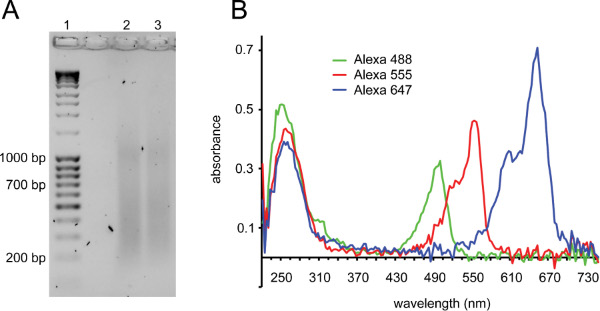
איור 2. תיוג בדיקות על ידי ניק-תרגום ובקרת איכות של בדיקות שכותרת. א) למרוח ג'ל מראה אידיאלי לפני החימום כדי להשבית DNase אני (מסלול 1: סולם DNA, מסלול 2 ו 3: Bács לאחר ניק-תרגום). ברים צריכים להיות בטווח שבין 150-700 נקודות בסיס. כתם נוסף ב~ 1 קילו הוא ציין בתדירות גבוהה עם תגובות ניק-תרגום מוצלחים. ב ') ניתוח ספקטרום מלא Microvolume של בדיקות שכותרת. שיא ה-DNA ב260 ננומטר הוא ציין עם שיא שני מקביל לאורך גל הספיגה של fluorophore הבדיקה תחת כותרת: Alexa פלואוריד 488: 495 ננומטר, Alexa פלואוריד 555: 555 ננומטר, Alexa פלואוריד 647: 650 ננומטר. הראה שלוש בדיקות עם שילוב טוב: פסגות ספיגת fluorophore הן גובה דומה או גבוה יותר מפסגות DNA. יש Alexa פלואוריד 647 בדרך כלל הספיגה גבוהה יותרמAlexa פלואוריד 555, אשר בתורו יש ספיגת גבוהה יותר מאשר Alexa פלואוריד 488. אלקסה פלואוריד 488 גם סופג קצת אור ב 260 ננומטר, ולכן השיא הראשון לבדיקה זו הוא גבוה יותר מהאחרים. בדיקות עם ספיגת fluorophore תכנית שילוב גרועה 2-3-לקפל נמוכות מספיגת ה-DNA. בדיקות עם יותר משיא fluorophore הגבוה פי 2 מאשר ה-DNA השיא מכילות בדרך כלל צבע unconjugated שעלול לגרום לרקע בדגים.
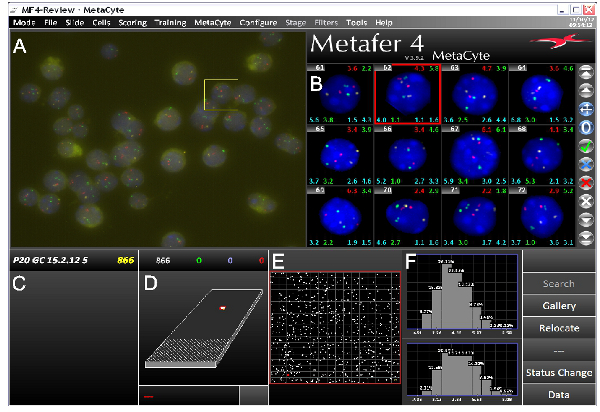
איור 3. צילום מסך מהתוכנה ההדמיה דגי 3D MetaCyte מראה ניסוי דגים בשלושה צבעים אופייניים. המסך מחולק למספר חלקים. תמונה בשדה של נוף (FOV) Raw) שנתפס על ידי מערכת סריקת שקופיות MetaCyte Metafer /. ב ') גלריה של תמונות של גרעינים זיהו כי יש לבטל את עיבוד תמונת dergone ופילוח לאותות דגים. סוגים שונים של נתונים יכולים להיות מוצגים על כל תמונה בגלריה. שם שקופיות במספר תא דוגמה זו מוצג שמאלית עליונה עם interallelic השונים ומרחקי interlocus ימניים עליונה וכל צד מתחת לכל תמונה. C) עם מספר הגרעינים שזוהו בניתוח. ד ') תיאור של השקופית עם האזור שנסרק על ידי מערכת. ה) הגדלה של האזור שנסרק. כתמים לבנים מייצגים זיהו גרעינים לFOV. F) נתונים מעובדים. בדוגמה זו מרחקי interallelic המקסימאליים בין אותות ירוקים (למעלה) ואותות אדומים (תחתון) מוצגים. הנתונים שמוצגים הוא מP20 תאי הנבט של עכבר. בדיקות נמצאות על כרומוזומים שונים, המכסים Hbb וגנים HBA ואשכול היסטון. לחצו כאן לצפייה בדמות גדולה.
. בתוך עמודים = "תמיד"> 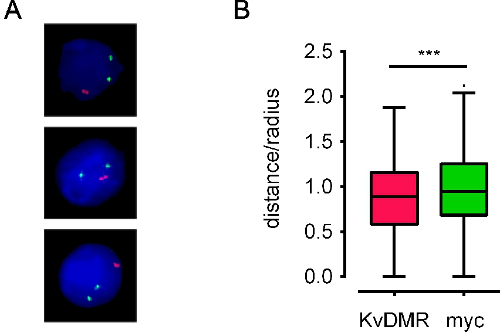
איור 4. דוגמאות לתמונות שעובדו ונתונים positional נגזרו. A תמונות) מעובד לE13.5 תאי כבד עוברי של עכבר מוכתמים בדיקות BAC ממוקמות על כרומוזומים שונים המכסים Myc וKCNQ1 גנים (מכונה myc וKvDMR, בצבע ירוק ואדום, בהתאמה). B) עלילות תיבה-זיף טיוקי המייצגים את מרחק interallelic החלוקה לאותן לוקוסים 600 בגרעינים. מרחק Interallelic הוא להתוות כחלק של רדיוס הגרעין '(מרחק / רדיוס) לדין וחשבון על שינויים בגודל גרעיני. יש גרעיני תאי גזע עובריים ברדיוס של כ 5 מיקרומטר. בדיקות אדומות הן משמעותית יחד קרוב יותר מחלליות ירוקות (***: p <0.01, מבחן t מזווג). נתונים מ10.
סרט 1. מודלים 3D של שני לוקוסים בתוכם לא כרומוזוםerritory. שתי בדיקות BAC ממוקמים קרוב לשני קצוות של כרומוזום 7 בעכבר תויגו (אדום אדום רחוק, (לבן פסאודו בצבע)) והכלאה יחד עם כל צבע כרומוזום (ירוק) לתאי הגזע העובריים של עכבר. לחץ כאן לצפייה בסרט.
Discussion
דגי ה-DNA 3D הפך לכלי להכרה רחבה לנתח סידורים מרחביים בגרעין. בעוד דגים מספק תוצאות חזותיות וישירה, כמו בכל טכניקה, צריך להיות מודעים למגבלותיו. דגי ה-DNA בפני הבעיה המהותית שטיפולים קשים יחסית יש צורך להפוך את הכרומטין נגיש לבדיקות דגים שסופו של דבר משבשים את מבנה הדבר מאוד הגרעיני שהוא להיות מנותחים. כמה אסטרטגיות כבר רדף ללהטט נגישות ושימור מבנה. בפרוטוקול המתואר כאן, ה-DNA הכרומוזומלי נעשתה נגיש על ידי permeabilization הקפאת הפשרה של תאים וDenaturation חום לפני ההכלאה חללית. Solovei, et al., (2002) ניתחו שינויים מבניים לאחר טיפול דומה ומצא כי התזוזה הממוצעת של תחומים הכרומטין הייתה 300 ננומטר אשר מגביל את הרזולוציה של ניתוח מבני לאזורים בערך 1 MB בגנום 8. אמנם זה לא ברזולוציה גבוהה, זההוא בקנה מידה סבירה לניתוח עמדה גרעינית.
שיקול מעשי יותר לניתוח דג הוא שרכישת תמונה ומדידות של מרחקים גרעיניים הן תהליכי זמן רב המגבילים את מספר הגרעינים שניתן לנתח. על מנת ללמוד אירועים נדירים שמטרתם לעשות הדמיה אוטומטית קצב העברת נתונים גבוהה. ואז, עם בקרות מתאימות במקום, ניתן להשוות בכמות מספקת כדי לאפשר ניתוח סטטיסטי חזק של יחסים מרחביים. אנו שגרתי לנתח 600 גרעינים לכל נקודת נתונים שעבורו אנו קובעים את קואורדינטות 3D של כל אותות הדגים בתוך הנפח הגרעיני. נתונים אלה דורשים שטח אחסון קטן מאוד ומאפשרים ניתוח של מרחקים בין משפחות ותוך allelic, או עמדות רדיאליים בכל שלב מאוחר יותר. יתר על כן, אפשר לעשות עיבוד אוטומטי באופן עיוור חוקר אשר מקטין באופן משמעותי את הסבירות להטיה לא מודעת.
כדי לאפשר לanalys תפוקה גבוהה מסוג זההוא, המטרה שלנו הייתה להקים בדרך מהירה ויעילה של ביצוע דגי ה-DNA. מצאנו הפרוטוקול מתואר כאן להיות מאוד חזק, באופן עקבי לייצר אותות בהירים עם רקע נמוך. זה עבד לכל סוגי התאים שניסינו סיפק לנו להתאים את הצעד של הצמדת התאים לשקופית. יתר על כן, עם חריג אחד, כולנו משמשים Bács יכול להפוך לבדיקות בהירות. יש לנו גם זוהו בהצלחה מספר החלבונים גרעיניים על ידי מכתים נוגדן לאחר דגי ה-DNA. בעוד עבור חלבונים מסוימים זה עובד טוב, אנו ממליצים השוואה עם immunofluorescence המסורתי (IF) על מנת להבטיח עקביות של דפוס מכתים הנוגדן בין אם ודגים חיסוני דנ"א (השווה 11).
באופן כללי, מצאנו כי בדיקות שכותרת בצבעים שונים הפיקו את אותן תוצאות. עם זאת, יש לשקול את ההיבטים הבאים בעת בחירת צבע הסימון. ראשית, הצבע של fluorophore צריך להיות גם לזיהוי על ידי u מיקרוסקופSED. שנית, אורך הגל של האור הנפלט על ידי fluorophores צריך להיות שונה במידה מספקת, כדי למנוע דימום דרך לערוץ האחר. זה יהיה תלוי במסננים במיקרוסקופ. והשלישי, לפחות בידיים שלנו, כמה צבעים לייצר אותות בהירים יותר באופן עקבי יותר מאחרים. יש לנו תמיד משמשים DAPI (כחול) כcounterstain שהופך אלקסה פלואוריד 555 (אדום), 488 (ירוק), ו647 (הרבה אדום) בחירות טובות עבור תיוג בדיקות. עם מערכת ההדמיה שלנו, מצא אלקסה פלואוריד 555 (אדום) כדי לייצר את האותות הבהירים ביותר, ואחריו Alexa פלואוריד 488 (ירוק). יש Alexa פלואוריד 647 (הרבה אדום) חסרון שלא ניתן לאתר אותו על ידי העין האנושית ולכן לא ניתן לראות אותות כשמסתכלים למטה למיקרוסקופ. לכן, אם עושים דגים בשני צבעים, אנו ממליצים על שילוב של צבעים אדומים וירוקים.
שתי בעיות עיקריות שעשויות להתעורר: תאים לשטוף מעליו את השקופיות ואותות חלשים. כיצד תאים גם לדבוק בשקופית היא betw עצומה משתנהסוגי een סלולריים, ואת הפרוטוקול הטוב ביותר ליישב / תאי זרע צריך להיות נחושים. אנחנו השתמשנו בהצלחה גם מטען חשמלי חיובי או שקופיות מצופות פולי-L-ליזין (קנה מוכן לשימוש), אבל מצא תאים בדרך כלל דבקו טובים יותר לשקופיות מצופות פולי-L-ליזין. מצאו גם כי כאשר תאים היו אזורים שלמים צפופים מדי הייתם להתקלף כמו סדין, ואילו הדמיה אוטומטית הכבידה אם התאים היו דלילים מדי. לכן, אם המדגם הוא לא יקר מדי, יש זורעים מספרי תאים שונים כדי לקבוע את הצפיפות האידיאלית. אם תאים נוטים לשטוף במיוחד, ניתן להשתמש בעט מחסום הידרופובי, וניתן לבצע את הפעולות דגים על ידי pipetting בזהירות פתרונות ישירות על גבי שקופית. גם מפחית באופן דרסטי Pipetting הכרכים של חומרים כימיים הנחוצים, אבל לוקח זמן רב יותר במידה ניכרת כאשר עושה מספר שקופיות.
אותות חלשים הם בדרך כלל עקב בדיקות עניות, וזה בהחלט שווה להשקיע את הזמן לעשייה טוב. הנקי BAC-DNA יש להשתמשד כחומר מוצא אשר ניתן להשיג על ידי משקעים חוזרים ונשנים או ערכות זמינות מסחרי. זיהום חיידקים עם הדנ"א הגנומי משפיע לרעה על איכות בדיקה וטיפול זהיר במהלך תמוגה תא וסינון של lysate התא נדרש כדי לשמור אותו למינימום. , היא, לעומת זאת אין צורך להשתמש בצעד exonuclease לעיכול ה-DNA ליניארי, כמו זה מפחית תשואה במידה רבה. תיוג יעיל של הבדיקה הוא קריטי. בקרת האיכות החשובה ביותר של שלב זה היא לבדוק את גודל השבר לאחר תרגום ניק (ראה נציג תוצאות). למרוח 'טוב' כמעט תמיד יגרום לחללית צבעונית. עם זאת, מצאנו שמדי פעם BAC מסוים לא יכול להיות מעובד לתוך חללית טובה, וBAC שונה צריך להיות נבחרים. צעד חשוב נוסף הוא denaturation חום. אם הטמפרטורה נמוכה מדי, ה-DNA יהיה רק באופן חלקי מפוגל וכלת חללית תהיה לקויה. אם הטמפרטורה גבוהה מדי, מבנה הגרעיני wiתהיה מוטרד יותר ממה שנחוץ. בידיים שלנו, 78 מעלות צלזיוס בבלוק חם הפוך היא הפשרה האידיאלית, אבל זה עשוי להשתנות בהתאם לבלוק החם המתאים בשימוש.
היו לנו תוצאות טובות באמצעות הרכבה בינונית Vectashield, אבל גילינו שיש לו פחות זהב SlowFade רקע ומשמר את אות הניאון למשך זמן ארוך יותר. אנו לא ממליצים על שימוש בהרכבה בינונית קשה להגדיר כפי שמצאנו את זה כדי להשפיע על מבנה 3D וליצור בועות אוויר לאורך זמן.
לסיכום, בהיר בדיקות ניאון ישירות כותרתו יחד עם פרוטוקול FISH-DNA תואר כאן מציעות פתרון יעיל לניתוח חזק ומהיר של ארכיטקטורה גרעינית אשר חל על מגוון רחב של שאלות ביולוגיות.
Disclosures
ההפקה של מאמר זה באופן חלקי בחסות Zeiss וMetaSystems קארל.
Acknowledgements
עבודה זו מומנה על ידי BBSRC וקרן Wellcome. ברצוננו להודות לסיימון ווקר לקבלת סיוע עם הדמיה ופליקס קרוגר לעזרה עם ניתוח bioinformatic.
Materials
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||||||||||
| Reagent/Material | |||||||||||||||||||||||||||||||||||||||
| NTB buffer | Step 1.1.1 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||||
| DTT | Invitrogen | D-1532 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| dNTPs | Bioline | BIO-39025 | Step 1.1.1 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| Aminoallyl-dUTP | Ambion | AM8439 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| DNA Polymerase I | New England Biolabs | M02095 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| DNase I recombinant RNase free | Roche | 4716728001 | Step 1.1.1 | ||||||||||||||||||||||||||||||||||||
| QIAquick PCR purification kit | Qiagen | 28104 | Step 1.1.4, 1.2.3 | ||||||||||||||||||||||||||||||||||||
| NaOAc | VWR | 27653 | Step 1.1.5, Step 2.1.1.2 | ||||||||||||||||||||||||||||||||||||
| NaHCO3 | Sigma | S5761 | Step 1.2.1 | ||||||||||||||||||||||||||||||||||||
| Alexa Fluor Reactive Dye Decapacks for Microarray Applications | Invitrogen (Molecular Probes) | A32750, A32756, A32757 | Step 1.2.2 | ||||||||||||||||||||||||||||||||||||
| DMSO (anhydrous) | Sigma Aldrich | 276855 | Step 1.2.2 | ||||||||||||||||||||||||||||||||||||
| SYBR Safe DNA gel stain | Life Technologies | S33102 | Step 1.2.4 (alternative to ethidium bromide) | ||||||||||||||||||||||||||||||||||||
| Cot-1 DNA | Invitrogen | 18440-016 | Step 2.1.1.1 (Cot-1 DNA can be home-made in large quantities and works just as well) | ||||||||||||||||||||||||||||||||||||
| Single stranded DNA from salmon testes | Sigma | D7656 | Step 2.1.1.1 | ||||||||||||||||||||||||||||||||||||
| Deionised formamide | Sigma | F-9037 | Step 2.1.1.3 (Health hazard) | ||||||||||||||||||||||||||||||||||||
| Dextran sulphate | Sigma Life Sciences | D8906 | Step 2.1.1.4 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| XMP painting probes | MetaSystems | 000000-0528-837 | Step 2.1.1.4 | ||||||||||||||||||||||||||||||||||||
| Poly-L-lysine coated slides | Sigma Aldrich | P0425 | Step 2.1.2 | ||||||||||||||||||||||||||||||||||||
| Hydrophobic pen (ImmEdge) | Vector Laboratories | H-4000 | Step 2.1.2 | ||||||||||||||||||||||||||||||||||||
| 70 μm sieve (Mouse f–tal liver cells only) | BD Falcon | 352350 | Step 2.1.2.1 | ||||||||||||||||||||||||||||||||||||
| PFA | Sigma Aldrich | P6148 | Step 2.1.3 (Flammable, corrosive, acute toxicity, health hazard) (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| Tris-Cl | Step 2.1.3 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||||
| Saponin from Quillaja bark | Sigma Aldrich | 47036 | Step 2.1.4, 2.1.11 (Acute toxicity), (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||
| Triton X-100 | Sigma | T9284 | Step 2.1.4, 2.1.11 (Acute toxicity, hazardous to the environment) | ||||||||||||||||||||||||||||||||||||
| 10 x PBS | Life Technologies (GIBCO) | 70011-036 | Step 2.1.4, 2.1.5, 2.1.6, 2.1.8, 2.1.10, 2.1.11, 2.1.12, 2.2.7, 2.2.9, | ||||||||||||||||||||||||||||||||||||
| Glycerol | Fisher Scientific | G/0650 | Step 2.1.6 | ||||||||||||||||||||||||||||||||||||
| HCl | VWR | 20252 | Step 2.1.9 (Acute toxicity, corrosive) | ||||||||||||||||||||||||||||||||||||
| Formamide | Sigma Aldrich | 47670 | Step 2.1.14, 2.2.3 (Health hazard) | ||||||||||||||||||||||||||||||||||||
| SSC | Step 2.1.14, 2.2.2-2.2.6, 2.2.8 (See 'FISH buffers and reaction mixes' list below) | ||||||||||||||||||||||||||||||||||||||
| Coverslips 22 x 22 | Menzel-Glaser | BB022022A1 | Step 2.1.15 | ||||||||||||||||||||||||||||||||||||
| Coverslips 22 x 50 | Menzel-Glaser | BB022050A1 | Step 2.1.15 | ||||||||||||||||||||||||||||||||||||
| Rubber cement | Marabu | 2901 (10 000) | Step 2.1.15 (Flammable, health hazard, danger to the environment) | ||||||||||||||||||||||||||||||||||||
| DAPI | Invitrogen Molecular Probes | D3571 | Step 2.2.8 (Health hazard) | ||||||||||||||||||||||||||||||||||||
| SlowFade Gold | Invitrogen | S36936 | Step 2.2.10 (mounting medium) | ||||||||||||||||||||||||||||||||||||
| Clear nail polish | Any supplier | Step 2.2.10 | |||||||||||||||||||||||||||||||||||||
| Equipment | |||||||||||||||||||||||||||||||||||||||
| Nanodrop 2000 | Thermo Scientific | Step 1.1.6, 1.2.4 (microvolume spectroscopy) | |||||||||||||||||||||||||||||||||||||
| Typhoon FLA 7000 phosphoimager | GE Life Sciences | Step 1.2.4 | |||||||||||||||||||||||||||||||||||||
| Coplin jars | Sigma-Aldrich | S6016 (6EA)/S5516 (6EA) | Step 2.1.3 onwards | ||||||||||||||||||||||||||||||||||||
| Liquid nitrogen dewar | Any supplier | Step 2.1.7 | |||||||||||||||||||||||||||||||||||||
| Base with Black Lid (light-tight chamber) | Simport | M920-2 | Step 2.1.17 | ||||||||||||||||||||||||||||||||||||
| Thermomixer comfort | Eppendorf | 5355 000.011 | Step 2.2.3 (or use shaker in a 37 °C room) | ||||||||||||||||||||||||||||||||||||
| Imaging and Image processing | |||||||||||||||||||||||||||||||||||||||
| Metafer - Imaging Automation Platform | MetaSystems | automated imaging software | |||||||||||||||||||||||||||||||||||||
| MetaCyte - Automated Interphase FISH analysis | MetaSystems | automated imaging software | |||||||||||||||||||||||||||||||||||||
| Axio Imager Z2 upright | Zeiss | epifluorescence microscope used with automated imaging | |||||||||||||||||||||||||||||||||||||
| IX81 confocal microscope (FV1000) | Olympus | confocal microscope | |||||||||||||||||||||||||||||||||||||
| Bitplane, version 7.3 | Imaris | image analysis and 3D modelling software | |||||||||||||||||||||||||||||||||||||
| Scientific volume Imaging, version 4.1 | Huygens | image analysis and deconvolution software | |||||||||||||||||||||||||||||||||||||
FISH buffers and reaction mixes
| |||||||||||||||||||||||||||||||||||||||
References
- Chakalova, L., Debrand, E., Mitchell, J. A., Osborne, C. S., Fraser, P. Replication and transcription: shaping the landscape of the genome. Nat. Rev. Genet. 6, 669-677 (2005).
- Misteli, T. Beyond the sequence: cellular organization of genome function. Cell. 128, 787-800 (1016).
- de Wit, E., de Laat, W. A decade of 3C technologies: insights into nuclear organization. Genes Dev. 26, 11-24 (2012).
- Sambrook, J., Russell, D. . Molecular Cloning: A laboratory Manual. , (2000).
- Boyle, S., Rodesch, M. J., Halvensleben, H. A., Jeddeloh, J. A., Bickmore, W. A. Fluorescence in situ hybridization with high-complexity repeat-free oligonucleotide probes generated by massively parallel synthesis. Chromosome Res. 19, 901-909 (2011).
- Brown, K. Visualizing nuclear proteins together with transcribed and inactive genes in structurally preserved cells. Methods. 26, 10-18 (2002).
- Hewitt, S. L., Yin, B., et al. RAG-1 and ATM coordinate monoallelic recombination and nuclear positioning of immunoglobulin loci. Nat. Immunol. 10, 655-664 (2009).
- Solovei, I., Cavallo, A., et al. Spatial preservation of nuclear chromatin architecture during three-dimensional fluorescence in situ hybridization (3D-FISH. Experimental Cell Research. 276, 10-23 (2002).
- Solovei, I., Beatty, B., Mai, S., Squire, J. FISH on three-dimensionally preserved nuclei. FISH: A Practical Approach. , (2002).
- Krueger, C., King, M. R., et al. Pairing of homologous regions in the mouse genome is associated with transcription but not imprinting status. PLoS One. 7, e38983 (2012).
- Solovei, I., Cremer, M., Bridger, J. M., Volpi, E. V. 3D-FISH on Cultured Cells Combined with Immunostaining. Fluorescence in situ hybridization (FISH): Protocols and Applications. , (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved