A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ثابت للدولة، قبل المطرد للدولة، واحدة دوران قياس الحركية للنشاط الحمض النووي Glycosylase
In This Article
Summary
الدورات الزمنية لنشاط glycosylase من 8 oxoguanine glycosylase DNA هي ثنائي الطور واظهار وابلا من تشكيل المنتج ومرحلة ثابتة للدولة الخطية. استخدام تقنيات تدفق إخماد، وانفجر ويمكن قياس معدلات ثابتة للدولة، والتي تتوافق مع استئصال 8 oxoguanine والإفراج عن glycosylase من الحمض النووي المنتج، على التوالي.
Abstract
الإنسان 8 oxoguanine DNA glycosylase (OGG1) المكوس والتشوهات الخلقية التأكسدي الآفة DNA 8 أوكسو-7 ،8-dihydroguanine (8 oxoG) من الحمض النووي. ويجري توصيف الحركية للOGG1 لقياس معدلات الختان 8 oxoG والافراج عن المنتج. عندما يكون تركيز OGG1 أقل من الحمض النووي الركيزة، ملاعب وقت تكوين المنتج هي ثنائي الطور؛ ويعقب مرحلة الأسي السريع (أي انفجار) من تشكيل المنتج من قبل مرحلة ثابتة للدولة الخطية. انفجار الأولي من تشكيل المنتج يتوافق مع تركيز الإنزيم تعمل بشكل صحيح على الركيزة، والسعة انفجار يعتمد على تركيز الانزيم. معدل من الدرجة الأولى المستمر للانفجار يتوافق مع معدل لا يتجزأ من الختان 8 oxoG ويقيس معدل ثابت للدولة أبطأ معدل إصدار المنتج (منتج DNA معدل التفكك المستمر، ك إيقاف). هنا، نحن تصف نهج ثابت للدولة، قبل المطرد للدولة، ودوران واحد لعزل وقياس SPخطوات ecific خلال OGG1 الدراجات الحفاز. ويستخدم الفلورسنت المسمى قليل النوكليوتيد المحتوية على الآفة وOGG1 تنقيته لتسهيل القياسات الحركية الدقيقة. حيث يتم استخدام تركيزات منخفضة انزيم لإجراء قياسات ثابتة للدولة، ودليل خلط الكواشف والتبريد من رد الفعل لا يمكن أن يؤديها للتأكد من معدل ثابت للدولة (ك إيقاف). بالإضافة إلى ذلك، استقراء معدل ثابت للدولة إلى نقطة على الإحداثي في وقت الصفر يشير إلى أن وابلا من تشكيل المنتج وقعت خلال دوران الأول (أي التقاطع y موجبة). معدل ثابت من الدرجة الأولى من مرحلة انفجار الأسي يمكن قياسها باستخدام تقنية الخلط والتبريد السريع الذي يتناول كمية المنتج شكلت في فترات زمنية قصيرة (<1 ثانية) قبل مرحلة ثابتة للدولة ويتوافق مع معدل 8 -oxoG الختان (أي الكيمياء). ويمكن أيضا أن الخطوة الكيميائية يمكن قياسها باستخدام نهج دوران واحد حيث ركوب الدراجات الحفاز هوالوقاية منها عن طريق الحمض النووي تشبع الركيزة مع انزيم (E> S). ويمكن لهذه المناهج قياس الثوابت معدل الابتدائية التي تؤثر على كفاءة إزالة آفة الحمض النووي.
Introduction
بيئة الهوائية يعجل عدم الاستقرار الجيني. A الآفة DNA promutagenic رئيسية ناجمة عن الإجهاد التأكسدي هو 7،8-ثنائي هيدرو-8-oxoguanine (8 oxoG). ويرجع ذلك إلى إمكانية الترميز غامضة من 8 oxoG هذا. الإنسان 8 oxoguanine DNA glycosylase (OGG1) هي المسؤولة عن الشروع في قاعدة إصلاح الختان من 8 oxoG. النشاط glycosylase من OGG1 المكوس قاعدة 8 oxoG الناتجة في الحمض النووي المنتج مع موقع منزوع البورين (AP-موقع). A النشاط ياز ضعف OGG1 يمكن شق الموقع AP في بعض الحالات.
توصيف الحركية للglycosylases الحمض النووي يرى عموما أن هم يعرضون دورات الوقت ثنائي الطور. بعد مرحلة سريع الأولي من تشكيل المنتج (أي انفجار)، ويلاحظ مرحلة ثابتة للدولة خطي 1-3. هذا السلوك يدل على الخطوة التالية الكيمياء (أي تغيير متعلق بتكوين جزئي أو إطلاق المنتج) يجري معدل منظم أثناء جزء خطية من دورة الزمن، في حين أن برسانت المرحلة، غالبا ما يشار الى مرحلة عابرة، يتوافق مع تشكيل المنتج في موقع نشط انزيم خلال الدورة الأولى من رد الفعل. عندما إطلاق المنتج هو معدل الحد خلال مرحلة ثابتة للدولة، توفير قياسات النشاط مقياس النوعية من الناتج الحمض النووي تقارب ملزمة، ولكنها لا توفر المعلومات الحركية بشأن الأحداث في موقع نشط انزيم (أي الكيمياء). وفقا لذلك، هناك حاجة إلى أساليب لعزل وقياس مرحلة ما قبل انفجار ثابت للدولة الأسي للتحقيق في الأحداث خلال أول دوران الأنزيمية في موقع نشط 4 الإنزيم.
هناك ثلاثة مناهج الحركية القياسية لتوصيف السلوك الحفاز OGG1، (1) الحالة المستقرة، (2) ما قبل ثابت للدولة، و (3) واحد دوران. هذه الأساليب تختلف عن بعضها البعض من تركيز الانزيم في خليط التفاعل والإنزيم إلى نسبة الركيزة المستخدمة في كل نهج. في نهج ثابت للدولة نموذجية،يشار إليها أحيانا باسم حركية دوران متعددة، وتستخدم التركيزات المنخفضة من الانزيم لمتابعة تشكيل المنتج. تركيز الركيزة يتجاوز كثيرا من تركيز الانزيم بحيث تحولات متعددة الأنزيمية لا تؤثر بشكل ملحوظ تركيز الركيزة. في هذه الحالة، ينبغي أن تكون دورات الزمن الخطي وغالبا ما يكون من الصعب تمييز ما إذا كان انفجار وقع أثناء دوران الأول بسبب تركيز انزيم منخفضة تستخدم في هذا النهج، علما أن السعة انفجر ما يعادل تركيز الانزيم. ويمكن التغلب على هذا باستخدام تركيز انزيم العالي واستقراء مسار الزمن الخطي إلى وقت الصفر للكشف عن ما إذا كان أول دوران الأنزيمية حدث بسرعة. التقاطع على الإحداثي (المحور الصادي) وينبغي أن يكون متناسبا مع تركيز الانزيم ويوفر قدرا من الانزيم تشارك بنشاط مع الركيزة. ورغم أن هذا النهج يمكن من حيث المبدأ تقديم أدلة على وجود مرحلة الاندفاع، وDIFمطلوب نهج مختلفتين لقياس حركية مرحلة الانفجار. في كثير من الحالات في المرحلة انفجار سريع جدا لقياس بواسطة تقنيات المزج والتبريد اليدوي. في هذه الحالة، ما قبل الحركية ثابت للدولة ودوران واحد (أي الحركية عابرة) تقترب غالبا ما تتطلب أداة سريعة لخلط والتبريد لمتابعة نقاط وقت مبكر من رد فعل 5. في نهج ما قبل ثابت للدولة وتستخدم تركيزات عالية من انزيم بحيث كمية كبيرة من المنتج وشكلت أثناء دوران الأول. منذ يتم اتباع تحولات متعددة لمراقبة الدراجات الحفاز (أي المرحلة الخطي الذي يلي انفجار)، وتركيز الركيزة أكبر من تركيز انزيم ([إنزيم] <[الركيزة]). لعزل الأحداث في موقع نشط من الانزيم دون ركوب الدراجات الحفاز، وتستخدم ظروف دوران واحد. في هذه الحالة، غير المشبعة الركيزة مع انزيم (E >> S) حتى يتسنى لجميع من الركيزة ستشارك أنان 'دوران واحد' وسوف تظهر عادة بطبيعة الحال الوقت الأسي واحد.
وكما لوحظ أعلاه للحصول على الانزيمات التي تظهر في مرحلة الاندفاع، إصدار المنتج (ك إيقاف) كثيرا ما يحد من معدل المرحلة الحالة المستقرة للدوام. معدل إصدار المنتج (. الوقت / V SS، اضرب) يمكن تحديد من المنحدر من مرحلة ثابتة للدولة الخطية. هناك حاجة إلى تركيز الانزيم النشط (E) لتحويل نسبة من الافراج عن المنتج إلى معدل الجوهرية ثابتة حيث k = V قبالة SS / [E]. الأهم من ذلك أن تركيز الانزيم النشط هو أقل عادة من تركيز قياس البروتين بسبب الشوائب، إنزيم غير نشط، إنزيم ملزمة غير منتجة إلى الركيزة، والطريقة المستخدمة لتحديد تركيز البروتين. يمكن تحديد تركيز انزيم بالموقع من السعة انفجار عند إطلاق المنتج هو بطيء. وبالتالي، استقراء مسار وقت ثابت للدولة إلىالساعة الصفر تقديرا من انزيم نشط اللازمة لحساب ك قبالة (إصدار المنتج) من معدل ثابت للدولة المرصودة.
لقياس حركية انفجر، نهج ما قبل ثابت للدولة ضروري لمتابعة تشكيل المنتج أثناء دوران الأولى التي يحدث قبل مرحلة ثابتة للدولة الخطية. حركية انفجار يلي تشكيل انزيم منتج وسيط. مرة واحدة يبدأ رد الفعل عن طريق خلط الانزيم مع الركيزة، وكمية من الإنزيم المنتج بشكل سريع حتى يصل إلى مرحلة رد الفعل حالة مستقرة. إذا الحفز هو أكثر من ذلك بكثير السريع من إصدار المنتج، واتساع انفجار تساوي الانزيم تشارك بنشاط والنهج الأسي المرصودة للتوازن (K OBS) يتوافق مع معدل التحويل الكيميائي للالركيزة للمنتج، على افتراض أن معدل العكسي لل كيمياء لا يكاد يذكر.
في بعض الحالات قبرصي الحفازتتشبث يتداخل مع تحليل ما قبل ثابت للدولة، مثل عندما مقادير من معدلات للكيمياء وإطلاق المنتج ليست مختلفة بشكل كبير. في هذه الحالة، وتوظيف فائض نسبي انزيم إلى الركيزة يمنع ركوب الدراجات الحفاز وحدود الركيزة ملزمة مع الانزيم لدوران واحد. وفقا لذلك، فإن الخطوة الأولى الكيميائية من رد فعل يمكن أن تكون معزولة وتحديدها بدقة وثابت معدل من الدرجة الأولى (K OBS). هذا معدل ثابت يجب ان يكون مماثلا لK OBS تحديد من قبل نهج ثابت للدولة المذكورة أعلاه.
نحن هنا وصف كيف يمكن لهذه المناهج الحركية يمكن استخدامها لتحليل النشاط glycosylase من OGG1.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إعداد إنزيم الحمض النووي والركيزة
- الإفراط في التعبير عن OGG1 كما بروتين GST الانصهار في E. كولاي، واستخدام GST-شعارا لتنقية، ثم قم بإزالة العلامة من قبل GST-الانقسام مع الهريفي-3C البروتيني (الشكل 1) 6.
- شراء تصنيعه كيميائيا 5'-6-carboxyfluorescein (6 FAM) المسمى قليل النوكليوتيد تحتوي على بقايا واحدة 8-oxoG ومكملة أونلبلد حبلا قليل النوكليوتيد لها. وأليغنوكليوتيد] 34 مير تحتوي على oxoG-8 في موقف 17 من 5'نهاية. تنقية هذه أليغنوكليوتيد] عن طريق بولي أكريلاميد الكهربائي للهلام.
- إعداد الركيزة الحمض النووي المزدوج تقطعت بهم السبل تحتوي على 8 oxoG عن طريق خلط 5'-6-FAM قليل النوكليوتيد المسمى مع حبلا المكملة له في نسبة المولي من 1:1.2 في الصلب العازلة (10 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 7.5، 50 ملي مول كلوريد الصوديوم، 1 ملي EDTA) في 1.5 مل microfuge أنبوب. وضع أنبوب في عوامة في الماء المغلي لمدة 5 دقائق. ترك الأنبوب في مكان ومن ثم السماح للماء بارد ببطء إلى Rدرجة الحرارة OOM (وهذا يستغرق حوالي 2 ساعة).
- تنفيذ إعداد العينات والتجربة تحت ظروف الإضاءة الخافتة أو أدنى وذلك لتقليل photobleaching من التسمية الفلورسنت.
2. قياس دوام ثابت للدولة والمعايرة بالموقع الموقع من OGG1
2.1. إعداد العينات ودوام ثابت للدولة
- إعداد الركيزة الحمض النووي وOGG1 الحلول بشكل منفصل في رد فعل العازلة (50 ملي HEPES، ودرجة الحموضة 7.5، 20 ملي بوكل، 0.5 ملي EDTA، و 0.1٪ ألبومين المصل البقري) في 1.5 مل أنابيب microfuge على الجليد. تركيز الحمض النووي هو 400 نانومتر، وتركيز واضح من OGG1 هو 30، 60، 90، أو 120 نانومتر على النحو الذي يحدده فحص البروتين برادفورد. وضع أنابيب رد فعل في مجموعة كتلة الحرارة عند 37 درجة مئوية. انزيم قبل احتضان والحلول الركيزة الحمض النووي بشكل منفصل عند 37 درجة مئوية لمدة 1 دقيقة.
- بدء رد فعل عن طريق خلط كميات متساوية من الحلول الركيزة OGG1 والحمض النووي من قبل pipetting. بعد خلط هذه المحاليلستعقد 01:01 (V / V)، وتركيزات النهائية هي 200 نانومتر DNA و 15، 30، 45، أو 60 نانومتر OGG1، على التوالي. إزالة مأخوذة (10 ميكرولتر) في فترات زمنية وإخماد رد فعل عن طريق خلط مع 1 ميكرولتر من 1 M هيدروكسيد الصوديوم. كما سيطرة للدورات الوقت، 10 ميكرولتر من خليط التفاعل دون إنزيم يتم مزجه مع 1 ميكرولتر من 1 M هيدروكسيد الصوديوم.
- وضع عينات التفاعل في 90 ° C كتلة الحرارة لمدة 5 دقائق ليلتصق المنتج الناتجة AP-موقع. بعد التسخين، إضافة 1 ميكرولتر من 1 M حمض الهيدروكلوريك لتحييد كل عينة.
- إضافة حجم مساو (12 ميكرولتر) من هلام العازلة تحميل (95٪ الفورماميد، 20 ملي EDTA، 0.02٪ برموفينول، و 0.02٪ cyanol الزيلين) لكل عينة رد فعل، ثم ضع الخليط في كتلة الحرارة وضعت في 95 ° C لمدة 2 دقيقة، ثم وضع على الفور الأنبوب على الجليد.
- تحميل عينات (5 ميكرولتر) في الصعود إلى 15٪ هلام بولي أكريلاميد تغيير طبيعة تحتوي على 8 M اليوريا في 89 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 8.8، 89 ملم حمض البوريك، و 2 ملي EDTA. الركيزة والمنتجات المشقوق يتم فصل جيدا بعدتشغيل هلام.
2.2. التصوير من هلام
- مسح الجل باستخدام تصوير التي يمكن الكشف عن الحمض النووي fluorescently المسمى وتصور الركيزة وشرائح المنتج.
- تحديد نطاقات بعد التصوير الجل. لاحظ أن بعض انشقاق الخلفية يمكن ملاحظة بعد العلاج من الركيزة نفسها مع هيدروكسيد الصوديوم (الشكل 2A). طرح هذه الخلفية من المبلغ يقاس من كل ناتج التفاعل.
2.3. تحليل البيانات
- رسم كمية من المنتج في كل مرة شكلت رد فعل (ر) (الشكل 2B). تحليل البيانات الخام باستخدام المعادلة 1 لتحديد السعة من انفجار (A 0، التقاطع y) والمنحدر من مرحلة ثابتة للدولة الخطية (V SS).
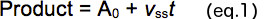
- مؤامرةالنسبية التقاطع y إلى تركيز البروتين الكلي (أي تركيز الانزيم واضح؛ الشكل 2C)، وتوفير مقياس لجزء نشط من الانزيم. استخدام نوبة خطي مع اعتراض صفر على توفير معامل التصحيح لتحديد جزء من الإنزيم النشط.
- رسم معدل ثابت للدولة نسبة إلى تركيز انزيم نشط (الشكل 2D)، وتوفير معدل التفكك المنتج ثابت (أي ميل الخط المجهزة).
3. قياس دوام قبل المطرد للدولة
كما هو مبين في الشكل 2، وتشكيل المنتج خلال مرحلة انفجار سريع جدا لقياس عن طريق خلط اليدوي والتبريد. وبالتالي، يمكن صك تدفق إخماد السريع توفير وسيلة قوية لقياس ردود الفعل السريعة التي تحدث على مقياس الوقت ميلي ثانية واحدة (الشكل 3) 5. يستخدم أداة محرك الأقراص الكمبيوتر التي تسيطر عليها لخلط بسرعةالثانية إرواء ردود الفعل بعد أوقات رد الفعل المحدد. على سبيل المثال، استخدام Kintek RQF-3 السريع الصك تطفئوا التدفق لقياس مرحلة الاندفاع الأولي ومرحلة ثابتة للدولة لاحقة من تشكيل المنتج يحفزه OGG1. تتوفر أدوات تطفئوا التدفق السريع من العديد من الشركات المصنعة.
3.1. إعداد عينة
إعداد على حدة الركيزة الحمض النووي وOGG1 الحلول في أنابيب 1.5 مل كما هو موضح في 2-1. تركيزات الحمض النووي وOGG1 النشطة هي 400 نانومتر و 80 نانومتر، على التوالي. هذه النتائج في تركيزات النهائي من 200 نانومتر DNA و 40 نانومتر OGG1 بالموقع بعد خلط 01:01 (V / V).
3.2. إعداد صك السريع تدفق إخماد
- ربط حمام مائي تعميم على أداة تدفق إخماد السريع للسيطرة على درجة الحرارة (37 درجة مئوية).
- ضبط المعلمات الصك وتحديد حلقة رد الفعل المناسب في الوقت المطلوب النقاط وفقا لمدرس الشركة المصنعةستعقد. الحلقات هي رد فعل من أطوال متغير لتوفير أوقات رد الفعل بديل.
- إعداد رد فعل العازلة وهيدروكسيد الصوديوم إرواء حلول في 10 مل لور قفل المحاقن ونعلق هذه الحقن إلى الموانئ القرص وتحميل الخزانات محرك مع العازلة رد فعل (الحقن ب) و 142 ملي هيدروكسيد الصوديوم (حقنة س) (صمامات تحميل الحقنة في موقف LOAD) . لإزالة فقاعات الهواء من الحقنة، والعمل على حل ذهابا وإيابا عدة مرات.
- خفض موتور السائر حتى إنها تجري اتصالات مع أعلى المحاقن (الصمامات تحميل المحاقن والصمامات تحميل عينة في موقف النار).
- مسح عينة حلقات، حلقة رد الفعل، والخط الخروج مع الماء والميثانول. تجفيف مناطق طهرتها تماما (الصمامات في موقف FLUSH).
3.3. بالطبع الوقت قبل ثابت للدولة
- جعل ثقب في الجزء العلوي من أنبوب 1.5 مل توج باستخدام إبرة عيار 16. إرفاق الأنبوب في الخط خروج لجمع رد فعل مروي.
- تعيين reactio المطلوبالوقت N (بالثواني) باستخدام لوحة المفاتيح. فإن السائر نسخة احتياطية لضبط حجم حلقة وذلك للحفاظ على حجم إخماد ثابتة. الغطاسون موقف لحقنة ضد B منصة السائر بإضافة العازلة مع المحاقن التي تعلق على محرك المنافذ.
- ملء 1 مل لور قفل المحاقن مع الركيزة الحمض النووي وOGG1 الحلول، على التوالي (صمامات عينة في موقف الحمل). نعلق المحاقن مع الركيزة الحمض النووي وOGG1 حلول لكل من موانئ تحميل عينة، ومن ثم ملء نموذج حلقات مع الركيزة الحمض النووي وOGG1 الحلول، على التوالي (صمامات تحميل عينة في موقف الحمل).
- تعيين كافة صمامات تحميل المحاقن وصمامات تحميل نموذج لموقف إطلاق النار. بدء رد فعل من جانب السكتة الدماغية لوحة المفاتيح (على سبيل المثال الصحفي "G" أو "ابدأ" مفتاح). الركيزة الحمض النووي وOGG1 حلول (18 ميكرولتر لكل منهما) يتم خلط فورا في حلقة رد الفعل.
- الانتظار حتى تطفئ رد فعل تلقائيا في وقت رد الفعل المطلوب عن طريق خلط 36 ميكرولتر من Rخليط eaction مع 86 ميكرولتر من 142 ملي هيدروكسيد الصوديوم. بعد التبريد رد الفعل، لا تبرأ عينة من الخط الخروج.
- ضبط صمامات تحميل حقنة لموقف LOAD وصمامات تحميل نموذج لموقف دافق. مسح عينة حلقات، حلقة رد الفعل، والخط الخروج مع الماء والميثانول وتجف كما هو موضح في 3.2. كرر الإجراء أعلاه للحصول على كل نقطة زمنية.
- إجراء تجربة التحكم دون إنزيم لتحديد تصحيح الخلفية، والتي يمكن أن يتم يدويا أو مع الصك السريع إخماد. لأداء عنصر تحكم مع الصك السريع إخماد، وملء نموذج لحلقة الحمض النووي DNA مع الركيزة ولكن الحفاظ على حلقة عينة لOGG1 فارغة. ضبط الوقت رد فعل، نفذ المزيج وإخماد كما هو موضح في 3.3.4-3.3.6.
- غسل عينة حلقات وحلقة التفاعل مع هيدروكسيد الصوديوم M 2، 2 M حمض الهيدروكلوريك والماء، والميثانول وثم تجفيف خطوط غسلها. بعد تعيين السائر موتور لموقف البيت، تبديل صمامات تحميل المحقنة إلى positio LOADن وغسل الخزانات القرص مع الماء.
- علاج عينات مروي رد فعل مع الحرارة، ومن ثم الركيزة منفصلة والحمض النووي المنتج بنسبة 15٪ تغيير طبيعة بولي أكريلاميد الكهربائي للهلام كما هو موضح في 2.1.
- تصور وتحديد نطاقات على الجل كما هو موضح في 2.2.
3.4. تحليل البيانات
تناسب هذه الدورات وقت تكوين المنتج من خلال تحليل الانحدار غير الخطية لمعادلة مع ارتفاع شروط الأسي والخطي (المعادلة 2) توفير معدل ثابت من الدرجة الأولى (K OBS)، واتساع انفجار (A 0)، و معدل الخطية (V SS).
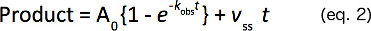
4. واحد دوران دورة تدريبية
- إعداد الركيزة الحمض النووي وOGG1 في 1.5 مل أنابيب منفصلة كما هو موضح في 2-1. وتركيزاتستعقد من الحمض النووي وOGG1 بالموقع هي 100 نانومتر و 500 نانومتر، على التوالي، وهذا غلة تركيزات النهائي من 50 نانومتر DNA و 250 نانومتر OGG1 بعد خلط 01:01 (V / V).
- إعداد صك تدفق إخماد السريع وتحضير عينات رد فعل كما هو موضح في 3.2 و 3.3.
- علاج عينات رد فعل مروي مع الحرارة وإخضاعها إلى 15٪ تغيير طبيعة بولي أكريلاميد الكهربائي للهلام لالركيزة والمنتجات منفصلة كما هو موضح في 2.1.
- تصور وتحديد نطاقات على الجل كما هو موضح في 2.2.
- تناسب هذه الدورات وقت تكوين المنتج إلى الأسي واحدة لتحديد معدل ثابت من الدرجة الأولى (K OBS) على النحو الوارد في المعادلة 3.
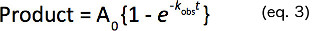
Access restricted. Please log in or start a trial to view this content.
النتائج
تم إجراء التحليل الحركي ثابت للدولة باستخدام 200 نانومتر الركيزة الحمض النووي وأربعة تركيزات مختلفة من الواضح OGG1 (15، 30، 45، و 60 نانومتر) على النحو الذي يحدده برادفورد مقايسة البروتين 2. وتناسب هذه الدورات وقت تكوين المنتج إلى المعادلة الخطية لتحديد التقاطع y، والت...
Access restricted. Please log in or start a trial to view this content.
Discussion
النهج الحركية وصفها هنا الخطوط العريضة طرق لتعريف الثوابت الحركية الابتدائية. إذا كان الحال وقت تشكيل المنتج هو ثنائي الطور مع أول دوران الأنزيمية التي تحدث بسرعة، ثم خطوة بعد الكيمياء هو معدل منظم خلال تحولات الحفاز لاحقة. في حالة OGG1، ودوران الأول يمكن قياسها باستخ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
نشكر الدكتورة جولي K. هورتون لقراءة نقدية للمخطوطة والدكتور راجندرا براساد للحصول على اقتراحات مفيدة والمناقشات. ونشرت أجزاء من هذا البحث أصلا في مجلة الكيمياء البيولوجية، ساسا A وآخرون. آل.، "DNA تسلسل تأثيرات السياق على آخر Glycosylase من الإنسان Glycosylase DNA 8 Oxoguanine." J بيول كيم 287، 36702-36710 (2012) 2. وأيد هذا العمل، كليا أو جزئيا، من قبل المعاهد الوطنية للبحوث الصحية مشروع المنح Z01-ES050158 في برنامج بحوث جماعية، معهد علوم الصحة البيئية.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| 5’-6-FAM labeled oligonucleotides containing a single 8-oxoG | Eurofins MWG Operon | 5’-P32 radiolabeled oligonucleotides can be used as well. Polyacrylamide gel purification grade is recommended. | |
| Unlabeled oligonucleotides (complementary strand) | Eurofins MWG Operon | Polyacrylamide gel purification grade is recommended. | |
| 1 ml BD Luer Lock disposable syringe | BD Medical | 309628 | Lue Lock disposable syringe from other vendors can be used as well. |
| 10 ml BD Luer Lock disposable syringe | BE Medical | 309604 | Luer Lock disposable syringe from other vendors can be used as well. |
| Equipment | |||
| Circulating water bath | Any vender | ||
| RQF-3 Rapid Quench-Flow Instrument | KinTek Corporation | Rapid Quench-Flow Instrument from other vendors can be used as well. | |
| Typhoon Phosphorimager 8600 | GE Healthcare Life Sciences | Imager from other vendors can be used as well. | |
| KaleidaGraph | Synergy Software | ||
References
- Porello, S. L., Leyes, A. E., David, S. S. Single-turnover and pre-steady-state kinetics of the reaction of the adenine glycosylase MutY with mismatch-containing DNA substrates. Biochemistry. 37, 14756-14764 (1998).
- Sassa, A., Beard, W. A., Prasad, R., Wilson, S. H. DNA sequence context effects on the glycosylase activity of human 8-oxoguanine DNA glycosylase. The Journal of Biological Chemistry. 287, 36702-36710 (2012).
- Wong, I., Lundquist, A. J., Bernards, A. S., Mosbaugh, D. W. Presteady-state analysis of a single catalytic turnover by Escherichia coli uracil-DNA glycosylase reveals a "pinch-pull-push" mechanism. The Journal of Biological Chemistry. 277, 19424-19432 (1074).
- Johnson, K. A. Advances in transient-state kinetics. Current Opinion in Biotechnology. 9, 87-89 (1998).
- Johnson, K. A. Rapid kinetic analysis of mechanochemical adenosinetriphosphatases. Methods in Enzymology. 134, 677-705 (1986).
- Kovtun, I. V., et al. OGG1 initiates age-dependent CAG trinucleotide expansion in somatic cells. Nature. 447, 447-452 (2007).
- Hill, J. W., Hazra, T. K., Izumi, T., Mitra, S. Stimulation of human 8-oxoguanine-DNA glycosylase by AP-endonuclease: potential coordination of the initial steps in base excision repair. Nucleic Acids Research. 29, 430-438 (2001).
- Zharkov, D. O., Rosenquist, T. A., Gerchman, S. E., Grollman, A. P. Substrate specificity and reaction mechanism of murine 8-oxoguanine-DNA glycosylase. The Journal of Biological Chemistry. 275, 28607-28617 (2000).
- Waters, T. R., Swann, P. F. Kinetics of the action of thymine DNA glycosylase. The Journal of Biological Chemistry. 273, 20007-20014 (1998).
- Nilsen, H., et al. Excision of deaminated cytosine from the vertebrate genome: role of the SMUG1 uracil-DNA glycosylase. The EMBO Journal. 20, 4278-4286 (2001).
- Gill, S. C., von Hippel, P. H. Calculation of protein extinction coefficients from amino acid sequence data. Analytical Biochemistry. 182, 319-326 (1989).
- Van de Berg,, Beard, B. J., A, W., Wilson, S. H. DNA structure and aspartate 276 influence nucleotide binding to human DNA polymerase beta. Implication for the identity of the rate-limiting conformational change. The Journal of Biological Chemistry. 276, 3408-3416 (2001).
- Krishnamurthy, N., Haraguchi, K., Greenberg, M. M., David, S. S. Efficient removal of formamidopyrimidines by 8-oxoguanine glycosylases. Biochemistry. 47, 1043-1050 (2008).
- Leipold, M. D., Muller, J. G., Burrows, C. J., David, S. S. Removal of hydantoin products of 8-oxoguanine oxidation by the Escherichia coli DNA repair enzyme, FPG. Biochemistry. 39, 14984-14992 (2000).
- Zhao, X., Krishnamurthy, N., Burrows, C. J., David, S. S. Mutation versus repair: NEIL1 removal of hydantoin lesions in single-stranded, bulge, bubble, and duplex DNA contexts. Biochemistry. 49, 1658-1666 (2010).
- Leipold, M. D., Workman, H., Muller, J. G., Burrows, C. J., David, S. S. Recognition and removal of oxidized guanines in duplex DNA by the base excision repair enzymes hOGG1, yOGG1, and yOGG2. Biochemistry. 42, 11373-11381 (2003).
- Robey-Bond, S. M., Barrantes-Reynolds, R., Bond, J. P., Wallace, S. S., Bandaru, V. Clostridium acetobutylicum 8-oxoguanine DNA glycosylase (Ogg) differs from eukaryotic Oggs with respect to opposite base discrimination. Biochemistry. 47, 7626-7636 (2008).
- Jarem, D. A., Wilson, N. R., Delaney, S. Structure-dependent DNA damage and repair in a trinucleotide repeat sequence. Biochemistry. 48, 6655-6663 (2009).
- Livingston, A. L., Kundu, S., Henderson Pozzi, M., Anderson, W. D., David, S. S. Insight into the roles of tyrosine 82 and glycine 253 in the Escherichia coli adenine glycosylase MutY. Biochemistry. 44, 14179-14190 (2005).
- Kundu, S., Brinkmeyer, M. K., Livingston, A. L., David, S. S. Adenine removal activity and bacterial complementation with the human MutY homologue (MUTYH) and Y165C, G382D, P391L and Q324R variants associated with colorectal cancer. DNA Repair. 8, 1400-1410 (2009).
- Zharkov, D. O., Rosenquist, T. A. Inactivation of mammalian 8-oxoguanine-DNA glycosylase by cadmium(II): implications for cadmium genotoxicity. DNA Repair. 1, 661-670 (2002).
- Jarem, D. A., Wilson, N. R., Schermerhorn, K. M., Delaney, S. Incidence and persistence of 8-oxo-7,8-dihydroguanine within a hairpin intermediate exacerbates a toxic oxidation cycle associated with trinucleotide repeat expansion. DNA Repair. 10, 887-896 (2011).
- Mokkapati, S. K., Wiederhold, L., Hazra, T. K., Mitra, S. Stimulation of DNA glycosylase activity of OGG1 by NEIL1: functional collaboration between two human DNA glycosylases. Biochemistry. 43, 11596-11604 (2004).
- Sidorenko, V. S., Nevinsky, G. A., Zharkov, D. O. Mechanism of interaction between human 8-oxoguanine-DNA glycosylase and AP endonuclease. DNA Repair. 6, 317-328 (2007).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved