JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
DNA의 Glycosylase 활동에 대한 정상 상태, 전 정상 상태 및 단일 매출 운동 측정
요약
8 oxoguanine의 DNA glycosylase의 glycosylase 활동 시간 코스 제품의 형성과 선형 정상 상태 위상 버스트를 전시 이상성입니다. 각각 8-oxoguanine 및 제품 DNA에서 glycosylase 릴리스의 절제에 해당 담금질 흐름 기술, 버스트 및 정상 상태 속도를 측정 할 수 있습니다, 활용.
초록
인간의 8 oxoguanine DNA glycosylase (OGG1)는 DNA에서 돌연변이 산화 DNA 병변 8 - 옥소-7 ,8-dihydroguanine (8 oxoG를) 소비세. OGG1의 운동 특성은 8 oxoG 절단 및 제품 릴리스의 속도를 측정하기 위해 실시된다. OGG1 농도가 기질 DNA보다 낮은 경우, 제품 형성의 시간 코스는 이상성이다, 제품 형성의 급속한 지수 단계 (즉 버스트) 선형 안정 상태 단계가옵니다. 제품 형성의 초기 버스트가 제대로 기판에 종사하는 효소의 농도에 해당하고 버스트 진폭은 효소의 농도에 따라 달라집니다. 버스트의 정수 1 차 비율은 8 oxoG 절단의 고유 속도에 대응하고 느린 정상 상태의 속도는 제품 릴리스 (일정한 제품 DNA 분리 속도, K 해제)의 속도를 측정합니다. 여기, 우리는 정상 상태, 전 정상 상태 및 단일 매출 접근법 SP를 분리하고 측정하는 기술OGG1 촉매 순환하는 동안 ecific 단계. 형광 표지 병변을 포함하는 올리고 뉴클레오티드 및 정제 OGG1은 정확한 운동 측정을 용이하게하기 위해 사용됩니다. 낮은 효소 농도가 정상 상태 측정, 반응 시약의 혼합 수동 및 냉각을 만드는 데 사용되기 때문에 정상 상태 속도 (K 해제) 확인하기 위해 수행 할 수 있습니다. 또한, 시간 제로의 좌표에 점으로 정상 상태 속도의 추정 제품 형성의 버스트는 첫 번째 회전율 (즉, y 절편이 양수) 동안 발생했음을 나타냅니다. 지수 버스트 위상 상수 1 차 속도는 정상 상태 단계 전에 짧은 시간 간격 (<1 초)에 형성된 제품의 양을 검사하고 8의 비율에 해당하는 빠른 혼합 및 냉각 기술을 사용하여 측정 할 수있다 - oxoG 절제 (즉, 화학). 촉매 순환이 어디에 화학적 단계는 단일 매출 방식을 사용하여 측정 할 수있다효소 (E> S)과 포화 기판 DNA에 의해 못했습니다. 이 방법은 DNA 병변의 제거 효율에 영향을 미치는 초등학교 속도 상수를 측정 할 수 있습니다.
서문
호기성 환경 게놈 불안정성을 서둘러. 산화 스트레스로 인한 주요 promutagenic DNA 병변은 7,8 - 디 하이드로-8-oxoguanine (8 oxoG)입니다. 이 8 oxoG의 모호한 코딩 가능성 때문이다. 인간의 8 oxoguanine DNA glycosylase (OGG1)는 8 oxoG의 기본 절단 복구를 시작 책임이 있습니다. OGG1의 glycosylase 활동 apurinic 사이트 (AP 현장)과 제품 DNA의 결과로 8 oxoG베이스 소비세. OGG1의 약한 분해 효소 활동은 어떤 경우에 AP-사이트를 절개 할 수 있습니다.
DNA의 glycosylases의 운동 특성은 일반적으로 그들이 이상성 시간 과정을 나타내는 것을 발견. 제품 형성의 초기 빠른 단계 (즉, 버스트) 한 후, 선형 정상 상태 위상은 1-3 관찰된다. 이 동작은 가시 반면, 화학 (즉, 구조적 변화 또는 제품 릴리스) 시간 코스의 직선 부분을 진행하는 동안 속도 제한되고 다음 단계의 지표입니다종종 과도 단계로 불리는 세인트 단계, 반응의 첫 번째주기 동안 효소 활성 부위의 제품 형성에 해당합니다. 제품 출시가 정상 상태 단계 속도 제한되면 활동 측정 제품 DNA 결합력의 질적 측정을 제공하지만, 효소 활성 부위 (즉, 화학)에서 이벤트에 관한 운동 정보를 제공하지 않습니다. 따라서, 지수 전 정상 상태 버스트 위상을 분리하고 측정하는 방법은 효소의 활성 사이트 4에서 처음 효소 매출액 동안 이벤트를 조사하기 위해 필요합니다.
(1) 정상 상태 (2) 전 정상 상태, (3) 단일 매출 OGG1의 촉매 동작을 특징 짓는 세 가지 표준 운동 방법이 있습니다. 이러한 방법은 반응 혼합물에있는 효소의 농도와 각 방법의 활용 기판의 비 효소 서로 다릅니다. 일반적으로 정상 상태 접근,때로는 여러 회전율 반응 속도라고도 효소의 낮은 농도는 제품의 형성을 따라하는 데 사용됩니다. 여러 효소 회전율이 크게 기질 농도에 영향을주지 않도록 기질 농도가 크게 효소 농도를 초과합니다. 이 상황에서, 시간 코스는 직선이어야하며, 그 폭발이 방법에 사용되는 낮은 효소 농도에 의한 최초의 매출액 동안 발생했는지 여부를 식별하는 것이 어려운, 참고 버스트 진폭이 효소의 농도에 해당합니다. 이 높은 효소 농도를 사용하여 첫 번째 효소 매출이 빠르게 발생 여부를 감지하는 시간 제로에 선형 시간 과정을 외삽하여 극복 할 수 있습니다. 좌표에 절편 (y 축)은 효소 농도에 비례 적극적으로 기판 종사하는 효소의 측정을 제공합니다. 이 방법은 원칙적으로 버스트 위상의 존재에 대한 증거, DIF를 제공 할 수 있지만,ferent 접근 방식은 버스트 단계의 반응 속도를 측정하기 위해 필요합니다. 많은 경우에 버스트 위상은 수동 혼합 및 냉각 기술로 측정하기에는 너무 빠릅니다. 이 상황에서, 이전 정상 상태 및 단일 매출 운동 (즉, 일시적인 운동)은 종종 반응을 5 초 시점을 따라 급속 혼합 및 냉각 장비를 필요로 접근한다. 전 정상 상태 접근 방식 효소의 높은 농도는 제품의 상당한 양의 첫 매출이 형성되도록 사용됩니다. 여러 개의 턴 오버가 촉매 순환 (즉, 버스트를 다음과 선형 위상) 관찰하기 위해 다음되기 때문에, 기질 농도는 효소 농도 ([효소] <[기질])보다 큽니다. 촉매 순환하지 않고 효소의 활성 사이트에서 이벤트를 분리하려면 단일 매출 조건을 활용하고 있습니다. 이 경우, 기판은 기판의 내가 참여 할 수 있도록 (E >> S) 효소 포화N '단일 매출'과는 일반적으로 단일 지수 시간 경과를 전시 할 예정이다.
버스트 위상, 제품 릴리스 (K 오프) 전시 효소에 대해 위에서 언급 한 바와 같이 종종 시간 코스의 정상 상태 단계의 속도를 제한합니다. 제품 출시 (V SS, 진한. / 시간)의 비율은 선형 정상 상태 위상의 기울기에서 확인할 수 있습니다. 활성 효소의 농도 (E)는 일정한 고유 속도로 제품 릴리스의 속도를 변환하는 데 필요한 곳에 K 오프 = V SS / [E]. 중요한 것은, 활성 효소 농도는 불순물에 의한 측정 단백질 농도, 비활성 효소, 효소가 아닌 생산적으로 기판에 바인딩 단백질 농도를 결정하는 데 사용하는 방법보다 일반적으로 낮다. 제품 출시 속도가 느린 경우 활성 효소 농도는 버스트 진폭에서 확인할 수 있습니다. 따라서,에 대한 정상 상태 시간 과정을 외삽시간 제로 관찰 된 정상 상태 속도에서 K 오프 (제품 출시)를 계산하는 데 필요한 활성 효소의 견적을 제공합니다.
버스트의 반응 속도를 측정하기 위해, 사전에 정상 상태 방법은 선형 안정 상태 단계 이전에 발생하는 첫 번째 매출 중 제품의 형성을 따를 필요가있다. 버스트 속도론은 효소 제품 중간의 형성을 다음과 같습니다. 반응이 기판과 혼합 효소에 의해 시작하면 반응이 정상 상태 단계에 도달 할 때까지, 효소 제품의 양이 급격히 증가합니다. 촉매 훨씬 더 빠른 제품 출시보다는 더 많은 것 인 경우에, 버스트의 진폭은 가정 제품 기판의 화학 변환의 속도에 해당하는 평형에 적극적으로 관여 효소와 관찰 지수 방식 (K OBS)와 동일합니다 그 반대 비율 화학 무시할 수 있습니다.
어떤 경우에는 촉매 CY에서집착은 화학 제품 출시 가격의 진폭은 유의 한 차이가없는 경우로 사전에 정상 상태 분석을 방해합니다. 이 경우, 기판에 과도한 효소 상대를 채용하는 것은 하나의 회전율 효소 결합 촉매 순환 및 제한 기판을 방지 할 수 있습니다. 1 차 속도 상수 (K OBS)로 따라서, 반응의 첫 번째 화학적 단계는 분리 할 수 있으며 정확하게 결정했다. 일정이 비율은 OBS K 유사한 위에서 설명한 사전 정상 상태 접근법을 결정해야한다.
여기에서 우리는이 운동 방법은 OGG1의 glycosylase 활동을 분석하는 데 사용할 수있는 방법에 대해 설명합니다.
프로토콜
1. 효소와 DNA 기판의 제조
- E.의 GST 융합 단백질 등을 통해 표현 OGG1 대장균, 정화 GST-태그를 사용하고 HRV-3C 프로테아제 (그림 1) 6 절단하여 GST-태그를 제거합니다.
- 단일 8 oxoG 잔류 물을 포함하는 화학적으로 합성 5'-6-carboxyfluorescein (6-FAM)로 표시 올리고 뉴클레오티드 및 그 보완 레이블 올리고 뉴클레오티드 가닥을 구입할 수 있습니다. 34 메르 올리고 뉴클레오티드는 5'-말단의 위치 17에서 8 oxoG가 포함되어 있습니다. 폴리 아크릴 아마이드 겔 전기 영동하여 이러한 올리고 뉴클레오티드를 정화.
- 어닐링 버퍼에 1:1.2의 몰비 (10 MM 트리스 - 염산, 산도 7.5, 50 MM의 염화나트륨, 1에서의 보완 가닥 혼합 5'-6-FAM 표시 올리고 뉴클레오티드에 의해 8 oxoG를 포함하는 이중 가닥 DNA 기판을 준비 1.5 ML의의 microfuge 튜브 밀리미터 EDTA (에틸렌 다이아 민 테트라 초산)). 5 분 동안 끓는 물에 부유물에 튜브를 놓습니다. R에 천천히 물이 식지 그 장소에 관두고움 온도 (이 약 2 시간 소요).
- 형광 라벨의 photobleaching에 최소화 할 수있는만큼 낮거나 최소한의 조명 조건 하에서 시료 준비와 실험을 수행 할 수 있습니다.
2. 정상 상태 시간 코스 및 OGG1의 활성 부위의 적정 측정
2.1. 샘플 준비 및 정상 상태 시간 코스
- 얼음에 1.5 ML의의 microfuge 튜브 (50 MM의 HEPES, 산도 7.5, 20 MM의 KCl을, 0.5 mM의 EDTA, 0.1 % 소 혈청 알부민) 반응 버퍼에 별도로 DNA 기판 및 OGG1 솔루션을 준비합니다. DNA의 농도는 400 nm의이며 OGG1의 명백한 농도는 60 30, 90, 또는 120 nm의은 브래드 포드 단백질 분석에 의해 결정됩니다. 37 열 블록 세트의 반응 튜브를 놓습니다 ° C. 37 미리 부화 효소 및 따로 DNA 기판 솔루션 ° 1 분 C.
- pipetting하여 OGG1 및 DNA 기판 솔루션의 동일한 볼륨을 혼합하여 반응을 시작합니다. 이러한 솔루션을 혼합 한 후화 : 1시 1분 (V / V)의 최종 농도는 200 nm의 DNA와 15, 30, 45, 또는 60 nM의 OGG1, 각각입니다. 시간 간격으로 분주 (10 μL)를 제거하고 1 M NaOH를 1 μL와 혼합하여 반응을 끄다. 시간 과정, 효소없이 반응 혼합물의 10 μL에 대한 제어는 1 M NaOH를 1 μL와 혼합 때문입니다.
- 다니엘 5 분 결과물 AP-사이트 90 ° C 열 블록에 반응 샘플을 놓습니다. 가열 후, 각각의 샘플을 중화하기 위해 1 M 염산 1 μl를 추가합니다.
- 각 반응 샘플 겔 로딩 버퍼의 동일한 볼륨을 (12 μL) (95 % 포름 아미드, 20 mM의 EDTA, 0.02 %의 브롬 페놀, 0.02 %의 크실렌 cyanol)를 추가하고 95 ° C에서 설정 열 블록에 혼합 배치 2 분 후, 즉시 얼음에 튜브를 놓습니다.
- 89 MM 트리스 - 염산, 산도 8.8, 89 MM의 붕산, 2 mM의 EDTA (에틸렌 다이아 민 테트라 초산)의 8 M의 요소를 포함하는 15 % 변성 폴리 아크릴 아마이드 겔에 샘플을 (10 μL)을로드합니다. 기판 절단 된 제품은 잘 후 분리젤을 실행할 수 있습니다.
2.2. 젤의 영상
- 찬란 분류 DNA를 감지하고 기판과 제품의 밴드를 시각화 할 수있는 영상을 사용하여 젤을 검사합니다.
- 영상 젤 후 밴드를 정량화. 몇 가지 배경 분열은 수산화 나트륨 (그림 2A)와 기판 자체의 치료 후 관찰 할 수도 있습니다. 각 반응 생성물의 측정 금액에서 이러한 배경을 뺍니다.
2.3. 데이터 분석
- 각 반응 시간 (t) (그림 2B)에 형성된 제품의 양을 플롯합니다. 버스트 (0, y 절편) 및 선형 정상 상태 상 (V SS)의 기울기의 크기를 결정하기 위해 식 1을 사용하여 원시 데이터를 분석합니다.
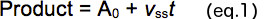
- 줄거리효소의 활성 분획의 측정을 제공, y 절편 총 단백질 농도 (그림 2C 즉, 명백한 효소 농도)을 기준. 활성 효소의 비율을 결정하기위한 보정 계수를 제공하는 제로 절편과 선형 피팅을 사용합니다.
- 제품의 해리 속도 상수 제공하는 활성 효소의 농도 (그림 2D)를 기준으로 정상 상태 속도 플롯 (적합 선 즉 기울기).
3. 전 정상 상태 시간 코스의 측정
그림 2, 버스트 단계에서 제품의 형성에 표시하는 설명서를 혼합하고 냉각에 의해 측정하기에는 너무 빠릅니다. 따라서, 빠른 급냉 흐름 악기 밀리 초 시간 간격 (그림 3) 5에서 발생하는 빠른 반응을 측정 할 수있는 강력한 방법을 제공 할 수 있습니다. 기기는 급속하게 혼합하는 컴퓨터 제어 드라이브 모터를 사용ND는 특정 반응 시간 후 반응을 끄다. 예를 들어, 초기 버스트 위상과 OGG1에 의해 촉매 제품의 형성 이후 정상 상태 위상을 측정하는 Kintek RQF-3 빠른 담금질 - 흐름 악기를 사용합니다. 빠른 담금질 유량 계측기는 여러 제조 업체에서 사용할 수 있습니다.
3.1. 시료의 준비
별도로 2-1에서 설명한대로 1.5 ML 튜브에 DNA 기판 및 OGG1 솔루션을 준비합니다. DNA와 활성 OGG1의 농도는 각각 400 nm의 80 nm의 수 있습니다. 최종 200 nm의 DNA의 농도 및 40 nm의 혼합 1시 1분 (V / V)의 활성 OGG1이 발생합니다.
3.2. 빠른 담금질 흐름 악기 준비
- 온도 제어를위한 빠른 담금질 흐름 악기 (37 ° C)에 순환 물 목욕을 연결합니다.
- 기기의 매개 변수를 조정하고 원하는 시간에 적절한 반응 루프를 선택하면 제조업체의 지시에 따라 포인트화 :. 반응 루프는 다른 반응 시간을 제공하기 위해 변수의 길이입니다.
- 반응 버퍼를 준비하고 NaOH를 10 ML 루어 잠금 일회용 주사기에 솔루션을 냉각 및 드라이브 포트에이 주사기를 연결하고 반응 버퍼 (주사기 B) 및 142 mM의 수산화 나트륨 (주사기 Q) (LOAD 위치에 주사기 부하 밸브)로 드라이브 저수지를로드 . 주사기에서 공기 방울을 제거하려면 여러 번 앞뒤로 솔루션을 작동합니다.
- 스테퍼 모터를 내리고 그것을 접촉 주사기의 상단 (FIRE 위치에 주사기로드 밸브 및 샘플 부하 밸브)까지.
- 샘플 루프, 반응 루프, 물과 메탄올 종료 선을 세척하십시오. 완전히 플러시 지역 (FLUSH 위치에서 밸브) 건조.
3.3. 전 정상 상태 시간 코스
- 16 게이지 바늘을 사용 덮인 1.5 ML 튜브의 상단에 구멍을 만든다. 침묵 반응을 수집하는 출구 라인에 튜브를 연결합니다.
- 원하는 reactio을 설정키패드를 사용하여 해당 시간 (초)입니다. 일정 급냉 볼륨을 유지하기로 스테퍼 모터, 그래서 루프 볼륨을 조정하는 백업합니다. 드라이브 포트에 부착 된 일회용 주사기로 버퍼를 추가하여 스테퍼 모터 플랫폼에 주사기 B에 대한 위치 플런저.
- DNA 기판에 1 ML 루어 잠금 일회용 주사기 및 OGG1 솔루션, 각각 (LOAD 위치에 샘플 밸브)를 입력합니다. 샘플로드 포트의 각 DNA 기판 및 OGG1 솔루션과 주사기를 연결하고 (LOAD 위치에 샘플 부하 밸브)는 각각 DNA 기판 및 OGG1 솔루션 샘플 루프를 입력합니다.
- 화재 위치로 모든 주사기로드 밸브 및 샘플로드 밸브를 설정합니다. 키패드 치기 ( "G"또는 "START"키의 예를 누름)하여 반응을 시작합니다. DNA 기판 및 OGG1 솔루션 (18 μL 각각) 즉시 반응 루프에 혼합한다.
- 반응이 자동으로 R의 36 μl를 혼합하여 원하는 반응 시간에 소멸 될 때까지 기다립니다142 밀리미터의 NaOH 86 μL와 eaction 혼합물. 냉각 반응 후, 샘플은 출구 줄에서 배출된다.
- LOAD 위치와 FLUSH 위치에 샘플로드 밸브에 주사기로드 밸브를 설정합니다. 샘플 루프, 반응 루프, 물과 메탄올 종료 선을 세척하고 3.2에 설명 된대로 건조. 각 시점에 대해 위의 절차를 반복합니다.
- 수동으로 또는 급속 급냉 장비로 수행 할 수있는 백그라운드 교정을 결정하는 효소가없는 컨트롤 실험을 수행 할 수 있습니다. 급속 급냉 장비와 제어를 수행하기 위해 DNA 기판에 DNA의 샘플 루프를 채울하지만 OGG1 빈에 대한 샘플 루프를 유지합니다. 반응 시간을 설정, 혼합 된 작업을 수행하고 3.3.4-3.3.6에 설명 끄다.
- 2 M NaOH를 2 M 염산, 물 및 메탄올로 샘플 루프와 반응 루프를 세척하고 세척 선을 건조. 홈 위치로 스테퍼 모터를 설정 한 후,로드 positio에 주사기로드 밸브를 전환n과 물 드라이브 저수지를 씻는다.
- 그 침묵 반응 열을 샘플 및 2.1에 설명 된대로 폴리 아크릴 아마이드 겔 전기 영동을 변성 15 % 별도의 기판과 제품 DNA를 취급합니다.
- 시각화 및 2.2에 설명 된대로 젤의 밴드를 정량화.
3.4. 데이터 분석
일정 1 차 속도 (K OBS), 버스트 (0)의 크기를 제공하는 상승 지수 및 선형 조건 (식 2)와 식을 비선형 회귀 분석하여 제품 형성의 시간 과정에 맞게, 그리고 선형 속도 (V SS).
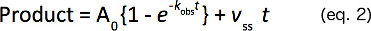
4. 단일 회전율 시간 코스
- 2-1에서 설명한대로 별도의 1.5 ML 튜브에 DNA 기판 및 OGG1를 준비합니다. 농도DNA와 활성 OGG1의 화 :은 각각 100 nm의 500 nm의이다;이 금리 혼합 1시 1분 (v / v)의 후 50 nm의 DNA와 250 nm의 OGG1의 최종 농도.
- 빠른 담금질 흐름 악기를 준비하고 3.2 및 3.3에 설명 된대로 반응 샘플을 준비합니다.
- 열을 냉각 된 반응 샘플을 처리하고 2.1에 설명 된대로 15 %가 별도의 기판과 제품 폴리 아크릴 아마이드 겔 전기 영동을 변성 그들을 변경 될 수 있습니다.
- 시각화 및 2.2에 설명 된대로 젤의 밴드를 정량화.
- 식 3에 주어진 1 차 속도 상수 (K OBS)을 결정하는 하나의 지수로 제품 형성의 시간 코스를 맞 춥니 다.
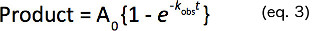
결과
정상 상태 운동 분석은 브래드 포드 단백질 분석이 결정에 따라 200 nm의 DNA 기판 및 OGG1의 네 가지 명백한 농도 (15, 30, 45, 60 nm의)를 사용하여 수행되었다. 제품 형성의 시간 코스는 2.2이었다 y 절편, 11, 15, 각각의 단백질 농도 (그림 2B)에 비해 각각 26 nm의, 결정하는 선형 방정식 맞게되었다. Y-차단은 더욱 각 실제 단백질 농도 (그림 2C)를 기준으로 꾸몄다되었다. 활?...
토론
운동 방법은 초등학교 운동 상수를 정의하는 방법을 설명 여기에 설명. 제품 형성의 시간 코스의 첫 번째 효소 매출이 빠르게 발생과 이상성 경우, 화학 후 단계 이후의 촉매 턴 오버 중에 속도 제한됩니다. OGG1의 경우, 최초의 회전율도 (S E 높음) DNA의 농도를 제한하는 높은 효소 농도를 사용하여 측정 할 수 있습니다. 첫 번째 경우, 반응은 '단일 매출'로 제한되며 효소의 활?...
공개
저자는 공개 아무것도 없어.
감사의 말
우리는 도움이 제안과 토론 원고 박사 라젠 드라 프라 사드의 중요한 읽기 박사 줄리 K. 호튼 감사합니다. 본 연구의 일부는 원래 생물 화학, 사사 등의 저널에 발표되었다. 알., "인간 8 Oxoguanine DNA의 Glycosylase의 Glycosylase 활동에 DNA 시퀀스 컨텍스트 효과."J BIOL 화학. 287, 36702-36710 (2012) 2. 이 작품은 교내 연구 프로그램에 건강 연구 프로젝트 그랜트 Z01-ES050158의 국립 연구소, NIEHS에 의해 전체 또는 일부를 지원 하였다.
자료
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| 5’-6-FAM labeled oligonucleotides containing a single 8-oxoG | Eurofins MWG Operon | 5’-P32 radiolabeled oligonucleotides can be used as well. Polyacrylamide gel purification grade is recommended. | |
| Unlabeled oligonucleotides (complementary strand) | Eurofins MWG Operon | Polyacrylamide gel purification grade is recommended. | |
| 1 ml BD Luer Lock disposable syringe | BD Medical | 309628 | Lue Lock disposable syringe from other vendors can be used as well. |
| 10 ml BD Luer Lock disposable syringe | BE Medical | 309604 | Luer Lock disposable syringe from other vendors can be used as well. |
| Equipment | |||
| Circulating water bath | Any vender | ||
| RQF-3 Rapid Quench-Flow Instrument | KinTek Corporation | Rapid Quench-Flow Instrument from other vendors can be used as well. | |
| Typhoon Phosphorimager 8600 | GE Healthcare Life Sciences | Imager from other vendors can be used as well. | |
| KaleidaGraph | Synergy Software | ||
참고문헌
- Porello, S. L., Leyes, A. E., David, S. S. Single-turnover and pre-steady-state kinetics of the reaction of the adenine glycosylase MutY with mismatch-containing DNA substrates. Biochemistry. 37, 14756-14764 (1998).
- Sassa, A., Beard, W. A., Prasad, R., Wilson, S. H. DNA sequence context effects on the glycosylase activity of human 8-oxoguanine DNA glycosylase. The Journal of Biological Chemistry. 287, 36702-36710 (2012).
- Wong, I., Lundquist, A. J., Bernards, A. S., Mosbaugh, D. W. Presteady-state analysis of a single catalytic turnover by Escherichia coli uracil-DNA glycosylase reveals a "pinch-pull-push" mechanism. The Journal of Biological Chemistry. 277, 19424-19432 (1074).
- Johnson, K. A. Advances in transient-state kinetics. Current Opinion in Biotechnology. 9, 87-89 (1998).
- Johnson, K. A. Rapid kinetic analysis of mechanochemical adenosinetriphosphatases. Methods in Enzymology. 134, 677-705 (1986).
- Kovtun, I. V., et al. OGG1 initiates age-dependent CAG trinucleotide expansion in somatic cells. Nature. 447, 447-452 (2007).
- Hill, J. W., Hazra, T. K., Izumi, T., Mitra, S. Stimulation of human 8-oxoguanine-DNA glycosylase by AP-endonuclease: potential coordination of the initial steps in base excision repair. Nucleic Acids Research. 29, 430-438 (2001).
- Zharkov, D. O., Rosenquist, T. A., Gerchman, S. E., Grollman, A. P. Substrate specificity and reaction mechanism of murine 8-oxoguanine-DNA glycosylase. The Journal of Biological Chemistry. 275, 28607-28617 (2000).
- Waters, T. R., Swann, P. F. Kinetics of the action of thymine DNA glycosylase. The Journal of Biological Chemistry. 273, 20007-20014 (1998).
- Nilsen, H., et al. Excision of deaminated cytosine from the vertebrate genome: role of the SMUG1 uracil-DNA glycosylase. The EMBO Journal. 20, 4278-4286 (2001).
- Gill, S. C., von Hippel, P. H. Calculation of protein extinction coefficients from amino acid sequence data. Analytical Biochemistry. 182, 319-326 (1989).
- Van de Berg, ., Beard, B. J., A, W., Wilson, S. H. DNA structure and aspartate 276 influence nucleotide binding to human DNA polymerase beta. Implication for the identity of the rate-limiting conformational change. The Journal of Biological Chemistry. 276, 3408-3416 (2001).
- Krishnamurthy, N., Haraguchi, K., Greenberg, M. M., David, S. S. Efficient removal of formamidopyrimidines by 8-oxoguanine glycosylases. Biochemistry. 47, 1043-1050 (2008).
- Leipold, M. D., Muller, J. G., Burrows, C. J., David, S. S. Removal of hydantoin products of 8-oxoguanine oxidation by the Escherichia coli DNA repair enzyme, FPG. Biochemistry. 39, 14984-14992 (2000).
- Zhao, X., Krishnamurthy, N., Burrows, C. J., David, S. S. Mutation versus repair: NEIL1 removal of hydantoin lesions in single-stranded, bulge, bubble, and duplex DNA contexts. Biochemistry. 49, 1658-1666 (2010).
- Leipold, M. D., Workman, H., Muller, J. G., Burrows, C. J., David, S. S. Recognition and removal of oxidized guanines in duplex DNA by the base excision repair enzymes hOGG1, yOGG1, and yOGG2. Biochemistry. 42, 11373-11381 (2003).
- Robey-Bond, S. M., Barrantes-Reynolds, R., Bond, J. P., Wallace, S. S., Bandaru, V. Clostridium acetobutylicum 8-oxoguanine DNA glycosylase (Ogg) differs from eukaryotic Oggs with respect to opposite base discrimination. Biochemistry. 47, 7626-7636 (2008).
- Jarem, D. A., Wilson, N. R., Delaney, S. Structure-dependent DNA damage and repair in a trinucleotide repeat sequence. Biochemistry. 48, 6655-6663 (2009).
- Livingston, A. L., Kundu, S., Henderson Pozzi, M., Anderson, W. D., David, S. S. Insight into the roles of tyrosine 82 and glycine 253 in the Escherichia coli adenine glycosylase MutY. Biochemistry. 44, 14179-14190 (2005).
- Kundu, S., Brinkmeyer, M. K., Livingston, A. L., David, S. S. Adenine removal activity and bacterial complementation with the human MutY homologue (MUTYH) and Y165C, G382D, P391L and Q324R variants associated with colorectal cancer. DNA Repair. 8, 1400-1410 (2009).
- Zharkov, D. O., Rosenquist, T. A. Inactivation of mammalian 8-oxoguanine-DNA glycosylase by cadmium(II): implications for cadmium genotoxicity. DNA Repair. 1, 661-670 (2002).
- Jarem, D. A., Wilson, N. R., Schermerhorn, K. M., Delaney, S. Incidence and persistence of 8-oxo-7,8-dihydroguanine within a hairpin intermediate exacerbates a toxic oxidation cycle associated with trinucleotide repeat expansion. DNA Repair. 10, 887-896 (2011).
- Mokkapati, S. K., Wiederhold, L., Hazra, T. K., Mitra, S. Stimulation of DNA glycosylase activity of OGG1 by NEIL1: functional collaboration between two human DNA glycosylases. Biochemistry. 43, 11596-11604 (2004).
- Sidorenko, V. S., Nevinsky, G. A., Zharkov, D. O. Mechanism of interaction between human 8-oxoguanine-DNA glycosylase and AP endonuclease. DNA Repair. 6, 317-328 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유