Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
DNA glikosilaz Faaliyet için kararlı durum, Ön kararlı durum ve Tek cirosu Kinetik Ölçüm
Bu Makalede
Özet
8-oxoguanine DNA glikozilaz en glikozilaz aktivite için zaman kurslar ürün oluşumu ve doğrusal kararlı durum faz bir patlama gösteren bifazik bulunmaktadır. Sırasıyla 8-oxoguanine ve ürün DNA'dan glikozilaz serbest çıkarılması karşılık bastırma-akım teknikleri, patlama ve kararlı durum oranları ölçülebilir, kullanılması.
Özet
İnsan 8-oxoguanine DNA glikosilaz (OGG1) DNA mutajenik oksidatif DNA lezyon 8-okso-7 ,8-dihidroguanin (8-oxoG) excises. OGG1 kinetik karakterizasyonu 8-oxoG eksizyon ve ürün sürümü oranları ölçmek için yapılmaktadır. OGG1 konsantrasyonu yüzey DNA daha az olması durumunda, ürün oluşum zamanlı kurslar bifaziktir, ürün oluşumunun hızlı bir üstel faz (yani patlama) doğrusal kararlı durum faz takip eder. Ürün oluşumunun ilk patlama alt tabaka üzerinde düzgün bir şekilde yapan enzim konsantrasyonu karşılık gelir ve patlama genlik enzim konsantrasyonuna bağlıdır. Patlama sürekli birinci dereceden 8-oxoG eksizyon içsel oranı karşılık gelir ve yavaş kararlı durum oranı ürün sürümü (sürekli ürün DNA ayrışma oranı, k kapalı) oranını ölçer. Burada, kararlı durum, öncesi kararlı durum ve tek cirosu yaklaşımlar sp izole etmek ve ölçmek için tarifOGG1 katalitik devir esnasında ecific adımları. Bir floresan etiketli lezyon içeren bir oligonükleotit ve saflaştırılmış OGG1 hassas Kinetik ölçümleri kolaylaştırmak için kullanılır. Düşük enzim konsantrasyonları kararlı durum ölçümleri, reaksiyon reaktiflerin karıştırma manuel ve soğutma yapmak için kullanılan bu yana kararlı durum oranı (k off) tespit etmek için yapılabilir. Ayrıca, sıfır zamanda ordinat üzerinde bir noktaya kararlı durum oranı ekstrapolasyon ürün oluşumu bir patlama ilk sermaye (yani y-kesişim pozitif) sırasında oluştuğunu gösterir. Üslü kayma fazı sürekli birinci dereceden kararlı durum faz önce kısa zaman aralıklarında (<1 saniye) de elde edilen ürünün miktarını inceler ve 8 hızına karşılık gelen bir hızlı karıştırma ve soğutma tekniği kullanılarak ölçülebilir -oxoG eksizyon (yani kimya). Katalitik bisiklet olduğu kimyasal adım, aynı zamanda, bir tek ciro yaklaşım kullanılarak ölçülebilirenzim (E> S) ile doyurarak substrat DNA ile önlenebilir. Bu yaklaşımlar bir DNA lezyonun çıkarılması verimliliğini etkileyen temel hız sabitleri ölçebilirsiniz.
Giriş
Aerobik ortam genomik istikrarsızlık hızlandırır. Oksidatif stresten kaynaklanan önemli bir promutagenic DNA lezyon 7,8-dihidro-8-oxoguanine (8-oxoG) 'dir. Bu 8-oxoG en belirsiz kodlama potansiyelinin kaynaklanmaktadır. İnsan 8-oxoguanine DNA glikozilaz (OGG1) 8-oxoG baz eksizyon onarımı başlatmak için sorumludur. OGG1 glikozilaz aktivitesi apurinic sitesi (AP-sitesi) ile ürün DNA ile sonuçlanan 8-oxoG tabanı özel tüketim vergilerine. OGG1 Zayıf bir liyaz aktivite bazı durumlarda AP-sitesi insizyon olabilir.
DNA glikolazdan kinetik karakterizasyonu genelde bifazik zamanlı kurslar sergi bulur. Ürün oluşumu bir ilk hızlı faz (yani patlama) sonra, doğrusal kararlı durum faz 1-3 görülmektedir. Bu davranış, bur ise, kimya (yani yapısal bir değişiklik veya ürün ayırma) arasında, zaman akışının lineer kısmı boyunca oran-sınırlayıcı olma aşağıdaki bir aşama göstergesidirgenellikle geçiş fazı olarak adlandırılan faz st, birinci reaksiyon döngüsü sırasında, enzim aktif bölgesinde ürün oluşumuna tekabül eder. Ürün sürümü kararlı durum aşamasında sınırlama oranı olduğunda, aktivite ölçümleri ürün DNA bağlanma afinitesi niteliksel bir ölçü sağlar, ancak enzim aktif bölge (yani kimya) de olaylarla ilgili kinetik bilgi vermemektedir. Buna göre, üstel öncesi kararlı durum patlama faz izole etmek ve ölçmek için yöntemler enzimin aktif bölge 4 ilk enzimatik devir sırasında olayları araştırmak için gereklidir.
(1) kararlı durum, (2) öncesi kararlı durum ve (3) tek cirosu OGG1 katalitik davranışını karakterize etmek için üç standart kinetik yaklaşım vardır. Bu yaklaşımlar, reaksiyon karışımı içinde enzim konsantrasyonu ve her bir yaklaşımda kullanılan substrat oranı için enzim tarafından birbirinden farklıdır. Tipik bir kararlı durum yaklaşımda,bazen birden devir kinetik olarak adlandırılan, enzimin düşük konsantrasyonlarda ürün formasyonu takip etmek için kullanılır. Birden fazla enzimatik kaybı önemli alt tabaka konsantrasyonu etkilemez böylece substrat konsantrasyonu büyük ölçüde Enzim konsantrasyonu aşmaktadır. Bu durumda, zaman içerisinde doğrusal olmalıdır ve bir patlama bu yaklaşımda kullanılan düşük enzim konsantrasyonu nedeniyle ilk devir sırasında meydana gelen olmadığını ayırt etmek zordur; not genlik kayma Enzim konsantrasyonu eşdeğer olduğunu. Bu daha yüksek bir enzim konsantrasyonu kullanılarak ve ilk enzimatik cirosu hızla oluştu olup olmadığını tespit etmek için sıfır zaman doğrusal zaman ders extrapolating aşılabilir. Ordinat üzerinde kesişim noktası (y-ekseni), enzim konsantrasyonu ile orantılı olması ve aktif alt-tabaka ile enzimin yapan bir ölçüsünü sağlar gerekir. Bu yaklaşım, ilke olarak, bir kayma fazı varlığı için kanıt, dif sağlayabilir rağmenlara yaklaşım kayma fazı kinetiğini ölçmek için gereklidir. Birçok durumda patlama aşamasında el karıştırma ve soğutma teknikleri ile ölçmek için çok hızlı. Bu durumda, ön-kararlı durum ve tek cirosu kinetik (yani geçici kinetik) genellikle reaksiyon 5 erken zaman noktalarında takip etmek bir hızlı karıştırma ve soğutma cihazı gerektirir yaklaşır. Bir ön-kararlı durum yaklaşımda enzimin yüksek konsantrasyonlarda ürünün önemli bir miktarı, ilk devir sırasında oluşacak şekilde kullanılır. Birden fazla cirolar katalitik bisiklet (yani patlama aşağıdaki doğrusal faz) gözlemlemek için takip olduğundan, substrat konsantrasyonu enzim konsantrasyonu ([enzim] <[yüzey]) daha büyüktür. Katalitik binme olmadan, enzimin aktif bölgesinde olayları izole etmek için, tek devir koşulları kullanılmaktadır. Bu durumda, alt-tabaka alt-tabakanın tüm i katılacak şekilde (E >> S) enzimi ile doymuşn 'tek cirosu' ve genellikle tek üstel zaman tabii sergileyecek.
Bir kayma fazı, ürün serbest (k off) sergileyen enzimler için yukarıda belirtildiği gibi çoğu zaman akışının kararlı durum faz hızını sınırlar. Ürün sürümü (v ss, kons. / Saat) oranı doğrusal kararlı durum faz eğimi tespit edilebilir. Aktif enzim konsantrasyonu (E) sabit bir iç Oranı ürün sürümü oranını dönüştürmek için gerekli olduğu k off = v ss / [E]. En önemlisi, aktif enzim konsantrasyonu kirleri nedeniyle ölçülen protein konsantrasyonu, etkin enzim, enzim olmayan üretken bir substrata bağlı ve protein konsantrasyonu belirlemek için kullanılan yöntem, genellikle daha düşüktür. Ürün serbest yavaş olduğunda, aktif enzim konsantrasyonu patlama genlik belirlenebilir. Böylece, bir kararlı durum zaman tabii extrapolatingsıfır zaman gözlenen kararlı durum oranı k off (ürün sürümü) hesaplamak için gerekli aktif enzim bir tahmin sağlar.
Kaymasının kinetiği ölçmek için, bir ön-kararlı durum yaklaşım doğrusal kararlı-durum faz önce meydana gelen ilk devir esnasında ürün oluşumunu takip etmek gereklidir. Patlama kinetik enzim ara ürünün oluşumu izler. Reaksiyon alt-tabaka ile enzimin karıştırma başlatılır Reaksiyon tamamlandıktan sonra sabit bir durum faz ulaşana kadar, enzim-ürününün miktarı hızla artmaktadır. Kataliz çok daha hızlı bir ürün serbest fazla ise, kayma genliği varsayarak, ürün substratm kimyasal dönüştürme hızına karşılık gelen denge aktif yapan enzim ve gözlemlenen üslü yaklaşım (k OBS) eşit olan bir tam tersi oranı kimya ihmal edilebilir düzeydedir.
Bazı durumlarda katalitik cysarılmak gibi kimya ve ürün sürümü için oranları büyüklükleri önemli ölçüde farklı değil olduğu gibi bir ön-kararlı durum analizi, müdahale. Bu durumda, yüzeye aşırı enzim göre istihdam tek bir ciroya enzim ile bağlı katalitik bisiklet ve sınırları yüzey önler. Birinci derece hız sabiti (K OBS) Buna göre, birinci reaksiyon kimyasal adım izole edilebilir ve daha doğru bir şekilde tespit edilmiştir. Bu oran sabit bir atıl k benzer yukarıda tarif edilen ön kararlı hal yaklaşımdan belirlenmelidir.
Burada bu kinetik yaklaşımlar OGG1 glikozilaz etkinliği analiz etmek için nasıl kullanılabileceğini açıklar.
Protokol
1. Enzim ve DNA Yüzey hazırlanması
- E. bir GST-füzyon proteini olarak aşırı ifade OGG1 coli, saflaştırma için GST-tag, uygulanması ve daha sonra, HRV-3C proteaz (Şekil 1) 6 ile bölünme ile GST-tag çıkarın.
- Tek 8-oxoG kalıntı içeren kimyasal olarak sentezlenmiş 5'-6-carboxyfluorescein (6-FAM) etiketli oligonükleotid ve tamamlayıcı etiketsiz oligonükleotid iplikçik satın alın. 34-mer oligonükleotid 5'-ucundan 17 pozisyonunda bir 8-oxoG içerir. Poliakrilamid jel elektroforezi ile, bu oligonükleotitler arındırın.
- Tavlama tamponu 1:1.2 arasında bir mol oranında (10 mM Tris-HCI, pH 7.5, 50 mM NaCI, 1 onun tamamlayıcı dizi karıştırma 5'-6-FAM etiketli oligonükleotid tarafından yapılmış 8-oxoG içeren çift-sarmallı DNA substrat hazırlama 1.5 ml mikrofüj tüpüne mM EDTA). 5 dakika için kaynayan su içinde yüzen ise tüp yerleştirin. R yavaş yavaş su soğumasını bekleyin sonra yerde tüp bırakın veoom sıcaklığı (bu yaklaşık 2 saat sürer).
- Floresan etiket Photobleaching en aza indirmek için çok düşük ya da çok az ışık koşulları altında numune hazırlama ve deney yapın.
2. Durağan Durum gün Dersin ve OGG1 Aktif Sitesi titrasyonu ölçümü
2.1. Örnek hazırlama ve kararlı durum zamanlı kurs
- Buz üzerinde 1.5 ml mikrofüj tüplerine (50 mM HEPES, pH 7.5, 20 mM KCI, 0.5 mM EDTA ve% 0.1 sığır serum albümini), reaksiyon tamponu içinde ayrı ayrı DNA alt tabaka ve OGG1 çözümler hazırlayın. DNA konsantrasyonu 400 nM ve OGG1 belirgin konsantrasyonu, 60 30 olan, 90 ya da 120 nM bir Bradford protein deneyi ile tayin edilmiştir. 37, bir ısıtma bloğu grubu olarak reaksiyon tüpleri ° C 37 ile ön inkübe, enzim ve alt tabaka ayrı ayrı DNA çözümler ° C 1 dakika boyunca kurutuldu.
- Pipetleme OGG1 ve DNA substrat çözeltileri, eşit hacimlerde karıştırılarak reaksiyon başlar. Bu çözüm karıştırma sonrasılar 1:1 (h / h), son konsantrasyon 200 nM DNA ve 15, 30, 45 ya da 60 nM OGG1, sırasıyla. Zaman aralıklarında alikotları (10 ul) çıkarın ve 1 M NaOH, 1 ul ile karıştırılarak reaksiyon soğutun. Zaman içerisinde, enzim olmadan reaksiyon karışımı, 10 ul için bir kontrol 1 M NaOH, 1 ul ile karıştırılır gibi.
- Yanlması için 5 dakika elde edilen ürün, AP-sitesi için bir 90 ° C ısıya blok içindeki reaksiyon örnekleri yerleştirin. Isıtmadan sonra, her bir numune nötralize etmek için 1 M HCl 1 ul.
- Her reaksiyon için örnek jel yükleme tamponu eşit bir hacmi (12 ul) (% 95 formamid, 20 mM EDTA,% 0.02 bromofenol, ve% 0.02 ksilen cyanol) ekleyin ve daha sonra 95 ° C'de ayarlanmış bir ısıtma bloğu karışım yerleştirmek 2 dakika boyunca, daha sonra buz üzerinde hemen tüp yerleştirin.
- 89 mM Tris-HCI, pH 8.8, 89 mM borik asit, 2 mM EDTA, 8 M üre içeren% 15'lik bir denatüre edici poliakrilamid jel üzerine numuneleri (5 ul) yükleyin. Yüzey ve bölünmüş ürünleri de sonra ayrılırjel çalışıyor.
2.2. Jelin Görüntüleme
- Floresan etiketli DNA tespit ve yüzey ve ürün grupları oluşturulabiliyor bir kamera kullanarak jel tarayın.
- Görüntüleme jel sonra bantları sayısal. Bazı arka plan bölünme NaOH (Şekil 2A) ile yüzeye kendisinin tedaviden sonra görülebilir unutmayın. Her bir reaksiyon ürününün ölçülen miktarından Bu arka plana çıkartır.
2.3. Veri analizi
- Her reaksiyon süresi (T) (Şekil 2B) oluşan ürün miktarı çizilir. Patlama (A 0, y-kesişim) ve doğrusal kararlı durum faz (v ss) eğimi genliği belirlemek için Denklem 1 kullanarak ham veri analiz edin.
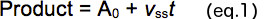
- Arsa, enzimin aktif fraksiyonu bir ölçü temin edilmesi; y kesişim toplam protein yoğunluklarının (Şekil 2C, yani belirgin Enzim konsantrasyonu) göre. Aktif enzim fraksiyonu için düzeltme faktörü sağlamak için bir sıfır kesme ile doğrusal bir uyum kullanın.
- Ürün ayrılma oranı sabitesi sağlayan, aktif enzim konsantrasyonu (Şekil 2B) göre sabit durum oranı alanı (takılmış hattı yani eğim).
3. Ön kararlı durum gün Dersin ölçümü
Şekil 2'den görüleceği gibi, kayma aşamasında ürün oluşumu gösterilmektedir Elle karıştırma ve soğutma ile ölçmek için çok hızlıdır. Bu nedenle, hızlı bir söndürme-akış alet milisaniye zaman ölçeği (Şekil 3) 5 meydana hızlı reaksiyonlar ölçmek için güçlü bir yöntem sağlayabilir. Cihaz hızla karıştırmak için bir bilgisayar kontrollü tahrik motoru kullanırnd belirtilen reaksiyon süreleri sonra reaksiyonlar gidermek. Örneğin, ilk patlama faz ve OGG1 tarafından katalize ürün oluşum sonraki kararlı durum faz ölçmek için bir KinTek RQF-3 Hızlı Soğutma-Akış Enstrüman kullanın. Hızlı Soğutma-Akış Instruments çeşitli üreticilerin mevcuttur.
3.1. Örnek hazırlanması
Ayrı 2-1 açıklandığı gibi 1,5 ml tüpler DNA substrat ve OGG1 çözümler hazırlar. DNA ve aktif OGG1 konsantrasyonları, sırasıyla, 400 nM ve 80 nM. 200 nM son DNA konsantrasyonu ve 40 nM karıştırma 01:01 (v / v) sonrasında aktif OGG1 ile sonuçlanır.
3.2. Hızlı söndürme akış alet hazırlanması
- Sıcaklık kontrolü için hızlı söndürme akış Aracı (37 ° C) bir dolaşan su banyosu bağlayın.
- Cihaz parametrelerini ayarlamak ve istenilen zaman için uygun reaksiyon döngü seçin üreticinin talimatlarına göre işaretlar. Reaksiyon döngüler alternatif reaksiyon süreleri sağlamak için değişken uzunlukları vardır.
- Reaksiyon tamponu hazırlayın ve NaOH 10 ml Luer Lock tek kullanımlık enjektör çözümler gidermek ve Sürücü Limanlar bu şırınga takın ve reaksiyon tamponu (şırınga B) ve 142 mM NaOH (şırınga Q) (YÜK konumda Şırınga Yük Vanalar) ile Sürücü Rezervuarlar yük . şırınga gelen hava kabarcıklarını çıkarmak için, birkaç kez ileri geri çözüm çalışır.
- Step motor indirin temas şırınga üst (YANGIN konumda Şırınga Yük vana ve örnek Yük vanalar) kadar.
- Örnek Döngüler, Reaksiyon Döngü, ve su ve metanol ile Çıkışı Hat yıkayın. Tamamen kızarmış alanlar (FLUSH konumunda vanalar) kurutun.
3.3. Ön kararlı durum zamanlı kurs
- 16 ölçek iğne kullanılarak bir şapkalı 1.5 ml tüp üst kısmında bir delik açın. Söndürülen reaksiyon toplamak için Çıkışı Hat bir tüp takın.
- İstenen reactio ayarlamatakımını kullanarak N süre (saniye olarak). Sabit söndürme hacmi korumak olarak Step Motor çok döngü ses ayarlamak için yedekler. Sürücü Limanlar bağlı tek şırınga ile tampon ekleyerek Step Motor platformu karşı şırınga B için pozisyon pistonları.
- DNA substrat ile 1 ml Luer Lock tek kullanımlık enjektör ve OGG1 çözümleri, sırasıyla (YÜK konumda örnek vanalar) doldurun. Örnek Yük Limanlar her birine DNA substrat ve OGG1 çözümleri ile şırınga takın, ve sonra (YÜK konumda örnek Yük Vanalar) sırasıyla, DNA substrat ve OGG1 çözümleri ile örnek Döngüler doldurun.
- YANGIN konumuna tüm Şırınga Yük Vanalar ve örnek Yük Vanalar ayarlayın. Bir tuş takımı inme ("G" veya "START" tuşuna basın örneğin) ile reaksiyon başlar. DNA yüzey ve OGG1 çözümleri (18 ul her biri) hemen Reaksiyon döngü karıştırılır.
- Reaksiyon otomatik olarak R 36 ul karıştırılarak istenen reaksiyon zamanında söndürülmüş kadar bekleyin142 mM NaOH ile 86 ul eaction bir karışım. Söndürme Reaksiyon sonra, numune çıkış hattına boşaltılır.
- YÜK konumu ve FLUSH konumuna Örnek Yük Vanalar için Şırınga Yük Vanalar ayarlayın. Örnek Döngüler, reaksiyon döngü ve su ve metanol ile çıkış hattına yıkayın ve 3.2 'de tarif edildiği gibi kurutun. Her noktası için yukarıdaki işlemi tekrarlayın.
- Elle ya da hızlı söndürme aleti ile yapılabilir bir arka plan düzeltmesi belirlemek için enzim olmayan bir kontrol deneyi gerçekleştirin. Hızlı söndürme aleti ile bir kontrol gerçekleştirmek için, DNA substrat ile DNA için örnek döngü doldurmak ama OGG1 boş için örnek döngü tutun. Reaksiyon süresi ayarlamak, karışım yapmak ve gibi 3.3.4-3.3.6 açıklandığı quench.
- 2 M NaOH, 2 M HCI, su ve metanol ile birlikte Örnek Döngüler ve reaksiyon döngü yıkayın ve daha sonra yıkanmış hatları kurutun. Başlangıç konumuna Step Motor ayarladıktan sonra, YÜK positio için Şırınga Yük Vanalar geçişn ve su ile Sürücü Rezervuarlar yıkayın.
- Daha sonra, söndürülen reaksiyon ısı örnekler ve 2.1 'de tarif edildiği gibi poliakrilamid jel elektroforezi, denatüre edici% 15 oranında ayrı bir substrat ve ürün DNA tedavi edin.
- Görselleştirmek ve 2.2 'de tarif edildiği gibi, jel üzerindeki bant miktarı belirlenir.
3.4. Veri analizi
Sürekli birinci dereceden (k atıl), patlama (A 0) genliği sağlayan yükselen bir üstel ve doğrusal açısından (Eşitlik 2) ile bir denkleme doğrusal olmayan regresyon analizi ile ürün oluşum zamanlı kurslar Fit ve doğrusal bir oranı (v ss).
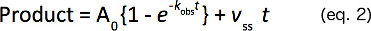
4. Tek cirosu gün Dersin
- 2-1 de tarif edildiği gibi ayrı bir 1.5 ml tüpler DNA alt tabaka ve OGG1 hazırlayın. KonsantrasyonDNA ve aktif OGG1 lar, sırasıyla, 100 nM ve 500 nM; verimi bu karışım 01:01 (v / v) sonra en az 50 nM ve 250 nM DNA OGG1 son konsantrasyonları.
- Hızlı söndürme akış alet hazırlamak ve 3.2 ve 3.3 'de tarif edildiği gibi reaksiyon, numunelerin hazırlanması.
- Isı ile Söndürülmüş tepkime örnekleri tedavi ve 2.1 'de tarif edildiği gibi% 15 ayrı substrat ve ürünler denatüre poliakrilamid jel elektroforezi ile karşı karşıya bırakmaktadır.
- Görselleştirmek ve 2.2 'de tarif edildiği gibi, jel üzerindeki bant miktarı belirlenir.
- Denklem 3'te verilen birinci dereceden hız sabiti (k atıl) belirlemek için tek bir üstel ürün oluşumu zamanlı kurslar takın.
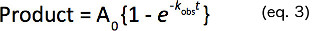
Sonuçlar
Kararlı durum kinetik analizi, bir Bradford protein deneyi 2 ile belirlenen 200 nM DNA alt tabaka ve OGG1 dört farklı görünen konsantrasyonları (15, 30, 45 ve 60 nM) kullanılarak gerçekleştirildi. Ürün oluşumu süresi içerisinde 2.2 idi y kesişim noktası, 11, 15, ve her bir protein konsantrasyonuna (Şekil 2B) göre, sırasıyla 26 nM, belirlemek için bir doğrusal eşitliğe oturtuldu. Y yakaladığını ayrıca, her biri gerçek protein konsantrasyonu (Şekil 2C)
Tartışmalar
Kinetik yaklaşımlar temel kinetik sabitleri tanımlamak için yöntemler ana hatlarıyla burada açıklanan. Ürün oluşumu, bir zaman süreci ilk enzimatik devir hızla meydana gelen iki fazlı ise, kimya sonra bir adım daha sonra katalitik devirleri sırasında oran-sınırlayıcı. OGG1 durumunda, birinci devir ya da (S e yüksek) DNA konsantrasyonları sınırlayıcı yüksek enzim konsantrasyonu kullanılarak ölçülebilir. İlk durumda, reaksiyon, bir 'tek-ciro' sınırlıdır ve en...
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Biz yararlı öneriler ve tartışmalar için el yazması ve Dr Rajendra Prasad eleştirel okuma Dr Julie K. Horton teşekkür ederim. Bu araştırmanın bazı bölümleri ilk Biyolojik Kimya, Sassa A et Dergisi yayımlandı. al., "İnsan 8-Oxoguanine DNA glikosilaz en glikosilaz Aktivitesi Üzerine DNA Dizi Bağlam Etkileri." Chem. 287, 36.702-36.710 (2012) 2. Bu çalışma İntramural Araştırma Programı Sağlık Araştırma Projeleri Z01-ES050158 Ulusal Enstitüleri, NIEHS tarafından, tamamen veya kısmen, desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| 5’-6-FAM labeled oligonucleotides containing a single 8-oxoG | Eurofins MWG Operon | 5’-P32 radiolabeled oligonucleotides can be used as well. Polyacrylamide gel purification grade is recommended. | |
| Unlabeled oligonucleotides (complementary strand) | Eurofins MWG Operon | Polyacrylamide gel purification grade is recommended. | |
| 1 ml BD Luer Lock disposable syringe | BD Medical | 309628 | Lue Lock disposable syringe from other vendors can be used as well. |
| 10 ml BD Luer Lock disposable syringe | BE Medical | 309604 | Luer Lock disposable syringe from other vendors can be used as well. |
| Equipment | |||
| Circulating water bath | Any vender | ||
| RQF-3 Rapid Quench-Flow Instrument | KinTek Corporation | Rapid Quench-Flow Instrument from other vendors can be used as well. | |
| Typhoon Phosphorimager 8600 | GE Healthcare Life Sciences | Imager from other vendors can be used as well. | |
| KaleidaGraph | Synergy Software | ||
Referanslar
- Porello, S. L., Leyes, A. E., David, S. S. Single-turnover and pre-steady-state kinetics of the reaction of the adenine glycosylase MutY with mismatch-containing DNA substrates. Biochemistry. 37, 14756-14764 (1998).
- Sassa, A., Beard, W. A., Prasad, R., Wilson, S. H. DNA sequence context effects on the glycosylase activity of human 8-oxoguanine DNA glycosylase. The Journal of Biological Chemistry. 287, 36702-36710 (2012).
- Wong, I., Lundquist, A. J., Bernards, A. S., Mosbaugh, D. W. Presteady-state analysis of a single catalytic turnover by Escherichia coli uracil-DNA glycosylase reveals a "pinch-pull-push" mechanism. The Journal of Biological Chemistry. 277, 19424-19432 (1074).
- Johnson, K. A. Advances in transient-state kinetics. Current Opinion in Biotechnology. 9, 87-89 (1998).
- Johnson, K. A. Rapid kinetic analysis of mechanochemical adenosinetriphosphatases. Methods in Enzymology. 134, 677-705 (1986).
- Kovtun, I. V., et al. OGG1 initiates age-dependent CAG trinucleotide expansion in somatic cells. Nature. 447, 447-452 (2007).
- Hill, J. W., Hazra, T. K., Izumi, T., Mitra, S. Stimulation of human 8-oxoguanine-DNA glycosylase by AP-endonuclease: potential coordination of the initial steps in base excision repair. Nucleic Acids Research. 29, 430-438 (2001).
- Zharkov, D. O., Rosenquist, T. A., Gerchman, S. E., Grollman, A. P. Substrate specificity and reaction mechanism of murine 8-oxoguanine-DNA glycosylase. The Journal of Biological Chemistry. 275, 28607-28617 (2000).
- Waters, T. R., Swann, P. F. Kinetics of the action of thymine DNA glycosylase. The Journal of Biological Chemistry. 273, 20007-20014 (1998).
- Nilsen, H., et al. Excision of deaminated cytosine from the vertebrate genome: role of the SMUG1 uracil-DNA glycosylase. The EMBO Journal. 20, 4278-4286 (2001).
- Gill, S. C., von Hippel, P. H. Calculation of protein extinction coefficients from amino acid sequence data. Analytical Biochemistry. 182, 319-326 (1989).
- Van de Berg, ., Beard, B. J., A, W., Wilson, S. H. DNA structure and aspartate 276 influence nucleotide binding to human DNA polymerase beta. Implication for the identity of the rate-limiting conformational change. The Journal of Biological Chemistry. 276, 3408-3416 (2001).
- Krishnamurthy, N., Haraguchi, K., Greenberg, M. M., David, S. S. Efficient removal of formamidopyrimidines by 8-oxoguanine glycosylases. Biochemistry. 47, 1043-1050 (2008).
- Leipold, M. D., Muller, J. G., Burrows, C. J., David, S. S. Removal of hydantoin products of 8-oxoguanine oxidation by the Escherichia coli DNA repair enzyme, FPG. Biochemistry. 39, 14984-14992 (2000).
- Zhao, X., Krishnamurthy, N., Burrows, C. J., David, S. S. Mutation versus repair: NEIL1 removal of hydantoin lesions in single-stranded, bulge, bubble, and duplex DNA contexts. Biochemistry. 49, 1658-1666 (2010).
- Leipold, M. D., Workman, H., Muller, J. G., Burrows, C. J., David, S. S. Recognition and removal of oxidized guanines in duplex DNA by the base excision repair enzymes hOGG1, yOGG1, and yOGG2. Biochemistry. 42, 11373-11381 (2003).
- Robey-Bond, S. M., Barrantes-Reynolds, R., Bond, J. P., Wallace, S. S., Bandaru, V. Clostridium acetobutylicum 8-oxoguanine DNA glycosylase (Ogg) differs from eukaryotic Oggs with respect to opposite base discrimination. Biochemistry. 47, 7626-7636 (2008).
- Jarem, D. A., Wilson, N. R., Delaney, S. Structure-dependent DNA damage and repair in a trinucleotide repeat sequence. Biochemistry. 48, 6655-6663 (2009).
- Livingston, A. L., Kundu, S., Henderson Pozzi, M., Anderson, W. D., David, S. S. Insight into the roles of tyrosine 82 and glycine 253 in the Escherichia coli adenine glycosylase MutY. Biochemistry. 44, 14179-14190 (2005).
- Kundu, S., Brinkmeyer, M. K., Livingston, A. L., David, S. S. Adenine removal activity and bacterial complementation with the human MutY homologue (MUTYH) and Y165C, G382D, P391L and Q324R variants associated with colorectal cancer. DNA Repair. 8, 1400-1410 (2009).
- Zharkov, D. O., Rosenquist, T. A. Inactivation of mammalian 8-oxoguanine-DNA glycosylase by cadmium(II): implications for cadmium genotoxicity. DNA Repair. 1, 661-670 (2002).
- Jarem, D. A., Wilson, N. R., Schermerhorn, K. M., Delaney, S. Incidence and persistence of 8-oxo-7,8-dihydroguanine within a hairpin intermediate exacerbates a toxic oxidation cycle associated with trinucleotide repeat expansion. DNA Repair. 10, 887-896 (2011).
- Mokkapati, S. K., Wiederhold, L., Hazra, T. K., Mitra, S. Stimulation of DNA glycosylase activity of OGG1 by NEIL1: functional collaboration between two human DNA glycosylases. Biochemistry. 43, 11596-11604 (2004).
- Sidorenko, V. S., Nevinsky, G. A., Zharkov, D. O. Mechanism of interaction between human 8-oxoguanine-DNA glycosylase and AP endonuclease. DNA Repair. 6, 317-328 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır