Method Article
تحديد الشركاء التفاعل البروتين في خلايا الثدييات عن طريق SILAC مناعي الكمي البروتيوميات
In This Article
Summary
تمثل التجارب SILAC مناعي وسيلة قوية لاكتشاف البروتين الرواية: تفاعلات البروتين. من خلال السماح للالكمي النسبي دقيقة من وفرة البروتين في كل من السيطرة واختبار العينات، والتفاعلات الحقيقية يمكن تمييزها بسهولة من الملوثات التجريبية، وانخفاض التفاعلات تقارب الحفاظ من خلال استخدام الظروف العازلة أقل صرامة.
Abstract
البروتيوميات الكمية جنبا إلى جنب مع تنقية المناعية تقارب، SILAC مناعي، تمثل وسيلة قوية لاكتشاف البروتين الرواية: تفاعلات البروتين. من خلال السماح للالكمي النسبي دقيقة من وفرة البروتين في كل من السيطرة واختبار العينات، والتفاعلات الحقيقية يمكن تمييزها بسهولة من الملوثات التجريبية. يمكن الحفاظ على التفاعلات تقارب منخفضة من خلال استخدام الظروف العازلة أقل صرامة ويبقى التعرف عليه بسهولة. يناقش هذا البروتوكول بوضع العلامات على الخلايا زراعة الأنسجة مع النظائر مستقرة الأحماض الأمينية المسمى، وترنسفكأيشن مناعي لتقارب الموسومة البروتين من الفائدة، تليها تمهيدا لرفعها إلى مرفق مطياف الكتلة. ثم يناقش هذا البروتوكول كيفية تحليل وتفسير البيانات التي تم إرجاعها من مطياف الكتلة من أجل تحديد الشركاء الخلوية التفاعل مع بروتين من الفائدة. كمثال يتم تطبيق هذه التقنية لالاتساعtify البروتينات ملزمة للعوامل ترجمة حقيقية النواة بدء: eIF4AI وeIF4AII.
Introduction
خطوة أساسية في فهم وظيفة البروتين هو تحديد البروتينات المتفاعلة ذات الصلة. حيث مثل البروتينات غير معروفة وهناك عدد من التقنيات المتاحة، ولكل منها مزاياها وسلبياتها. وتشمل هذه الخميرة نظام هجين اثنين، المقايسات المنسدلة باستخدام البروتين المؤتلف، وكذلك تنقية تقارب جنبا إلى جنب أو TAP الجغرافية 1، 2.
وبالإضافة إلى ذلك أكثر حداثة لهذه التقنيات هو مزيج من تنقية تقارب من البروتين من الفائدة من خط خلايا الثدييات ذات الصلة، تليها الكمي باستخدام مطياف الكتلة وضع العلامات النظائر مستقرة من الأحماض الأمينية في الثقافة الخلية (SILAC) 3. هذا لم يتم مضطرب المزايا على نهج الخميرة اثنين الهجين في ذلك توطين الخلية والتعديلات بعد متعدية، فضلا عن المزايا أكثر من التقليدية في أنه هو النهج الكمي النوعي بدلا من السماح للمستخدم الجرمية الجغرافية TAP تميز dily غير وجه التحديد التفاعل البروتينات والملوثات، من العوامل المضيفة التي تربط على وجه التحديد. كذلك، عادة ما يتم تحليل عينة ككل، بدلا من العصابات البروتين الفردية، لا يتم ملثمين البروتينات من الفائدة عن طريق ترحيل بالمثل البروتينات على هلام، كما أنها لا تحتاج عادة ليكون حاضرا في مستويات كافية لتكون واضحة بعد تلطيخ، مما يؤدي إلى الأعداد المتزايدة من البروتينات التي تم تحديدها بثقة 4.
لإثبات هذه التقنية، اندماج GFP من حقيقية النواة عامل بدء ترجمة وثيقة الصلة وتم التحقيق eIF4AI وeIF4AII أن حصة أكثر من 90٪ من الأحماض الأمينية التي كتبها الهوية SILAC مناعي البروتينات الكمي. تم استنساخ eIF4AI الإنسان والثاني في pEGFP-C1 لتشكيل البروتين الانصهار حيث تنصهر GFP إلى N-محطة من eIF4A. لتجنب الحاجة لتوليد خطوط الخلايا مستقرة استخدمت ترنسفكأيشن عابرة لتقديم هذه التركيبات إلى النظائر الخلايا 293T المسمى مستقرة.
"jove_content"> وصفت الخلايا الأولى لمدة أسبوعين في SILAC سائل الإعلام والثقافة الخلية، تليها ترنسفكأيشن من الحمض النووي البلازميد ترميز البروتين من الفائدة. وبعد ذلك هي lysed الخلايا، وتركيز البروتين تطبيع، وكميات متساوية من المحللة تقارب تنقيته على الاغاروز مكافحة GFP. كميات متساوية من شطافة ثم تم الجمع بين وقدم لتحليل LC-MS/MS. ثم تتم معالجة نتائج هذا التحليل إلى تحديد البروتين ثقة عالية: تفاعلات البروتين (الشكل 1).
SILAC مناعي يمكن تحديد ليس فقط التفاعلات المباشرة ولكن أيضا منخفضة تقارب أو التفاعلات غير المباشرة مع المجمعات البروتين 4. باستخدام هذا النظام، والثاني eIF4AI immunoprecipitations يسمح تحديد استنساخه واثقة من الشريك الأساسي ملزمة eIF4G (الأشكال الإسوية I / II و III) 5، وكذلك التفاعلات غير المباشرة مع eIF4E، ومكونات عديدة من مجمع eIF3.
Protocol
1. انشاء والركض من خطوط الخلايا المسمى SILAC
ملاحظة: يجب تجنب استخدام التربسين EDTA-في جميع مراحل الركض وإعداد نماذج تجريبية لتحليل مثل التربسين قد تحتوي على الأحماض الأمينية غير المسماة، والذي من شأنه أن يؤدي إلى وضع العلامات غير مكتملة من العينات.
- لإعداد زجاجة من وسائل الإعلام SILAC إضافة 0.5 مل قسامة من أرجينين (84 ملغ / مل في برنامج تلفزيوني) ويسين (146 ملغ / مل في برنامج تلفزيوني) بشكل مناسب SILAC المسمى لزجاجة 500 مل من الارجنتين / ليز DMEM الحرة (التي تحتوي على L-الجلوتامين).
- المقبل، إضافة 50 مل من مدال FBS و 5 مل من البنسلين / الستربتوميسين إلى زجاجة 500 مل.
ملاحظة: ينبغي الحفاظ على خلايا كلوة الجنين البشري 293T (آي تي سي سي) في DMEM سائل الإعلام التي تفتقر إلى أرجينين ويسين وتستكمل مع ضوء (R0K0) ومتوسطة (R6K4) أو الثقيلة (R10K8) والأحماض الأمينية، ومدال مصل بقري جنيني (10 كيلو دالتون قطع)، والبنسلين / الستربتومايسين. يجب الحفاظ على خلايا في وسائل الإعلام لمدة لا تقل عن 5 انقسامات الخلية لضمان كاملةوضع العلامات. في معظم الحالات وصفت الخلايا بسهولة في ≥ 2 أسابيع. - لتقسيم الخلايا لمدة الركض، يجب فكها الخلايا من أحادي الطبقة من خلال ضرب القارورة. وتشمل البدائل استخدام مكاشط خلية أو باستخدام خالية من الانزيم، استنادا PBS العازلة الخلية تفارق.
ملاحظة: للحفاظ على وسائل الإعلام، وينبغي passaged الخلايا في قوارير T25 وأرقام الخلية أكبر ولدت فقط مباشرة قبل تجربة. - قبل 24 ساعة من خلايا transfecting، البذور 3.5 × 10 6 خلايا المسمى SILAC الى واحدة 10 سم 2 طبق لكل حالة تجريبية قيد التحقيق.
2. ترنسفكأيشن من الخلايا المسمى مع التركيبات pEGFP الانصهار
- إزالة وسائل الإعلام من الخلايا واستبدالها مع 9 مل من خالية من المضادات الحيوية SILAC DMEM (خفيفة أو متوسطة أو ثقيلة) وسائل الاعلام.
ملاحظة: يجب عدم إضافة المضادات الحيوية إلى وسائل الإعلام لأنها قد تتداخل مع كفاءة الكواشف ترنسفكأيشن القائم على الحويصلية. - استعداداتإعادة مزيج من 10 ميكروغرام من البلازميد المناسب (epEGFP-C1، pEGFP-eIF4A-I، pEGFP-eIF4A-II) في 500 ميكرولتر من خالية من المضادات الحيوية SILAC DMEM ومزجها مع 500 ميكرولتر من خالية من المضادات الحيوية SILAC DMEM تحتوي على 10 ميكرولتر من كاشف ترنسفكأيشن (على سبيل المثال، lipofectamine 2000). خلط رد فعل جيدا من قبل pipetting انها صعودا وهبوطا عدة مرات.
- احتضان مزيج التفاعل في درجة حرارة الغرفة لمدة 20 دقيقة ثم قم بإضافة الإفلات من الحكمة أن أحادي الطبقة الخلية. موسيقى الروك لوحة بلطف من جانب إلى آخر.
- احتضان الخلايا المصابة بالعدوى بالنقل عند 37 درجة مئوية و 10٪ CO 2 لمدة 24 ساعة.
ملاحظة: إذا كان التعبير عن بروتين من نتائج في مصلحة أي سمية واضحة، ومن ثم قد يكون من الضروري تقليل كمية البلازميد transfected و / أو مدة الفترة اللاحقة التعبير.
3. حصاد الخلية لست]
- خلايا الحصاد من الطبق في الجليد الباردة PBS باستخدام مكشطة الخلية. جمع الخلايا بواسطة الطرد المركزي في 220 x ج، 476؛ مئوية لمدة 5 دقائق. غسل خلايا 3X أخرى في 10 مل من برنامج تلفزيوني الجليد الباردة.
- resuspend الكرية الخلية في 200 ميكرولتر من العازلة تحلل الخلية (10 ملي TrisCl / درجة الحموضة 7.5، 150 مم كلوريد الصوديوم، 0.5 ملي EDTA، 0.5٪ NP40) مضاف حديثا مثبط البروتياز كوكتيل الثالث في 1X التركيز وريبونوكلياز كوكتيل (اختياري) في 5 ميكرولتر لكل مل.
ملاحظة: للحصول على البروتينات مع الحمض النووي المعروفة النشاط ملزم، فإنه قد يكون من الضروري إضافة nucleases إلى المحللة قبل هطول الأمطار. في الحالات التي يتم إضافتها نوكلياز، ينبغي حضنت العينات على الجليد لمدة 30 دقيقة على الجليد، مع pipetting لكل 10 دقيقة. يمكن استخراج الحمض النووي من مجموع جزء صغير من العينة والتحليل الكهربائي للهلام الاغاروز اختبار فعالية نوكلياز. - عينات الطرد المركزي في 13،000 x ج، 4 درجة مئوية لمدة 10 دقيقة الاحتفاظ طاف باسم المحللة الخلية القابلة للذوبان.
- ينبغي تقييم تركيز المحللة الخلية عن طريق فحص BCA وفقا لتعليمات الشركة الصانعة.
- استخدام تحلل العازلة التي تحتوي على مثبط البروتياز كوكتيل الثالث لتطبيع تركيز البروتين في الحجم النهائي من 500 ميكرولتر.
- ضبط مستوى الصوت إلى 1 مل مع إضافة 500 ميكرولتر من العازلة تخفيف (10 ملي TrisCl / درجة الحموضة 7.5، 150 مم كلوريد الصوديوم، 0.5 ملي EDTA) التي تحتوي على مثبط البروتياز كوكتيل الثالث في النهائي تركيز 1X. ينبغي الاحتفاظ قسامة 50 ميكرولتر من العينة كإدخال عينة وأبقى المحللة على الجليد بينما تستعد حبات مكافحة GFP (على سبيل المثال، GFP شرك).
ملاحظة: عادة عوائد تختلف بين 1-3،5 ملغ من البروتين في النهائي 1 مل عينة. في حين أن مخازن أعلاه هي مناسبة لكثير من البروتينات ذات الاهتمام، والبعض الآخر قد يكون من الضروري تعديل مكونات عازلة لضمان solubilized البروتين الطعم وللحفاظ على تفاعلات البروتين البروتين. وتشمل التعديلات الممكنة وكيل التخزين المؤقت (الفوسفات، HEPES)، تركيز الملح (150-500 ملم)، واختيار المنظفات، أو غيرها من المواد المضافة.
4. تجليد لمكافحة Gالخرز FP
- لفترة وجيزة دوامة الطين حبة ل resuspend الخرز. باستخدام ماصة غيض 200 ميكرولتر مع نهاية تقطع، ونقل 25 ميكرولتر من الخرز لكل عينة لأنبوب جديد.
ملاحظة: يجب على المستخدم إعداد حبات لتجربة SILAC واحد باعتباره MASTERMIX لتقليل التباين عينة إلى عينة. - لكل ميكرولتر من 25 حبة الطين، وإضافة 20 مجلدات (1،500 ميكرولتر في 75 ميكرولتر الطين) من العازلة التخفيف، وأجهزة الطرد المركزي حبات في 2،700 x ج لمدة 5 دقائق. المقبل، تغسل حبات لمزيد من 2X في 20 مجلدا من العازلة التخفيف.
- إضافة 100 ميكرولتر التخفيف العازلة في 25 ميكرولتر حبة الطين. باستخدام تلميح 200 ميكرولتر مع نهاية تقطع، ونقل 85 ميكرولتر من هذا الطين معلق إلى كل من عينات المسمى SILAC من الخطوة 3.6.
- احتضان العينات مع الخرز على محور دوار عند 4 درجة مئوية لمدة 2 ساعة.
5. غسل، شطف، وإعداد العينات لتحليل MS
- عينات الطرد المركزي في 2،700 x ج، 46؛ مئوية لمدة 5 دقائق. ينبغي الإبقاء على 50 ميكرولتر من طاف كما العينة غير منضم، مع ما تبقى من طاف التخلص منها.
- وينبغي أن يضاف العازلة تخفيف 1ml إلى كل أنبوب ل resuspend الخرز والعينة طرد في 2،700 x ج، 4 درجة مئوية لمدة 5 دقائق. يجب التخلص من طاف. هذا يجب أن يتم تنفيذ مرتين.
- أزل البروتين من الخرز بإضافة 50 ميكرولتر من 2X العازلة تحميل SDS، والتدفئة على 95 درجة مئوية لمدة 10 دقيقة. بيليه الخرز بواسطة الطرد المركزي في 2،700 x ج لمدة 2 دقيقة في 4 درجات مئوية
- الاحتفاظ طاف في أنابيب prelubricated، حيث يمكن بعد ذلك تخزينها في -80 درجة مئوية حتى المطلوبة. لتقديمها إلى مرفق مطياف الكتلة، وخلط العينات وصفت 01:01:01 (على سبيل المثال، 10 ميكرولتر من كل منهما) وتقديم عينة مختلطة.
ملاحظة: عند هذه النقطة يمكن اختبار عينات من قبل لطخة غربية، والفضة تلطيخ أو وسائل أخرى لاختبار للتفاعل مع الشركاء ملزمة المعروفة / غير معروف. ويرد مثال في الشكللدى عودتهم 2 تظهر ملزمة محددة من شريك المعروف التفاعل - eIF4G بواسطة لطخة غربية، وظهور عصابات الفضة تلطيخ موجودة في عينات المنسدلة من البروتين من الفائدة، ولكن ليس العينة الضابطة. - تقديم عينة للتحليل LC-MS/MS.
ملاحظة: راض مرة واحدة أن بروتين الموسومة الاهتمام بنجاح ملزمة شركاء التفاعل وأحجام متساوية من كل عينة المسمى (الخفيفة والمتوسطة والثقيلة) ويتم الجمع بين المقدمة للتحليل LC-MS/MS. ومن المعتاد أن تقدم 30 ميكرولتر مجموع عينة IP للتحليل. ويستتبع ذلك خلط 10 ميكرولتر من الضوء المسمى عينة مع 10 ميكرولتر من العينات الثقيلة المسمى 10 ميكرولتر المسمى المتوسطة وإعطاء ما مجموعه 30 ميكرولتر.
6 تحليل البيانات الأول: فهم النتائج، وإزالة تعريفات منخفضة الثقة
ملاحظة: وترد قائمة من عناوين الأعمدة التي يتم إرجاعها بواسطة برنامج بروتيوم مكتشف في الجدول 1 ضيف.برامج خمتلفة (على سبيل المثال، MSQuant، MaxQuant) سيعود عناوين مختلفة، ولكن فقط مجموعة فرعية من هذه مطلوبة من أجل التحليل وهذه هي مشتركة بين حزم البرامج المختلفة. وينبغي أن تتضمن البيانات دائما عددا الانضمام لكل البروتين التي تم تحديدها، نسبة لمقارنة كل نسبة العينة (ضوء مباراة متوسطة، وعلى ضوء مباراة الثقيلة والمتوسطة مقابل الخ الثقيلة)، وعدد من الببتيدات فريدة من نوعها التي تم تحديدها، وشكلا من أشكال معدل إيجابية كاذبة أو إشارة الثقة.
- قبل أن يذهب من خلال البيانات، أولا نسخ البيانات الخام إلى جدول بيانات جديد. من هذا جدول إزالة كافة الأعمدة باستثناء إعطاء عدد الانضمام، عدد من الببتيدات فريدة من نوعها، ونسب مقارنة عينات، وتقلب النسبة، ووصف البروتين. إذا أجريت التجارب المتماثلة، ينبغي الجمع بين هذه إلى ملف Excel واحد، مع كل تجربة الظهور على علامة تبويب منفصلة.
ملاحظة: يتضمن بيانات ثقة منخفضة البروتينات التي حددتها فقط الببتيد فريدة من نوعها واحدة، وتلك ثهنا كان الكمي غير ممكن. - استخدام يبرع 'الدالة' نوع 'أن تأمر البيانات من قبل عدد من الببتيدات وإزالة إدخالات للبروتينات الببتيد تفتقر إلى أكثر من واحد. ثم فرز حسب نسبة وإزالة البروتينات التي تفتقر نسب SILAC (البروتينات غير المحددة).
- تحويل نسب SILAC إلى سجل 2 القيم باستخدام الصيغة: '= سجل (نسبة SILAC، 2)'، حيث يتم استبدال "نسبة SILAC 'لمعرف الخلية.
ملاحظة: ونتيجة لنتائج نسبة SILAC في أي بيانات عن البروتينات مما يدل على انخفاض في وفرة اقتصار قيم بين 0 و 1، ومن المعتاد لتحويل نسبة SILAC إلى نسبة SILAC سجل 2، وهذا يعني البروتينات على حد سواء زيادة أو نقصان في يتم تمثيل عينة على نطاق وسجل فيها 2 أو -2 يمثل زيادة بنسبة 4 أضعاف أو نقصان في وفرة، و3 أو -3 زيادة 9 أضعاف أو نقصان في وفرة على التوالي. بعد هذا التحول، ينبغي للبيانات تناسب غاتوزيع ussian تتمحور حول نسبة SILAC سجل 2 0. يتم إعطاء مثال على ذلك في الشكل 3. - إنشاء أعمدة جديدة في ملف اكسل وحساب نسب تسجيل 2 SILAC لجميع عينة / أعمدة وهمية. لتحويل نسبة وهمية / عينة لعينة / نسبة وهمية، استخدم الصيغة: "= 1/ratio"
7 تحليل البيانات الثاني: تحديد التفاعلات الثقة السامية لمزيد من الدراسة
- مفتوحة Graphpad بريزم، حدد جديد> بيانات الجدول والرسم البياني ... اختار 'عمود' من القائمة الموجودة على الجانب الأيسر من النافذة، وحدد إدخال البيانات / استيراد> أدخل القيم المتماثلة، مكدسة في خيارات الأعمدة. اضغط على "إنشاء".
- حدد ونسخ تعطى سجل 2 عينة / موك SILAC نسبة عمود من جدول بيانات Excel إلى ملف بريزم جديدة.
- انقر فوق القائمة المنسدلة "إدراج"، واختر "تحليل جديد '. قيد التحليل العمود حدد "توزيع الترددات. الحفاظ على الخيارات الافتراضية انقر 'موافق'.
ملاحظة: هذه الخطوة بإنشاء رسم بياني يوضح عدد من البروتينات التي تم تحديدها بنسبة معينة. هذا ينبغي أن تشكل توزيع جاوس. - في مجلد 'نتائج' سيكون قد تم إنشاء قسم 'الرسم البياني "الجديدة. حدد قسم توزيع الترددات.
- انقر فوق القائمة المنسدلة "إدراج"، واختر تحليل جديد> XY> غير الخطية الانحدار (منحنى مناسبا). انقر على 'توزيع جاوس "وانقر فوق موافق.
ملاحظة: هذه الخطوة يناسب منحنى لبيانات توزيع الترددات إنشاؤها في الخطوة 7.3، مما أسفر عن القيم التي يمكن أن تستخدم لاحقا لحساب عتبات أهمية. - في الإطار الذي يظهر النتائج، وبالنظر إلى المتوسط والانحراف المعياري. توليد عتبة بإضافة 1.96 الانحرافات المعيارية للمتوسط.
ملاحظة: هذه القيم تمثل الوسط والانحرافات المعيارية للحي جاوسribution، وليس مجموعة البيانات الإجمالية. سيكون 1.96 الانحرافات المعيارية وضع عتبة في حد الثقة 95٪ (P ≤ 0.05). سيكون 2.58 SD تعطي 99٪، و 3.3 SD 99.9٪. وينبغي أن تحدد عتبة بشكل فردي لكل تجربة متماثلة لأنها قد تختلف.
8 تحليل البيانات ثالثا: دمج مجموعات البيانات المقلدة
ملاحظة: لتكون على ثقة في تحديد الشركاء التفاعل ينبغي من الناحية المثالية أن يتم تنفيذ تجربة نموذجية المنسدلة SILAC ثلاث مرات، مع المتوسطة والثقيلة وصفت عينات تحولت لواحدة من تكرار للتحكم عن أي تأثير وسائل الإعلام على النتائج. والبروتين الذي يظهر كما تتفاعل في اثنين على الأقل من التجارب الثلاث، مع 'عينة switched' وسائل الإعلام التي تمثل واحدة من هذه الناحية المثالية، هي التفاعل ثقة عالية.
- العودة إلى ملف Excel، قم بإنشاء علامة تبويب جديدة تسمى 'جنبا إلى جنب'. العمود تسمية A 'الانضمام' ونسخ جميع الأرقام انضمام كل من سو التجارب الفردية في هذا عمود واحد.
- حدد علامة التبويب "البيانات"، ثم خيار "إزالة التكرارات.
- إنشاء أعمدة للنسب SILAC، ونسبة التباين من كل تجربة فضلا عن البروتين اسم / وصف العمود.
- في علامة التبويب الوصف، استخدام الصيغة VLOOKUP لجمع وصف كل عدد الانضمام. اسحب الصيغة لأسفل العمود لملء في وصف البروتين. الصيغة VLOOKUP هو: "= VLOOKUP (AccessionNo، WheretoLook، ColumnsAccross، كاذبة)"، حيث: AccessionNo دولار فاس مع X كونها رقم الصف WheretoLook هو 'اسم علامة التبويب تجربة' $ A $ 2:.! $ Y $ Z حيث Y و Z هي قطعة اليمنى السفلى من البيانات على جدول بيانات يتم الرجوع إليها. ColumnsAccross هو عدد الأعمدة على الجانب الآخر من الأسطوانات الانضمامالبر في العمود A تكمن القيمة المطلوبة.
ملاحظة: على سبيل المثال، إذا كان الرقم الانضمام في العمود A، والبيانات ذات الاهتمام يكمن في العمود E. قيمة هنا سيكون 5 (العمود A بحساب ك 1). كما كان يتم تجميع أرقام الانضمام في الخطوة ب، فمن الأرجح أن VLOOKUP لن الحصول على جميع الأسماء المطلوبة من تجربة واحدة. حيث تقوم بإرجاع N / A، تعديل الصيغة للحصول على وصف من كل تجربة بدوره حتى يتم الحصول على جميع الأوصاف. - لتسليط الضوء على التفاعل البروتينات في مجموعة البيانات مجتمعة، حدد كل عمود على حدة ونسبة النقر على علامة التبويب الصفحة الرئيسية، تليها القواعد خلايا تنسيق شرطي> تسليط الضوء على> المزيد من القواعد.
- حدد أسلوب 'الكلاسيكية'. تنسيق الخلايا فقط التي تحتوي على "القيمة خلية '،' أكبر من أو يساوي '. في المربع، اكتب في قيمة الانحراف القياسي 1.96، ثم انقر على "موافق".
- تقييم تقلب نسبة لكل التفاعل الإيجابي. إذا طرح٪ من فارiability شأنه إسقاط 'ضرب' أقل من قيمة الحد الأدنى، وهذا يجب أن يعامل بحذر.
ملاحظة: هذا يمثل كيف يتفق النسب الفردية لكل الببتيد التي تشكل معا نسبة SILAC على البروتينات 'هي، وتعطى كنسبة مئوية. عندما يتم أخذ نسبة التباين بعين الاعتبار وبروتين يعطي نسبة SILAC فوق عتبة، وهذا البروتين يمثل ضربة. إذا كانت نسبة التباين يعطي مجموعة التي تقع تحت عتبة، و 'ضرب' قد تمثل الملوثات. - كرر ذلك لكل من الأعمدة النتائج والمقارنة بين مختلف التجارب. البروتينات أبرز المحددة في اثنين أو أكثر من التجارب تمثل التفاعل ثقة عالية.
ملاحظة: اعتمادا على قاعدة البيانات المستخدمة لتخصيص أرقام الانضمام البروتين، في تجارب مختلفة قد تم تحديد البروتين في إطار مختلف، أو حتى عدة أعداد الانضمام. فمن المهم للتحقق من هذا لضمان أن البروتينات لا يتم حذف بطريق الخطأ.
النتائج
في تجربة نموذجية SILAC المنسدلة، فإن الغالبية العظمى من البروتينات المحددة (> 90٪) وتمثل الملوثات فضلا عن البروتينات غير الملزم خصيصا لمصفوفة تقارب وهذا موضح في الشكل 2B، حتى عندما إزالة البروتوكولات الغسيل غالبية الملوثات حشوية مثل GAPDH (الشكل 2A). ومع ذلك، فإن تجميع غير الملزمة تحديدا البروتينات في التوزيع الطبيعي يسمح البروتينات التي تربط خصيصا لبروتين من الفائدة لتمييزها حيث أن هذه العينة لديهم أعلى / نسب وهمية من الخلفية. في حين أن الكتلة الملوثات نظريا حول نسبة SILAC سجل 2 0، وهذا ليس بالضرورة، وتعطى مثالا على هذا في الشكل 3. الأسباب المحتملة لهذا تشمل وضع العلامات SILAC الكمال من الخلايا، وتحميل كميات غير متكافئة أو تركيزات المحللة على حبات مكافحة GFP، فقدانها من خلال تنقية الخرز أو مزيج غير متكافئة جي العينات في نهاية الإجراء تنقية 3. ومع ذلك، يتم تحليل البيانات على أساس افتراض انحراف عتبة قياسية من المتوسط من الملوثات توزع عادة، يجب أن التحولات الطفيفة في توسيط البيانات لن يؤثر على نوعية النتائج.
عند مقارنة الاختلافات في تفاعلات البروتين بين اثنين من البروتينات ذات الصلة، قد تحدث حالة مماثلة حيث يتم إنتاج بروتين واحد من الفائدة إلى مستويات أعلى داخل الخلايا من ثانية (إما بسبب الاختلاف في كفاءة ترنسفكأيشن، أو خاصية جوهرية من البروتين أو مرنا) . بعض الاختلاف في التعبير (على سبيل المثال، الشكل 2A) يمكن تصحيحها عن طريق تحليل نسبة SILAC لهذه العينتين. في هذا المثال ستكون هذه العينات GFP-eIF4AI وGFP-eIF4AII. من خلال تحليل نسبة 4AI/4AII SILAC كما نوقش في الباب 7، فمن الممكن لتحديد البروتينات التي يختلف اختلافا كبيرا بين الأشكال الإسوية ملزمة.
الطبقة = "jove_content"> في الشكل 4، يظهر تمثيل البروتينات ملزمة eIF4A المحددة في واحدة من التجارب التي أجريت طبق الاصل يدل على تغطية عامل معقدة بدء هذا البروتوكول تحقيقها. وقد لوحظت أعلى النسب عادة مع eIF4G، الذي يربط مباشرة إلى eIF4A، مع نسب أقل للeIF4E، الذي يربط eIF4G في موقع بعيدا عن موقع ملزم eIF4A. وقد لوحظت نسب أقل لأعضاء المجمع eIF3. ومع ذلك، وهذا يوضح بجلاء أن التجربة التي تم تحديدها بصورة مرضية الشركاء ملزمة المباشرة وغير المباشرة من eIF4AI والثاني. كما يمكن أن يتوقع من الهوية تسلسل العالية 6، بروتين: ظهرت تفاعلات البروتين الحفظ إلى حد كبير بين الأشكال الإسوية اثنين في هذا النظام التجريبي 7، 8. يتم إعطاء مجموعة مختارة من بعض البروتينات المتفاعلة في الجدول 2، مما يدل على تنسيق البيانات.
| عنوان العمود | وصف |
| الانضمام | يعرض عدد الانضمام لتسلسل |
| تغطية | نسبة تسلسل البروتين من الببتيدات التي تم تحديدها غطت |
| ♯ PSM | الببتيد مباراة الطيفية |
| ♯ الببتيدات | إجمالي عدد الببتيدات فريدة من نوعها التي تم تحديدها لبروتين |
| ♯ العاص | طول البروتين في الأحماض الأمينية |
| MW (دا) | الوزن الجزيئي للبروتين في دالتون. يستبعد التعديلات |
| أحسب. PI | نقطة تساوي الكهربية النظرية من البروتين |
| نتيجة | الدرجة الكلية من البروتين (والذي يمثل مجموع فرديعشرات الببتيد idual). والنتيجة الدقيقة اللازمة لأهمية تختلف بين التجارب. وهناك منشأة MS عادة تطبيق 5٪ معدل اكتشاف كاذبة قطع. |
| تسلسل | تسلسل الأحماض الأمينية المكونة للبروتين |
| نسبة | كثافة نسبية من الببتيدات في عينة المسمى اسمه، مقارنة على عينة المسمى الثاني |
| نسبة عدد | عدد نسب الببتيد التي كانت تستخدم لحساب نسبة بروتين معين |
| تقلب نسبة (٪) | تباين نسب الببتيد الفردية المستخدمة لحساب نسبة بروتين معين |
| وصف | اسم البروتين |
الجدول 1. عناوين الأعمدة قياسي من تقرير بروتيوم مكتشف.في حين يمكن الحصول على معلومات مفيدة من جميع هذه الأعمدة، وأولئك الذين ينتقدون لهذا التحليل تظهر في جريئة.
| الانضمام | الببتيدات | 4AI/Mock | 4AII/Mock | اسم | تحليل SILAC |
| A8K7F6 | 21 | 100 | 1 | eIF4AI | البروتين 'بيت' |
| Q14240 | 22 | 0.01 | 90.855 | eIF4AII | |
| G5E9S1 | 25 | 47.575 | 30.53 | eIF4GI | التفاعل البروتينات |
| Q59GJ0 | 5 | 11.778 | 10.619 | eIF4GII60؛ | |
| P06730 | 3 | 7.22 | 7.57 | eIF4E | |
| Q5T6W5 | 4 | 0.685 | 0.646 | hnRNPK | الملوثات غير الملزم على وجه التحديد |
| P62805 | 1 | 0.531 | 0.498 | هيستون H4 | |
| H6VRG2 | 18 | - | - | الكيراتين-1 | الملوثات البيئية |
| P35527 | 11 | 0.01 | 0.01 | الكيراتين-1 هيكل الخلية 9 |
الجدول 2. بيانات نموذجية من تجربة SILAC مناعي. إعطاء بيانات المثال لبروتين من الفائدة / الطعم (الببتيدات عالية، ونسبة عالية)، والبروتينات التي تتفاعل مع بروتين من الفائدة (عالية / منخفضة الببتيدات، ونسبة عالية)، غير ملزمة على وجه التحديد البروتينات (عالية / منخفضة peptايديس، تقع نسبة أدناه قطع - في هذه التجربة 0.96)، والملوثات البيئية (غالبا ما الببتيدات عالية، نسبة سلبية / تحت عتبة).

الشكل 1. خطة التجريبية. أولا وتزرع الخلايا في وسائل الإعلام التي تفتقر إلى أرجينين ويسين واستبداله مع النظائر مستقرة المسمى أرجينين ويسين لمدة 2 أسابيع (1). (2) وخلايا المصنف إلى 10 سم 2 أطباق وعابر مع البلازميدات ترميز GFP (وهمية) أو البروتينات الانصهار GFP (عينات). (3) والخلايا هي lysed وimmunoprecipitated GFP أو GFP الانصهار البروتينات من الخلية لست]. (4) يتم الجمع بين عينات في نسبة 1:1، وقدم للتحليل LC-MS/MS. ثم يتم تحليل البيانات لإزالة منخفض البروتين الثقة الايدنتifications وتحديد مستوى تخصيب البروتين الموافق البروتينات التفاعل حقيقية.
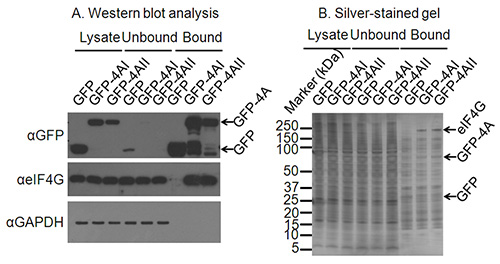
الشكل 2. تأكيد الشروط مناعي مناسب. أ) تحليل لطخة غربية من الخلية لست]، وكذلك الكسور غير منضم والمنضم من مناعي يؤكد التعبير ومناعي للبروتين من الفائدة. لطخة غربية ضد GAPDH يؤكد استنزاف غير التفاعل البروتينات وزيادة وصمة عار الغربية شريكا التفاعل المعروفة من eIF4A يؤكد مناعي ناجح من البروتينات ملزمة للبروتين من الفائدة. ب) أين ليست معروفة شركاء التفاعل من البروتين من الفائدة، هلام الملطخة الفضة قد يؤكد مناعي للبروتينات التفاعل. على هذا الفضة وصمة عار العصابات هلام إد لGFP وGFP-eIF4AI/II واضحة، وفرقة المهاجرة في الحجم الصحيح لeIF4G موجود فقط في الممرات GFP-4AI/II-bound وليس في حارة السيطرة GFP.

الرقم 3. ممثل النتائج. الرسم البياني تبين توزيع نسب البروتين من تكرار واحد من (A) GFP-eIF4AI أو (B) GFP eIF4AII المنسدلة. تم وضع علامة على 1.96 الانحراف المعياري قطع مع خط متقطع. البروتينات المتفاعلة التي تقع خارج الملوثات توزع عادة هي واضح من ~ 0.25 و 1 في (أ)، و~ 0،3-1،5 في (B).
les/ftp_upload/51656/51656fig4.jpg "/>
الشكل 4. تحديد أعضاء اتحاد الصناعات المعقدة من نسخة متماثلة واحدة على التجربة SILAC IP. باللون الأخضر والبروتينات البروتين من الفائدة المستخدم لالمنسدلة التفاعل البروتينات مظللة من الأحمر بإعطاء الأبيض لتسجيل نسبة 2 SILAC في SILAC IP مع الأحمر كونها البروتين الأكثر وفرة في التحليل، والأبيض كونه قطع 1.96 SD. لم يتم تحديد البروتينات المظللة باللون الرمادي في هذا التحليل.
Discussion
استراتيجية المنسدلة SILAC الموصوفة هنا تمثل وسيلة حساسة للغاية وقوية للكشف عن البروتين الرواية: تفاعلات البروتين، ويسمح علاوة على التمييز السريع والبسيط لأنماط ملزمة تغير بين العينات ترتبط ارتباطا وثيقا من الفائدة. في هذا المثال تم استخدام هذه التقنية لتحقيق البروتين: تفاعلات البروتين من eIF4AI وeIF4AII البروتينات 6. لمعرفة صاحب البلاغ، وهذا هو أول دراسة في الأدب استغلال فائدة البروتينات SILAC للتحقيق في interactome الخلوية من هذه الأشكال الإسوية اثنين من eIF4A.
النهج كما هو موضح أعلاه يستخدم GFP علامة ومكافحة GFP الخرز 9، 10، وبالتالي قد تكون هناك حاجة إلى تعديلات تمكين هذا النهج لاستخدامها لبروتين معين من الفائدة، على سبيل المثال ما إذا كان يتم وضع علامة على N-أو C-محطة من البروتين. حيثما أمكن، البقع الغربية أو المقايسات الفنية ينبغيأن يؤديها للكشف ملزمة للبروتين شريك التفاعل معروفة. يجب بروتين لن تتسامح مع الانصهار مع علامة GFP، علامات أخرى أو استراتيجيات المنسدلة تم تطبيقها على pulldowns SILAC باستخدام كل العلامات الأخرى (FLAG 11، بيوتين 12، بكتيريا (البيانات الخاصة، غير منشورة))، أو باستخدام الأجسام المضادة الأولية ضد بروتين من الفائدة حيث سيرنا ضربة قاضية للبروتين الهدف يوفر العينة الضابطة 13. وقد وصفت هذه التجارب في أماكن أخرى من الأدب، ولكن باختصار، الخطوة 1 والخطوات 5،4-8 ستطبق على النحو الوارد أعلاه، مع الخطوات 2-5،3 تعديل بما يتناسب مع نظام التعبير / المنسدلة من خيار استخدام مدخلات البروتين متساوية كما هو موضح في الخطوات 2.4-2.5. كما تسمح المراحل الكمي البروتينات غير محددة وملزمة لإزالتها على مستوى التحليل، فمن المستحسن لحذف ما قبل الحضانة مع حبات السيطرة، أو يغسل عالية من الملح من أجل الحفاظ على البروتين منخفضة تقارب: تفاعلات البروتين مع بروتين من الفائدة . أماه نوكليازذ إدراجها أو حذفها من هذا البروتوكول وفقا لخصوصيات تجربة معينة. على سبيل المثال: مثل البروتينات المستخدمة في هذه الطريقة هي helicases الحمض النووي الريبي، أدرج ريبونوكلياز كوكتيل في بروتوكول لإزالة التفاعلات غير المباشرة بوساطة عبر الحمض النووي الريبي (الخطوة 3.2). في بعض الحالات ومع ذلك، يمكن أن يكون هناك استفادة من تجارب تشغيل بالتوازي مع وبدون نوكلياز لتحديد الحمض النووي تعتمد التفاعلات.
في هذا البروتوكول، وأوصى التحول من 'متوسطة' وعينات 'الثقيلة' في التجارب تكرار للسيطرة على الاختلاف الذي عرضته الاختلافات في وسائل الإعلام أو SILAC نمو الخلايا. ينطوي على المكافحة البديلة التبديل التتابعي من كل ثلاثة ('ضوء'، 'المتوسط'، و 'الثقيلة') وسائل الاعلام في التجارب متماثلة. بينما هذا النهج هو يحتمل أن تكون أكثر صرامة، فإنه يزيد من تعقيد التحليل، كما هو الحال في تكرار واحد على الأقل، وهو بروتين من الفائدة ثسوء يتم إنتاجها في "خفيف" الخلايا المسمى ولذا فمن الضروري التمييز بين البروتينات التي تم تحديدها في عينات باستمرار "خفيف" (الملوثات البيئية مثل keratins)، وتلك التي هي المخصب فقط في عينات 'النور' عندما منضما إلى البروتين الفائدة.
في حين أن استخدام البيانات الكمي يسمح التمييز محددة من التفاعلات غير محددة من خلال استخدام عتبة، حتما قد يتم تجاهل بعض التفاعلات حقيقية. النهج المذكور أعلاه هو نهج بسيطة وسريعة لتحديد البروتين: البروتين التفاعلات التي يمكن أن تكون محاولة من قبل الباحثين بسهولة مع عدم وجود خبرة سابقة مع مطياف الكتلة، أو تحليل البروتين كبيرة: البروتين مجموعات البيانات التفاعل. بالنسبة لمعظم الاستخدامات وهذا هو أكثر من كافية لتحديد البروتينات الرواية المثيرة للاهتمام. موصوفة تعديلات إضافية على هذا النهج للمساعدة في تقليل هذه الخسارة البيانات في أي مكان آخر في الأدب وتشمل استخدام العلاقات العامةمكتبة تردد otein حيث يعرف البروتينات الملوثة لمجموعة محددة من المعلمات التجريبية (خط الخلية، وحبة مصفوفة، وظروف العازلة) يجوز استبعاد 10، 14. ومع ذلك، اعتمادا على المعلمات التجريبية معينة قد يكون من الضروري لتشغيل عدد من التجارب تحكم لتوليد بروتيوم حبة، وبالتالي يمكن زيادة كل هذا على حساب وتعقيد التجربة. مزيد من المعلومات عن هذه التقنية هو متاح من موقع www.peptracker.co.uk 14.
وتجدر الإشارة أيضا إلى أن البروتوكول هو موضح أعلاه ينطوي خلط العينات وصفت بشكل مختلف في نهاية عملية مناعي (وهو ما يسمى في خلط بعد تنقية - التجربة SILAC MAP). يتم ذلك كما البروتين: تحدث تفاعلات البروتين في توازن معين 15. تجدر الإشارة إلى أن مجموعات أخرى تضافرت هذا النهج MAP SILAC الموصوفة في هذا البروتوكول مع الحضانة من العيناتقبل المنسدلة (تنقية بعد خلط - حزب الأصالة والمعاصرة SILAC) لفترات مختلفة من الزمن (وقد استخدمت 20 دقيقة إلى 2 ساعة في الأدب) 15، 16. على أساس مدى سرعة انخفاض نسبة البروتين نحو 1:1، فمن الممكن للتحقيق نوعيا الانتماءات الملزمة وتحديد البروتينات بأنها مستقرة أو ديناميكية التفاعل البروتينات 15.
باختصار، تمثل pulldowns SILAC وسيلة قوية للغاية لتحديد البروتينات التفاعل مع بروتين معين من الفائدة، في جو من الناحية الفسيولوجية ذات الصلة. تقنية يمكن تكييفها بسهولة للغاية لعدد من الاستراتيجيات تنقية مختلفة، مما يسمح تطبيقه على أي بروتين معين من الفائدة. الكمي لنتائج يبسط إلى حد كبير تحديد التفاعلات حقيقية، ويسمح تخفيف الشروط الصارمة العازلة المستخدمة لإزالة المجلدات غير محددة، وبالتالي يحافظ على انخفاض التفاعلات تقارب. ما يصل الى ثلاث عينات يمكن مقارنة في أعلاهاستراتيجية وتقنية لديه نقاط قوة واضحة في المقارنة بين الاختلافات في بروتين ملزمة بين الأشكال الإسوية مختلفة من البروتين والبروتينات متحولة، أو تأثير مثبطات الدوائية. كما يتم تحليل شرائح هلام كله بدلا من العصابات الفردية التي وصمة عار بواسطة Coomassie، فإن أعداد البروتينات التي تم تحديدها في ثقة عالية وعادة ما تكون أعلى من تلك المحددة في معيار ضريبة المبيعات / TAP-المنسدلة، والمجرب التحيز في اختيار البروتينات ذات الاهتمام تتم إزالة. ولذلك فإن تقنية يقارن ايجابيا جدا مع التقنيات الأخرى المستخدمة استخداما في تحديد رواية البروتين التفاعلات (الخميرة 2 الهجين، ضريبة المبيعات / صاحب أو TAP Pulldowns).
Disclosures
يعلن الكتاب أنه ليس لديهم مصالح مالية المتنافسة.
Acknowledgements
وأيد هذا العمل من المنح المقدمة من ويلكوم ترست وBBSRC لIG. IG هو زميل أقدم يلكوم.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium (DMEM) | Dundee Cell Products | LM010 | DMEM lacking Arginine and Lysine. (and containing L-glutamine) |
| Dialysed FBS (10 kDa cutoff) 500 ml | Dundee Cell Products | DS1003 | |
| Arginine (R0) 25 g | Sigma-Aldrich | A8094 | Resuspend 0.5 g in 6 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 84 mg/ml stock) |
| Arginine (R6) 0.5 g | Cambridge Isotope Labs | CLM-2265 | Resuspend 0.5 g in 6 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 84 mg/ml stock) |
| Arginine (R10) 0.5 g | Cambridge Isotope Labs | CNLM-539 | Resuspend 0.5 g in 6 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 84 mg/ml stock) |
| Lysine (K0) 25 g | Sigma-Aldrich | L8662 | Resuspend 0.5 g in 3.5 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 146 mg/ml stock) |
| Lysine (K4) 0.5 g | Cambridge Isotope Labs | DLM-2640 | Resuspend 0.5 g in 3.5 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 146 mg/ml stock) |
| Lysine (K8) 0.5 g | Cambridge Isotope Labs | CNLM-291 | Resuspend 0.5 g in 3.5 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 146 mg/ml stock) |
| Penicillin/streptomycin, Liquid. 100 ml | Gibco | 15140-122 | |
| Lipofectamine 2000 transfection reagent | Invitrogen | 11668-027 | |
| GFP-trap Agarose (500 μl resin) | Chromotek | gta-20 | |
| 5x SDS Sample loading buffer | Fisher Scientific | PN39000 | The use of purchased rather than homemade sample buffer is recommended to minimize keratin contamination. |
| Protease inhibitor cocktail set III | Calbiochem | 539134 | |
| 1.7 ml prelubricated tubes | Costar | 3207 | |
| BCA protein assay kit (1 L) | Pierce | 23225 | |
| Tris (Trizma) | Sigma-Aldrich | T1503 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6758 | |
| Sodium chloride | Sigma-Aldrich | S3014 | |
| Rnase cocktail | Ambion | AM2286 | |
| NP-40 alternative | Millipore | 492016 |
References
- Williamson, M. P., Sutcliffe, M. J. Protein-protein interactions. Biochem Soc Trans. 38, 875-878 (2010).
- Bailey, D., Urena, L., Thorne, L., Goodfellow, I. Identification of protein interacting partners using tandem affinity purification. J. Vis. Exp. (60), (2012).
- Trinkle-Mulcahy, L. Resolving protein interactions and complexes by affinity purification followed by label-based quantitative mass spectrometry. Proteomics. 12, 1623-1638 (2012).
- Emmott, E., et al. The cellular interactome of the coronavirus infectious bronchitis virus nucleocapsid protein and functional implications for virus biology. J Virol. 87, 9486-9500 (2013).
- Li, W., Belsham, G. J., Proud, C. G. Eukaryotic initiation factors 4A (eIF4A) and 4G (eIF4G) mutually interact in a 1:1 ratio in vivo. J Biol Chem. 276, 29111-29115 (2001).
- Nielsen, P. J., Trachsel, H. The mouse protein synthesis initiation factor 4A gene family includes two related functional genes which are differentially expressed. EMBO J. 7, 2097-2105 (1988).
- Galicia-Vazquez, G., Cencic, R., Robert, F., Agenor, A. Q., Pelletier, J. A cellular response linking eIF4AI activity to eIF4AII transcription. RNA. 18, 1373-1384 (2012).
- Zakowicz, H., et al. Mutational analysis of the DEAD-box RNA helicase eIF4AII characterizes its interaction with transformation suppressor Pdcd4 and eIF4GI. RNA. 11, 261-274 (2005).
- Rothbauer, U., et al. A versatile nanotrap for biochemical and functional studies with fluorescent fusion proteins. Mol Cell Proteomics. 7, 282-289 (2008).
- Trinkle-Mulcahy, L., et al. Identifying specific protein interaction partners using quantitative mass spectrometry and bead proteomes. J Cell Biol. 183, 223-239 (2008).
- Dobreva, I., Fielding, A., Foster, L. J., Dedhar, S. Mapping the integrin-linked kinase interactome using SILAC. J Proteome Res. 7, 1740-1749 (2008).
- Mittler, G., Butter, F., Mann, M. A SILAC-based DNA protein interaction screen that identifies candidate binding proteins to functional DNA elements. Genome research. 19, 284-293 (2009).
- Selbach, M., Mann, M. Protein interaction screening by quantitative immunoprecipitation combined with knockdown QUICK. Nat Methods. 3, 981-983 (2006).
- Boulon, S., et al. Establishment of a protein frequency library and its application in the reliable identification of specific protein interaction partners. Mol Cell Proteomics. 9, 861-879 (2010).
- Wang, X., Huang, L. Identifying dynamic interactors of protein complexes by quantitative mass spectrometry. Mol Cell Proteomics. 7, 46-57 (2008).
- Fang, L., et al. Characterization of the human COP9 signalosome complex using affinity purification and mass spectrometry. J Proteome Res. 7, 4914-4925 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved