Method Article
Идентификация белков взаимодействию Партнеры в клетках млекопитающих Использование SILAC-иммунопреципитации количественная протеомика
В этой статье
Резюме
SILAC иммунопреципитации эксперименты представляют собой мощное средство для обнаружения новый белок: белковых взаимодействий. Допуская точное относительное количественное определение белка изобилии в контрольной группе и тестовых образцов, истинных взаимодействий может быть легко отличить от экспериментальных загрязняющих веществ и низкой аффинности взаимодействия сохраняется за счет использования менее жестких условиях буфера.
Аннотация
Количественные протеомика в сочетании с очистки иммуно-аффинной, SILAC иммунопреципитацией, представляют собой мощное средство для открытия нового белка: белковых взаимодействий. Допуская точную количественную оценку относительного белка изобилии в контрольной группе и образцов, истинные взаимодействия могут быть легко отличить от экспериментальных загрязнений. Низким сродством взаимодействия могут быть сохранены путем использования менее жестких условиях буферных и быть легко идентифицировать. Этот протокол обсуждает маркировки клетках тканевой культуры с стабильный изотоп меченых аминокислот, трансфекции и иммунопреципитации сродством отмеченных интерес белок, после чего готовится для представления к массовому объекта спектрометрии. Этот протокол, то обсуждается, как анализировать и интерпретировать данные, возвращенные из масс-спектрометра с целью выявления клеточных партнеров, взаимодействующих с белком интересов. В качестве примера этот метод применяется для идентифы белки обязательные для эукариотических факторов инициации трансляции: eIF4AI и eIF4AII.
Введение
Существенным шагом в понимании функции белка является выявление соответствующих взаимодействующих белков. Где такие белки неизвестны есть ряд методов доступны, каждый со своими достоинствами и недостатками. К ним относятся дрожжи двух гибридную систему, раскрывающиеся анализов с использованием рекомбинантного белка, а также очистку тандем сродства или TAP-тегов 1, 2.
Более недавнее дополнение к этих методов является сочетание аффинной очистки интересующего белка от соответствующей линии клеток млекопитающих, а затем количественного масс-спектрометрии с использованием изотопа стабильного маркировки аминокислот в клеточной культуре (SILAC) 3. Это имеет преимущества по сравнению с дрожжевой двухгибридной подхода в этой локализации клеток и пост-трансляционных модификаций не возмущается, а также преимуществ по сравнению с традиционным TAP-тегов в том, что это количественное, а не качественное подход, позволяющий пользователю РиDíly отличить неспецифически взаимодействующих белков и загрязнителей, от хозяина факторов, которые специфически связываются. Кроме того, как образец анализировали обычно целом, а не в виде отдельных белковых полос, белки, представляющие интерес, не маскируется аналогично миграции белки в геле, и они, как правило, должны присутствовать в достаточном уровне, чтобы быть видимыми после окрашивания, что приводит к увеличение числа уверенно идентифицированных белков 4.
Чтобы продемонстрировать эту технику, GFP слитые тесно связанной с эукариотической фактор инициации трансляции eIF4AI и eIF4AII, что доля более 90% идентичности аминокислотной были исследованы SILAC-иммунопреципитации количественных протеомики. Человека eIF4AI и II, были клонированы в pEGFP-C1 сформировать гибридный белок, где GFP закрепляется на N-конце eIF4A. Чтобы избежать необходимости создания стабильных клеточных линий временная трансфекция был использован для доставки этих конструкций в стабильный изотоп меченых клеток 293Т.
Клетки сначала помечены течение двух недель в SILAC клеточной культуральной среде, а затем трансфекции плазмидной ДНК, кодирующей интересующий белок. Клетки затем лизируют, концентрация белка нормализованы, и равное количество лизата сродством очищают на анти-GFP агарозы. Равные количества элюата, затем были объединены и представлены для анализа LC-MS/MS. Результаты этого анализа затем обрабатываются для выявления высокого доверия белок: белковые взаимодействия (рис. 1).
SILAC иммунопреципитацию позволяет выявить не только прямых взаимодействий, но и низким сродством или косвенных взаимодействий с белковыми комплексами 4. Используя эту систему, eIF4AI и II immunoprecipitations разрешено воспроизводимый и уверенный опознавание первичной связывающим партнером eIF4G (изоформ I / II и III) 5, а также косвенные взаимодействия с eIF4E, а также многочисленные компоненты комплекса eIF3.
протокол
1. Генерация и пассажи SILAC меченных клеточных линий
Примечание: использование трипсина-EDTA следует избегать на всех этапах пассажей и подготовки экспериментальных образцов для анализа, как трипсин может содержать немеченые аминокислоты, которые привели бы к неполной маркировки образцов.
- Чтобы подготовить бутылку SILAC сред добавить 0,5 мл аликвоты соответствующим SILAC-меченого аргинина (84 мг / мл в PBS) и лизина (146 мг / мл в PBS) в 500 мл бутылку Arg / Lys свободного DMEM (содержащей L-глутамин).
- Затем добавьте 50 мл диализовали FBS и 5 мл пенициллина / стрептомицина в бутылки емкостью 500 мл.
Примечание: HEK 293T-клетки (АТСС) должны быть сохранены в DMEM средах без аргинин и лизин и с добавлением света (R0K0), средние (R6K4) или тяжелой (R10K8) аминокислоты, диализовали фетальной бычьей сыворотки (10 кДа среза) и пенициллин / стрептомицина. Клетки должны быть сохранены в среде в течение минимум 5 делений, чтобы обеспечить полноемаркировка. В большинстве случаев клетки легко помечать в ≥ 2 недель. - Чтобы разделить клетки для пассажей, клетки должны быть вытеснены из монослоя, нажав колбу. Альтернативы включают использование сотовых скребками или с помощью фермента свободной, PBS-буфера на основе клеточной диссоциации.
Примечание: Для экономии средств массовой информации, камеры должны быть пассировать в колбы Т25 и большее число клеток генерируется только непосредственно перед экспериментом. - За 24 часа до трансфекции клеток, семян 3,5 х 10 6 SILAC меченных клеток в единый 10 см 2 блюдо для каждой экспериментальной состоянии ведется расследование.
2. Трансфекцию меченых клеток с pEGFP-слитые конструкции
- Выньте материал из клеток и заменить его 9 мл антибиотиков без SILAC DMEM (светлый, средний или тяжелый) средств массовой информации.
Примечание: Антибиотики не должны быть добавлены в средствах массовой информации, так как они могут мешать эффективности липосом на основе реагентов трансфекции. - Prepaповторно смеси 10 мкг соответствующего плазмиды (epEGFP-С1, pEGFP-eIF4A-я, pEGFP-eIF4A-II) в 500 мкл антибиотикам свободного SILAC DMEM и смешайте его с 500 мкл антибиотик без SILAC DMEM, содержащей 10 мкл реагента для трансфекции (например, липофектамин 2000). Смешайте реакцию тщательно с помощью пипетки вверх и вниз несколько раз.
- Инкубируют реакционную смесь при комнатной температуре в течение 20 мин и затем добавляют по каплям к клеточный монослой. Рок планшет слегка из стороны в сторону.
- Инкубируйте трансфицированных клеток при 37 ° С и 10% CO 2 в течение 24 часов.
Примечание: Если экспрессия белка процентных приводит к какой-либо видимой токсичности, то это может быть необходимо, чтобы уменьшить количество трансфицированных плазмидой и / или длительность последующего периода экспрессии.
3. Сбор клеточных лизатов
- Урожай клеток в чашке в охлажденный льдом PBS с использованием клеточного скребка. Сбор клеток путем центрифугирования при 220 х г, 476; C в течение 5 мин. Промыть клетки еще 3 раза в 10 мл охлажденного льдом PBS.
- Ресуспендируют осадок клеток в 200 мкл буфера для лизиса клеток (10 мМ TrisCl / рН 7,5, 150 мМ NaCl, 0,5 мМ ЭДТА, 0,5% NP40), содержащий недавно добавленный коктейль ингибиторов протеаз III при концентрации 1х и РНКазы коктейль (по желанию) в 5 мкл на мл.
Примечание: белков с известной нуклеиновой кислоты связывающую активность, это может быть необходимо добавить нуклеазы в лизате до осаждения. В случаях, когда нуклеазы добавлен, образцы должны быть инкубировали на льду в течение 30 мин на льду, с пипеткой каждые 10 мин. Извлечение общей нуклеиновой кислоты из небольшой части образца и анализ методом электрофореза в агарозном геле можно проверить эффективность нуклеазы. - Центрифуга образцов при 13000 х г, 4 ° С в течение 10 мин сохранить супернатант в качестве растворимого клеточного лизата.
- Концентрация клеточного лизата должны быть оценены ВСА в соответствии с инструкциями изготовителя.
- С помощью лизирующего буфера, содержащий коктейль ингибиторов протеаз III нормализовать концентрацию белка в конечном объеме 500 мкл.
- Регулировка громкости до 1 мл с добавлением 500 мкл буфера для разведения (10 мМ TrisCl / рН 7,5, 150 мМ NaCl, 0,5 мМ ЭДТА), содержащего ингибитор протеазы коктейль III в конечной концентрации 1х. 50 мкл аликвоты образца должны быть сохранены в качестве входа образца и лизат хранили на льду во время приготовления анти-GFP бусы (например, GFP-ловушка).
Примечание: Обычно выходы варьироваться в зависимости от 1-3,5 мг белка в конечном 1 мл образца. В то время как указанные выше буферы пригодны для многих белков, представляющих интерес, для других это может быть необходимо модифицировать буферные компоненты, чтобы обеспечить белок солюбилизируют приманки и поддерживать белок-белковых взаимодействий. Возможные изменения включают в себя буферный агент (фосфат, HEPES), концентрацию соли (150-500 мм), то выбор моющего средства, или другие добавки.
4. Привязка к Anti-GFP бусы
- Кратко вихрь шарик суспензии для ресуспендирования бисером. Использование пипетки 200 мкл с конца отрезаны, передать 25 мкл шариков на образца в свежую пробирку.
Примечание: Пользователь должен подготовить бисером для одного SILAC эксперимента как Mastermix минимизации образца к образцу изменение. - Для каждого 25 мкл суспензии борта, добавьте 20 томов (1500 мкл на 75 мкл суспензии) буфера для разведения, и центрифуга шарики в 2700 мкг в течение 5 мин. Далее, Вымойте бисером еще 2 раза в 20 объемах буфера для разведения.
- Добавить 100 мкл буфера для разведения за 25 мкл шарик суспензии. Использование наконечника 200 мкл с конца отрезаны, трансфер 85 мкл этой ресуспендированного суспензии в каждый из SILAC меченных образцов, полученных на шаге 3.6.
- Инкубируйте образцы с бисером на ротатора при 4 ° С в течение 2 часов.
5. Стиральная, Элюция, и подготовка образцов для MS анализа
- Центрифуга образцов при 2700 мкг в, 46; С в течение 5 мин. 50 мкл супернатанта следует сохранить в качестве несвязанного образца, с остатком супернатант отбрасывали.
- 1 мл буфера разбавление должно быть добавлено к каждой пробирке ресуспендируют бусины и образец центрифугировали при 2700 х г, 4 ° С в течение 5 мин. Супернатант должны быть отброшены. Это должно быть выполнено дважды.
- Элюируют белок из гранул путем добавления 50 мкл 2x буфера для ДСН, и нагревание при 95 ° С в течение 10 мин. Гранул шарики центрифугированием при 2700 х г в течение 2 мин при 4 ° С
- Сохранить супернатант в смазанные труб, где оно может быть затем хранили при -80 ° С до использования. Для представления в масс-спектрометрии объекта, смешать меченых образцов 1:01:01 (например, 10 мкл каждый) и представить смешанный образец.
Примечание: На данный момент образцы можно тестировать помощью вестерн-блоттинга, окрашиванием серебром или другими средствами для проверки взаимодействия с известными и / или неизвестных связывающих партнеров. Пример приведен на рисЮр 2 показывает специфическое связывание известного партнера взаимодействия - eIF4G по вестерн-блоттинга, и появление серебряных окрашивания полос, присутствующих в выпадающих образцов из интересующего белка, но не контрольного образца. - Представьте образец для анализа LC-MS/MS.
Примечание: после удовлетворен тем, что меченый белок, представляющий интерес, успешно связывания партнеров взаимодействия, равных объемов каждого меченого образца (легкие, средние и тяжелые) объединены и представлены для анализа LC-MS/MS. Это обычная представить 30 мкл общей сложности образца IP для анализа. Это повлечет за собой смешивание 10 мкл меченных света образца с 10 мкл меченных средних и тяжелых 10 мкл меченных проб, чтобы дать общей 30 мкл.
6 Анализ данных Я:. Понимание результаты, и отмена низкого доверия идентификаций
Примечание: Перечень заголовков столбцов, возвращаемых программного обеспечения Протеом Discoverer приведены в таблице 1 DIF.обнаружению разных программное обеспечение (например, MSQuant, MaxQuant) будет возвращать разные заголовки, однако, только часть из них необходимы для анализа и эти общие для различных программных пакетов. Данные всегда должны включать инвентарный номер для каждого белка определены, соотношение'S сравнения каждого соотношение образца (светло против среды, свет против тяжелый, средний и тяжелый и т.д.), количество уникальных пептидов, идентифицированных и некоторые формы ложных срабатываний или указанием достоверности.
- Прежде, чем идти через данные, сначала скопируйте исходные данные, чтобы новую электронную таблицу. Из этой таблицы удалить все столбцы, кроме тех, давая инвентарный номер, число уникальных пептидов, коэффициенты сравнении образцов, вариабельность отношение, описание белка. Если были выполнены реплики эксперименты, они должны быть объединены в один файл Excel, причем каждый эксперимент появляться на отдельной вкладке.
Примечание: низкий данные уверенность включает в себя белки, определенные только одной уникальной пептида, и те, шздесь количественная не удалось. - Функцию превосходит '' сортировки 'Используйте заказать данные по количеству пептидов и удалите записи для белков, не имеющих более одного пептида. Затем сортировать по соотношению и удаления белков, которые не имеют отношения SILAC (бескванторная белки).
- Преобразование соотношения SILAC в журнал 2 значения по формуле: '= лог (SILAC побед, 2)', где 'SILAC побед "заменяется идентификатором клеток.
Примечание: как отношение SILAC результатов в любых данных для белков, показывающих уменьшение обилия ограничивается до значений от 0 до 1, это обычная для преобразования соотношение SILAC в соотношении журнал 2 SILAC, так как это означает, белки и увеличивается или уменьшается в образец представлены в логарифмической шкале, где 2 или -2 представляет собой 4-кратное увеличение или уменьшение в изобилии, и 3 или -3 9-кратное увеличение или уменьшение в изобилии соответственно. После этого преобразования, данные должны соответствовать GaОССИЙСКОЙ распределение сосредоточена вокруг SILAC логарифма отношения 2 0. Примером этого дается на рисунке 3. - Создание новых столбцов в файле первенствовать и рассчитать войти 2 коэффициенты SILAC для всех образцов / макетов столбцов. Для преобразования соотношении макет / образца к образцу / макет отношение, использовать формулу: "= 1/ratio"
7 Анализ данных II:. Выбор высокого доверия Взаимодействие для дальнейшего изучения
- Открыть Graphpad Призма, выберите Создать> Таблица данных и график ... Выбрать 'столбца' из списка на левой стороне окна и выберите Ввод / Импорт данных> Введите значения реплики, многоярусные в столбцы вариантов. Нажмите 'Создать'.
- Выделите и скопируйте данный журнал 2 примера / Мок SILAC отношение столбец из таблицы Excel в новую Prism файла.
- Нажмите меню в выпадающем окне "Insert" и выберите "Новый анализ". Под анализа столбца выберите 'Плотность распределения. Хранение параметры по умолчанию нажмите «OK».
Примечание: Этот шаг генерирует гистограмму, иллюстрирующую количество белков, определенных в заданном соотношении. Это должно сформировать распределение Гаусса. - В папку "результатов" будет создано разделе новая 'гистограмма'. Выберите раздел распределения частот.
- Нажмите меню в выпадающем окне "Insert" и выберите Новый анализ> XY> Нелинейная регрессия (кривая нужным). Нажмите на 'распределения Гаусса "и нажмите кнопку ОК.
Примечание: Этот шаг соответствует кривой с данными распределения частот, генерируемых на этапе 7,3, получая значения, которые впоследствии могут быть использованы для вычисления пороговые значения для значения. - В окне результатов, которое появляется, среднее значение и стандартное отклонение даны. Создайте порог, добавив 1,96 стандартных отклонений к среднему.
Примечание: Эти значения представляют собой среднее и стандартное отклонение Гаусса р-нribution, а не общее набор данных. 1,96 стандартных отклонений бы разместить порог на 95% доверительного интервала (р ≤ 0,05). 2.58 SD даст 99%, и 3,3 SD 99,9%. Порог должен быть определен индивидуально для каждого эксперимента реплики, как это может варьироваться.
8 Анализ данных III:. Объединение Реплика наборов данных
Примечание: Чтобы быть уверенным в выявлении партнеров взаимодействия типичный SILAC пулдаун эксперимент в идеале должны быть выполнены три раза, с средних и тяжелых меченых образцов включается для одного из повторов по контролю для любого эффекта СМИ о результатах. Белок, который показывает, как взаимодействуют в по крайней мере два из трех экспериментов, с 'switched'-медиа образца идеально, представляющей один из них, является высокая взаимодействие доверия.
- Вернуться на файл Excel, создать новую вкладку под названием «Объединенный». Столбце Метка "Присоединение" и скопировать все номера вступлении друг от ое отдельные эксперименты в этой одной колонке.
- Выберите вкладку «Данные», а затем опцию "удалить дубликаты.
- Создание колонки для отношений SILAC и изменчивости соотношения от каждого эксперимента, а также для белка имя / описание столбца.
- На вкладке описание, использовать формулу ВПР собрать описание каждого инвентарным номером. Перетащите формулу вниз по колонне, чтобы заполнить в описании белка. Формула ВПР является: "= ВПР (AccessionNo, WheretoLook, ColumnsAccross, False)", где: AccessionNo составляет $ топор с X является номер строки WheretoLook является закладка 'Эксперимент Имя' $ A $ 2:.! $ Y $ Z, где Y и Z являются нижний правый фрагмент данных на электронных таблиц которые ссылаются. ColumnsAccross является число столбцов напротив вступления питBER в колонке А требуемое значение лежит.
Примечание: Например, если число Присоединение находится в колонке А, и данные интерес лежит в колонке Е. Значение здесь будет 5 (колонка приравнивается к 1). Как регистрационные номера были объединены на стадии б, то, скорее всего, что ВПР не получит все необходимые имена из одного эксперимента. Где он возвращает N / A, изменить формулу для получения описания от каждого эксперимента, в свою очередь, пока все описания не приобрел. - Чтобы подчеркнуть взаимодействующих белков в комбинированном наборе данных, выберите каждый столбец соотношение индивидуально и нажмите на вкладке Главная, а затем Условное форматирование> Выделите клеток правил> еще правила.
- Выберите стиль "Classic". Формат только клетки, которые содержат 'значение ячейки', 'Больше или Равно'. В поле типа в значения стандартного отклонения 1,96, и нажмите «OK».
- Оценка изменчивости соотношения для каждого позитивного взаимодействия. Если вычитания% Variability упадет "хит" ниже порогового значения, то это должно относиться с осторожностью.
Примечание: Это представляет, насколько последовательны отдельные коэффициенты для каждого пептида, которые вместе составляют соотношение SILAC белков »являются, и выражается в процентах. Когда изменчивость соотношение учитывается и белок дает отношение SILAC выше порога, этот белок представляет хит. Если изменчивость соотношение дает диапазон, который падает ниже порога, "хит" может представлять собой загрязнитель. - Повторите эту процедуру для каждого из столбцов результатов и сравнить через экспериментов. Выделенные белки, определенные в двух или более экспериментов представляют собой высокий доверительный уровень взаимодействия.
Примечание: В зависимости от используемой базы данных, чтобы назначить белковые цифры о вступлении, в различных экспериментах белок, возможно, были определены под другим, или даже нескольких номерами доступа. Важно, чтобы проверить это, чтобы гарантировать, что белки не случайно опущено.
Результаты
В типичном эксперименте SILAC выпадающего, подавляющее большинство из идентифицированных белков (> 90%) представляют загрязняющие вещества, а также белки, связывающие неспецифически с аффинной матрицы, и это показано на фиг.2В, даже когда стиральные протоколы удалить большую часть цитоплазматического загрязняющих веществ таких как GAPDH (рис. 2А). Тем не менее, кластеризация неспецифически связывающих белков в нормальном распределении позволяет белки, которые специфически связываются с представляющим интерес белком следует отличать так как они имеют более высокие образец / макет коэффициенты, чем фон. В то время как загрязняющие вещества теоретически должна группироваться вокруг SILAC логарифма отношения 2 0, это не обязательно так, пример этого приведен на рис 3. Возможными причинами этого включают несовершенную SILAC маркировки клеток, загрузка неравные объемы или концентраций лизата на анти-GFP бусы, случайной потери из бисера во время очистки или неравной смесиING образцов в конце процедуры очистки 3. Тем не менее, предполагая данные анализируются на основе порогового стандартного отклонения от среднего значения нормально распределенных примесей, незначительные сдвиги в центрирования данных не должны влиять на качество результатов.
При сравнении различия в белковых взаимодействий между двумя родственных белков, аналогичная ситуация может возникнуть, когда один интерес белок производится до более высоких уровней, чем в клетках второго (или из-за различий в эффективности трансфекции, или внутреннее свойство белка или мРНК) . Некоторые изменение в выражении (например, 2А) может быть скорректирована на основе анализа соотношение SILAC для этих двух образцов. В данном примере это будут образцы GFP-eIF4AI и GFP-eIF4AII. Анализируя соотношение 4AI/4AII SILAC как описано в разделе 7, можно идентифицировать белки, связывание значительно варьируется между изоформ.
На рисунке 4, представление eIF4A-связывающих белков, выявленных в одном из экспериментов, проведенных реплики показано иллюстрирующий охват фактора комплекса инициации этот протокол достигнутом. Самые высокие показатели, как правило, наблюдается с eIF4G, который связывает непосредственно к eIF4A, с низким соотношением для eIF4E, который связывается с eIF4G на участке, вдали от eIF4A-связывающий сайт. При более низком коэффициенте наблюдались для членов комплекса eIF3. Тем не менее, это ясно показывает, что эксперимент удовлетворительно определены прямые и косвенные обязательные партнеров eIF4AI и II. Как и следовало ожидать от своей идентичности высокой последовательности 6, белок: белковые взаимодействия появился во многом сохраняется между двумя изоформ в этой экспериментальной системе 7, 8. Выбор некоторых из взаимодействующих белков приведены в таблице 2, иллюстрирующий формат данных.| Заголовок столбца | Описание |
| Вступление | Отображает регистрационный номер, для последовательности |
| Охват | Доля последовательности белка, покрытой идентифицированных пептидов |
| ♯ PSM | Пептид спектральная матч |
| ♯ пептиды | Общее количество уникальных пептидов, идентифицированных белок |
| ♯ АА | Длина белка в аминокислоты |
| МВт (Да) | Молекулярная масса белка в дальтон. Исключает изменения |
| известково. П.И. | Теоретическое изоэлектрическая точка белка |
| Счет | Общий балл белка (который представляет собой сумму Individual забивает пептидные). Точная оценка требуется для значения будут варьироваться между экспериментами. Объект, MS, как правило, применяются 5% отсечку на ложных открытие. |
| Последовательность | Последовательность аминокислот, составляющих белок |
| Соотношение | Относительная интенсивность пептидов в именованный меченого образца, по сравнению со вторым меченым образца |
| Соотношение Граф | Количество коэффициентов пептидных, которые были использованы для расчета данного коэффициента белка |
| Изменчивость побед (%) | Изменчивость отдельных коэффициентов пептидных, используемых для расчета данного коэффициента белка |
| Описание | Название белка |
Таблица 1. Стандартные заголовки столбцов из отчета Протеом Discoverer.В то время как полезная информация может быть получена от всех этих столбцов, те критическим для этого анализа, выделены жирным шрифтом.
| Вступление | Пептиды | 4AI/Mock | 4AII/Mock | Название | Анализ SILAC |
| A8K7F6 | 21 | 100 | 1 | eIF4AI | "Приманка" белок |
| Q14240 | 22 | 0.01 | 90,855 | eIF4AII | |
| G5E9S1 | 25 | 47,575 | 30.53 | eIF4GI | Взаимодействие белков |
| Q59GJ0 | 5 | 11,778 | 10,619 | eIF4GII60; | |
| P06730 | 3 | 7.22 | 7.57 | eIF4E | |
| Q5T6W5 | 4 | 0.685 | 0,646 | hnRNPK | Номера для специально связывания загрязнений |
| P62805 | 1 | 0,531 | 0.498 | Гистонов H4 | |
| H6VRG2 | 18 | - | - | Кератин-1 | Загрязнители окружающей среды |
| P35527 | 11 | 0.01 | 0.01 | Кератин-1 цитоскелета 9 |
Таблица 2. Типичные Данные эксперимента SILAC иммунопреципитации. Предоставление данные примера для интересующего белка / приманки (высокие пептиды, высокий коэффициент), белки, взаимодействующие с белком интересов (высокая / низкая пептидов, высоким коэффициентом), не специфически связываться белки (высокая / низкая Peptиды, соотношение падает ниже отсечки - в этом эксперименте 0,96), и загрязнители окружающей среды (часто высокие пептиды, отрицательное отношение / ниже порога).

Рисунок 1. Экспериментальный план. Во-первых клетки выращивают в средах без аргинин и лизин и замещенный стабильного изотопа меченого аргинин и лизин в течение 2 недель (1). (2) Клетки высевают в 10 см 2 блюд и транзитной трансфекции плазмид, кодирующих GFP (Мок) или GFP слитых белков (Образцы). (3) клетки лизируют и GFP или GFP слитые белки иммунопреципитации из лизатов клеток. (4) Образцы объединены в соотношении 1:1 и представлены для анализа ЖХ-МС/МС. Затем данные анализируются, чтобы удалить низкий идент уверенность белкаifications и выбрать уровень обогащения белка, соответствующего подлинных взаимодействующих белков.
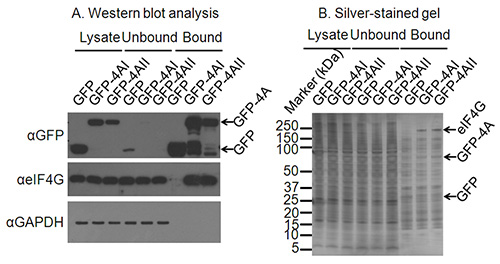
Рисунок 2. Подтверждение подходящие условия иммунопреципитации. A) Вестерн-блот анализ клеточных лизатов, а также несвязанные и связанные фракции из иммунопреципитации подтверждает экспрессию и иммунопреципитации белка, представляющего интерес. Вестерн-блот против GAPDH подтверждает истощение невзаимодействующих белков и еще вестерн-блоттинга известная взаимодействующих партнером eIF4A подтверждает успешное иммунопреципитацию белков, связывающихся с белка. B) Где взаимодействующие партнеры интерес белка не известны, окрашивали серебром гель может подтвердить иммунопреципитацию взаимодействующих белков. На этой серебристо-пятно ред гель полосы для GFP и GFP-eIF4AI/II ясны, и группа мигрирующих с правильным размером для eIF4G присутствует только в GFP-4AI/II-bound полос, а не в контрольной GFP-лейн.

Рисунок 3. Представитель результаты. Гистограмму, показывающую распределение коэффициентов белка от одного повторения (А) GFP-eIF4AI или (В) GFP-eIF4AII пулдауна. 1.96 стандартное отклонение среза отмечен пунктирной линией. Взаимодействующих белков выходящие за нормально распределенных загрязняющих веществ очевидны из ~ 0,25 и 1 в (А) и ~ 0,3-1,5 в (B).
les/ftp_upload/51656/51656fig4.jpg "/>
Рисунок 4. Идентификация EIF сложных членов из одной реплики эксперимента SILAC IP. Белки в зеленый были представляющий интерес белок, используемый для выпадающего меню белков, взаимодействующих с заштрихованы от красного до белого в зависимости от войти 2 соотношение SILAC в SILAC IP с красным является наиболее распространенный белок в анализе, и белый быть отсечка 1.96 SD. Белки, окрашенные в серый не были определены в этом анализе.
Обсуждение
Стратегия пулдаун SILAC описано здесь представляет собой очень чувствительные и мощные средства обнаружения новый белок: белковых взаимодействий, и, кроме того позволяет быстро и просто дискриминация измененных обязательных моделей между тесно связанных образцов, представляющих интерес. В этом примере этот метод был использован для исследования белок: белок взаимодействий eIF4AI и eIF4AII белков 6. Насколько известно автору, это первое исследование, в литературе эксплуататорского полезность SILAC протеомики исследовать клеточный интерактома этих двух изоформ eIF4A.
Подход, как описано выше использует GFP-тегов и анти-GFP бусы 9, 10 и, следовательно, изменения могут потребоваться, с тем чтобы этот подход, который будет использоваться для конкретного интересующего белка, например, является ли тег помещается в N-или С-конец белка. Где это возможно, западные пятна или функциональные тесты должныбыть выполнены, чтобы обнаружить связывание известного партнера белка взаимодействия. Если белок не переносят слияние с GFP тега, другой маркировкой или выпадающих стратегий были применены к SILAC Pulldowns использованием как другие метки (FLAG 11, биотин 12, STREP (собственные данные, не опубликовано)), или с помощью первичных антител против белка интереса, где миРНК нокдаун белка-мишени обеспечивает контрольный образец 13. Такие эксперименты были описаны в другом месте в литературе, но вкратце, шаг 1 и шаги 5.4-8 будет применяться, как указано выше, с шагами 2-5.3 модифицированных в случае необходимости для экспрессии / выпадающего системы выбора с использованием равных входных белка, как описано в шаги 2.4-2.5. Как этапы количественного позволяют неспецифического связывания белков должны быть удалены на уровне анализа, рекомендуется опустить преинкубации с контрольными бисером, или высоких моет соли для того, чтобы сохранить низким сродством белок: белковые взаимодействия с интересующего белка . Нуклеазы мау быть включены или исключены из этого протокола в соответствии со спецификой конкретного эксперимента. Например: как белки, используемые в этом методе являются РНК геликазы, РНКазы коктейль был включен в протокол, чтобы удалить косвенного взаимодействия, опосредованные через РНК (шаг 3.2). Однако в некоторых случаях, не может быть выгоду от запуска параллельных экспериментов с и без нуклеазы определить нуклеиновых кислот зависимые взаимодействия.
В рамках этого протокола, переключение "среды" и "тяжелых" образцов в повторных экспериментах рекомендуется контролировать для изменения введенной различий в SILAC СМИ или рост клеток. Альтернативный контроль включает в себя последовательное переключение всех трех («легкие», «среднего» и «тяжелый») СМИ в реплик экспериментов. В то время как этот подход является потенциально более строгими, это увеличить сложность анализа, как минимум в одной репликации, представляющего интерес белка шплохо быть произведены в «свет» меченых клеток и поэтому необходимо различать белков последовательно, определенных в «свет» образцов (загрязнители окружающей среды, такие как кератинами), и те, которые обогащены только в «свет» образцов при связывании с белком интерес.
В то время как использование количественного данных позволяет различение конкретных-от неспецифических взаимодействий за счет использования порогового значения, неизбежно некоторые подлинные взаимодействия могут быть отброшены. Подход выше простой и быстрый подход к идентификации белков: белковых взаимодействий, которые могут быть легко попытки исследователей без предыдущего опыта с масс-спектрометрии, или анализа большого белка: наборы данных белковых взаимодействий. Для большинства применений этого более чем достаточно для идентификации новых белков, представляющих интерес. Дальнейшие модификации данного подхода, чтобы помочь уменьшить эту потерю данных описаны в другом месте в литературе и включают использование пр.otein библиотека частота где известно примесей белков для конкретного набора параметров эксперимента (клеточной линии борта матрицы, условий буфер) могут быть исключены 10, 14. Тем не менее, в зависимости от конкретных экспериментальных параметров может быть необходимо, чтобы запустить ряд контрольных экспериментов, чтобы генерировать шарик протеом и, следовательно, это может увеличить как расходы и сложность эксперимента. Дополнительная информация об этой технике можно получить в www.peptracker.co.uk сайте 14.
Следует также отметить, что протокол, описанный выше включает смешивание по-разному меченых проб в конце процесса иммунопреципитации (называется смесительной после очистки - MAP SILAC эксперимента). Это делается белка: белковые взаимодействия происходить при заданной равновесия 15. Следует отметить, что другие группы объединили Эта карта SILAC подход, описанный в данном протоколе с инкубации образцовдо пулдауна (очистка после смешивания - PAM SILAC) для различных отрезков времени (20 мин до 2 ч, были использованы в литературе) 15, 16. На основе того, насколько быстро падает соотношение белок к 1:1, то можно качественно исследовать аффинности связывания и для определения белков в качестве стабильных или динамических взаимодействующих белков 15.
Таким образом, SILAC Pulldowns представляют собой очень мощные средства идентификации белков, взаимодействующих с данной интерес белка, в физиологически соответствующего обстановке. Этот метод может быть очень легко адаптировать к ряду различных стратегий очистки, что позволяет его применение к той или иной интерес белка. Количественное определение результатов значительно упрощает идентификацию подлинных взаимодействий и позволяет релаксацию жестких условиях буфер, используемый для удаления неспецифических связующих и, следовательно, сохраняет низкие взаимодействия сродством. Как до трех образцов можно сравнить в приведенном вышеСтратегия, техника имеет четкие преимущества в сравнении различия в Связывание белков между различными белковых изоформ, мутантных белков, или эффекта фармакологических ингибиторов. Как целые кусочки геля анализируются, а не отдельных групп, которые пятно Кумасси, количество белков, выявленных на высокое доверие, как правило, выше, чем те, которые определены в стандартном GST / TAP-пулдауна, и экспериментатор предвзятость в выборе белки интересов удаляется. Техника поэтому сравнивает очень выгодно отличается от других широко используемых методов, используемых в идентификации новых белков-взаимодействий (дрожжи 2-гибридных, GST / Его или TAP Pulldowns).
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
Эта работа была поддержана грантами от Wellcome Trust и BBSRC в ИГ. И.Г. является Wellcome старший научный сотрудник.
Материалы
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium (DMEM) | Dundee Cell Products | LM010 | DMEM lacking Arginine and Lysine. (and containing L-glutamine) |
| Dialysed FBS (10 kDa cutoff) 500 ml | Dundee Cell Products | DS1003 | |
| Arginine (R0) 25 g | Sigma-Aldrich | A8094 | Resuspend 0.5 g in 6 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 84 mg/ml stock) |
| Arginine (R6) 0.5 g | Cambridge Isotope Labs | CLM-2265 | Resuspend 0.5 g in 6 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 84 mg/ml stock) |
| Arginine (R10) 0.5 g | Cambridge Isotope Labs | CNLM-539 | Resuspend 0.5 g in 6 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 84 mg/ml stock) |
| Lysine (K0) 25 g | Sigma-Aldrich | L8662 | Resuspend 0.5 g in 3.5 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 146 mg/ml stock) |
| Lysine (K4) 0.5 g | Cambridge Isotope Labs | DLM-2640 | Resuspend 0.5 g in 3.5 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 146 mg/ml stock) |
| Lysine (K8) 0.5 g | Cambridge Isotope Labs | CNLM-291 | Resuspend 0.5 g in 3.5 ml PBS, filter sterilize, and freeze in 0.5 ml aliquots (gives a 146 mg/ml stock) |
| Penicillin/streptomycin, Liquid. 100 ml | Gibco | 15140-122 | |
| Lipofectamine 2000 transfection reagent | Invitrogen | 11668-027 | |
| GFP-trap Agarose (500 μl resin) | Chromotek | gta-20 | |
| 5x SDS Sample loading buffer | Fisher Scientific | PN39000 | The use of purchased rather than homemade sample buffer is recommended to minimize keratin contamination. |
| Protease inhibitor cocktail set III | Calbiochem | 539134 | |
| 1.7 ml prelubricated tubes | Costar | 3207 | |
| BCA protein assay kit (1 L) | Pierce | 23225 | |
| Tris (Trizma) | Sigma-Aldrich | T1503 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6758 | |
| Sodium chloride | Sigma-Aldrich | S3014 | |
| Rnase cocktail | Ambion | AM2286 | |
| NP-40 alternative | Millipore | 492016 |
Ссылки
- Williamson, M. P., Sutcliffe, M. J. Protein-protein interactions. Biochem Soc Trans. 38, 875-878 (2010).
- Bailey, D., Urena, L., Thorne, L., Goodfellow, I. Identification of protein interacting partners using tandem affinity purification. J. Vis. Exp. (60), (2012).
- Trinkle-Mulcahy, L. Resolving protein interactions and complexes by affinity purification followed by label-based quantitative mass spectrometry. Proteomics. 12, 1623-1638 (2012).
- Emmott, E., et al. The cellular interactome of the coronavirus infectious bronchitis virus nucleocapsid protein and functional implications for virus biology. J Virol. 87, 9486-9500 (2013).
- Li, W., Belsham, G. J., Proud, C. G. Eukaryotic initiation factors 4A (eIF4A) and 4G (eIF4G) mutually interact in a 1:1 ratio in vivo. J Biol Chem. 276, 29111-29115 (2001).
- Nielsen, P. J., Trachsel, H. The mouse protein synthesis initiation factor 4A gene family includes two related functional genes which are differentially expressed. EMBO J. 7, 2097-2105 (1988).
- Galicia-Vazquez, G., Cencic, R., Robert, F., Agenor, A. Q., Pelletier, J. A cellular response linking eIF4AI activity to eIF4AII transcription. RNA. 18, 1373-1384 (2012).
- Zakowicz, H., et al. Mutational analysis of the DEAD-box RNA helicase eIF4AII characterizes its interaction with transformation suppressor Pdcd4 and eIF4GI. RNA. 11, 261-274 (2005).
- Rothbauer, U., et al. A versatile nanotrap for biochemical and functional studies with fluorescent fusion proteins. Mol Cell Proteomics. 7, 282-289 (2008).
- Trinkle-Mulcahy, L., et al. Identifying specific protein interaction partners using quantitative mass spectrometry and bead proteomes. J Cell Biol. 183, 223-239 (2008).
- Dobreva, I., Fielding, A., Foster, L. J., Dedhar, S. Mapping the integrin-linked kinase interactome using SILAC. J Proteome Res. 7, 1740-1749 (2008).
- Mittler, G., Butter, F., Mann, M. A SILAC-based DNA protein interaction screen that identifies candidate binding proteins to functional DNA elements. Genome research. 19, 284-293 (2009).
- Selbach, M., Mann, M. Protein interaction screening by quantitative immunoprecipitation combined with knockdown QUICK. Nat Methods. 3, 981-983 (2006).
- Boulon, S., et al. Establishment of a protein frequency library and its application in the reliable identification of specific protein interaction partners. Mol Cell Proteomics. 9, 861-879 (2010).
- Wang, X., Huang, L. Identifying dynamic interactors of protein complexes by quantitative mass spectrometry. Mol Cell Proteomics. 7, 46-57 (2008).
- Fang, L., et al. Characterization of the human COP9 signalosome complex using affinity purification and mass spectrometry. J Proteome Res. 7, 4914-4925 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены