A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
طريقة بسيطة لDNA الإسفار
In This Article
Summary
Here, we present a simple method for performing fluorescence DNA in situ hybridization (DNA ISH) to visualize repetitive heterochromatic sequences on slide-mounted chromosomes. The method requires minimal reagents and it is versatile for use with short or long probes, different tissues, and detection with fluorescence or non-fluorescence-based signals.
Abstract
DNA الموقع التهجين (DNA ISH) في هو طريقة تستخدم عادة لتسلسل رسم الخرائط للمناطق كروموسوم محددة. هذا النهج غير فعالة بشكل خاص في رسم الخرائط تسلسل المتكررة للغاية لمناطق heterochromatic، حيث تواجه المناهج الحسابية التحديات باهظة. نحن هنا وصف بروتوكول مبسط للDNA ISH أن تلتف يغسل الفورماميد التي هي الخطوات القياسية في غيرها من البروتوكولات ISH DNA. هو الأمثل لدينا بروتوكول لالتهجين مع واحدة تحقيقات DNA حبلا القصيرة التي تحمل الأصباغ الفلورية، والتي احتفال بفعالية تسلسل الحمض النووي المتكررة داخل المناطق الكروموسومات heterochromatic عبر عدد من مختلف أنواع الأنسجة الحشرات. ومع ذلك، يجوز تمديد التطبيقات لاستخدام مع تحقيقات أكبر والتصور من متواليات نسخة واحدة (غير متكرر) DNA. ونحن لشرح هذه الطريقة عن طريق تعيين عدة سلاسل متكررة مختلفة لسحق الكروموسومات من الخلايا العصبية الدروسوفيلاميلانوجاستر وNasoniavitripennis الخلايا المنوية. وتبين لنا أنماط التهجين على حد سواء، تحقيقات صغيرة توليفها تجاريا وتحقيق أكبر للمقارنة. يستخدم هذا الإجراء وازم المختبرات بسيطة والكواشف، ويعتبر مثاليا للمحققين الذين لديهم خبرة قليلة مع أداء DNA ISH.
Introduction
DNA الموقع التهجين (DNA ISH) في هو طريقة تستخدم عادة لتسلسل رسم الخرائط للمناطق كروموسوم محددة. يمكن أن تتولد تحقيقات لمناطق نسخة واحدة داخل كروماتين حقيقي من خلال حفنة من النهج، بما نيك الترجمة أو نهاية توسيم منتجات DNA طويلة 1،2 وإدراج deoxygenin (DIG) النيوكليوتيدات -attached والاعتراف بها من خلال مجموعة متنوعة واسعة من الأجسام المضادة مترافق مجموعة 1-3. تصور تسلسل الكروماتين الحقيقي في قلة أو واحد في عدد النسخ يتطلب استخدام إما واحدة، تحقيقات واسعة للنشاط معين عالية أو مزيج من عدة تحقيقات أصغر التي تعزز إشارة جماعي.
في المقابل، تسلسل المتكررة للغاية وجدت في المغاير، مثل السلطات الوطنية المعينة الأقمار الصناعية، هي أهداف أسهل لDNA ISH لأنها موجودة بشكل طبيعي عن عشرات الآلاف من يكرر تتجمع في مناطق كروموسوم واحد يعرف باسم الكتل. العناصر القابلة للنقل أيضا يمكن أن يكونوجدت في أرقام نسخة عالية في مواضع متميزة الكروموسومات 2. في هذه الحالات، يمكن أن تحقيقات واحدة مع النشاط النوعي المنخفض التدريسية بشكل فعال تسلسل heterochromatic بسبب التهجين بهم في مواقع متعددة. تحقيقات للتسلسل المتكررة يمكن توليفها [أليغنوكليوتيد تجاريا قصيرة باسم (30-50 بي بي) ومترافق كيميائيا مع أي من مجموعات متعددة الفلورسنت مختلفة. رسم تسلسل المتكررة داخل المغاير باستخدام تقنيات الجينوم التسلسل من الصعب نظرا للتحديات التي واجهتها في بناء السقالات داخل كتل الفضائية المتكررة للغاية 4-6،7. حاليا، ISH تقف باعتبارها السبيل الأكثر فعالية لرسم هذه المتتاليات على مستوى كروموسوم الفرعية. هذه الاستراتيجية مهمة لرسم خرائط أعداد كبيرة من تسلسل المتكررة التي يتم كشفت عنه دراسات الجينوم وTranscriptome على التسلسل الجارية.
سيتم GRE كفاءة وسهولة رسم الخرائط تسلسل المتكررة على الكروموسومات محمولة على الشرائحتعزيز atly بأي بروتوكول مبسطة لDNA ISH. على سبيل المثال، والبروتوكولات القائمة لDNA ISH تنطوي يغسل متعددة من الأنسجة تهجين في حل الفورماميد 2،8، مما يضيف إلى حد كبير في الوقت المطلوب لمتواليات رسم الخرائط وأيضا إنتاج كميات كبيرة من النفايات الكيميائية لهذا كاشف مكلفة. نحن هنا تصف طريقة DNA ISH المنقحة التي تلتف على الحاجة لغسيل الفورماميد وتستخدم المعدات المختبرية الأساسية والكواشف. وهذه الطريقة صممت في الأصل لرسم خرائط السريع لتسلسل الحمض النووي المتكررة للغاية في المناطق heterochromatic من neuroblasts اليرقات ذبابة الفاكهة باستخدام oligos تصنيعه تجاريا التي يتم مترافق مع الأصباغ مضان. ومع ذلك، يعمل هذا الأسلوب أيضا لرسم خرائط تسلسل المتكررة باستخدام مجسات أكبر توليفها من خلال وسائل أخرى 9،10 وعبر عدة أنواع الأنسجة وكروموسوم مختلفة. بالإضافة إلى ذلك، وهذه الطريقة يمكن أن تستخدم لرسم خريطة تسلسل الكروماتين الحقيقي باستخدام أطول أو multipجنيه، تحقيقات قصيرة ضمن تسلسل الكروماتين الحقيقي من الاهتمام.
Protocol
1. الأنسجة تشريح والتثبيت (60 دقيقة)
- لالعقول ذبابة الفاكهة، ضع 3 الثالثة طور مرحلي اليرقات في قطرة من برنامج تلفزيوني 1X (الفوسفات مخزنة المالحة). اختر كبيرة 3 الثالثة طور مرحلي اليرقات التي يتم الزحف بنشاط من قوارير أو زجاجات ليست مكتظة.
- استخدام متناهية الصغر زوج واحد منتاش لانتزاع عقد من السنانير الفم وزوج منتاش آخر لانتزاع 2/3 أسفل طول الجسم (الشكل 1A، B). سحب بلطف على السنانير الفم لفضح الدماغ، العقد بطني، الغدد اللعابية وجزء من الجهاز الهضمي اليرقات. استخدام ملاقط للفصل بين الدماغ وبطني العقد (الشكل 1A، B) من الأنسجة ومكان أخرى في بقطرة من 1X PBT (الفوسفات مخزنة المالحة مع توين) على لوحة بيتري البلاستيك.
- لNasonia تشريح الخصية، واختيار الذكور الشرانق من العمر 3 يوما (الهيئات الأصفر مع عيون حمراء). ذكر Nasonia ديك صغيرة أطوال سادة الجناح النسبية إلى females خلال طور العذراء (الشكل 1C).
- عقد خادرة في الجزء العلوي من البطن بالقرب من منطقة الصدر مع زوج منتاش واحد، وباستخدام الملقط الزوج الآخر، والاستيلاء على الطرف البعيد جدا من البطن وسحب الخصيتين شكل المسيل للدموع قطرة (أنها سوف تكون محاطة الدهون الجسم الذي يمكن أن تهتز برفق بعيدا؛ 1D الشكل). فصل أي أجزاء الجسم الخارجي من الخصيتين، والتي سوف تمنع سحق السليم، ومكان في بقطرة من 1X PBT على لوحة بيتري البلاستيك.
- لكل شريحة، تشريح ما مجموعه أربع أو خمس عينات الأنسجة (أي.، ذبابة الفاكهة العقول اليرقات أو الخصيتين Nasonia).
ملاحظة: سوف أكثر من خمس عينات تؤدي إلى نوى مكتظة والكروموسومات. - اختياريا، لتحقيق بعض انفصال الصبغيات الشقيقة في مناطق الكروماتين الحقيقي من الكروموسومات الإنقسامية، علاج الأنسجة مع حل منخفض التوتر: نقل أدمغة من 1x PBT إلى انخفاض بنسبة 0.5٪ سترات الصوديوم لمدة 5-10 (لا يزيد عن 10) دقيقة.
ملاحظة: الكولشيسين (مثبط الإنقسامية) يمكن أن تكون مفيدة لزيادة عدد من الشخصيات الإنقسامية في الطورية 11. ومع ذلك، واستخدامه غير ضروري إذا تم استخدام اليرقات صحية كبيرة جدا، وحتى غير مرغوب فيه لأنه يمكن أن تؤثر سلبا على قرار كروموسوم، ونشر والتشكل. - وضع قطرة (~ 20 ميكرولتر) من الحل تثبيتي (2.5٪ امتصاص العرق في حامض الخليك 45٪) على سطح نظيف Sigmacote المعاملة غطاء زلة.
ملاحظة: تأكد الحل تثبيتي الطازجة لكل يوم من الاستخدام. حلول تثبيتي تتراوح 1،8-3،7٪ امتصاص العرق في حامض الخليك 45٪ العائد على أفضل النتائج لFISH. باستخدام الأنسجة الأخرى من العقول أو الخصيتين، أو التكيف مع هذا البروتوكول لالمناعية FISH قد تتطلب تجريب مثبتات مختلفة (للحصول على قائمة مثبتات مختلفة، راجع 12). - نقل بعناية كل عينة الأنسجة من المخزن المؤقت تشريح (1X PBT) في الحبرية تثبيتي مع ملاقط متناهية الصغر، minimiزينغ نقل تشريح عازلة في حل تثبيتي. ضع عينات الأنسجة بحيث تكون متباعدة بشكل متساو عن بعضها البعض داخل الحبرية مثبت. احتضان الأنسجة في تثبيتي لمدة 4 دقائق في درجة حرارة الغرفة.
- وضع بعناية وجها الشرائح المغلفة بولي يسين إلى أسفل على الأنسجة وغطاء زلة. لا اضغط لأسفل عند هذه النقطة ولكن بدلا من السماح للاثنين في الاتصال طفيفة بحيث زلة تغطية العصي على الجانب السفلي من الشريحة. عكس الشريحة بحيث انزلاق الغطاء على القمة.
- ساندويتش زلة الشريحة / نسيج / تغطية داخل قطعة مطوية من ورق الترشيح. على سطح ثابت، وذلك باستخدام الإبهام، اضغط جدا بقوة لأسفل على التوالي على الموقف مباشرة فوق انزلاق الغطاء. كن حذرا لتجنب الانزلاق الجانبي من انزلاق الغطاء (وهذا سوف يسبب تلطيخ من الأنسجة).
- غمر الشريحة / الأنسجة / تغطية الانزلاق في النيتروجين السائل (انظر جهاز في الشكل 1E، F)، واسمحوا الوقوف حتى توقف النيتروجين المغلي (يعد هو و المعهد الوطني للإحصاء). إزالة الشريحة والمفاجئة على الفور قبالة زلة تغطية بشفرة حلاقة جديدة التحريك من قبل زاوية من انزلاق الغطاء في اتجاه تصاعدي (تجنب خدش أنسجة ثابت مع شفرة الحلاقة).
- ما قبل التبريد الشريحة / الأنسجة / زلة تغطية على كتلة من الثلج الجاف، زلة تغطية ما يصل، لمدة 1-2 دقيقة قبل غمر في النيتروجين السائل سيساعد على منع الشرائح من تكسير.
- وضع على الفور الشريحة مع الأنسجة في جرة Coplin مليئة الإيثانول بنسبة 100٪ في درجة حرارة الغرفة واسمحوا الوقوف لمدة 5 دقائق على الأقل (هذه المرة يمكن أن تكون أطول إذا لزم الأمر).
ملاحظة: يمكن أيضا البارد الإيثانول بنسبة 100٪ يمكن استخدامها. - إزالة الشريحة مع الأنسجة، والفتيل بعيدا الايثانول الزائد مع Kimwipe (دون لمس الأنسجة الثابتة)، وترك الشريحة الهواء الجاف لمدة 1 ساعة.
- الانتقال مباشرة إلى الخطوة 2 أو الاحتفاظ الشرائح الجافة في الهواء منخفضة الرطوبة أو في غرفة جفاف لمدة أسابيع إلى أشهر حتى قبل تنفيذ التهجين.
= "jove_content" FO: المحافظة على together.within صفحة = "دائما"> 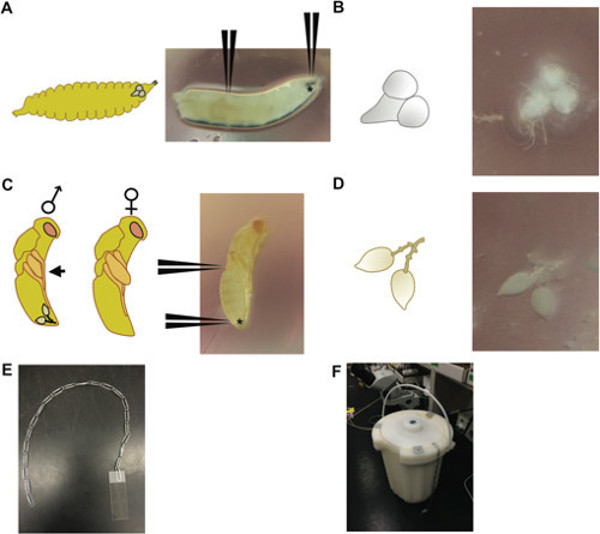
الشكل (1): (أ) 3 طور مرحلي الثالثة يرقة ذبابة الفاكهة (يمين)، مع المواقف المشار إليها لمعرفة كيفية الاستيلاء على السنانير الفم (الرمز مع *) و2/3 من طول الطريق اليرقات لتشريح أدمغة. (يسار) تخطيطي من يرقة إلى المرحلة التنموية نفسها، والتي تصور الوضع النسبي للدماغ داخل الرأس اليرقات. (B) والدماغ والعقد البطنية تشريح من 3 طور مرحلي الثالثة يرقة ذبابة الفاكهة (يمين) وتخطيطي لهذا الأنسجة (يسار). خادرة Nasonia العمر 3 يوما (C) في الجسم أحمر أصفر مرحلة العين. (D) زوج الخصية تشريح من العمر Nasonia الذكور خادرة 3 يوم (يمين) مع مواقف تشير فيها للاستيلاء على خادرة في الخلفي من البطن (الرمز مع *) وفي منتصف الطريق على الجسم. (يسار) والتي تصور تخطيطي الذكور والإناثص الشرانق. الشرانق الذكور يمكن تمييزها عن طريق الأجنحة التي لا تمتد الماضي الشخصى saggital (السهم الأسود)، على النقيض من الإناث، والتي لها أجنحة تمتد الماضي الشخصى. يظهر الوضع النسبي للزوج الخصية في الذكور خادرة. (E) وجهاز واحد سلسلة من الدبابيس الورقية و(F) الطريقة المستخدمة لتزج الشرائح في وعاء من النيتروجين السائل. سلاسل مشبك متعددة يمكن استخدامها لغمر المتزامن لعدة شرائح.
2. في الموقع التهجين (30 دقيقة في يوم 1؛ 1 ساعة 2.5 ساعة لفترة طويلة تحقيقات-في يوم 2)
- إضافة 1 ميكرولتر (100 نانوغرام) لكل التحقيق إلى 20 ميكرولتر من العازلة 1.1x التهجين. الماصة التحقيق / العازلة التهجين على سطح الأنسجة ثابتة (تجنب لمس الأنسجة).
- وضع بعناية زلة تغطية مباشرة على المخزن المؤقت التحقيق / التهجين، والتأكد من أن زلة تغطية يتركز مباشرة على الأنسجة. المخزن المؤقت يجب أن تهاجر إلى thالبريد الحافة الخارجية من انزلاق الغطاء، دون ترك أي فقاعات الهواء.
ملاحظة: فقاعات الصغيرة التي لا تتصل الأنسجة لا تشكل أي مشاكل للإجراء. إزالة فقاعات كبيرة من خلال رفع بعناية زاوية من انزلاق الغطاء وبعناية إسقاطه مرة أخرى على الشريحة. - ضع زلة الشريحة / نسيج / تغطية على سطح كتلة قبل تسخينها إلى 95 درجة مئوية (تغطية زلة متابعة). تغطية مع قطعة كبيرة من رقائق الألومنيوم لمنع التعرض للضوء. السماح بانزلاق احتضان عند 95 درجة مئوية لمدة 5 دقائق.
ملاحظة: كتلة الحرارة نموذجي مع فتحات للأنابيب يمكن انقلبت لتوفير سطح مستو الذي وضع الشريحة / الأنسجة / تغطية زلة. - إزالة الشريحة، والسماح لها تبرد قليلا حتى يصبح دافئا لمسة. التفاف بعناية قطعة من امتدت بارافيلم حول زلة غطاء لختم السائل تحتها.
- ضع الشريحة مختومة داخل غرفة الرطوبة ووضع الغرفة في حاضنة مسخن إلى 30 ° C. احتضان عند 30 درجة مئوية لمدة 4 ساعات ليلة وضحاها.
- إنشاء غرفة الرطوبة من طرف مربع فارغ أو حاوية تثبرور بغطاء مع Kimwipes قلل أو مناشف ورقية وضعت في أسفل.
ملاحظة: واحد الذين تقطعت بهم السبل تحقيقات بنسبة ضئيلة DNA تم تصميمها لتكون 28-33 قواعد لتحقيق درجة حرارة انصهار النظرية (T م) من 45-47 درجة مئوية. هذه طول وT نطاقات م تعكس حقيقة أن العديد من تسلسل المتكررة التي قمنا بدراستها هي AT-الأغنياء ولها محتوى منخفض جدا GC بالتالي. سوف أطول تحقيقات على الأرجح أعلى القيم م T. هذا قد يؤدي إلى ارتفاع التهجين الخلفية في درجة الحرارة التهجين القياسية من 30 ° C. وهكذا، وبعض استكشاف الأخطاء وإصلاحها مع درجات الحرارة التهجين قد تكون هناك حاجة لتحقيق أفضل النتائج. للعثور على أفضل درجة حرارة التهجين، وزيادة (أو نقصان) درجة الحرارة بمقدار 5 درجات مئوية، تدريجيا.
- إنشاء غرفة الرطوبة من طرف مربع فارغ أو حاوية تثبرور بغطاء مع Kimwipes قلل أو مناشف ورقية وضعت في أسفل.
- إزالة بعناية بارافيلم من الشريحة ومن ثم إزالة بعناية زلة تغطية من خلال رفع ببطء زاوية واحدة. واSH الشريحة ثلاث مرات لمدة 15 دقيقة كل غسل العازلة في SSC 0.1X. تغطية جرة Coplin مع رقائق الألومنيوم خلال يغسل للحد من التعرض للضوء.
- إذا لم تكن تستخدم مسبار المعقدة البيروكسيديز طويلة، انتقل إلى الخطوة 2.8.
- إذا باستخدام مسبار المعقدة البيروكسيديز طويلة، تجفيف المنطقة المحيطة الأنسجة مع Kimwipe، والحرص على عدم لمس الأنسجة نفسها. وضع 100 ميكرولتر من عرقلة الحل على الأنسجة وتغطية بلطف مع ساترة، مع الحرص على تجنب فقاعات محاصرة. التفاف الشريحة على ساترة مع بارافيلم ومكان عند 37 درجة مئوية لمدة 30 دقيقة.
- إزالة بعناية ساترة وصمة عار في جميع أنحاء الأنسجة مع Kimwipe. الماصة 100 ميكرولتر من-رودامين أفيدين المخفف 1: الرعاية 1،000 في SBT على الأنسجة وتغطية بلطف مع ساترة، مع لتجنب احتباس فقاعات. التفاف الشريحة على ساترة مع بارافيلم ومكان عند 37 درجة مئوية لمدة 30 دقيقة.
- إزالة بعناية ساترة وغسل الشريحة 3 مرات لمدة 5 دقائق في كل من 4X SSCT ثم3 مرات لمدة 5 دقائق في كل من 0.1X SSC.
ملاحظة: الشرائح يمكن غسلها لفترات أطول من الوقت.
- إزالة الشريحة وصمة عار في جميع أنحاء الأنسجة مع Kimwipe جافة لإزالة عازلة الزائد (تجنب لمس الأنسجة). وضع الجانب الأنسجة الشريحة تصل في مكان مظلم لمدة 10-15 دقيقة أو حتى الرطوبة تبدد تماما.
- الماصة 11 ميكرولتر من Vectashield تصاعد المتوسطة (مع 4 "، 6-diamidino-2-phenylindole-دابي) على الأنسجة. وضع بعناية زلة غطاء نظيف (لا تعامل مع Sigmacote) مباشرة فوق مركز للوسط تصاعد والأنسجة. المتوسط تصاعد يجب أن يهاجر ببطء إلى الخارج في اتجاه حواف من انزلاق الغطاء.
ملاحظة: في حالة فشل المتوسطة المتزايدة للوصول إلى حافة الانزلاق غطاء من جميع الجوانب، ثم و1-2 ميكرولتر إضافية من تصاعد المتوسطة يمكن تطبيقها على وظيفة واحدة على حافة الغطاء زلة لملء في حجم الحاجة. في هذه الحالة، ومن المؤكد أن يمسح أي وسيلة الزائدة من سطح الشريحة قبلالختم. - ختم حواف الغطاء زلة مع طلاء الأظافر. تجنب طلاء طلاء الأظافر على عينة الأنسجة.
- ضع الشريحة تستقيم في مكان مظلم والسماح للجفاف طلاء الأظافر حتى من الصعب تماما (عادة 30 دقيقة أو أكثر). عند هذه النقطة، صورة الأنسجة أو تخزينها في -20 درجة مئوية لمدة تصل إلى 1 في الاسبوع للتصوير في وقت لاحق.
عازلة / الحل وصفات
10X PBS
- 80 جم كلوريد الصوديوم
- 2.0 ز بوكل
- 14.4 ز نا 2 هبو 4
- 2.4 ز KH 2 PO 4
- الرقم الهيدروجيني إلى 7.4، H 2 O إلى 1 L
1X PBT
- 5 مل 10X PBS
- 45 مل H 2 O
- 0.1٪ توين 20
20x وSSC
- 175.3 ز كلوريد الصوديوم
- 88.2 ز نا السيترات
- في 800 مل H 2 O
- الرقم الهيدروجيني إلى 7، H 2 O إلى 1 L
4X SSCT
- 200 مل 20X SSC
- 799 مل H 2 O
- 0.1٪ توين 20
0.1X SSC
- 5 مل 20X SSC
- 995 مل H 2 O
مزيج التهجين (20 ميكرولتر؛ معدلة من 11)
- 10 ميكرولتر الفورماميد
- 4 ميكرولتر 50٪ ديكستران كبريتات
- 2 ميكرولتر 20X SSC
- 4 ميكرولتر H 2 O
SBT 8 (10 مل)
- 2 مل 20X SSC
- 0.01 ز الأبقار مصل الزلال (BSA)
- 10 ميكرولتر توين 20
- 7.9 مل H 2 O
عرقلة الحل 8 (10 مل)
- 0.3 ز BSA
- 10 ميكرولتر توين 20
- 2 مل 20X SSC
- 8 مل H 2 O
حل تثبيتي مع بارافورمالدهيد (1 مل)
- 393.75 ميكرولتر H 2 O (إضافة الماء لأول مرة)
- 450 ميكرولتر حمض الخليك الجليدي
- 156.25 ميكرولتر 16٪ بارافورمالدهيد
النتائج
لشرح هذا الأسلوب، نحن تهجين مجموعة من oligos صغيرة توليفها تجاريا التي تم تعديلها كيميائيا مع تقارن الفلورسنت (الشكل 2) والتحقيق يعد المعقدة البيروكسيديز (التي تتم من خلال الترجمة نيك لمنتج PCR، الشكل 2B)، إلى الكروموسومات من عدة أنسجة مختلفة أنواع (انظر ...
Discussion
كثيرا ما يستخدم الحمض النووي ISH لرسم خريطة تسلسل محددة لالكروموسومات. وصفناها طريقة بسيطة لDNA ISH الأمثل لعدد نسخ عالية، متواليات heterochromatic. بدلا من استخدام يغسل في حل الفورماميد، الذي هو شرط في غيرها من البروتوكولات ISH DNA الموجودة، ونحن نضع شرائح محمولة على الأنسجة مباش...
Disclosures
The authors declare that they have no competing financial or any other conflict of interest.
Acknowledgements
We thank Zhaohua Irene Tang in the W. M. Keck Science Department for the use of her epifluorescence microscope and the Werren lab for donating Nasonia for dissections. This work was supported in part by an NIH-NRSA fellowship (5F32GM105317-02) to AML.
Materials
| Name | Company | Catalog Number | Comments |
| Poly-L-lysine coated slides (regular slides also can be used) | Sigma Aldrich | ||
| Ultrafine tweezers (5 gauge) | Dumont | ||
| 22 x 22 mm cover slips | Fisher | Sigmacote-treated by immersion for 15 sec, blotting dry, and wiping away all traces of Sigmacote so that cover slip is clear | |
| Sigmacote | Sigma | ||
| Filter paper | 75 - 150 mm | ||
| Paraffin wax paper | |||
| Heat block with thermometer | |||
| Dry incubator | |||
| Razor blades | |||
| Humidity chamber | empty pipette tip box or Tupperware, lined with moistened paper towels or Kimwipes | ||
| Coplin jars | with slide grooves | ||
| Aluminum foil | |||
| Pasteur pipettes | |||
| 1.5 ml microfuge tubes | |||
| Nail polish | clear or colored | ||
| P20 micropipette and plastic tips | |||
| Paperclips | 20 - 25 standard metal paperclips linked to form a chain | ||
| Reagents | |||
| 16% EM grade paraformaldehyde | Electron Microscopy Reagents | ||
| Acetic acid | Sigma | ||
| Liquid nitrogen | |||
| 100% Ethanol, chemical grade | |||
| Commercially synthesized, fluorescently labeled oligos | |||
| Long biotinylated probe | Invitrogen; Alternative steps 2.7.1-2.7.3 | e.g., nick translated and biotinylated with BioNick from Invitrogen | |
| Rhodamine-Avidin | Roche; Alternative steps 2.7.1-2.7.3 | for detection of long biotinylated probe | |
| Hybridization buffer | Recipe above | ||
| 4x SSCT | Recipe above | saline-sodium citrate + Tween | |
| 0.1x SSC | Recipe above | saline-sodium citrate | |
| Blocking solution | Recipe above | ||
| SBT | Recipe above | SSC, bovine serum albumin, Tween | |
| 1x PBT | Recipe above | phosphate-buffered saline + Tween | |
| 1x PBS | phosphate-buffered saline | ||
| Hypotonic solution | 0.5% sodium citrate in H2O | ||
| Formamide | Sigma Aldrich | ||
| Vectashield mounting medium with DAPI | Vector laboratories | ||
References
- Blattes, R., Kas, E. Fluorescent in situ hybridization (FISH) on diploid nuclei and mitotic chromosomes from Drosophila melanogaster larval tissues. Cold Spring Harbor Protocols. 2009 (9), (2009).
- Dimitri, P. Fluorescent in situ hybridization with transposable element probes to mitotic chromosomal heterochromatin of Drosophila. Methods in Molecular Biology. 260, 29-39 (2004).
- Pardue, M. L. In situ hybridization to polytene chromosomes in Drosophila using digoxigenin-labeled probes. Cold Spring Harbor Protocols. 2011 (8), 1003-1006 (2011).
- Hoskins, R. A., et al. Heterochromatic sequences in a Drosophila whole-genome shotgun assembly. Genome Biology. 3 (12), (2002).
- Hoskins, R. A., et al. Sequence finishing and mapping of Drosophila melanogaster heterochromatin. Science. 316 (58331), 1625-1628 (2007).
- Treangen, T. J., Salzberg, S. L. Repetitive DNA and next-generation sequencing: computational challenges and solutions. Nature Reviews Genetics. 13 (1), 36-46 (2012).
- He, B., et al. Mapping the pericentric heterochromatin by comparative genomic hybridization analysis and chromosome deletions in Drosophila melanogaster. Genome Research. 22 (12), 2507-2519 (2012).
- Pimpinelli, S., Bonaccorsi, S., Fanti, L., Gatti, M. Fluorescent in situ hybridization (FISH) of mitotic chromosomes from Drosophila larval brain. Cold Spring Harbor Protocols. 2010 (3), (2010).
- Larracuente, A. M., Noor, M. A., Clark, A. G. Translocation of Y-linked genes to the dot chromosome in Drosophila pseudoobscura. Molecular Biology and Evolution. 27 (7), 1612-1620 (2010).
- Ferree, P. M., Barbash, D. A. Species-specific heterochromatin prevents mitotic chromosome segregation to cause hybrid lethality in Drosophila. PLoS Biology. 7 (10), e1000234 (2009).
- Williams, B. C., Karr, T. L., Montgomery, J. M., Goldberg, M. L. The Drosophila l(1)zw10 gene product, required for accurate mitotic chromosome segregation, is redistributed at anaphase onset. The Journal of Cell Biology. 118 (4), 759-773 (1992).
- Gatti, M., Bonaccorsi, S., Pimpinelli, S. Looking at Drosophila Mitotic Chromosomes. Methods in Cell Biology. 44, 371-391 (1994).
- Werren, J. H., Stouthamer, R. PSR (paternal sex ratio) chromosomes: the ultimate selfish genetic elements. Genetica. 117 (1), 85-101 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved