Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Floresan DNA için Basit Bir Yöntem
Bu Makalede
Özet
Here, we present a simple method for performing fluorescence DNA in situ hybridization (DNA ISH) to visualize repetitive heterochromatic sequences on slide-mounted chromosomes. The method requires minimal reagents and it is versatile for use with short or long probes, different tissues, and detection with fluorescence or non-fluorescence-based signals.
Özet
In situ hibridizasyon (ISH DNA) DNA spesifik kromozom bölgelerine haritalama dizileri için yaygın olarak kullanılan bir yöntemdir. Bu yaklaşım, hesaplama yaklaşımlar engelleyici zorluklarla karşı karşıya heterokromatik bölgelere haritalama derece tekrarlayan dizileri özellikle etkilidir. Burada başka DNA ISH protokolleri standart adımlar formamiddir yıkar circumvents DNA ISH için bir aerodinamik protokol açıklar. Bizim protokol de farklı böcek doku tiplerinin bir dizi boyunca heterokromatik kromozomal bölgeleri içinde olan tekrar eden DNA dizilerinin işaretlemek floresan boyalar, taşımak kısa tek sarmallı DNA probları ile hibridizasyon için optimize edilmiştir. Ancak, uygulamalar daha büyük prob ve tek kopya (non-tekrarlayan) DNA dizilerinin görselleştirme ile kullanmak için uzatılabilir. Biz sinir hücreleri ve Nasonia melanogaster Drosophila gelen ezilmiş kromozomlar için birkaç farklı tekrarlayan dizileri haritalama bu yöntemi göstermektedirvitripennis spermatosit. Biz de, küçük ticari olarak sentezlenir problar için ve karşılaştırma için daha büyük bir sonda için hibridizasyon desen göstermektedir. Bu prosedür, basit laboratuvar malzemeleri ve ayıraçları kullanır, ve DNA ISH performans ile çok az deneyime sahip araştırmacılar için idealdir.
Giriş
In situ hibridizasyon (ISH DNA) DNA spesifik kromozom bölgelerine haritalama dizileri için yaygın olarak kullanılan bir yöntemdir. Ökromatin olan tek kopyalı bölgelere problar çeşitli ile nik-çevirisi ya da büyük DNA ürünleri 1,2 uç-etiketleme ve deoxygenin (DIG) dahil edilmesi de dahil olmak üzere yaklaşımlar, -attached edilmiş nükleotitler ve bunların tanınma bir avuç yoluyla oluşturulabilir grup konjüge antikorlar 1-3. Az ya da tek bir kopya sayısında ökromatik dizilerin Görselleştirme yüksek spesifik aktiviteye veya birlikte sinyali artırmak çok küçük prob bir kokteyli ile tek bir büyük problar ya da kullanılmasını gerektirir.
Normalde on blok olarak da bilinen tek bir kromozom bölgelerinde kümelenmiş tekrarların binlerce olarak mevcut çünkü aksine, uydu DNAlar gibi heterokromatin bulunan çok tekrar eden diziler, DNA ISH için daha kolay hedeflerdir. Transpoze edilebilir elemanları da olabilirfarklı kromozom anomalisi 2 yüksek kopya sayılarında bulundu. Bu durumda, düşük özgül etkinliği olan bir sonda etkili bir nedeniyle çok sayıda yerde bunların hibridizasyona heterokromatik dizileri etiketleyebilir. Tekrar eden dizilere Problar ticari olarak kısa oligonükleotitler (30-50 bp), sentezlenmiş ve kimyasal olarak çok sayıda farklı floresan gruplarının biri ile birleşebilir. Genom-sıralama teknolojileri kullanarak heterokromatindir içinde tekrarlayan dizileri Haritalama nedeniyle oldukça tekrarlayıcı uydu blokları 4-6,7 içinde bina iskeleleri karşılaşılan zorluklar zordur. Şu anda, ISH alt-kromozom düzeyinde bu dizileri haritalama en etkili yol olarak duruyor. Bu strateji, devam etmekte olan genom ve transcriptome sıralama çalışmaları ile ortaya olan tekrar eden dizilerin büyük sayıda haritalanması için önemlidir.
slayt monte kromozomlar üzerinde haritalama tekrarlayan dizilerin verimlilik ve kullanım kolaylığı gre olacakatlı DNA ISH için basitleştirilmiş bir protokol tarafından geliştirilmiş. Örneğin, DNA, ISH mevcut protokoller, böylece eşleme dizileri için gerekli süre büyük ölçüde eklenmesi ve aynı zamanda bu pahalı reaktifin kimyasal atık büyük miktarlarda üretilmesi, formamid çözeltisi 2,8 hibridize dokuların birden fazla yıkama içerir. Burada formamıd yıkar ihtiyacını circumvents ve temel laboratuvar ekipmanları ve reaktifler kullanan bir revize DNA ISH yöntemi tarif. Bu yöntem, ilk olarak floresan boyalar ile konjuge edilmiş ticari olarak sentezlenir oligolar kullanılarak, Drosophila larva neuroblasts heterokromatik bölgelerinde yüksek olan tekrar eden DNA dizilerinin hızlı eşleme için tasarlanmıştır. Ancak, bu yöntem, aynı zamanda, diğer yollarla 9,10 ile ve birden fazla farklı doku ve kromozom türleri arasında sentezlendi büyük probları kullanılarak çok tekrarlanan diziyi eşleştirmek için de kullanılabilir. Buna ek olarak, bu yöntem, daha uzun ya da multip kullanılarak ökromatik dizileri eşlemek için kullanılabilirle, ilgi euchromatic dizisi içinde kısa sondalar.
Protokol
1. Doku Diseksiyon ve Fiksasyon (60 dk)
- Drosophila beyinleri için, 1 x PBS (fosfat tamponlu tuzlu su), bir damla 3. instar larvaları yerleştirin. Aktif kalabalık olmayan flakon ya da şişe tarama olan büyük 3. instar larvaları seçin.
- Ağız kanca tutmak ve vücudun (Şekil 1A, B) uzunluğu aşağı 2/3 kapmak için başka bir cımbız çifti kapmak için bir ultra ince cımbız çifti kullanın. Larva sindirim sistemi beyin, ventral ganglionlar, tükürük bezleri ve bir kısmını ortaya çıkarmak için ağız kanca yavaşça çekin. Beyin ve ventral ganglionlar ayırmak için cımbız kullanarak (Şekil 1A, B), bir plastik Petri plakası üzerinde 1x PBT (Tween ile fosfat tamponlu tuzlu su) bir damlacık Diğer doku ve yerden.
- Nasonia testis disseksiyonlarıyla için, erkek 3 günlük eski pupa (kırmızı gözlü sarı organları) seçin. Erkek Nasonia f göreceli küçük kanat ped uzunlukları varpupa aşamada (Şekil 1C) sırasında emales.
- Bir cımbız çifti ve diğer cımbız çifti kullanarak göğüs bölgesinde yakın karın üstündeki pupa tutun, karın çok uzak ucu kapmak ve gözyaşı bırak şeklinde testisler çekin (onlar yağ ile çevrili olacak nazikçe sarsılmış olabilir gövdesi; Şekil 1D). Bir plastik Petri plaka üzerinde 1x PBT bir damlacık uygun Ezici, ve yer önleyecek testis, herhangi bir dış vücut parçaları ayırın.
- Her slayt için, dört ya da beş doku örneklerinde (yani., Drosophila larva beyinleri veya Nasonia testisler) toplam teşrih.
NOT: Daha fazla beş numune kalabalık çekirdekleri ve kromozomların yol açacaktır. - İsteğe bağlı olarak, mitotik kromozom euchromatic bölgelerinde kardeş kromozomlardalerde bir ayrılmanın elde edilmesi için bir hipotonik çözelti ile dokuyu tedavi etmek: (5-10% 0.5 sodyum sitrat bir damla 1x PBT'den beyinleri aktarmaken fazla 10) dakika.
NOT: Kolşisin (bir mitoz inhibitörü) metafaz 11 de mitoz sayısının artırılması için yararlı olabilir. Olumsuz kromozom çözünürlüğü etkileyebilir çünkü çok büyük sağlıklı larva yayılması ve morfolojisi, kullanılan ve hatta istenmeyen doğruya, kullanımı gereksizdir. - Temiz Sigmacote ile tedavi edilen kapak kayma yüzeyi üzerine tespit edici çözeltisi (% 45, asetik asit içinde% 2.5 paraformaldehit) bir damlacık (~ 20 ul) yerleştirin.
NOT: Kullanım her gün için sabitleştirici çözüm taze olun. % 45 asetik asit içinde 1.8-3.7% paraformaldehid kadar Sabitleme çözeltiler FISH için en iyi sonuçları vermektedir. Immün-FISH için bu protokolü beyinleri veya testis dışındaki dokuları kullanarak, ya da uyarlama farklı fiksatif ile deneme gerekebilir (farklı fiksatif listesi için, 12 bakınız). - Dikkatle ultra ince cımbız, minimide ile sabitleştirici damlacık içine diseksiyon tampon (1x PBT) her doku örneği aktarmakfiksatif çözüm içine tampon diseksiyon transferini zing. Dengeli bir şekilde tespit edici damlacık içinde birbirinden aralıklı olacak şekilde doku örnekleri yerleştirin. Oda sıcaklığında 4 dakika süreyle tespit sıvısı içerisinde dokuların inkübe edin.
- Dikkatli bir şekilde, doku ve kapak slip üzerinde bir poli-lisin-kaplanmış slayt yüzü koyun. Bu noktada aşağı bastırın ancak bunun yerine kapak kayma slayt alt üzerine yapışır, böylece iki hafifçe temas etmesine izin vermeyin. Kapak kayma üstünde olacak şekilde slayt ters çevirin.
- Filtre kağıdı katlanmış parçası içinde slayt / doku / kapak kayma sandviç. Sabit bir yüzeye, çok sıkıca düz aşağı doğrudan kapak kayma üzerinde pozisyon üzerine başparmak, basın kullanarak. (Bu doku, leke neden olur) kapak kayma kayma yanal önlemek için dikkatli olun.
- Sıvı azot içine slayt / doku / kapak kayma Batmak (Şekil 1E, F cihazı bakınız), ve Azot kaynar durana kadar bekletin (uzun fine). Slayt çıkarın ve hemen (jilet ile sabit doku çizilmesini önlemek) yukarı yönde kapak kayma bir köşesini iterek taze jilet ile kapak kayma koparmak.
- Kuru buz bloğu slayt / doku / kapak kayma Ön soğutma, kapak önce çatlama slaytlar önlemeye yardımcı olur sıvı azot içinde daldırarak 1-2 dakika kadar slip.
- Hemen oda sıcaklığında% 100 etanol ile dolu bir kavanozun içine Coplin doku ile slayt yerleştirin ve (gerekirse bu sefer daha uzun olabilir) en az 5 dakika bekletin.
Not: Soğuk% 100 etanol de kullanılabilir. - Doku ile slayt çıkarın (sabit doku dokunmadan) bir Kimwipe ile aşırı etanol uzak fitil ve 1 saat kuru hava slayt bırakın.
- 2. adıma veya hafta için hibridizasyon yapmadan önce bile aylar için düşük nem havada veya bir kuruma odasında kuru slaytlar tutmak için doğrudan devam edin.
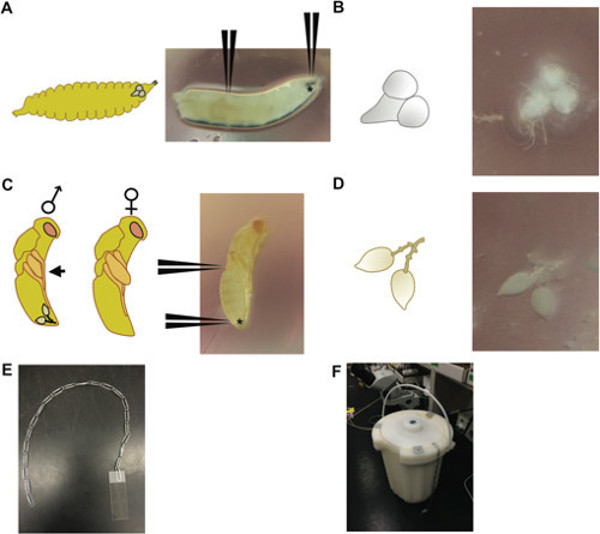
Şekil 1: (A) 3 instar Drosophila larva (sağda), ağız kanca kapmak için nereye belirtilen pozisyonlara ile (ile gösterilir *) ve beyinleri incelemek için larva aşağı yol 2/3; (Solda) larva kafa içinde beyin göreli konumunu gösteren, aynı gelişim aşamasında bir larva şematik. (B) beyin ve 3 instar Drosophila larva (sağda) ve bu bir şematik disseke ventral ganglionlar doku (solda). Sarı vücut kırmızı göz aşamasında (C) 3-günlük-eski Nasonia pupa. (D) pupa kapmak için gösteren pozisyonlarda (sağ) 3 günlük Nasonia erkek pupa disseke bir testis çifti Karın posterior (* ile gösterilen) ve vücut üzerinde yarıda; (Solda) şematik tasvir erkek ve dişi oldup pupa; erkek pupa profili geçmiş uzatmak kanatları var kadın, aksine, saggital profili (siyah ok) geçmiş uzatmak değil kanatları ile ayırt edilebilir; Testis çiftinin göreli konumu erkek pupa gösterilmektedir., sıvı azot içinde bir kap içinde slaytlar sokmak için kullanılan ataç-ve (F) yöntemi (E) aparat bir dizge. Birden ataş dizeleri birden çok slayt aynı anda daldırma için kullanılabilir.
In situ hibridizasyon 2. (1 gün, 30 dakika, uzun 1 saat-2.5 saat probları-günde 2)
- 1.1x hibritleme tampon maddesi 20 ul, her bir prob 1 ul (100 ng) ekleyin. Pipet Sonda / sabit kağıdın sathına hibridizasyon tamponu (doku dokunmaktan kaçının).
- Dikkatlice kapak kayma doku üzerinde doğrudan merkezli emin, prob / hibridizasyon tamponu üzerine doğrudan bir kapak kayma yerleştirin. tampon inci geçirmelisinizhava kabarcıkları bırakarak, kapak kayma dış kenarını e.
NOT: prosedüre herhangi bir sorun teşkil etmez doku temas etmemesine Küçük kabarcıklar. Dikkatle slayt üzerine geri bırakarak dikkatlice kapak kayma bir köşesini kaldırarak tarafından büyük kabarcıklar çıkarın. - Bir blok (kapak yukarı kayma), 95 ° C'ye önceden ısıtılmış yüzey üzerinde kayma / doku / kapak kayma yerleştirin. Işık maruz kalmasını önlemek için alüminyum folyo büyük bir parça ile kaplayın. Sürgü 5 dakika boyunca 95 ° C'de inkübe edin.
NOT: tüpler için delikler ile tipik bir ısı bloğu slayt / doku / kapak kayma yerleştirmek için düz bir yüzey sağlamak için devrildiğinde olabilir. - Dokunmak sıcak kadar biraz soğumasını icar, slayt çıkarın. Dikkatle altındaki sıvı mühür kapak kayma etrafında gergin Parafilm bir parça sarın.
- Bir nemlilik bölmesi içinde yalıtılmış ve slayt yerleştirin ve 30 ° C'ye ısıtılmış bir inkübatör içine bölmenin. 4 saat gece boyunca için 30 ° C'de inkübe edilir.
- Altına yerleştirilen nemlendirilmiş Kimwipes veya kağıt havlu ile boş bir ipucu kutusundan nem odası veya kapaklı Tupperware konteyner oluşturun.
Not: Tek şeritli DNA oligo probları 45-47 ° C'lik bir teorik bir erime sıcaklığına (Tm) elde etmek için 28-33 baz olarak tasarlanmıştır. Bu uzunluk ve Tm aralıkları incelenen birçok tekrarlanan diziler AT-zengin ve bu nedenle çok düşük GC içeriği gerçeğini yansıtmaktadır. Daha uzun sondalar olasılıkla yüksek Tm değerleri olacaktır; bu, 30 ° C'de standart melezleştirme sıcaklığında yüksek bir arka plan hibridizasyon neden olabilir. Dolayısı ile de hibridizasyon sıcaklıklarda bir sorun, en iyi sonuçları elde etmek için gerekli olabilir. Adım adım, en iyi melezleme sıcaklığı, artış (veya azalış) 5 ° C sıcaklık bulmak için.
- Altına yerleştirilen nemlendirilmiş Kimwipes veya kağıt havlu ile boş bir ipucu kutusundan nem odası veya kapaklı Tupperware konteyner oluşturun.
- Dikkatle slayt Parafilm çıkarın ve sonra dikkatlice yavaş yavaş bir köşesini kaldırarak kapak kayma çıkarın. Wa15 dakika 0.1x SSC tamponu her yıkama için üç kez kaydırın sh. Işık maruziyeti en aza indirmek için yıkama sırasında alüminyum folyo ile örtün Coplin kavanoz.
- Uzun bir biyotinile prob kullanılarak değilse, 2.8 adıma geçin.
- Uzun biyotinillenmiş prob kullanılıyorsa, doku kendisi dokunmamaya dikkat ederek, bir Kimwipe ile dokuya çevresini kurulayın. Doku üzerinde çözüm engelleme 100 ul yerleştirin ve bindirme kabarcıklarını önlemek için özen, bir lamel ile hafifçe örtün. 30 dakika boyunca 37 ° C'de Parafilm ile lamel ve yerde slayt sarın.
- Dikkatlice lamel kaldırmak ve bir Kimwipe ile doku etrafında kurulayın. Pipetleyin rodamin-avidin 1 seyreltilmiş 100 ul: doku üzerinde SBT 1000 ve yavaşça bir lamel ile kaplayın alarak bakım kabarcıkları yakalama önlemek için. 30 dakika boyunca 37 ° C'de Parafilm ile lamel ve yerde slayt sarın.
- Dikkatlice lamel kaldırmak ve daha sonra 4x SSCT ve 5 dakika slayt, her 3 kere yıkayın0,1 x SSC içinde 5 dakika her biri için 3 kere yıkanır.
NOT: Slaytlar uzun süreler için yıkanabilir.
- Slayt çıkarın ve (doku dokunmaktan kaçının) aşırı tampon kaldırmak için kuru bir Kimwipe dokusu etrafında kurulayın. 10-15 dakika veya nem tamamen çözülene kadar karanlık bir yerde slayt doku tarafı yukarı yerleştirin.
- Vectashield montaj ortamı pipetle 11 ul (4 'ile birlikte, 6-diamidino-2-fenilindol-DAPI) dokunun üzerine. Dikkatle doğrudan montaj orta ve doku merkezi üzerinde (değil Sigmacote ile tedavi), temiz bir kapak kayma yerleştirin. montaj orta kapak kayma kenarlarına doğru dışa yavaş göç gerekir.
NOT: montaj orta her tarafta kapak kayma kenarına ulaşmak için başarısız olursa, o zaman montaj orta bir ek 1-2 ul gerekli hacme doldurmak için kapak kayma kenarında bir pozisyonda uygulanabilir. Bu durumda, önce slayt yüzeyinden herhangi bir aşırı orta silip emin olunSızdırmazlık. - Oje ile kapak kayma kenarları mühür. Doku numunesi üzerinde oje boyama kaçının.
- Karanlık bir yerde dik slayt yerleştirin ve tamamen sert (genellikle 30 dakika veya daha fazla) kadar oje kurumaya bırakın. Bu noktada, görüntü daha sonra görüntüleme için, 1 hafta boyunca 20 ° C'de doku ya da saklayın.
Tampon / Çözüm Tarifler
10x PBS
- 80 gr NaCl
- 2.0 g KCI
- 14.4 gr Na 2 HPO 4
- 2.4 gr KH 2 PO 4
- 7.4 pH, H2O, 1 L'
1x PBT
- 5 mi 10x PBS
- 45 mi H2O
- % 0.1 Tween 20
20x SSC
- 175.3 gr NaCl
- 88.2 gr Na Sitrat
- 800 mi, H2O içinde
- 7 pH, H2O, 1 L'
4x SSCT
- 200 mi 20x SSC
- 799 mi 'H 2 O
- % 0.1 Tween 20
0.1X SSC
- 5 mi 20x SSC
- 995 mi H2O
Hibridizasyon karışımı (20 ul; 11 ile değiştirilmiş)
- 10 ul formamid
- 4 ul% 50 dekstran sülfat
- 2 ul 20x SSC
- 4 ul H2O
SBT 8 (10 mi)
- 2 mi 20x SSC
- 0.01 gr Sığır Serum Albumin (BSA)
- 10 ul Tween 20
- 7.9 mi H2O
Engelleme 8 çözeltisine (10 mi)
- 0.3 gr BSA
- 10 ul Tween 20
- 2 mi 20x SSC
- 8 mi H2O
Paraformaldehit ile Sabitleme çözeltisi (1 mi)
- 2 O (ilk su ekleyin) 393,75 ul H
- 450 ul saf asetik asit
- 156,25 ul% 16 paraformaldehit
Sonuçlar
Birkaç farklı doku kromozomlara, (Şekil 2B, bir PCR ürününün çentik translasyonu vasıtasıyla yapılan) bu yöntem göstermek için, kimyasal olarak, floresan konjugatları (Şekil 2) ve daha uzun bir biyotinlenmiş prob ile değiştirilmiş küçük ticari olarak sentezlenir oligo kümesi hibridize türleri (Tablo 1 e bakınız). Hedef dizileri D. mitotik kromozom perisentromerik (heterokromatik) bölgelerinde bulunan uydu tekrarlar dahil pupa N
Tartışmalar
DNA, ISH sık kromozomlara özgü dizileri eşlemek için kullanılır. Bu yüksek kopya sayısında heterokromatik dizileri için optimize edilmiş DNA ISH için basit bir yöntem tarif edilmiştir. Aksine diğer mevcut DNA ISH protokolleri bir gerekliliktir bir formamıd çözelti içinde yıkar kullanmak yerine, biz DNA denatüre doğrudan önceden ısıtılmış blok üzerinde doku monte slaytlar yerleştirin. Bu yöntem, formamid yüksek miktarda kullanılmasına aşılmaktadır. Net melezleme sinyalleri üretmek i...
Açıklamalar
The authors declare that they have no competing financial or any other conflict of interest.
Teşekkürler
We thank Zhaohua Irene Tang in the W. M. Keck Science Department for the use of her epifluorescence microscope and the Werren lab for donating Nasonia for dissections. This work was supported in part by an NIH-NRSA fellowship (5F32GM105317-02) to AML.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Poly-L-lysine coated slides (regular slides also can be used) | Sigma Aldrich | ||
| Ultrafine tweezers (5 gauge) | Dumont | ||
| 22 x 22 mm cover slips | Fisher | Sigmacote-treated by immersion for 15 sec, blotting dry, and wiping away all traces of Sigmacote so that cover slip is clear | |
| Sigmacote | Sigma | ||
| Filter paper | 75 - 150 mm | ||
| Paraffin wax paper | |||
| Heat block with thermometer | |||
| Dry incubator | |||
| Razor blades | |||
| Humidity chamber | empty pipette tip box or Tupperware, lined with moistened paper towels or Kimwipes | ||
| Coplin jars | with slide grooves | ||
| Aluminum foil | |||
| Pasteur pipettes | |||
| 1.5 ml microfuge tubes | |||
| Nail polish | clear or colored | ||
| P20 micropipette and plastic tips | |||
| Paperclips | 20 - 25 standard metal paperclips linked to form a chain | ||
| Reagents | |||
| 16% EM grade paraformaldehyde | Electron Microscopy Reagents | ||
| Acetic acid | Sigma | ||
| Liquid nitrogen | |||
| 100% Ethanol, chemical grade | |||
| Commercially synthesized, fluorescently labeled oligos | |||
| Long biotinylated probe | Invitrogen; Alternative steps 2.7.1-2.7.3 | e.g., nick translated and biotinylated with BioNick from Invitrogen | |
| Rhodamine-Avidin | Roche; Alternative steps 2.7.1-2.7.3 | for detection of long biotinylated probe | |
| Hybridization buffer | Recipe above | ||
| 4x SSCT | Recipe above | saline-sodium citrate + Tween | |
| 0.1x SSC | Recipe above | saline-sodium citrate | |
| Blocking solution | Recipe above | ||
| SBT | Recipe above | SSC, bovine serum albumin, Tween | |
| 1x PBT | Recipe above | phosphate-buffered saline + Tween | |
| 1x PBS | phosphate-buffered saline | ||
| Hypotonic solution | 0.5% sodium citrate in H2O | ||
| Formamide | Sigma Aldrich | ||
| Vectashield mounting medium with DAPI | Vector laboratories | ||
Referanslar
- Blattes, R., Kas, E. Fluorescent in situ hybridization (FISH) on diploid nuclei and mitotic chromosomes from Drosophila melanogaster larval tissues. Cold Spring Harbor Protocols. 2009 (9), (2009).
- Dimitri, P. Fluorescent in situ hybridization with transposable element probes to mitotic chromosomal heterochromatin of Drosophila. Methods in Molecular Biology. 260, 29-39 (2004).
- Pardue, M. L. In situ hybridization to polytene chromosomes in Drosophila using digoxigenin-labeled probes. Cold Spring Harbor Protocols. 2011 (8), 1003-1006 (2011).
- Hoskins, R. A., et al. Heterochromatic sequences in a Drosophila whole-genome shotgun assembly. Genome Biology. 3 (12), (2002).
- Hoskins, R. A., et al. Sequence finishing and mapping of Drosophila melanogaster heterochromatin. Science. 316 (58331), 1625-1628 (2007).
- Treangen, T. J., Salzberg, S. L. Repetitive DNA and next-generation sequencing: computational challenges and solutions. Nature Reviews Genetics. 13 (1), 36-46 (2012).
- He, B., et al. Mapping the pericentric heterochromatin by comparative genomic hybridization analysis and chromosome deletions in Drosophila melanogaster. Genome Research. 22 (12), 2507-2519 (2012).
- Pimpinelli, S., Bonaccorsi, S., Fanti, L., Gatti, M. Fluorescent in situ hybridization (FISH) of mitotic chromosomes from Drosophila larval brain. Cold Spring Harbor Protocols. 2010 (3), (2010).
- Larracuente, A. M., Noor, M. A., Clark, A. G. Translocation of Y-linked genes to the dot chromosome in Drosophila pseudoobscura. Molecular Biology and Evolution. 27 (7), 1612-1620 (2010).
- Ferree, P. M., Barbash, D. A. Species-specific heterochromatin prevents mitotic chromosome segregation to cause hybrid lethality in Drosophila. PLoS Biology. 7 (10), e1000234 (2009).
- Williams, B. C., Karr, T. L., Montgomery, J. M., Goldberg, M. L. The Drosophila l(1)zw10 gene product, required for accurate mitotic chromosome segregation, is redistributed at anaphase onset. The Journal of Cell Biology. 118 (4), 759-773 (1992).
- Gatti, M., Bonaccorsi, S., Pimpinelli, S. Looking at Drosophila Mitotic Chromosomes. Methods in Cell Biology. 44, 371-391 (1994).
- Werren, J. H., Stouthamer, R. PSR (paternal sex ratio) chromosomes: the ultimate selfish genetic elements. Genetica. 117 (1), 85-101 (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır